Стабилизированная липидная препаративная форма промотора апоптоза
Иллюстрации
Показать всеПерорально доставляемая фармацевтическая композиция содержит соединение, ингибирующее белок семейства Bcl-2, в частности ABT-263, слаборастворимый в липидах антиоксидант, выбранный из группы, состоящей из сульфитов, бисульфитов, метабисульфитов, тиосульфатов и их смесей, и по существу неводный липидный носитель, включающий фосфолипид, нефосфолипидное поверхностно-активное вещество и солюбилизирующий компонент, включающий один или более гликолей, гликолидов и/или глицеридных соединений, где указанное соединение АВТ-263 и указанный акнтиоксидант находятся в растворе в липидном носителе. Композиция подходит для перорального введения нуждающемуся в ней индивиду для лечения заболевания, характеризуемого сверхэкспрессией одного или более антиапоптотических белков семейства Bcl-2, например рака. 3 н. и 25 з.п. ф-лы, 2 ил., 17 табл., 12 пр.
Реферат
Настоящая заявка испрашивает приоритет согласно предварительным заявкам на патент США № 61/174299, поданной 30 апреля 2009 г., и № 61/289254, поданной 22 декабря 2009 г.
Перекрестная ссылка делается на следующую совместно поданную заявку на патент США, содержащую объект изобретения, относящийся к настоящей заявке: № 12/770,122, озаглавленной «Липидная препаративная форма промотора апоптоза», которая испрашивает приоритет согласно предварительной заявке на патент США № 61/174245, поданной 30 апреля 2009 г.; № 12/770,345, озаглавленной «Соль ABT-263 и его формы в твердом состоянии», которая испрашивает приоритет согласно предварительной заявке на патент США № 61/174274, поданной 30 апреля 2009 г.; и № 12/770,299, озаглавленной «Препаративная форма для перорального введения промотора апоптоза», которая испрашивает приоритет согласно указанным выше предварительным заявкам на патент США № 61/174299 и 61/289254, а также № 61/174318, поданным 30 апреля 2009 г., № 61/185105, поданной 8 июня 2009 г., № 61/185130, поданной 8 июня 2009 г., № 61/218281, поданной 18 июня 2009 г., и № 61/289289, поданной 22 декабря 2009 г.
Полное описание каждой из указанных выше заявок включено в настоящее описание путем ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям, содержащим средство, стимулирующее апоптоз, и к способам их применения для лечения заболеваний, характеризуемых сверхэкспрессией антиапоптотических белков семейства Bcl-2. Конкретнее, изобретение относится к таким композициям, которые проявляют улучшенную пероральную биодоступность и химическую устойчивость стимулирующего апоптоз средства, и к схемам перорального введения такой композиции нуждающемуся в ней пациенту.
Уровень техники
Уклонение от апоптоза представляет собой отличительный признак онкологических заболеваний (Hanahan & Weinberg (2000) Cell 100:57-70). Злокачественные клетки должны преодолеть постоянную бомбардировку клеточными стрессами, такими как повреждение ДНК, активация онкогенов, течение аберрантного клеточного цикла и жесткие условия микросреды, которые могут вызывать апоптоз нормальных клеток. Одним из первичных средств, с помощью которого злокачественные клетки избегают апоптоза, является стимуляция антиапоптотических белков семейства Bcl-2.
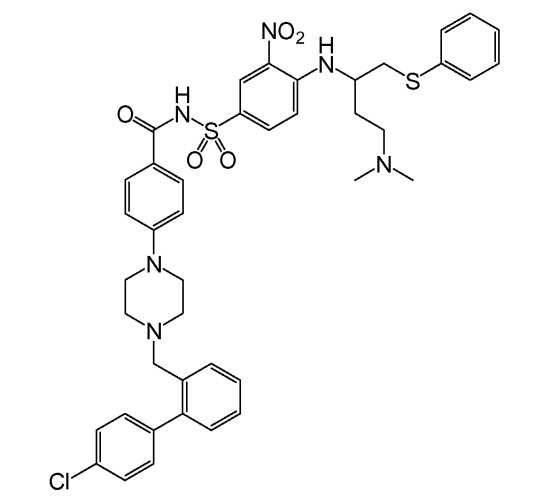
Соединения, которые занимают бороздку связывания BH3 белков Bcl-2, были описаны, например, Bruncko et al. (2007) J. Med. Chern. 50:641-662. Данные соединения включали N-(4-(4-((4'-хлор-(1,1'-бифенил)-2-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(диметиламино)-1-((фенилсульфанил)метил)пропил)амино-3-нитробензолсульфонамид, иначе известный как ABT-737, который имеет формулу:
ABT-737 связывается с высокой аффинностью (<1 нМ) с белками семейства Bcl-2 (в частности, Bcl-2, Bcl-XL и Bcl-w). Он проявляет активность при применении в качестве единственного средства против мелкоклеточного рака легких (SCLC) и лимфоидных злокачественных заболеваний и потенцирует проапоптотические эффекты других химиотерапевтических средств. ABT-737 и родственные соединения и способы получения таких соединений описаны в публикации заявки на патент США № 2007/0072860 Bruncko et al.
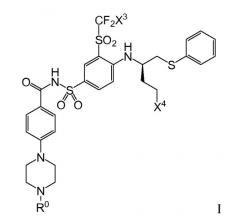
Позднее были идентифицированы другие группы соединений, имеющие высокую аффинность связывания с белками семейства Bcl-2. Данные соединения и способы их получения описаны в публикации заявки на патент США № 2007/0027135 Bruncko et al. (в настоящем описании обозначенной как «публикация '135»), полностью включенной в настоящее описание путем ссылки, и по их формуле (представленной ниже формуле I) видно, что они структурно связаны с ABT-737.
В соединениях формулы I:
X3 представляет хлор или фтор; и
(1) X4 представляет азепан-1-ил, морфолин-4-ил, 1,4-оксазепан-4-ил, пирролидин-1-ил, N(CH3)2, N(CH3)(CH(CH3)2), 7-азабицикло[2.2.1]гептан-1-ил или 2-окса-5-азабицикло[2.2.1]гепт-5-ил; и R0 представляет
где
X5 представляет CH2, C(CH3)2 или CH2CH2;
оба X6 и X7 представляют водород или метил; и
X8 представляет фтор, хлор, бром или йод; или
(2) X4 представляет азепан-1-ил, морфолин-4-ил, пирролидин-1-ил, N(CH3)(CH(CH3)2) или 7-азабицикло[2.2.1]гептан-1-ил; и R0 представляет
где X6, X7 и X8 такие, как указано выше; или
(3) X4 представляет морфолин-4-ил или N(CH3)2; и R0 представляет
где X8 такой, как указано выше.
В публикации '135 указано, что ранее известные ингибиторы белков семейства Bcl-2 могут иметь высокую клеточную эффективность или сильное системное воздействие после перорального введения, но они не обладают обоими этими свойствами. Типичным показателем клеточной эффективности соединения является концентрация, вызывающая 50% клеточный эффект (EC50). Типичным показателем системного воздействия после перорального введения соединения является площадь под кривой (AUC) в результате построения графика зависимости концентрации соединения в плазме от времени, прошедшего после перорального введения. В публикации '135 указано, что ранее известные соединения имеют низкое отношение AUC/EC50, означая, что они не являются эффективными при пероральном введении. Указано, что соединения формулы I, напротив, демонстрируют улучшенные свойства в отношении клеточной эффективности и системного воздействия после перорального введения, приводя к отношению AUC/EC50, значительно более высокому, чем таковое ранее известных соединений.
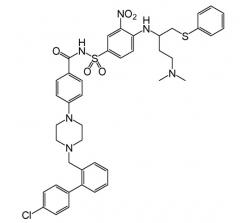
Одно соединение, идентифицированное как «Пример 1» в публикации '135, представляет собой N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино-3-((трифторметил)сульфонил)бензолсульфонамид, иначе известный как ABT-263. Данное соединение имеет молекулярную массу 974,6 г/моль и имеет формулу:
ABT-263 связывается с высокой аффинностью (<1 нМ) с Bcl-2 и Bcl-XL, и считается, что оно имеет такую же высокую аффинность к Bcl-w. В публикации '135 сообщается, что отношение AUC/EC50 составляет 56, что на порядок величины больше, чем величина, о которой сообщалось для ABT-737 (4,5). Для определения AUC в соответствии с публикацией '135, каждое соединение вводили крысам через рот в одной дозе 5 мг/кг в виде раствора с концентрацией 2 мг/л в носителе 10% DMSO (диметилсульфоксиде) в PEG-400 (полиэтиленгликоле со средней молекулярной массой примерно 400).
В публикации '135 не сообщается о пероральной биодоступности (выраженной, например, AUC после перорального введения в виде процентной доли AUC после внутривенного введения), но из нее можно сделать вывод, что пероральная биодоступность существенно выше для ABT-263, чем для ABT-737. Однако было бы предпочтительно дальнейшее улучшение пероральной биодоступности. В данной области были предложены различные решения проблемы низкой пероральной биодоступности. Например, в патенте США № 5645856, выданном Lacy et al., предложено включение в состав гидрофобного лекарственного средства с (a) маслом, (b) гидрофобным поверхностно-активным веществом (ПАВ) и (c) лиофильным ПАВ, которое по существу снижает ингибиторный эффект гидрофильного ПАВ на липолиз масла in vivo, причем считают, что липолиз является фактором, способствующим биодоступности лекарственного средства. Среди многочисленных классов гидрофильных ПАВ перечислены фосфолипиды, такие как лецитины.
Патент США № 6267985, выданный Chen & Patel, наряду с другими аспектами, относится к фармацевтической композиции, содержащей (a) триглицерид, (b) носитель, содержащий, по меньшей мере, два ПАВ, одно из которых является гидрофильным, и (c) терапевтическое средство, способное солюбилизироваться в триглицериде, носителе или обоих соединениях. В указанном документе указано, что триглицерид и ПАВ должны присутствовать в количествах, обеспечивающих получение прозрачной водной дисперсии, когда композиция смешивается с водным раствором в определенных условиях. Среди обширных списков иллюстративных ингредиентов в качестве триглицерида упоминается «глицерил трикаприлат/капрат» и фосфолипиды, включая фосфатидилхолин в качестве ПАВ.
В патенте США № 6451339, выданном Patel & Chen, указаны недостатки присутствия триглицеридов в таких композициях и предложены аналогичные композиции, которые по существу не содержат триглицеридов, но которые аналогичным образом обеспечивают получения прозрачных водных дисперсий.
В патенте США № 6309663, выданном Patel & Chen, предложены фармацевтические композиции, содержащие комбинацию ПАВ, которые, как указано, усиливают биоабсорбцию гидрофильного терапевтического средства. Фосфолипиды, такие как фосфатидилхолин, снова перечислены среди иллюстративных ПАВ.
В патенте США № 6464987, выданном Fanara et al., предложена жидкая фармацевтическая композиция, содержащая поверхностно-активное вещество, от 3% до 55% масс. фосфолипида, от 16% до 72% масс. растворителя и от 4% до 52% масс. жирной кислоты. В частности, иллюстрируются композиции, содержащие Phosal 50 PG™ (в первую очередь включающий фосфатидилхолин и пропиленгликоль), в некоторых случаях, вместе с Phosal 53 MCT™ (в первую очередь включающим фосфатидилхолин и среднецепочечные триглицериды). Указано, что такие композиции имеют свойство немедленно застудневать в присутствии водной фазы и обеспечивают возможность контролируемого высвобождения поверхностно-активного вещества.
В патенте США № 5538737, выданном Leonard et al., предложена капсула, содержащая эмульсию вода-в-масле, в которой соль растворимого в воде лекарственного средства растворена в водной фазе эмульсии и где масляная фаза содержит масло и эмульгирующий агент. Среди указанных масел, указаны среднецепочечные триглицериды; среди эмульгирующих агентов указаны фосфолипиды, такие как фосфатидилхолин. Сообщается, что Phosal 53 MCT™, который содержит фосфатидилхолин и среднецепочечные триглицериды, используется в соответствии с приведенными в нем различными примерами.
В патенте США № 5536729, выданном Waranis & Leonard, предложена пероральная препаративная форма, содержащая рапамицин в концентрации от примерно 0,1 до примерно 50 мг/мл, в носителе, содержащем раствор фосфолипидов. В патенте указано, что предпочтительная препаративная форма может быть получена с использованием Phosal 50 PG™ в качестве раствора фосфолипида. Упомянутый альтернативный раствор фосфолипидов представляет собой Phosal 50 MCT™.
В патенте США № 5559121, выданном Harrison et al., предложена пероральная препаративная форма, содержащая рапамицин в концентрации от примерно 0,1 до примерно 100 мг/мл, в носителе, содержащем N,N-диметилацетамид и раствор фосфолипидов. В примерах более предпочтительных вариантов осуществления показано, что препаративные формы получают с использованием Phosal 50 PG™. Указанный альтернативный раствор фосфолипидов представляет собой Phosal 50 MCT™.
В публикации заявки на патент США № 2007/0104780 Lipari et al. указано, что низкомолекулярное лекарственное средство (определенное в описании как имеющее молекулярную массу, исключая противоионы в случае солей, не более чем примерно 750 г/моль, обычно не более чем примерно 500 г/моль), имеющее низкую растворимость в воде, может быть включено в композицию в виде раствора в по существу неводном носителе, содержащем, по меньшей мере, один фосфолипид и фармацевтически приемлемый солюбилизирующий агент. Указано, что раствор при смешивании с водной фазой образует не застудневающую, по существу непрозрачную жидкую дисперсию. В документе иллюстративно описаны препаративные формы N-(4-(3-амино-1H-индазол-4-ил)фенил)-N'-(2-фтор-5-метилфенил)мочевины (ингибитора протеин-тирозинкиназы ABT-869), содержащие Phosal 53 MCT™ и другие ингредиенты.
Реакции окисления представляют важный путь распада фармацевтических средств, особенно при включении в состав в растворе. Имеется большое количество информации по окислительным механизмам, но было выполнено относительно небольшое количество исследований с определенными лекарственными средствами. Hovorka & Schőneich (2001) J. Pharm. Sci. 90:253-269 указали, что данное отсутствие фармацевтически релевантных данных приводит к слабой прогностической способности в отношении окисления лекарственного средства между изготовлением и введением препаративной формы окисляемого лекарственного средства и, следовательно, к неинформированному, в значительной степени эмпирическому использованию антиоксидантов в препаративных формах.
Окисление может происходить рядом путей, включая некатализируемое автоокисление субстрата молекулярным кислородом, фотолитическую инициацию, гемолитическое термическое расщепление и катализ металлами. Различные функциональные группы проявляют определенную чувствительность к окислению. В частности, тиоэфиры могут распадаться через отщепление водорода в α-положении к атому серы или прямое присоединение α-пероксильного радикала или посредством процесса переноса одного электрона, который трансформирует сульфид в сульфин, сульфон или сульфоксид (Hovorka & Schőneich, см. выше).
Видно, что (фенилсульфанил)метильная группа соединений формулы I имеет тиоэфирную связь, которая восприимчива к окислению, например, в присутствии кислорода или реакционноспособных частиц кислорода, таких как супероксид, пероксид водорода или гидроксильные радикалы. Приведенная выше публикация '135 включает антиоксиданты в обширном списке эксципиентов, которые, как указано, могут применяться для введения соединения формулы I.
Определенным типом заболевания, по поводу которого требуются улучшенные способы лечения, является неходжкинская лимфома (NHL). NHL представляет собой шестой самый распространенный тип нового онкологического заболевания в США и возникает в первую очередь у пациентов в возрасте 60-70 лет. NHL - это не одно заболевание, а семейство родственных заболеваний, которые классифицируются на основании нескольких характеристик, включая клинические симптомы и гистологию.
Один способ классификации распределяет различные гистологические подтипы на две основные категории на основании естественного течения заболевания, т.е. в зависимости от того, является ли заболевание вялотекущим или агрессивным. В целом, вялотекущие подтипы растут медленно и являются в целом неизлечимыми, тогда как агрессивные подтипы растут быстро и являются потенциально излечимыми. Фолликулярные лимфомы представляют собой наиболее распространенный вялотекущий подтип, а диффузные крупноклеточные лимфомы составляют самый распространенный агрессивный подтип. Онкопротеин Bcl-2 был первоначально описан при неходжкинской B-клеточной лимфоме.
Лечение фолликулярной лимфомы обычно состоит из биологически основанной или комбинированной химиотерапии. Обычно применяется комбинированная терапия ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP), как и комбинированная терапия ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Применяется также монотерапия ритуксимабом (нацеленная на CD20, фосфопротеин, равномерно экспрессированный на поверхности B-клеток) или флударабином. Добавление ритуксимаба к схемам химиотерапии может обеспечить повышенную частоту реакции и увеличенное выживание без прогрессирования заболевания.
Средства радиоиммунотерапии, высокодозовая химиотерапия и трансплантаты стволовых клеток могут применяться для лечения рефракторной или рецидивирующей неходжкинской лимфомы. В настоящее время нет утвержденной схемы лечения, которая обеспечивает излечение, и современные руководства рекомендуют лечение пациентов в контексте клинического испытания, даже при использовании первой линии лечения.
Лечение первой линии пациентов с агрессивной лимфомой из крупных B-клеток обычно состоит из ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизона (R-CHOP) или подобранной дозы этопозида, преднизона, винкристина, циклофосфамида, доксорубицина и рутиксимаба (DA-EPOCH-R).
Большинство лимфом первоначально реагируют на любую из указанных схем лечения, но опухоли обычно рецидивируют и в конечном счете становятся рефракторными. По мере увеличения числа схем лечения, которые получают пациенты, заболевание становится более устойчивым к химиотерапии. Средняя реакция на лечение первой линии составляет приблизительно 75%, 60% на лечение второй линии, 50% на лечение третьей линии и примерно 35-40% на лечение четвертой линии. Частоты реакции, приближающиеся к 20%, при лечении одним средством при множественной рецидивирующей форме заболевания считаются положительными и оправдывают дальнейшее исследование.
Современные химиотерапевтические средства вызывают свою противоопухолевую реакцию, вызывая апоптоз посредством разнообразных механизмов. Однако многие опухоли в конечном счете становятся устойчивыми к указанным средствам. Было известно, что Bcl-2 и Bcl-XL придают устойчивость к химиотерапии в кратковременных анализах выживания in vitro и позднее in vivo. Это свидетельствует о том, что если можно разработать улучшенные способы лечения, направленные на подавление функции Bcl-2 и Bcl-XL, то можно успешно преодолеть такую устойчивость к химиотерпии.
Стимулирующие апоптоз лекарственные средства, которые нацелены на белки семейства Bcl-2, такие как Bcl-2 и Bcl-XL, наилучшим образом вводятся в соответствии со схемой, которая обеспечивает непрерывное, например ежедневное, восполнение концентрации в плазме для поддержания концентрации в терапевтически эффективном диапазоне. Это может быть достигнуто ежедневным парентеральным, например, внутривенным (i.v.) или внутрибоюшинным (i.p.), введением. Однако ежедневное парентеральное введение часто непрактично в клинических условиях, особенно для амбулаторных пациентов. Для повышения удобства клинического применения стимулирующего апоптоз средства, например, в качестве химиотерапевтического агента у онкологических пациентов очень желательна была бы лекарственная форма с хорошей пероральной биодоступностью. Такая лекарственная форма и схема ее перорального введения представили бы значительный прогресс в лечении многих типов онкологических заболеваний, включая неходжкинскую лимфому, и облегчили бы возможность проведения комбинированных видов лечения другими химиотерапевтическими средствами.
Еще желательнее было бы получить такую лекарственную форму, в которой была бы снижена скорость окислительного распада, особенно у атома серы (фенилсульфанил)метильной группы соединения формулы I, обеспечивая возможность приемлемой устойчивости лекарственной формы при хранении.
Сущность изобретения
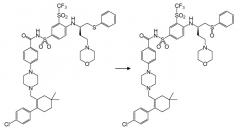
Было обнаружено, что ABT-263 при включении в состав в виде раствора в системе липидного носителя подвергается существенному окислительному распаду при хранении, даже в условиях, в которых по существу устраняется контакт с атмосферным кислородом. Окислительные реакции в случае ABT-263 включают образование сульфоксида; реакция, обеспечивающая данный продукт распада, может быть представлена следующим образом:
Кроме того, было обнаружено, что не все антиоксиданты в приемлемой степени эффективны в ингибировании указанного окислительного распада. Конкретнее, было обнаружено, что класс антиоксидантов, известных в данном случае как «антиоксиданты на основе тяжелого халькогена» или «HCA», проявляет превосходящую эффективность в этом отношении по сравнению с антиоксидантами, более широко используемыми в данной области. Халькоген представляет собой элемент Группы 16 (ранее известной как Группа VIA) периодической таблицы, включающей кислород, серу, селен и теллурий. «Тяжелый халькоген» в настоящем описании означает халькоген, имеющий бóльшую атомную массу, чем кислород, и, в частности, включает серу и селен. «Антиоксидант на основе тяжелого халькогена» или «HCA» представляет собой соединение, имеющее антиоксидантные свойства, которое содержит один или более окисляемых атомов серы или селена, наиболее конкретно, атомов серы.
Получение в виде раствора препаративной формы ABT-263 или соединения формулы I вместе с эффективным антиоксидантным количеством фармацевтически приемлемого HCA в липидном носителе не является просто вопросом выбора подходящего HCA. Должна быть выбрана система носителя, которая способна поддерживать в растворе не только лекарственное средство в терапевтически полезной концентрации, но также эффективное антиоксидантное количество HCA.
Соответственно, изобретение относится к перорально доставляемой фармацевтической композиции, содержащей (a) соединение формулы I:
где X представляет хлор или фтор; и
(1) X4 представляет азепан-1-ил, морфолин-4-ил, 1,4-оксазепан-4-ил, пирролидин-1-ил, N(CH3)2, N(CH3)(CH(CH3)2), 7-азабицикло[2.2.1]гептан-1-ил или 2-окса-5-азабицикло[2.2.1]гепт-5-ил; и R0 представляет
где
X5 представляет CH2, C(CH3)2 или CH2CH2;
оба X6 и X7 представляют водород или метил; и
X8 представляет фтор, хлор, бром или йод; или
(2) X4 представляет азепан-1-ил, морфолин-4-ил, пирролидин-1-ил, N(CH3)(CH(CH3)2) или 7-азабицикло[2.2.1]гептан-1-ил; и R0 представляет
где X6, X7 и X8 такие, как указано выше; или
(3) X4 представляет морфолин-4-ил или N(CH3)2; и R0 представляет
где X8 такой, как указано выше;
или его фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболит; (b) фармацевтически приемлемый антиоксидант на основе тяжелого халькогена; и (c) по существу неводный фармацевтически приемлемый носитель, который содержит один или более липидов; где указанное соединение и антиоксидант находятся в виде раствора в носителе.
Кроме того, изобретение относится к перорально доставляемой фармацевтической композиции, содержащей (a) соединение N-(4-(4-((2-(4-хлорфенил)-5,5-диметил-1-циклогекс-1-ен-1-ил)метил)пиперазин-1-ил)бензоил)-4-(((1R)-3-(морфолин-4-ил)-1-((фенилсульфанил)метил)пропил)амино-3-((трифторметил)сульфонил)бензолсульфонамид (ABT-263) или его соль, пролекарство, соль пролекарства или метаболит; (b) фармацевтически приемлемый антиоксидант на основе тяжелого халькогена; и (c) по существу неводный фармацевтически приемлемый носитель, который содержит один или более липидов; где указанное соединение и антиоксидант находятся в виде раствора в носителе. В еще более конкретном варианте осуществления соединение представляет свободное основание ABT-263 или соль бис-гидрохлорид ABT-263 (ABT-263 бис-HCl).
В некоторых вариантах осуществления HCA представляет антиоксидантное соединение формулы II:
где
n равно 0, 1 или 2;
Y1 представляет S или Se;
Y2 представляет NHR1, OH или H, где R1 представляет алкил или алкилкарбонил;
Y3 представляет COOR2 или CH2OH, где R2 представляет H или алкил; и
R3 представляет H или алкил;
где алкильные группы независимо необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбоксила, алкилкарбонила, алкоксикарбонила, амино и алкилкарбониламино; их фармацевтически приемлемой соли; или, если Y1 представляет S и R3 представляет H, его -S-S-димер или фармацевтически приемлемую соль такого димера.
В других вариантах осуществления HCA представляет антиоксидантое соединение формулы III:
где
Y представляет S, Se или S-S; и
R4 и R5 независимо выбраны из водорода, алкила и (CH2)nR6, где n=0-10 и R6 представляет арилкарбонил, алкилкарбонил, алкоксикарбонил, карбоксил или CHR7R8-замещенный алкил, где R7 и R8 представляют независимо CO2R9, CH2OH, водород или NHR10, где R9 представляет водород, алкил, замещенный алкил или арилалкил и R10 представляет водород, алкил, алкилкарбонил или алкоксикарбонил.
В еще одних вариантах осуществления HCA представляет соединение, слаборастворимое в липидах, таким образом, в результате введения HCA в качестве водного исходного раствора носитель в соответствии с такими вариантами осуществления содержит воду. Присутствие слишком большого количества воды может угрожать физической стабильности раствора на липидной основе и может также увеличить частоту образования сульфоксида, нивелирующего благоприятное воздействие добавления антиоксиданта. Поэтому обычно носитель в соответствии с такими вариантами осуществления содержит не более чем примерно 1% масс. воды. (Такой носитель все же является «по существу безводным», как определено в настоящем описании.) Подходящие слаборастворимые в липидах соединения включают сульфиты, бисульфиты, метабисульфиты и тиосульфаты.
Изобретение, кроме того, относится к способу получения композиции, как описано непосредственно выше, включающему:
растворение API (активного фармацевтического ингредиента), который состоит по существу из ABT-263 или его соли, пролекарства, соли пролекарства лили метаболита, по меньшей мере, в фосфолипиде и солюбилизирующем агенте для получения липидного раствора,
необязательно, смешивание нефосфолипидного ПАВ с солюбилизирующим агентом или липидным раствором,
растворение слаборастворимого в липидах антиоксиданта в воде для получения водного исходного раствора и
смешивание водного исходного раствора с липидным раствором для получения перорально доставляемой фармацевтической композиции.
Кроме того, изобретение относится к способу лечения заболевания, характеризуемого апоптотической дисфункцией и/или сверхэкспрессией антиапоптотического белка семейства Bcl-2, включающему пероральное введение индивиду, имеющему заболевание, терапевтически эффективного количества описанной выше композиции. Примеры такого заболевания включают многие неопластические заболевания, включая онкологические заболевания. Определенным иллюстративным типом онкологического заболевания, которое можно лечить в соответствии с настоящим способом, является неходжкинская лимфома. Другим определенным иллюстративным типом онкологического заболевания, которое можно лечить в соответствии с настоящим способом, является хронический лимфолейкоз. Еще одним определенным иллюстративным типом онкологического заболевания, которое можно лечить в соответствии с настоящим способом, является острый лимфолейкоз, например, у педиатрического пациента.
Кроме того, изобретение относится к способу поддержания в кровотоке у пациента, страдающего онкологическим заболеванием, например, пациента, имеющего неходжкинскую лимфому, хронический лимфолейкоз или острый лимфолейкоз, терапевтически эффективной концентрации в плазме ABT-263 и/или одного или более его метаболитов, включающему введение индивиду фармацевтической композиции, содержащей систему лекарственное средство-носитель, которая содержит ABT-263 или его фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболит (например, свободное основание ABT-263 или ABT-263 бис-HCl), в растворе по существу в неводном носителе, который содержит фармацевтически приемлемый антиоксидант на основе тяжелого халькогена и по существу неводный фармацевтически приемлемый носитель, содержащий фосфолипидный компонент и фармацевтически приемлемый солюбилизирующий компонент, где ABT-263 или его соль, пролекарство, соль пролекарства или метаболит и антиоксидант находятся в растворе в носителе; в дозировке, количество которой эквивалентно от примерно 50 до примерно 500 мг ABT-263 в день, при среднем интервале между введением доз от примерно 3 часов до примерно 7 дней.
Дополнительные варианты осуществления изобретения, включая более конкретные аспекты описанных выше вариантов осуществления, будут найдены в следующем детальном описании или станут очевидны из него.
Краткое описание чертежей
Фиг.1 представляет схематическую фазовую диаграмму растворов «IPT», описанных в примере 8. Заштрихованная часть диаграммы представляет область оптимизированной композиции препаративной формы.
Фиг.2 представляет схематическую фазовую диаграмму растворов «IST», описанных в примере 8. Заштрихованная часть диаграммы представляет область оптимизированной композиции препаративной формы.
Подробное описание
Система лекарственное средство-носитель содержит носитель, в котором равномерно распределено, по меньшей мере, одно лекарственное средство. В композициях по настоящему изобретению лекарственное средство (соединение формулы I или его соль, пролекарство, соль пролекарства или метаболит) и антиоксидант, как описано в настоящей заявке, в растворе в носителе, и в некоторых вариантах осуществления система лекарственное средство-носитель составляет по существу всю композицию. В других вариантах осуществления система лекарственное средство-носитель инкапсулирована внутри оболочки капсулы, которая подходит для перорального введения; в таких вариантах осуществления композиция содержит систему лекарственное средство-носитель и оболочку капсулы.
Носитель и система лекарственное средство-носитель представляют собой обычно жидкость, но в некоторых вариантах осуществления носитель и/или система лекарственное средство-носитель может быть твердой или полутвердой. Например, система лекарственное средство-носитель может быть иллюстративно получена растворением лекарственного средства и антиоксиданта в носителе при температуре выше температуры плавления или точки текучести носителя и охлаждением полученного раствора до температуры ниже температуры плавления или точки текучести для получения твердой системы лекарственное средство-носитель. Альтернативно или в дополнение, носитель может содержать твердую подложку, где или на которой адсорбирован раствор лекарственного средства и антиоксиданта, как описано в настоящей заявке.
Композиция по настоящему изобретению является «перорально доставляемой», т.е. адаптированной для перорального введения; однако такая композиция может применяться для доставки лекарственного средства нуждающемуся в нем индивиду другими путями введения, включая без ограничения парентеральный, сублингвальный, буккальный, интраназальный, легочный, местный, трансдермальный, интрадермальный, глазной, ушной, ректальный, влагалищный, внутрижелудочный, внутричерепной, внутрисиновиальный и внутрисуставной пути.
В настоящем описании термины «пероральное введение» и «перорально введенная» относятся к введению индивиду per os (p.o.), то есть введению, при котором композиция немедленно проглатывается, например, с помощью подходящего объема воды или другой приемлемой жидкости. В настоящем описании «пероральное введение» отличается от внутриротового введения, например сублингвального или буккального введения, или местного введения во внутриротовые ткани, такие как периодонтальные ткани, которое не предусматривает немедленного проглатывания композиции.
Терапевтически активные соединения, включая их соли, пролекарства, соли пролекарств и метаболиты, используемые в настоящем изобретении, обычно имеют низкую растворимость в воде, например, менее чем примерно 100 мкг/мл, в большинстве случаев менее чем примерно 30 мкг/мл. Настоящее изобретение может иметь особенные преимущества для лекарственных средств, которые по существу нерастворимы в воде, т.е. имеющих растворимость менее чем примерно 10 мкг/мл. Следует понимать, что водная растворимость многих соединений зависит от pH; в случае таких соединений растворимость, представляющая интерес в настоящем изобретении, находится при физиологически релевантном pH, например, pH от примерно 1 до примерно 8. Так, в различных вариантах осуществления лекарственное средство имеет растворимость в воде, по меньшей мере, в одной точке в диапазоне pH от примерно 1 до примерно 8, менее чем примерно 100 мкг/мл, например, менее чем примерно 30 мкг/мл, или менее чем примерно 10 мкг/мл. В качестве иллюстрации, ABT-263 имеет растворимость в воде при pH 2 менее чем 4 мкг/мл.
В одном варианте осуществления композиция содержит соединение формулы I, как определено выше, или фармацевтически приемлемую соль, пролекарство, соль пролекарства или метаболит такого соединения.
В еще одном варианте осуществления соединение имеет формулу I, где X3 представляет фтор.
В еще одном варианте осуществления соединение имеет формулу I, где X4 представляет морфолин-4-ил.
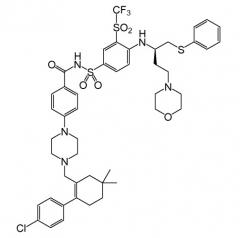
В еще одном варианте осуществления соединение имеет формулу I, где R0 представляет
где X5 представляет O, CH2, C(CH3)2 или CH2CH2; и оба X6 и X7 представляют водород или метил; и X8 представляет фтор, хлор, бром или йод. Иллюстративно, в соответствии с данным вариантом осуществления X5 может представлять CH2 или C(CH3)2, и/или каждый из X6 и X7 может представлять метил, и/или X8 может представлять хлор.
В еще одном варианте осуществления соединение имеет формулу I, где R0 представляет
где X5 представляет O, CH2, C(CH3)2 или CH2CH2; и оба X6 и X7 представляют водород или метил; и X8 представляет фтор, хлор, бром или йод. Иллюстративно, в соответствии с данным вариантом осуществления X5 может представлять CH2 или C(CH3)2, и/или каждый из X6 и X7 может представлять метил, и/или X8 может представлять хлор.
В еще одном варианте осуществления соединение имеет формулу I, где X3 представляет фтор и X4 представляют морфолин-4-ил.
В еще одном варианте осуществления соединение имеет формулу I, где X3 представляет фтор, а R0 представляет
где X5 представляет O, CH2, C(CH3)2 или CH2CH2; оба X6 и X7 представляют водород или метил; и X8 представляет фтор, хлор, бром или йод. Иллюстративно, в соответствии с настоящим вариантом осуществления X5 может представлять CH2 или C(CH3)2, и/или каждый из X6 и X7 может представлять метил, и/или X8 может представлять хлор.
В еще одном варианте осуществления соединение имеет формулу I, где X4 представляет морфолин-4-ил, а R0 представляет
где X5 представляет O, CH2, C(CH3)2 или CH2CH2; оба X6 и X7 представляют водород или метил; и X8 представляет фтор, хлор, бром или йод. Иллюстративно, в соответствии с настоящим вариантом осуществления X5 может представлять CH2 или C(CH3)2, и/или каждый из X6 и X7 может представлять метил, и/или X8 может представлять хлор.
В еще одном варианте осуществления соединение имеет формулу I, где X3 представляет фтор, X4 представляет морфолин-4-ил и R0 представляет
где X5 представляет O, CH2, C(CH3)2 или CH2CH2; оба X6 и X7 представляют водород или метил; и X8 представляет фтор, хлор, бром или йод. Иллюстративно, в соответствии с настоящим вариантом осуществления X5 может представлять CH2 или C(CH3)2, и/или каждый из X6 и X7 может представлять метил, и/или X8 может представлять хлор.
Соединения формулы I могут содержать асимметрично замещенные атомы углерода в R- или S-конфигурации; такие соединения могут присутствовать в виде рацематов или в избытке одной конфигурации относительно другой, например, в энантиомерном соотношении, по меньшей мере, примерно 85:15. Соединение может быть по сущ