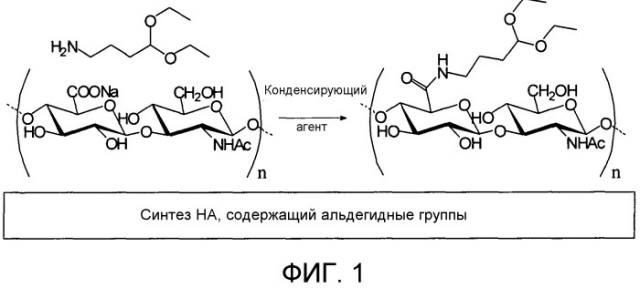
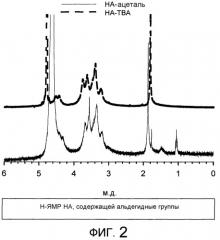
Способ синтеза конъюгатов гликозаминогликанов (gag) с биологически активными молекулами, полимерные конъюгаты и их соответствующие применения
Иллюстрации
Показать всеИзобретение относится к медицине. Описан способ синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами различной природы, включающими низкомолекулярные соединения и макромолекулы. Конкретно, изобретение относится к конъюгации гиалуроновой кислоты (HA) и ее производных с полипептидами и белками с биологической функцией, такими как, например, интерфероны, эритропоэтины, факторы роста, инсулин, цитокины, антитела и гормоны. Изобретение позволяет выделять промежуточные соединения, полученные с помощью частичного или полного взаимодействия GAG с защищенными аминоальдегидами в способе конъюгации. Конъюгаты способны повышать эффективность конъюгированного лекарственного средства и поддерживать ее в течение времени. 6 н. и 19 з.п. ф-лы, 13 ил., 15 пр.
Реферат
Настоящее изобретение относится к способу синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами различной природы, включающими низкомолекулярные соединения и макромолекулы. Конкретно, настоящее изобретение относится к конъюгации гиалуроновой кислоты (HA) и ее производных с полипептидами и белками с биологической функцией, такими как, например, интерфероны, эритропоэтины, факторы роста, инсулин, цитокины, антитела и гормоны.
Применение полимеров в области биомедицины является общеизвестным и широко распространенным. Гидрогели на полимерной основе широко используются, например, для восстановления плотного соединения в хирургических операциях при полостной хирургии, при восстановительной и косметической хирургии, в системах с контролируемым высвобождением, состоящих из желеобразных матриксов, или используются в качестве биоматериалов.
Другой важный пример представляет собой модификацию молекул с фармакологическим действием, содержащих полимерные цепи, которые улучшают растворимость и маскируют молекулы по отношению к процессам деградации, пролонгируя действие молекул.
Наиболее типичным примером в данном контексте является полиэтиленгликоль (ПЭГ), который, хотя и не присутствует в живых организмах, при этом является полностью биосовместимым и неиммуногенным. ПЭГ широко применяется для осуществления действия биологических лекарственных средств (терапевтических белков). Стоит упомянуть, например, пэгилированный альфа-интерферон или пэг-интерферон, который заменил простой рекомбинатный вариант белка, став предпочтительной терапией вирусного гепатита (европейский патент EP0809996). Ограничение функциональности белков с ПЭГ связано с получением конъюгатов с аномальной функциональностью или, в любом случае, с полидисперсными профилями. Кроме того, различные полученные изомеры могут характеризоваться различной биологической активностью, биодоступностью, периодом полужизни, иммуногенной эффективностью.
По этой причине в девяностые годы ПЭГ методом пэгилирования вводили так, чтобы получить белки, модифицированные только в специфических сайтах, среди которых N-концевая область является наиболее доступной благодаря тому, что ее pKa существенно отличается по отношению ко всем другим аминогруппам, присутствующим в белках.
В связи с этим Пепински и сотр. (Pepinsky R.B., Le Page D.J., Gill A., et al. J. Pharmac. Exp. Ther., 2001 297 (3): 1059-1066), конкретно изучали введение ПЭГ-цепи в N-концевую область интерферона-бета 1 (который используется в лечении рассеянного склероза) посредством восстановительного алкилирования полученного из альдегидного производного ПЭГ. Полученный аддукт продемонстрировал лучшую эффективность in vivo благодаря увеличенному периоду полужизни.
Другой белок, который модифицировали с помощью ПЭГ благодаря этому методу, - это G-CSF, фактор роста и активации нейтрофильных гранулоцитов, который Kinstler et al. функционализировали в N-концевой области (патент США № 6153655). Соответствующий продукт (Pegfilgrastim) уже имеется на рынке с 2002 года.
В группе полимеров в области биомедицины биополимеры представляют особый интерес. Некоторые из них естественным образом присутствуют в тканях человека, и обладают свойствами биосовместимости, и неиммуногенны, что характеризует их важную дополнительную ценность в этом контексте. Среди этих биополимеров гликозаминогликаны (GAG) представляют особый интерес, т.е. это неразветвленные полисахариды, имеющие высокую молекулярную массу, состоящие из повторяющихся элементов дисахаридов. GAG, например, обладают структурной функцией в соединительной ткани, сухожилиях и в хряще, или они могут действовать в качестве антикоагулянтов.
Гиалуроновая кислота (HA) представляет собой GAG, который можно обнаружить во внеклеточном матриксе, где у нее структурная роль, вовлеченная в процесс сократительной способности, но, кроме того, она обладает вязкоупругими свойствами дополнительно к тому, что она является агентом гидратации и пролиферации. Благодаря этим конкретным характеристикам, HA и ее производные используются в качестве матрикса для биоматериалов (EP 216453) и систем с контролируемым высвобождением (патентная заявка США № 4582865 и патент США № 4636524; K. Motokawa et al., Journal of Biomedical Materials Research Part A, (2006), pag. 459).
HA также вовлечена в механизмы молекулярного распознавания и регуляции, которые распознаются с помощью клеточных рецепторов, таких как RHAMM (CD168), CD44, LYVEl, Layilin. Специфичность взаимодействия HA с CD44 представляет большую важность. Фактически этот рецептор сверхэспрессируется в большинстве твердых опухолей эпителиального происхождения; с помощью связывания лекарственных средств, имеющих противоопухолевую активность, с HA может применяться активная направленность биополимера, которая дает возможность эндоцитоза и высвобождает противоопухолевое средство внутри неопластической клетки (WO2009001209).
Модификация терапевтических средств с использованием водорастворимых полимеров (как, например, GAG) особо полезна в случае полипептидов, полипептидных гормонов и белков. Этот класс молекул фактически обладает структурой, которая чрезвычайно чувствительна даже к небольшим модификациям, вызванным окружающей средой, в которой они присутствуют. Кроме того, полипептиды и белки обычно обладают временным диапазоном эффективности, очень ограниченным коротким периодом полужизни. Поэтому их функционализация с использованием водорастворимых полимеров чрезвычайно важна, что улучшает также их растворимость, биодоступность и уменьшает иммуногенность.
Способы конъюгации GAG с белками посредством дивинилсульфона (патент США № 7034127, который конкретно относится к IFN), дисульфидных мостиков (патент США № 7417021), известны из уровня техники. Единственный способ, который дает возможность контролировать сайт модификации, - это реакция с образованием дисульфидных мостиков; в этом случае полимер может связываться только сам с собой в соответствующих остатках цистеина в восстановленной форме.
Если полипептидная цепь содержит только один доступный остаток цистеина и в восстановленной форме, то способ модификации фактически является специфическим, но это достаточно редкий случай. Фактически белки часто содержат многочисленные остатки цистеина, но, главным образом, часто случается, что эти остатки уже вовлечены в дисульфидные мостики, чье восстановление включает значительную перестановку, которая может приводить к потере функциональности белка.
Ни один из методов, известных из уровня техники, не дает возможности получения однозначного профиля функциональности, даже с поддержанием биологической активности белка и соответственно эффективно монодисперсного и эффективного продукта.
На основе вышесказанного становится очевидной необходимость создания доступного способа конъюгации биоактивных молекул, таких как белки и полипептиды, с GAG (т.e. HA) без нарушения функциональности белка.
Авторы настоящего изобретения предлагают способ конъюгации с помощью гликозаминогликанов, содержащих биологически активные молекулы (т.e. белки и полипептиды), способные преодолевать ограничения, свойственные предшествующему уровню техники, поскольку они позволяют GAG (таким как HA) связываться без модификации основной структуры белка и риска потери функциональности. Следующая характеристика, которая позволяет отличить конъюгаты между GAG и терапевтическим средством (TA) по настоящему изобретению и конъюгаты, известные из уровня техники, заключается в том, что настоящий способ конъюгации приводит к образованию почти монодисперсного аддукта и не приводит к образованию смеси изомерных продуктов с различными химическими, физическими, биологическими характеристиками, чье поведение, терапевтическая эффективность и токсикологический профиль отличаются.
Кроме того, путем подходящего варьирования некоторых из параметров способа (т.e. pH) также возможно выбрать аминогруппы биологически активной молекулы, с которыми связывается гликозаминогликан; возможно, например, специфическое связывание водорастворимого полимера HA с N-концевой областью.
В случае лекарственных средств, таких как белки и полипептиды, конденсация аминогруппы часто происходит посредством ацилирования, которое приводит к образованию амидов, чей атом азота более не способен к участию в равновесии кислоты-основания.
Способ конъюгации по настоящему изобретению характеризуется тем, что он не подразумевает никакого изменения суммарного заряда, имеющегося на активных частицах, что приводит к трансформации первичного амина во вторичный амин, который поддерживает способность обмена протонов. Это очевидное преимущество по части поддержания биологической активности TA.
Еще более удивительным оказался обнаруженный авторами изобретения факт, состоящий в том, что биоконъюгаты по настоящему изобретению способны повышать эффективность конъюгированного лекарственного средства и поддерживать ее в течение времени (см. Пример 10 конъюгат HA-инсулин).
Конъюгация терапевтического средства с водорастворимым полимером улучшает его характеристики, делая его более растворимым, биодоступным и более активным. В отличие от водорастворимых полимеров, описанных в современной науке и технике (таких как, например, полиэтиленгликоль, ПЭГ), использование гликозаминогликанов дает возможность получения отличной системы доставки лекарственного средства, которая способна направлять терапевтическое средство со специфичностью, недоступной другим типам полимеров. Эта специфичность определяется сложной системой рецепторных взаимодействий, которые включают GAG. Кроме того, использование биополимеров, которые хотя и взаимодействуют с клеточными рецепторами, но не стимулируют иммунологического ответа, приводят в результате к синергическому действию с более высокой эффективностью.
Настоящее изобретение описывает способ синтеза конъюгатов гликозаминогликанов (GAG) с биологически активными молекулами, включающий следующие стадии:
a) модификация GAG по меньшей мере одной альдегидной группой (CHO) путем взаимодействия GAG со спейсерной молекулой (SP), где указанная спейсерная молекула включает в качестве первой функциональной группы одну или несколько альдегидных групп (SP-CHO), причем указанные альдегидные группы (SP-CHO) необязательно защищены, и в качестве второй функциональной группы нуклеофильную группу, подходящую для конъюгации с GAG;
a1) гидролиз активированного промежуточного соединения с помощью водных растворов кислот, когда указанные одна или несколько альдегидных групп защищены;
b) взаимодействие аддукта, полученного на стадии a) или a1) по меньшей мере с одной биологически активной молекулой (TA), характеризующейся тем, что она включает функциональную группу, способную к взаимодействию с альдегидной группой.
Гидрогели, состоящие из гиалуроновой кислоты, функционализированной с помощью амино- или альдегидной групп (защищенных или не защищенных), известны из уровня техники, однако эти производные затем поперечно сшивают с другими молекулами того же полисахарида, возможно, модифицированного с помощью различных функциональных групп, таких, которые реагируют с аминогруппой или с альдегидной группой исходной функционализированной гиалуроновой кислоты (EP1757314; Bulpitt P., et al. J. of Biomedical Materials Research, 1999 47(2): 152-169).
Как уже было упомянуто, гликозаминогликаны (GAG) представляют собой неразветвленные полисахариды, имеющие высокую молекулярную массу, состоящие из повторяющихся элементов дисахаридов. Общая характеристика GAG - это присутствие карбоксильной функциональной группы на дисахаридном элементе, которая имеется в естественном состоянии в кислой форме или в форме соли, генерируя таким образом полианионы. В настоящем изобретении аббревиатура GAG индифферентно указывает на кислую форму или форму соли полисахаридов, и в этом случае наиболее типичные противоионы - это щелочные и щелочноземельные металлы, такие как натрий, калий, магний, кальций. Полимеры, классифицированные как GAG, включают гиалуроновую кислоту, хондроитинсульфат, дерматансульфат, кератансульфат, гепарин, гепарансульфат. GAG, используемые по настоящему изобретению, могут быть представлены в нативной форме полусинтетических производных, включающих соли четвертичного аммония, эфиры карбоновых кислот, O-эфиры, амиды, перкарбоксилированные производные, O-сульфатированные производные, N-деацетилированные производные, N-сульфатированные производные или смешанные производные, характеризующиеся одновременным присутствием этих модификаций. Аббревиатура GAG используется далее для обозначения как упомянутых полимеров в нативной форме, так и соответствующих полусинтетических производных.
Даже если GAG, представленные в виде обычной структурной формулы, не несут альдегидной группы, стоит упомянуть, что естественное равновесие, которое устанавливается в растворе между открытой формой и закрытой формой области восстановления, проходит через образование функциональной альдегидной группы. Это присутствие количественно чрезвычайно ограничено, однако длина полимерных цепей создает низкое количество областей восстановления. Когда молекулярная масса GAG уменьшается, с другой стороны, соответствующее количество областей восстановления, доступных в альдегидной форме, прогрессивно увеличивается до тех пор, пока оно не становится количественно приемлемым для олигомеров GAG; это единственный случай, в котором области восстановления могут эффективно использоваться для воздействия на способ конъюгации, описанный в настоящем документе.
Во всех других случаях, предполагающих, что альдегидная группа скорее нестабильна даже в мягких условиях, удобно вводить ее синтетически в водорастворимый полимер в форме защищенного альдегида.
Таким образом, возможно выделение активированного промежуточного продукта, который затем реагирует с TA, без необходимости контакта всех компонентов в одной реакционной смеси.
Конъюгаты согласно настоящему изобретению соединены с терапевтическим средством TA, связанным с водорастворимым полимером в виде вторичного или третичного амина. Присутствие альдегидной группы (возможно защищенной, как описано на стадии a)) в качестве средства для обеспечения возможности образования связи между терапевтическим средством и GAG и способ синтеза, осуществленный авторами изобретения, проиллюстрированные в настоящем документе, следует рассматривать как отличительный признак настоящего изобретения.
Аддукт, полученный таким образом на стадии a), достаточно стабилен, чтобы его можно было выделить, но после высвобождения альдегидных групп он доступен по отношению к взаимодействию модификации с терапевтическим средством, представляющим интерес.
Полученный конъюгат может быть описан следующей общей формулой:
GAG-SP-TA,
где GAG обозначает гликозаминогликан, SP - спейсер и TA терапевтическое средство.
В переводе на систему обозначения в данном способе модификации получали следующее:
Стадия a. GAG+SP-(CHO) → GAG-SP-(CHO)
Стадия a1. GAG-SP-(CHO) → GAG-SP-CHO
Стадия b. GAG-SP-CHO+TA → GAG-SP-TA,
где CHO обозначает функциональную альдегидную группу, защищенную, если она находится между группами.
Данная защита может быть легко получена с помощью методов органического синтеза, известных специалисту в данной области. Подходящая форма защиты, например, заключается в использовании гемиацеталей или ацеталей, полученных посредством взаимодействия альдегидов с алифатическими или арилалифатическими спиртами или с диолами, включающими, например, метанол, этанол, н-пропанол, изопропанол, н-бутанол, втор-бутанол, трет-бутанол, изобутанол, этиленгликоль, пропиленгликоль, 1,3-пропандиол, 1,4-бутандиол и структурно подобные молекулы, способные к взаимодействию с альдегидами с образованием выделяемых ацеталей. Продукт стадии (a) характеризует то, что определяется как "активированное промежуточное соединение" или "активированное, но выделяемое полусинтетическое промежуточное соединение".
Химические взаимодействия, используемые для функционализации GAG с помощью спейсеров для получения активированного промежуточного соединения, могут выбираться каждый раз с использованием функциональных групп, присутствующих в полимере или в соответствующем полусинтетическом производном, т.e. карбоксильной группы, гидроксильных групп (4 для каждого повторяющегося элемента), иногда присутствуют в форме алкил- или О-сульфатированных эфиров, N-ацетильной группы, N-сульфатированной группы. Кроме того, условия конденсации между GAG и спейсером должны быть такими, чтобы не изменить альдегидную группу или не удалить ее защиту, если она есть.
Спейсер должен содержать функциональную группу, подходящую для ковалентного соединения с GAG, предпочтительно нуклеофильную, такую как, например, аминогруппа или спиртовая группа. Аминогруппа в свободной форме или в форме соли с использованием подходящих солей является предпочтительной для ее большей нуклеофильности. Спейсерная молекула SP-(CHO) предпочтительно представляет собой аминоальдегид, еще более предпочтительно защищенный в виде ацетали.
Примеры молекул, которые могут использоваться в качестве спейсера типа GAG-SP-(CHO), включают аминоальдегидные ацетали, состоящие из
• аминогруппы, свободной или в форме соли,
• углеводородной цепи, предпочтительно алифатической, с количеством углеродных атомов в интервале от 1 до 20,
• альдегидной группы, предпочтительно в форме ацеталя согласно следующей схеме, в которой n находится в интервале от 1 до 20, тогда как R и R' могут быть алифатическими или арилалифатическими остатками, одинаковыми или различными, или одинаковыми цепями, которые несут различные гидроксильные группы
Алифатическая цепь дополнительно к линейной форме может быть разветвленной или может содержать арильные группы.
Авторы изобретения подтвердили, что удобный способ конденсации включает образование амидов, в которых GAG участвует в качестве карбоновой кислоты, а спейсер в качестве амина. Этот тип взаимодействия осуществляется согласно методам органического синтеза, известным специалисту в данной области, и может проводиться, например, с помощью конденсирующих агентов, которые стимулируют нуклеофильную атаку на карбоновые кислоты. Эти реагенты включают те, которые могут использоваться в пептидном синтезе в гомогенной или гетерогенной фазе. Примеры этих агентов представляют собой карбонилдиимидазол, дисукцинимидил карбонат, карбодиимиды, такие как например, l-этил-3-(3-диметиламинопропил)карбодиимид (EDC); N,N'-дициклогексилкарбодиимид; N-аллил-N'-(β-гидроксиэтил)карбодиимид N-(α-диметиламинопропил-N'-трет-бутилкарбодиимид; N-(α-диметиламинопропил)-N'-(β-бромаллил)карбодиимид; 1-(3-диметиламинопропил)-3-(6-бензоиламиногексил)карбодиимид; циклогексил-β-(N-метилморфолин)этилкарбодиимид, п-толуолсульфонат (CMC) и подобные продукты.
Реакция может проводиться в водной среде или в органическом растворителе при температуре в интервале от -10 до 70°C в зависимости от типа используемой активации. Когда проводят получение в безводной среде, то удобно использовать соли GAG, которые более растворимы в этих условиях, например соли тетраалкиламмония. Противоионы должны в любом случае быть исключены посредством процесса ионообмена, проводимого в отношении модифицированного полимера перед его удалением.
Тетрааммонийные соли GAG (конкретно, HA), как правило, растворимы в апротонных полярных растворителях, таких как N-метилпирролидон (NMP), диметилсульфоксид (DMSO), диметилформамид (DMF), которые подходят в качестве реакционной среды. Использование этих растворителей удобным образом совпадает с использованием карбонилдиимидазола в качестве конденсирующего агента, чьему действию способствует слабо кислая среда благодаря небольшим количествам сильных кислот, например газообразной соляной кислоты, пропускаемой через раствор метансульфокислоты. Другие органические растворители, подходящие для осуществления этого типа синтеза активированного промежуточного соединения, представляют собой органические карбонаты, включающие пропиленкарбонат, диэтилкарбонат и, как правило, органические карбонаты, замещенные алифатическими, ароматическими или арилалифатическими цепями.
Реакцию прекращают путем добавления насыщенного раствора галогенида щелочного металла, например NaCl, NaBr, KCl, KBr. Гидратация реакционной смеси дезактивирует стимуляторы образования амидных связей, тогда как соль, добавляемая в таком количестве, чтобы быть в сильном избытке по отношению к молярному количеству повторяющегося элемента GAG, вызывает эффективный ионообмен. Требование стехиометрического избытка удовлетворяется путем добавления количества насыщенного раствора галогенида щелочного металла в интервале от 0,5% до 30% об. и предпочтительно от 5 до 15% по об.
Соответствующую соль щелочного металла и активированного промежуточного соединения последовательно очищают с помощью диализа, затем лиофилизируют. Хотя этот продукт можно выделить и он стабилен, при этом он активен по отношению к последующей реакции функционализации с терапевтическими средствами, содержащими функциональные группы, восприимчивые к взаимодействию с альдегидами.
Альтернативный способ очистки/выделения активированного промежуточного соединения состоит в применении циклов осаждения-промывания с использованием смеси растворителей соответствующей полярности. Осаждение-промывание может осуществляться, например, с использованием спиртов, таких как метанол, этанол, н-пропанол, изопропанол и высшие гомологи, возможно, смешанные с водой; другие подходящие растворители представляют собой ацетон, этилацетат, тетрагидрофуран, диоксан, ацетонитрил, апротонные полярные растворители (например, диметилформамид, диметилсульфоксид, н-метилпирролидон, н-метилацетамид), органические карбонаты. Каждый из вышеупомянутых растворителей может использоваться индивидуально или в смеси с любым растворителем или с водой с целью получения с большей точностью полярности и других физико-химических характеристик. Смеси, включающие вышеуказанные спирты, ацетон и воду, являются предпочтительными.
Стадия (b), которая описывает конденсацию между GAG-SP-(CHO) и TA, происходит через первую стадию a1) для высвобождения альдегидной группы (когда она защищена), которое состоит из гидролиза ацеталя, который осуществляется путем обработки водными растворами кислот согласно стандартным методам, известным специалистам в данной области.
Указанная стадия гидролиза a1) активированных промежуточных соединений с использованием водных растворов кислот для высвобождения альдегидной группы предпочтительно осуществляется при pH в интервале от 1,5 до 3,0, предпочтительно при pH в интервале от 2,0 до 2,5, при температуре в интервале от 25 до 65°C, предпочтительно от 40 до 60°C, в течение по меньшей мере 30 мин.
Свободный альдегид теперь является восприимчивым к нуклеофильной атаке со стороны терапевтического средства, активированного через аминогруппу, присутствующую в молекуле TA, которая приводит к образованию имина, восстанавливаемого до амина посредством неорганических гидридов, как правило, используемых в реакциях восстановительного аминирования, например, с использованием цианоборгидрида, алюмогидрида лития, раствора боргидрида и тому подобных.
Активные компоненты с фармацевтическим действием, представляющим интерес в рамках настоящего изобретения, включают, например, "низкомолекулярные соединения" с фармакологическим действием и/или полипептиды, гормоны, белки, гликопротеины, ферменты, цитокины, факторы роста или факторы клеточной дифференцировки, антитела, терапевтические полимеры, нуклеиновые кислоты или их комбинацию. Согласно предпочтительному воплощению настоящего изобретения "активный компонент", который может конъюгироваться с HA с использованием способа, описанного в настоящем изобретении, включает
полипептиды и/или белки, конкретно
- иммуномодуляторы, конкретно белки, принадлежащие к семейству интерферонов, такие как, например, интерфероны типа I, т.е. те, которые связываются с одним рецептором IFNα, который дополнительно к IFNα включает IFNβ и IFNω; интерфероны типа II и типа III, т.е. интерфероны, которые связываются с рецептором IFNγ и IFNλ соответственно;
- факторы роста, конкретно
1. Эритропоэтины и вообще молекулы, идентифицированные как ESA (агент, стимулирующий эритропоэз), включающие эритропоэтин-α и эритропоэтин-β, эритропоэтин-ω, эритропоэтин-δ, дарбепоэтин, CERA и вещества, генерированные или полученные на их основе, такие как сшитые белки, полученные при стимулировании эритропоэза;
2. Факторы, которые стимулируют гемопоэз, такие как факторы GM-CSF, G-CSF, которые также могут использоваться в области онкологии;
3. Факторы роста для костей и хряща, включающие белки, принадлежащие к семейству костного морфогенетического белка (BMP), такие как например, BMP1, BMP2, BMP3, BMP4, BMP5, BMP6, BMP7 (также обозначаемый в литературе как OP1), BMP8a, BMP8b, BMP10, BMP15, BMP9, также известный как GDF2 (фактор дифференцировки 2), белки, принадлежащие к суперсемейству TGF-бета, VEGF, PDGF, белки, принадлежащие к семейству FGF;
- цитокины и их рецепторные антагонисты, такие как, например, IL2, TNF с его растворимыми рецепторами или соответствующие моноклональные антитела; IL1-ra (рецепторный антагонист IL1 для лечения артрита и ревматоидного артрита) и, как правило, растворимые рецепторы провоспалительных цитокинов;
- гликопротеины, конкретно лубрицин;
- ферменты: конкретно супероксиддисмутаза (SOD); рибонуклеаза и глюкоцереброзидаза;
- антитела: конкретно, моноклональные антитела или их конъюгаты или сшитые белки; моноклональные антитела, которые вызывают противоопухолевое действие; моноклональные антитела, которые вызывают противовоспалительное действие;
- гормоны: белковые гормоны или по меньшей мере частично содержащие полипептидную цепь, конкретно кальцитонин, инсулин и его аналоги и гормон роста (GH или hGH).
Терапевтические средства, содержащие аминогруппы, не принципиальные для биологического функционирования:
- противоопухолевые лекарственные средства, конкретно:
1. Таксаны, алкалоиды барвинка; камптотецины;
2. Замещенные мочевины;
3. Комплексы платины, золота, серебра и других металлов, используемых, например, в терапии опухолей, или остеоартрита, и/или ревматоидного артрита, или бактериостатические/противобактериальные агенты;
4. Метотрексат, триметрексат, пеметрексат, тетрагидрофолат;
5. Аналоги пиримидина; цитидин, пурин;
6. Антибиотики для лечения онкологических заболеваний и аналоги; антрацендионы;
- противовирусные средства и антибиотики;
- протеазные и полимеразные ингибиторы;
- противовоспалительные, анальгезирующие, анестетические, обезболивающие лекарственные средства с центральным или периферическим действием;
- наркотики опиатного или неопиатного ряда;
- стероиды;
- миноксидил (обычно используемый в дерматологии).
Нуклеиновые кислоты, конкретно
1. Малая интерферирующая РНК (или короткая интерферирующая РНК, общеизвестная как киРНК (siRNA) - это молекула РНК длиной от 20 до 25 нуклеотидов. Более конкретно, киРНК вовлечена в ингибирование экспрессии одиночных генов, и их использование для лечения макулярной дегенерации в настоящее время находится на стадии эксперимента).
2. МикроРНК (микроРНК, миРНК (miRNA), представляет собой короткую некодирующую молекулу РНК, которая модулирует экспрессию специфических генов-мишеней. Таким образом, они могут функционировать в качестве опухолевых супрессоров в отношении специфических злокачественных гемопоэтических образований).
3. Антисмысловая РНК
Вещества, перечисленные выше, обозначаются далее как "терапевтические средства" (сокращенно TA) или "активные компоненты".
Молекулярная структура TA должна нести функциональную группу, способную к взаимодействия с альдегидами, например аминогруппу. Если этой группы нет в TA, то она может быть введена посредством реакций органического синтеза, известных специалистам в данной области. Таким образом, фактически возможно связать любую молекулу с GAG.
В рамках настоящего изобретения особый интерес представляет применение гиалуроновой кислоты (HA) и ее солей, указанных выше. HA, используемая по настоящему изобретению, может быть получена из любого источника; она может быть получена, например, путем ферментативной или биотехнологической экстракции из петушиного гребня, и она имеет молекулярную массу в интервале от 400 до 3×106 Да, предпочтительно от 1×103 Да до 1×106 Да, еще более предпочтительно от 10000 до 750000 Да.
Реакция модификации по изобретению может применяться как к полисахариду как таковому, так и к ранее модифицированному полисахариду. Таким образом получают молекулярные сетки (Molecular networks), начиная с гиалуроновой кислоты, модифицированной различными способами согласно известным методам, и конкретно:
- HA в форме соли с органическими и/или неорганическими основаниями (EP 138572 B1);
- HYAFF®: эфиры HA со спиртами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда, с процентом этерификации, который может варьироваться согласно типу и длине используемого спирта, предпочтительно, от 20 до 80%, тогда как оставшийся процент неэтерифицированной HA может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 216453);
- HYADD®: амиды HA с аминами алифатического, арилалифатического, циклоалифатического, ароматического, циклического и гетероциклического ряда с процентом амидирования 0,1-50%, тогда как оставшийся процент HA, не подвергнутой амидированию, может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 1095064);
- O-сульфатированные производные HA до 4-й степени сульфатирования (EP 702699);
- ACP®: внутренние эфиры HA с процентом этерификации не выше чем 20%, предпочтительно от 0,05 до 10% этерификации, тогда как оставшийся процент неэтерифицированной HA может быть превращен в форму соли с использованием органических и/или неорганических оснований (EP 341745);
- деацетилирование HA: эти производные получают путем деацитилирования остатков N-ацетилглюкозамина, присутствующих в HA, с процентом деацитилирования предпочтительно в интервале от 0,1 до 30%, тогда как все карбоксильные группы HA могут быть превращены в форму соли с использованием органических и/или неорганических оснований (EP 1313772);
- HYOXX™: перкарбоксилатные производные HA, полученные в результате окисления первичного гидроксила фракции N-ацетилглюкозамина со степенью перкарбоксилирования 0,1-100% и предпочтительно от 25 до 75%. Все карбоксильные группы HA могут быть превращены в форму соли с использованием органических и/или неорганических оснований (EP 1339753).
Согласно предпочтительному воплощению изобретения способ конъюгации HA и терапевтических средств включает следующие стадии:
a) взаимодействие модификации HA с помощью защищенных аминоальдегидов SP-(CHO), в которых HA участвует во взаимодействиях с карбоксильной группой, которая образует амид с амином аминоальдегида. Эту ступень проводят, начиная с HATBA (тетрабутиламмониевая соль HA) или с другой соли, растворимой в органическом апротонном полярном растворителе (DMSO, NMP, DMF, органические карбонаты). Активированное, но выделяемое промежуточное соединение получают из этой ступени;
a1) гидролиз активированного промежуточного соединения, т.е. HA-SP-(CHO) → HA-SP-CHO для высвобождения альдегидной группы: реакция с фосфорной кислотой при pH в интервале 1,5-3, предпочтительно при pH в интервале от 2 до 2,5, при температуре в интервале от 25 до 65°C, предпочтительно от 40°C до 60°C, в течение по меньшей мере 30 минут;
b) взаимодействие конъюгации активированного промежуточного соединения с молекулой TA, предпочтительно с белком. Путем добавления белка в восстанавливающих условиях с использованием цианоборгидрида натрия происходит образование имина и, таким образом, амина. Если выбранное терапевтическое средство представляет собой полифункциональное соединение, то существует возможность создания различных позиционных изомеров с различными химическими, физическими и биологическими характеристиками. Это состояние, как правило, подтверждается в случае белков, таких как, например, интерферон, который имеет 12 потенциальных сайтов связывания. Путем изменения pH, при котором осуществляется эта реакция, генерируют специфическую функционализацию в N-концевой области (pH=6,0) со всеми преимуществами, которые это подразумевает, или функционализацию HA, связанной с белком в различных точках, по невоспроизводимой схеме (pH≥7,5).
Химические взаимодействия, используемые для получения конъюгатов согласно настоящему изобретению, дают возможность эффективного выбора профиля функционализации.
Этот важный результат достигается благодаря использованию альдегидной группы, чья особенная реакционноспособность по отношению к нуклеофильным атакам дает возможность достаточной селективности по отношению к нуклеофильной силе входящей группы. Специфичные условия для соответствующего оказания влияния этой селективности определяются от случая к случаю посредством прогрессивной оптимизации. Возвращаясь к примеру наиболее важных полифункциональных активных компонентов, т.е. белков, нуклеофильные аминогруппы могут находиться в положениях с различной доступностью, но, кроме того, могут отличаться по отношению к их силе в качестве оснований, выраженной в pKa. Аминогруппы в ε-положении, присутствующие в остатках лизина, как правило, демонстрируют pKa в интервале от 9,3 до 9,5, тогда как аминогруппы в α-положении у карбоксила имеют pKa, как правило, в интервале от 7,6 до 8. С целью способствования взаимодействию аминов в ε-положении процесс конденсации должен проводиться при pH выше чем 8,0, предпочтительно в интервале от 8,5 до 9,0; с другой стороны, с целью способствования реакционноспособности аминов в N-концевой области pH должно быть в интервале 5-6,5 и предпочтительно в интервале 5,5-6,2. Этот второй случай является наиболее важным, поскольку белки, как правило, содержат только одну свободную α-аминогруппу, расположенную в N-концевой области. Установленные реакционные условия, когда главным образом реагирует данная аминогруппа, приводят к образованию почти монодисперсного конъюгата между GAG и белками.
Хотя указанные значения в основном характеризуют белки, представляющие интерес для настоящего изобретения, они являются показательными, поскольку они могут слегка варьироваться для различных молекул.
Эта процедура синтеза дает возможность получения биоактивных конъюгатов, обладающих по существу более высокой эффективностью по отношению к конъюгатам, известным из уровня техники. Путем исследования биологических свойств этих новых конъюгатов авторы изобретения фактически обнаружили по существу превосходящие характеристики по отношению к полимерным конъюгатам, известным из уровня техники.
Конкретно, конъюгаты по изобретению, полученные после модификации с использованием гиалуроновой кислоты, поддерживают биологические свойства как активного компонента, так и исходного полисахарида, но они характеризуются различными механическими и реологическими свойствами. Условия, при которых осуществляется процесс конденсации, такие, что не происходит модификации биологической функциональности TA.
Авторы изобретения фактически применили способ синтеза согласно настоящему изобретению для синтеза новых биоконъюгатов:
• между гиалуроновой кислотой (HA) и интерфероном (IFNα)
• между гиалуроновой кислотой (HA) и гормоном роста (hGH)
• между гиалуроновой кислотой (HA) и РНКазой А
• между гиалуроновой кислотой (HA) и инсулином
• между гиалуроновой кислотой и кальцитонином лосося (HA-sCT)
• между гиалуроновой кислотой и IL1-ra
• между гиалуроновой кислотой и лубрицином, которые, таким образом, являются задачей настоящего изобретения.
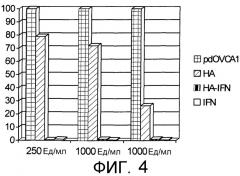
Получение конъюгата HA-IFNα описано в Примере 3. Рекомбинантный человеческий IFN ал