Пэгилированные соединения рекомбинантного гормона роста человека
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается фармацевтической композиции для стимуляции роста и репродукции клеток у человека и других животных, содержащей подходящие фармацевтические наполнители и также содержащей конъюгат пролекарства человеческого гормона роста, содержащий полиэтиленгликоль. Группа изобретений также касается способа получения указанного конъюгата. Группа изобретений обеспечивает более длительную рчГР активность по сравнению с немодифицированным рчГР, что позволяет снижать дозу и режим введения, понижать уровень липоатрофии. 3 н. и 10 з.п. ф-лы, 27 пр., 11 ил., 2 табл.
Реферат
Область техники
Данное изобретение относится к фармацевтическим композициям, содержащим подходящие фармацевтические наполнители и также содержащим клинически эффективное количество ПЭГилированного пролекарства рекомбинантного гормона роста человека, которые могут вводиться менее часто, чем доступные продукты гормона роста человека, и не вызывают липоатрофию в месте инъекции. Данное изобретение также относится к таким пролекарствам.
Предшествующий уровень техники
Гормон роста (ГР) представляет собой гормон, который стимулирует рост и репродукцию клеток у человека и других животных. Он представляет собой 191-аминокислоту, одноцепочечный полипептидный гормон, который синтезируется, хранится и выделяется в соматотрофных клетках в боковых крыльях передней доли гипофиза. Гормон также известен как соматотропин, если имеет отношение к гормону роста, полученному методом рекомбинантной ДНК, и обозначается как "рчГР".
Гормон роста имеет множество функций в теле, наиболее значимой из которых является увеличение роста в детстве, и существует несколько заболеваний, которые могут быть вылечены с помощью терапевтического применения ГР.
Эффект от дефицита гормона роста сильно варьируется в зависимости от возраста, в котором он возникает. У детей недостаток роста и низкорослость являются основными проявлениями дефицита ГР. Он также может вызывать половую недоразвитость. У взрослых эффект от дефицита выражен слабее и может включать дефицит силы, энергии и костной массы, а также повышенный сердечнососудистый риск.
Существует множество причин дефицита ГР, включая мутации определенных генов, врожденный порок развития, включая гипоталамус, и/или переднюю долю гипофиза, и повреждения гипофиза при травмах, хирургическом вмешательстве или заболевании.
Дефицит лечат введением внешнего ГР. Все применяемые в настоящее время ГР являются биосинтетической версией человеческого ГР, полученной методом рекомбинантной ДНК. ГР применяют в качестве заменяющей терапии у детей и взрослых, страдающих дефицитом ГР, возникшим либо в детстве (после завершения фазы роста), либо во взрослом состоянии (обычно в результате приобретенной опухоли гипофиза). У таких пациентов улучшения могут включать снижение массы жировой ткани, повышение массы нежировой ткани, улучшение плотности костей, улучшение липидного профиля, снижение факторов сердечнососудистого риска и улучшение психосоциального здоровья.
Genentech Inc (US) первые клонировали рчГР и описали это в патенте ЕР-В 22242. По данным на 2006, синтетические гормоны роста, доступные в Соединенных Штатах и Европе (и их производители) включают Нутропин (Genentech), Хуматроп (Eli Lilly), Генотропин (Pfizer), Нордитропин (Novo Nordisk), Сайзен (Merck Serono) и Омнитроп (Sandoz).
Хотя методы молекулярной биологии значительно повышают доступность многих белков и/или полипептидов (далее обозначенных как белки), терапевтическое применение указанных белков часто тормозится другими факторами, такими как короткий период полувыведения плазмы из-за почечного и рецептор-опосредованного клиренса, агрегации, протеолитического разложения, плохой биодоступности и физических свойств, которые исключают эффективность составов.
Механизм улучшения доступности белков заключается в слиянии белка с соединениями, используемыми для получения производных, которые включают, но не ограничены ими, полиэтиленгликоль и полипропиленгликоль. Некоторые из этих признанных преимуществ включают: пониженную иммуногенность и антигенность, повышенную продолжительность действия и измененные фармакокинетические свойства. [Veronese, F.M. "Enzymes for Human Therapy: Surface Structure Modifications," Chimica Oggi, 7: 53-56 (1989)] (Ссылка 5).
С помощью ПЭГилирования рчГР можно улучшить характеристики молекулы для медицинского применения через повышение периода полувыведения in vivo (что позволяет снизить дозу или частоту дозирования), улучшение ее стабильности и снижение ее антигенности, или их сочетание.
В общем, такой тип модификации молекулы хорошо известен в данной области техники, и существует множество патентов, доступных из литературных источников, которые описывают эту концепцию. Например, ПЭГилированный эритропоэтин (ЭПО) от Hofmann La Roche описан в ЕР-В 1196443, в котором заявляется специфический линкер, содержащий ПЭГ, ковалентно связанный с ЭПО, ПЭГилированный интерферон альфа, описанный в ЕР-В 975369, от компании Nektar/La Roche, и другой ПЭГилированный интерферон альфа в ЕР-В 1562634 от компании Hofmann La Roche.
Полагают, что in vivo клиренс рчГР происходит по двум представленным ниже механизмам. Первый представляет собой почечный клиренс, в котором рчГР выводится из кровотока почечной клубочковой фильтрацией. Почечный клиренс рчГР хорошо описан, и ПЭГилирование синтетического рчГР поэтому является очевидным выбором для решения этой проблемы. Почечный клиренс составляет 25-53% от общего клиренса рчГР (Girard, J. Mehls, O.J. Clin. Invest. 1994 March; 93 (3): 1163-1171, ссылка 3).
Вторым механизмом является печеночный клиренс (в печени). Поглощение ГР печенью вызывается рецептор-опосредованным эндоцитозом с последующей лизосомной деградацией.
Третьим механизмом является рецептор-опосредованный клиренс в других тканях, таких как хондроциты хрящей. При снижении сродства связывания ГР с рецептором ГР путем ПЭГилирования рецептор-опосредованный клиренс снижается.
Однако существуют определенные проблемы с введением рчГР. Одним из основных недостатков подкожного введения рчГР является возникновение липоатрофии у пациентов, получающих лечение.
Липоатрофия - это медицинский термин, применяемый для локализированной потери жировой ткани. Композиции для подкожного введения рчГР вызывают проблемы липоатрофии, которая, предположительно, вызывается высокой локальной концентрацией комплекса гормона роста в месте инъекции.
У Büyükgebiz A. et аl. в публикации в J.Pediatr. Endocrinol. Metab. 1999 Jan-Feb; 12 (1): 95-7 есть описание такой истории болезни (ссылка 1). Это отчет по пациенту с выделенным дефицитом ГР из-за делеции 6,7 т.п.н. гена, который получал высокую дозу рчГР, и у которого развивались локальные липоатрофии в местах инъекций без определения каких-либо антител через 6 лет после лечения. Этиология липоатрофии предположительно объясняется прямым липолитическим эффектом высоких доз рчГР.
Полагают, что липоатрофия, связанная с введением рчГР, вызывается активностью самого рчГР, более высокими концентрациями и пролонгированным воздействием. Такие высокие концентрации возникают в месте инъекции.
Шанс того, что высокая активность гормона роста аккумулируется рядом с местом инъекции, становится даже более высоким, если рчГР ПЭГилирован, из-за увеличенного времени пребывания. При применении составов ПЭГилированного рчГР ткань подвергается продолжительному и усиленному воздействию гормона роста из-за того, что ПЭГилированный конъюгат обладает активностью, необходимой для фармакологического действия, а диффузия конъюгата ограничена из-за размера конъюгата. Результатом является повышенный липолиз в месте инъекции.
В WO-A 2005/079838 описан ПЭГилированный чГР, где фрагмент чГР присоединен к полиэтиленгликольному полимеру через функциональную аминогруппу, что может считаться прочной связью из-за стабильности аминогруппы. Примером такого соединения ПЭГилированного чГР, которое вызывает липоатрофию, является соединение РНА-794428. Соединение РНА-794428 является ПЭГилированным рчГР и также описано в WO-A 2005/079838 от компании Pharmacia (приобретена Pfizer), a также описано в Horm. Res. 2006; 65 (suppl. 4): 1-213, CF1-98 ГР/IGF Treatment в статье "First in-human study ofPEGylated recombinant human growth hormone", Philip Harris et al. (ссылка 4).
Согласно информации по клиническим исследованиям, опубликованным на www.clinicaltrials.gov, исследования закончились 10 декабря 2007. Решение Pfizer's закончить программу было вызвано липоатрофией в месте инъекции, которая была отмечена на клинической Фазе 2 исследований после однократной инъекции РНА 794428.
В WO-A 2006/102659 (Nektar) также описывается и предлагаются конъюгаты рчГР-ПЭГ (линейного и разветвленного типа) через аминовую связь. Проблема, решаемая в WO-А 2006/102659, описана в параграфе [0005] на странице 2. Согласно заявителю, решаемой проблемой является пониженная частота дозирования. Так как терапия рчГР обычно требует ежедневных инъекций, пациентам, и в частности, педиатрическим пациентам, не нравится неудобство и дискомфорт, связанный с таким режимом. Решение, описанное в Nektar's WO-A, заключается в предоставлении новых конъюгатов ПЭГ-рчГР.
В таблице 6 [0257] WO-A можно увидеть, что конъюгаты ПЭГ-рчГР обладают достаточно низкой активностью т vitro по сравнению с природным гормоном роста без ПЭГ. Несмотря на низкую активность т vitro, конъюгаты ПЭГилированного рчГР активны in vivo. Более подробная информация дана в [0261]: "Хотя предварительные in vitro результаты позволяют предположить, что увеличение количества ПЭГ, присоединенного к чГР, снижает его способность стимулировать рецептор чГР, основываясь на предварительных in vivo результатах, судя по всему, снижение биодоступности более чем уравновешивается повышенным периодом полувыведения и/или доступностью в плазме, что позволяет сделать заключение, что представленные здесь конъюгаты обладают превосходным фармакодинамическим действием in vivo по сравнению с немодифицированным рчГР при идентичном режиме дозирования".
В WO-A 2006/102659 (Nektar) не описаны саморасщепляемые линкеры - т.е. просто отмечается, что конъюгаты ПЭГ-рчГР являются активными in vivo, хотя их in vitro активность значительно снижена. Проблема липоатрофии не рассматривается.
Решением проблем с получением желаемых свойств пониженной липоатрофии и пониженной частоты инъекций у ПЭГилированного конъюгата чГР является применение пролекарства. Пролекарством является любое соединение, которое претерпевает биопревращение перед проявлением фармакологического эффекта. Пролекарства, таким образом, могут рассматриваться как лекарственные средства, содержащие специализированные нетоксичные защитные группы, применяемые в переходном состоянии для изменения или удаления нежелательных свойств в исходной молекуле. В этом случае полимерный носитель может временно снижать активность гормона роста и, следовательно, снижать вероятность липолиза тканей. Переходное конъюгирование с полимерным носителем будет в то же время увеличивать период полувыведения конъюгата и, следовательно, обеспечивать пролонгированную доставку чГР.
Множество макромолекулярных пролекарств описаны в литературе, в которых макромолекулярный носитель связан через лабильную сложноэфирную группу с лекарственным агентом (например, Y. Luo, MR Ziebell, GD Prestwich, "A Hyalwonic Acid - Taxol Antitumor Bioconjugate Targeted to Cancer Cells", Biomacromolecules 2000, 1, 208-218, J Cheng et al. Synthesis of Linear, beta-Cyclodextrin Based Polymers and Their Carnptothecin Conjugates, Bioconjugate Chem. 2003, 14, 1007-1017, R. Bhatt et al. Synthesis and in Vivo Antitumor Activity ofPoly(L-glutamic acid) Conjugates of 20 (S)-Campththecin, J. Med. Chem. 2003, 46, 190-193; R.B.Greenwald, A.Pendri, C.D.Conover, H.Zhao, Y.H.Choe, A.Martinez, K.Shum, S.Guan, J. Med. Chem., 1999, 42, 3657-3667; В. Testa, J.M: Mayer in Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH, 2003, Chapter 8). В этих случаях конъюгированная функциональная группа биоактивного соединения является гидроксильной группой или карбоновой кислотой.
Особенно для биомакромолекул, но также для низкомолекулярных полимерных пролекарств, может быть желательно связывать макромолекулярный носитель с аминогруппами (т.е. N-концы или аминогруппы лизина белков) биоактивного вещества. Особенно это применимо, если маскировка биоактивности лекарственного средства требует конъюгирования определенной аминогруппы биоактивного вещества, например, аминогруппы, расположенной в активном центре, или области, или эпитопе, вовлеченных в связывание рецептора. Также во время получения пролекарства аминогруппы могут быть более хемоселективно адресованы и служат для лучшего управления конъюгированием носителя и лекарственного средства, благодаря их большей нуклеофильности по сравнению с гидроксильными или фенольными группами. Особенно это справедливо для белков, которые могут содержать огромное множество различных реакционноспособных функциональных групп. В этом случае неселективные реакции конъюгирования дают нежелательные смеси продуктов, которые требуют значительной характеризации или очистки и могут снижать выход реакции и терапевтическую эффективность продукта.
Активация пролекарств может происходить либо ферментативным, либо не ферментативным расщеплением лабильного мостика между носителем и молекулой лекарственного средства, или последовательным сочетанием обоих методов, например, ферментативной стадии с последующей неферментативной перегруппировкой.
В WO-А 2005/099768 описаны ПЭГилированные линкерные молекулы с саморасщепляющимися линкерами для большой группы биомолекул, включая соматотропины (пункт 6). В WO-A 2005/099768 решаемой проблемой является межиндивидуальные колебания и непредсказуемое действие активации пролекарства при вовлечении ферментативных механизмов (страница 12, строки 17-30). В этой заявке в качестве решения описан ароматический линкер, который может быть на основе ПЭГ. Такой линкер-ПЭГ связывает лекарственное средство таким образом, что активность лекарственного средства значительно снижается. Оно активируется только при высвобождении лекарственного средства, которое инициируется гидролизом. Гидролиз может контролироваться химически. Никаких специальных акцентов не сделано относительно ГР и связанных с ним проблем, таких как липоатрофия, связанных с указанным решением.
Вкратце, ни в одном из указанных выше источников не описывается решение разрабатывать рчГР пролонгированного действия на основе конъюгата пролекарства, который может вводиться менее часто без повышения частоты липоатрофии.
Таким образом, объектом данного изобретения является предоставление такого пролекарства или фармацевтической композиции, содержащей указанное пролекарство, для снижения частоты введения рчГР с применением ПЭГ конъюгированного с рчГР без значительного возникновения липоатрофии.
Сущность изобретения
Следовательно, данное изобретение обеспечивает фармацевтическую композицию, содержащую подходящие фармацевтические наполнители, а также содержащую клинически эффективное для человека in vivo ПЭГилированного конъюгата пролекарства рекомбинантного человеческого гормона роста рчГР, где ПЭГ связан с рчГР через самогидролизуемый (саморасщепляющийся) временный линкер; где указанный конъюгат пролекарства отличается тем, что:
(1): конъюгат имеет ГР активность, которая менее 5% от природного гормона роста без ПЭГ; и
(2): скорость самогидролиза линкера такова, что период полувыведения in vivo составляет от 10 часов до 600 часов.
Свойство (1) обеспечивает низкое количество случаев липоатрофии при приеме пролекарства несмотря на то, что оно имеет значительно более длительное время действия in vivo. He ограничиваясь теорией, авторы данного изобретения полагают, что если пролекарство имеет большую активность ГР, этот продукт все равно будет вызывать липоатрофию гораздо чаще, чем представленные в настоящее время на рынке продукты рчГР.
Свойство (2) обеспечивает выделение рчГР (без ПЭГ) постепенно, в течение определенного времени, так, чтобы вводить фармацевтический продукт рчГР менее часто, чем человеческий гормон роста, например, только один раз в неделю или один раз в месяц вместо ежедневного введения, при этом сохраняя полную эффективность по сравнению с рчГР.
Предпочтительно, период полувыведения in vivo вплоть до в 5 раз меньше, например в 2, 3, 4 или 5 раз меньше, чем соответствующий период полувыведения in vitro конъюгата ПЭГилированного пролекарства чГР. Более предпочтительно, период полувыведения in vivo вплоть до в 3 раза меньше, чем соответствующий период полувыведения in vitro конъюгата ПЭГилированного пролекарства чГР. Наиболее предпочтительно, период полувыведения in vivo вплоть до в 2 раза меньше, чем соответствующий период полувыведения in vitro конъюгата ПЭГилированного пролекарства чГР.
Данное изобретение относится к ПЭГилированным пролекарствам рчГР, в частности, рчГР ПЭГилированным пролекарствам, связанным с носителем, включая каскадные пролекарства, связанные с носителем (cascade carrier prodrugs).
Пролекарства могут быть определены как терапевтические агенты, которые являются неактивными сами по себе, но предсказуемо превращаются в активные метаболиты (см. В.Testa, J.M: Mayer в Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH, 2003, стр.4). В системах пролекарств, связанных с носителем, многие медицинские агенты являются неактивными или показывают пониженную биологическую активность, когда полимер ковалентно конъюгирован с молекулой лекарственного средства. В таких случаях временную связь лекарственного средства и носителя применяют таким образом, что медицинский агент высвобождается из полимерного носителя in vivo, восстанавливая свою биологическую активность. Пониженная биологическая активность пролекарства, по сравнению с выделенным лекарственным средством, является преимуществом, если желаемо замедленное или контролируемое выделение лекарственного средства. В этом случае относительно большое количество пролекарства может быть введено без сопутствующих побочных эффектов и риска передозировки. Высвобождение лекарственного средства происходит в течение времени, тем самым снижая необходимость повторного и частого введения лекарственного средства.
В пролекарствах, связанных с полимерным носителем, биологически активные фрагменты часто связаны с фрагментом полимерного носителя лабильным мостиком, образованным между фрагментом носителем и функциональной группой молекулы лекарственного средства. Расщепление носителя пролекарства создает молекулярное соединение (лекарственное средство) с повышенной биоактивностью и по меньшей мере один побочный продукт, носитель. Этот побочный продукт может быть биологически инертен (например, ПЭГ). После расщепления биологически активное соединение открывает по меньшей мере одну ранее конъюгированную и таким образом замаскированную или защищенную функциональную группу, и присутствие этой группы обычно вносит вклад в биологическую активность.
Активность ГР может быть измерена с применением методов, известных в данной области техники. В этом аспекте особенно внимание уделяется примеру 1. Основываясь на факте, что некоторые временные линкеры, применяемые в соответствии с данным изобретением, могут иметь период полувыведения in vitro менее 3000 ч, соответствующие измерения активности ГР проводят косвенно, через определение активности ГР соответствующего ПЭГ конъюгата, содержащего постоянный линкер вместо временного линкера. Это может быть проведено как описано в WO 2006102659 на странице 74, параграф 0240, биологическая активность рчГР и конъюгатов, описанных здесь, должна оцениваться in vitro с применением анализа пролиферации клеток лимфомы крыс NB2-II. Вкратце, клетки NB2-II, полученные из лимфомы крысы, инкубируют с рчГР, что приводит к связыванию молекулы рчГР с ее рецептором на поверхности клетки. Связывание с рецептором вызывает каскад сигнальной трансдукции, что дает пролиферацию клеток. Результаты анализа основаны на определенном содержании белка и 100% биологической активности немодифицированного рчГР.
Предпочтительно, для измерения активности ГР используют протокол, описанный в примере 24.
Период полувыведения in vitro может быть измерен с применением методов, известных в данной области техники. Здесь особое внимание уделяется примеру 2.
Следовательно, второй аспект данного изобретения относится к клинически эффективному количеству фармацевтической композиции, содержащей ПЭГилированное пролекарство рчГР из первого аспекта, для применения в способе лечения заболеваний, связанных с ГР, у человека.
Этот второй аспект альтернативно может быть сформулирован как способ лечения связанного с ГР заболевания у человека, предусматривающий введение человеку клинически эффективного количества фармацевтической композиции, содержащей ПЭГилированное пролекарство рчГР из первого аспекта.
В ситуации, где остаточная активность пролекарства (как, например, при применении временно конъюгированного с ПЭГ рчГР) значительно снижена по сравнению с природным человеческим ГР, липолитические эффекты могут не возникать даже при длительном приеме.
Описанные здесь соединения, названные ПЭГилированными пролекарствами рчГР, являются конъюгатами, которые могут иметь значительно сниженную остаточную активность по сравнению с человеческим ГР. Для оказания терапевтически полезного действия необходимо высвободить рчГР из конъюгата пролекарства, для чего необходимо, чтобы описанные пролекарства прошли стадию активации (например, механизмы 1,6-выделения), названную здесь саморасщеплением, отщепляя группу ПЭГ от лекарственного средства. Механизм 1,6-выделения описан в WO-A 2005/099768.
Не ограничиваясь теорией, авторы данного изобретения полагают, что описанные здесь временно ПЭГилированные конъюгаты рчГР значительно снижают липоатрофию благодаря низкой активности ПЭГилированных конъюгатов рчГР до того, как ПЭГ начинает постепенно отщепляться за счет самоотщепляющегося линкера. Это свойство обеспечивает то, что пролекарство не будет вызывать липоатрофию более часто, чем человеческий ГР или другие постоянно ПЭГилированные соединения рчГР, описанные выше.
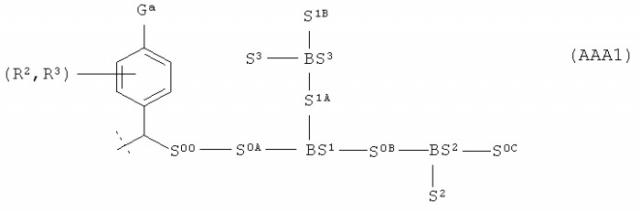
Проблема, лежащая в основе данного изобретения, также решается фармацевтической композицией, содержащей подходящие фармацевтические наполнители, и также содержащей конъюгат пролекарства человеческого гормона роста (чГР) формулы
,
где hGH-NH является остатком чГР;
La является функциональной группой, которая самогидролизуема (саморасщепляема) группой Ga, вызывающей саморасщепление; и
S0 является полимерной цепью, имеющей молекулярную массу по меньшей мере 5 кДа и содержащей по меньшей мере первую разветвляющую структуру ВS1, и по меньшей мере первая разветвляющая структура BS1, содержит по меньшей мере вторую полимерную цепь S1, имеющую молекулярную массу по меньшей мере 4 кДа, где по меньшей мере одна из S0, BS1, S1 также содержит группу Ga, вызывающую саморасщепление, и где разветвляющая структура BS1 также содержит по меньшей мере третью полимерную цепь S2, имеющую молекулярную массу по меньшей мере 4 кДа, или по меньшей мере одна из S0, S1 содержит по меньшей мере вторую разветвляющую структуру BS2, содержащую по меньшей мере третью полимерную цепь S2, имеющую молекулярную массу по меньшей мере 4 кДа, и где молекулярная масса конъюгата пролекарства без чГР-NH составляет по меньшей мере 25 кДа и не более 1000 кДа, предпочтительно по меньшей мере 25 кДа и не более 500 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 250 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 120 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 100 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 90 кДа.
Неожиданно было обнаружено, что остаточная активность пролекарства в соответствии с данным изобретением может быть эффективно понижена применением полимерного носителя, имеющего по меньшей мере 3 цепи определенной минимальной длины (что определено их молекулярной массой) и, таким образом, в сочетании с временным линкером, описанным здесь, решается проблема получения пролекарства чГР, которое может вводиться менее часто без увеличения риска липоатрофии. Пролекарство должно быть растворимо в воде.
Для по меньшей мере бис-конъюгированных пролекарств проблема может быть решена фармацевтической композицией, содержащей подходящие фармацевтические наполнители, а также содержащей конъюгат пролекарства человеческого гормона роста (чГР) формулы (АВ)
,
где
n равно 2, 3 или 4; предпочтительно 2;
чГР-(-NH)n является остатком чГР;
каждый L независимо является постоянной функциональной группой Lp или функциональной группой La, которая является самогидролизуемой (саморасщепляемой) посредством группы Ga, вызывающей саморасщепление; и
каждая S0 независимо является полимерной цепью, имеющей молекулярную массу по меньшей мере 5 кДа, где S0 при необходимости является разветвленной, так как она содержит по меньшей мере первую разветвляющую структуру BS1, где по меньшей мере первая разветвляющая структура BS1 содержит по меньшей мере вторую полимерную цепь S1, имеющую молекулярную массу по меньшей мере 4 кДа, где по меньшей мере одна из S0, BS1, S1 также содержит группу Ga, вызывающую саморасщепление, и где молекулярная масса конъюгата пролекарства без чГР-NH составляет по меньшей мере 25 кДа и не более 1000 кДа, предпочтительно по меньшей мере 25 кДа и не более 500 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 250 кДа, даже более предпочтительно по меньшей мере 30 кДа и не более 120 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 100 кДа, даже более предпочтительно по меньшей мере 40 кДа и не более 90 кДа.
Еще один аспект данного изобретения относится к конъюгату пролекарства, определенному выше.
Предпочтительные варианты данного изобретения описаны ниже только в качестве примеров.
ОПРЕДЕЛЕНИЯ
Перед обсуждением подробных вариантов осуществления данного изобретения представлены описания определенных терминов, связанных с основными аспектами данного изобретения.
В общем, все специфические технические термины, применяемые здесь, должны пониматься так, как их понимают специалисты в данной области техники в данном техническом контексте.
рчГР, или чГР, или ГР, или чГР остаток относится к человеческому гормону роста. NH-чГР является остатком чГР, где -NH- из -NH-чГР является аминогруппой чГР.
Термин «активность» понимается как способность гормона роста или его конъюгата вызывать биологическую реакцию в ответ при введении млекопитающему, например, в модели in vivo, или вызывать измеряемую реакцию в модели in vitro как описано в примерах.
В системе пролекарства измеряемая активность имеет две составляющих, одна из высвобожденного свободного лекарственного вещества, и одна из еще не расщепленного конъюгата пролекарства. Для разделения активности конъюгата пролекарства здесь применяют термин «остаточная активность», который означает часть измеренной активности пролекарства, которая может быть отнесена к конъюгату пролекарства.
Термин «саморасщепление» понимается как ограничивающее скорость гидролитическое расщепление связи между временным линкером и молекулой лекарственного средства рчГР в водном забуференном растворе в физиологических условиях рН 7,4 и 37°С. Саморасщепление не требует присутствия фермента. Такое саморасщепление или самогидролиз контролируется группой, вызывающей саморасщепление, которая является частью молекулы пролекарства. Такая группа, вызывающая саморасщепление может присутствовать как таковая или в замаскированной форме так, что требуется ее демаскирование до того, как сможет стартовать механизм самогидролиза.
Скорость самогидролиза линкера относится к скорости расщепления чГР-ПЭГилированного пролекарства in vivo. Ферментное или другое действие практически всегда приводит к тому, что гидролиз линкера пролекарства проходит быстрее in vivo, чем in vitro, и определено, что чГР ПЭГ пролекарство расщепляется аутогидролитическим путем, если период полувыведения пролекарства in vivo до 5 раз меньше, чем соответствующий период полувыведения конъюгата ПЭГилированного пролекарства чГР in vitro.
Термин «временная связь» или «временный линкер» описывает лабильность связи между ПЭГ и рчГР в ПЭГилированном пролекарстве рчГР. В таких временных связях рчГР выделяется из соответствующего пролекарства с in vivo периодом полувыведения линкера вплоть до 1200 часов.
Термин «конъюгат» понимается как одна или более молекул ПЭГ, ковалентно связанные с лекарственным средством, которым в данном случае является человеческий гормон роста.
Термин «временный конъюгат» относится к ПЭГилированным пролекарствам чГР, содержащим по меньшей мере одну временную связь.
Термин «постоянный конъюгат» относится к ПЭГилированным конъюгатам или пролекарствам чГР, где полимер ПЭГ связан с чГР с помощью связей, при этом период полувыведения in vitro составляет по меньшей мере 3000 часов.
Период полувыведения in vitro или период полувыведения линкера in vitro равен высвобождению 50% чГР из чГР ПЭГилированного продукта в буфере при рН 7,4 и 37°С.
Термины «период полувыведения in vivo» или «период полувыведения линкера in vivo» понимают как интервал времени, при котором 50% исходной доли гормона роста высвобождается из ПЭГилированного пролекарства чГР после введения в тело человека, рассчитанный с учетом периода полувыведения соответствующего конъюгата соединения, как описано в примере 2.
Термин «период полувыведения конъюгата» понимается как интервал времени, за который 50% ПЭГилированного постоянного конъюгата чГР, определенного выше, выводится из кровотока.
Термин «липоатрофия» понимается как медицинский термин для местной потери жировой ткани. В данном контексте «липоатрофия» относится к липоатрофии в месте инъекции, что означает прохождение липолиза ткани вблизи места инъекции.
Термин «пролекарство» понимается как любое соединение, которое претерпевает превращение до проявления его полного фармакологического эффекта. Классификация систем пролекарства дана в определениях IUPAC (http://www.chem.qmul.ac.uk/iupac/medchem, в доступе с 8 марта 2004):
Пролекарство
Пролекарством является любое соединение, которое подвергается биотрансформации до демонстрации своего фармакологического действия. Пролекарства могут рассматриваться как лекарственные средства, содержащие специализированные нетоксичные защитные группы, применяемые временно, для изменения или удаления нежелательных свойств в исходной молекуле.
Двойное пролекарство (или про-пролекарство)
Двойное пролекарство является биологически неактивной молекулой, которая превращается in vivo в две стадии (ферментативно и/или химически) в активные виды.
Пролекарство, связанное с носителем (пролекарство на носителе)
Связанное с носителем пролекарство является Пролекарством, которое содержит временную связь данного активного вещества с временной группой носителя, которая дает улучшенные физико-химические или фармакокинетические свойства, и которая может быть легко удалена in vivo, обычно гидролитическим расщеплением.
Каскадное пролекарство
Каскадное пролекарство является Пролекарством, для которого отщепление группы носителя становится эффективным только после демаскирования активирующей группы.
Биотрансформация
Биотрансформация является химическим превращением веществ живыми организмами или ферментными препаратами.
Соответственно, группа, вызывающая каскадный самогидролиз, становится эффективной только после демаскирования определенных вызывающих самогидролиз структурных элементов. Может быть проведена одна или более каскадных демаскирующих стадий, требуемых для открывания вызывающих самогидролиз структурных элементов. По меньшей мере, одна из стадий демаскирования может быть основана на стадии биотрансформации.
Термин «фармацевтическая композиция, содержащая клинически эффективное in vivo для человека количество ПЭГилированного пролекарства рекомбинантного человеческого гормона роста (рчГР)» означает количество, которое является достаточно высоким для того чтобы получить желаемый клинический эффект у человека после введения фармацевтической композиции человеку, например желаемый клинический эффект в отношении лечения заболевания, связанного с ГР. В данном контексте специалист в данной области техники сможет скорректировать количество ПЭГилированного пролекарства рекомбинантного человеческого гормона роста (рчГР), вводимого для получения желаемого клинического эффекта.
Термин «физиологическое состояние» понимается как любое in vitro или in vivo состояние, идентичное или похожее, на рН и температуру человеческого тела. Более конкретно, физиологическое состояние относится к состоянию с рН около рН 7,4 (рН 6,8 - рН 7,8) и температурой около 37°С (от 35°С до 40°С).
Термин «линкер» часто применяют в публикациях в области биоконъюгирования, и он широко описывает химические структуры, применяемые для связывания двух молекулярных соединений. Такая связь может быть постоянной или временной.
Временным линкером является линкер, при котором конъюгирование лекарственного средства с молекулой ПЭГ является обратимым. Это подразумевает, что отщепление линкера высвобождает лекарственное средство в его природной и активной форме. Структурная дифференциация структурной единицы временного линкера от полимерного носителя может быть сложной в случае пролекарств, связанных с носителем, особенно если полимер постоянно присоединен к линкеру, и поэтому продукты разложения линкера не выделяются в результате расщепления пролекарства.
Структурное определение линкера становится даже более сложным, если линкер функционирует и как группа, вызывающая саморасщепление, и как разветвляющая структурная единица. Поэтому в контексте данного изобретения термин «линкер» может применяться как синоним для сочетания функциональной группы La и группы, вызывающей саморасщепление Ga. В случаях, где описаны пролекарства на носителе, в которых носителем является разветвленный ПЭГ, предпочтительно применять структурные описания на основе сочетаний La и Ga. В таком случае группа Ga вызывающая расщепление, считается частью полимера носителя. Изменение химической природы Ga позволяет проектировать свойства саморасщепления соответствующего пролекарства, связанного с носителем, в значительной степени.
Термин «постоянный линкер» относится к ПЭГ конъюгату с чГР-донированной первичной аминогруппой через образование алифатического амида или алифатического карбамата. Если применяются обычные реагенты для ПЭГилирования, полученные конъюгаты обычно являются очень устойчивыми к гидролизу, и скорость расщепления амидной или карбаматной связи будет слишком низкой для терапевтического применения системы пролекарства. Тем не менее, такой конъюгат с постоянным линкером применяют для исследования терапевтической применимости конъюгатов пролекарства, так как они позволяют оценить остаточную активность.
Если такие стабильные связи применяются в пролекарстве, расщепление функциональной группы не возможно в терапевтически полезный промежуток времени без ферментативного катализа.
Термин «растворимое в воде пролекарство» означает пролекарство, которое растворимо в воде в физиологических условиях. Обычно растворимое в воде пролекарство пропускает по меньшей мере 75%, более предпочтительно по меньшей мере 95% света, пропускаемого тем же раствором после фильтрации. По массе, растворимый в воде полимер является, предпочтительно, на по меньшей мере около 35% (по массе) растворимым в воде, еще более предпочтительно, на по меньшей мере около 50% (по массе), еще более предпочтительно, на по меньшей мере около 70% (по массе), еще более предпочтительно, на по меньшей мере около 85% (по массе), еще более предпочтительно, на по меньшей мере около 95% (по массе) или является полностью растворимым в воде.
Термин «ПЭГ» или «остаток пэгилирования» в данном описании применяется для подходящих растворимых в воде полимеров, характеризуемых повторяющимися единицами. Подходящие полимеры могут быть выбраны из группы, включающей полиалкилокси полимеры, гиалуроновую кислоту и ее производные, поливиниловые спирты, полиоксазолины, полиангидриды, сложные поли(ортоэфиры), поликарбонаты, полиуретаны, полиакриловые кислоты, полиакриламиды, полиакрилаты, полиметакрилаты, полиорганические фосфазены, полисилоксаны, поливинилпирролидон, полицианоакрилаты и сложные полиэфиры.
Цепи ПЭГ могут состоять из связующей группы, полимерной группы и концевой группы.
Для разветвленных моноконъюгатов ПЭГилированных пролекарств чГР критическое расстояние определяет кратчайшее расстояние между местом присоединения ПЭ