Способ прогнозирования степени риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании
Иллюстрации
Показать всеИзобретение относится к области медицины, акушерства и перинатологии и может быть использовано для прогнозирования степени риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании. Проводят оценку вариабельности сердечного ритма матери и плода. Определяют коэффициент вариации полного массива кардиоинтервалов плода в исходном состоянии CV П I, индекс резистентности артерии пуповины ИР, коэффициент вариации полного массива кардиоинтервалов матери в исходном состоянии CV М, интервал RRmin матери в период восстановления после ментального теста RRmin М III. Рассчитывают ∑1, ∑2, ∑3 по формулам: ∑1=2 (при CV плода в исходном состоянии менее 5,4)+3 (при ИР менее 0,58)+3 (при CV матери в исходном состоянии менее 7,8)+2 (при RRmin матери в исходном состоянии менее 531); ∑2=2 (при CV П I менее 5,4)+3 (при ИР более 0,58)+2 (при CV М I менее 0,78)+4 (при RRmin M I менее 531); ∑3=3 (при CV П I менее 5,4)+3 (при CV М I менее 7,8)+3 (при ИР более 0,58). Значения ∑1 от 0 до 2 указывают низкий риск; от 3 до 5 баллов - средний; от 6 до 10 баллов - высокий риск; значения ∑2 от 0 до 2 указывают на низкий; от 3 до 5 баллов - средний; от 6 до 11 баллов - высокий риск, значения ∑3 от 0 до 3 указывают на низкий риск, от 4 до 9 баллов - высокий риск развития неблагоприятных перинатальных исходов. На основании полученных рисков по трем показателям: ∑1, ∑2, ∑3 определяют степень риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании. 3 пр., 6 табл., 3 ил.
Реферат
Изобретение относится к области медицины, акушерства и перинатологии и может быть использовано для прогнозирования степени риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании.
Несмотря на значительные успехи перинатологии внутриутробные инфекции остаются одной из наиболее важных проблем современной медицины [1; 2; 3], являясь наиболее частыми и опасными причинами заболеваний плода и новорожденного [4; 5; 6]. В структуре перинатальной смертности удельный вес внутриутробных инфекций составляет от 11 до 45% [7; 8]. Среди внутриутробных инфекций, вызывающих эмбрио- и фетопатии, наиболее распространенными являются цитомегаловирусная (ЦМВ), герпесвирусная (ВПГ), токсоплазменная, хламидийная инфекции и др. [1; 9; 10].
Исходы перинатально значимых инфекций разнообразны - от рождения здорового ребенка до формирования грубой патологии плода и плаценты. Прогнозирование исходов беременностей, развивающихся на фоне перинатально значимых инфекций, представляет важную и в настоящее время недостаточно эффективно решенную задачу, требует новых методологических подходов и клинических методов исследования системы мать-плацента-плод. Одним из клинических методов оценки функциональных систем матери и плода, взаимоотношений между ними является метод анализа вариабельности сердечного ритма (ВСР) [11; 12; 13]. Ритм сердца человека представляет собой сложный колебательный процесс, динамическая структура которого несет информацию о состоянии важнейших нейрогуморальных регуляторных систем организма [11; 13].
В литературе имеются лишь единичные работы, посвященные проблеме исследования вариабельности сердечного ритма матери и плода в акушерстве [14; 15; 16; 17; 18]. Этими исследованиями доказывается высокая прогностическая значимость анализа ВСР у матери и плода для диагностики акушерских и перинатальных осложнений.
Известен способ прогноза исхода беременности у женщин из группы риска по внутриутробному инфицированию плода [19]. Способ заключается в том, что во втором триместре беременности у женщин из группы риска по внутриутробному инфицированию оценивают комплекс клинико-лабораторных показателей матери и плода. Учитывают течение беременности, осложненное развитием гестоза средней или тяжелой степени (ДК=+6.3), не осложненное развитием гестоза (ДК=-7,5); наличие УЗИ-маркеров пренатальной патологии плода (ДК=+2,9); чистоту влагалищных мазков 3-4 степени (ДК=+1,8); количество сегментоядерных нейтрофилов в материнской крови 70% (ДК=+7,9), 65% (ДК=-2,9); лейкоцитоз в плодовой крови 4,510 9/л (ДК=+6,8), 3,0109/л (ДК=-6,9); абсолютный лимфоцитоз в плодовой крови 3,0109/л (ДК=+4,1); абсолютное содержание CD3+Т-клеток 1,9109/л (ДК=+5,4), 1,2109/л (ДК=-3,7) и уровень IgA в крови плода 0,3 г/л (ДК=+2,5), 0,4 г/л (ДК=-5,5); относительное количество HLA-DR+моноцитов и HLA-DR+лимфоцитов в крови плода соответственно 88 и 30% (ДК=-6,2) и (ДК=-4,0). При суммарной величине положительных диагностических коэффициентов (ДК=+13 и выше) прогнозируют развитие неблагоприятного перинатального исхода, а при суммарной величине отрицательных диагностических коэффициентов (ДК=-17 и ниже) - благоприятный исход беременности. Способ позволяет оптимизировать тактику ведения беременных женщин. Недостатком данного способа является инвазивность методики (использование крови плода, полученной при кордоцентезе), что требует наличия информированного согласия на проведение процедуры и связано с повышенным риском побочных реакций и осложнений, исключает использование в акушерских стационарах I-II уровня. Вторым существенным недостатком является высокая стоимость исследования, связанная с проведением генотипирования (определение HLA-DR+ моноцитов и HLA-DR+ лимфоцитов).
Известен способ прогнозирования перинатальной заболеваемости [20]. Определяют наличие анамнестических факторов: социально-биологических факторов риска, акушерско-гинекологического анамнеза, экстрагенитальных заболеваний матери, а также факторов беременности: осложнения беременности, оценку состояния плода, выявленным факторам присваивают балльные оценки, содержащиеся в описании, с помощью таблицы «Модифицированная шкала прогнозирования перинатальной заболеваемости». Затем суммируют выявленные баллы и при сумме баллов до 15 прогнозируют низкую степень риска перинатальной заболеваемости, при сумме баллов от 15 до 25 - среднюю степень, при сумме баллов более 25 - высокую степень. Способ направлен на повышение точности и объективности прогнозирования перинатальной заболеваемости и смертности, позволяет вовремя отнести беременную к группе риска и своевременно провести профилактические и лечебные мероприятия, а также выбрать наиболее адекватные методы и время родоразрешения. Недостатком метода является большое количество факторов, что увеличивает время подсчета суммарного риска; субъективность оценки отдельных признаков, получаемых при проведении дополнительных методов исследования; способ не учитывает компенсаторные возможности организма матери и плода.
Наиболее близким к предлагаемому способу, выбранному за прототип, является способ диагностики состояния плода и прогнозирования раннего неонатального периода новорожденного [21]. Способ заключается в определении индекса напряжения (ИН) плода при помощи вариационной пульсометрии по формуле Баевского P.M. (KH=AMo/2·Mo·dX) в покое при положении беременной лежа на спине или на боку при длительности измерения не менее 15 минут (ИН покоя); определении индекса напряжения плода после выполнения функциональной пробы матери при длительности измерения 3-7 минут (ИН нагрузки). По результатам измерений рассчитывают коэффициент динамики индекса напряжения плода (КДИН) как модуль разности величин (ИН покоя) и (ИН нагрузки), отнесенный к сумме этих величин и умноженный на 100, КДИН=100 × [ИН покоя - ИН нагрузки] / (ИН покоя + ИН нагрузки). При значениях КДИН от 3 до 10 определяют физиологическое состояние плода и физиологическое течение раннего неонатального периода новорожденного. Выход КДИН за эти значения указывает на нарушение функционального состояния плода и риск возникновения патологии новорожденных в раннем неонатальном периоде. Способ позволяет выявить скрытые проявления фетоплацентарной недостаточности и нарушения адаптации плода и прогнозировать течение раннего неонатального периода.
Недостатком известного способа является использование единственного показателя индекса напряжения (ИН), отсутствие балльной системы шкалы прогноза, в результате чего невозможно разграничить тяжесть ожидаемых отклонений периода адаптации.
Новый технический результат - повышение точности и информативности способа.
Для достижения нового технического результата в способе прогнозирования степени риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании путем проведения анализа вариабельности сердечного ритма матери и плода определяют коэффициент вариации полного массива кардиоинтервалов плода в исходном состоянии CV П I, индекс резистентности артерии пуповины ИР, коэффициент вариации полного массива кардиоинтервалов матери в исходном состоянии CV М, интервал RRmin матери в период восстановления после ментального теста RRmin M III и после чего рассчитывают ∑1, ∑2, ∑3 формулам:
∑1=2 (при CV плода в исходном состоянии менее 5,4)+3 (при ИР менее 0,58)+3 (при CV матери в исходном состоянии менее 7,8)+2 (при RRmin матери в исходном состоянии менее 531);
∑2=2 (при CV П I менее 5,4)+3 (при ИР более 0,58)+2 (при CV М I менее 0,78)+4 (при RRmin M I менее 531);
∑3=3 (при CV П I менее 5,4)+3 (при CV M I менее 7,8)+3 (при ИР более 0,58) и
значения ∑1 от 0 до 2 указывают низкий риск; от 3 до 5 баллов - средний; от 6 до 10 баллов - высокий риск;
значения ∑2 от 0 до 2 указывают на низкий; от 3 до 5 баллов - средний; от 6 до 11 баллов - высокий риск;
значения ∑3 от 0 до 3 указывают на низкий риск, от 4 до 9 баллов - высокий риск развития неблагоприятных перинатальных исходов;
на основании полученных рисков по трем показателям: ∑1, ∑2, ∑3 определяют степень риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании.
Способ осуществляют следующим образом.
У пациентки с документально подтвержденным диагнозом внутриутробного инфицирования проводят одномоментный анализ вариабельности сердечного ритма. Регистрация записи вариабельности сердечного ритма (ВСР) матери проводят с помощью компьютерного электрокардиографа для анализа вариабельности ритма серда (вегетотестер) «ВНС-ритм» (сертификат соответствия РОСС RU.ИМ 18.В00228 №6943114, RU. C.39.026.A №19009 от 01.11.2009 года). С целью диагностики состояния регуляторных и адаптационных процессов в организме беременной женщины и плода используют спектральный, математический и временной анализ ВСР. Анализ ВРС основывается на расчетах статистических показателей, рекомендованных и утвержденных Европейским обществом кардиологии и Североамериканским обществом кардиостимуляции и электрофизиологии [22] и группой отечественных авторов [11; 13; 23].
Запись ВСР осуществляют в виде нескольких последовательных этапов: динамической регистрации сердечного ритма, анализа, классификации, клинико-спектральной оценки полученных результатов.
Условия проведения записи ВСР: запись ВСР беременным проводят в III триместре беременности. Исследование выполняют в первой половине дня (при наличии показаний - в любое время суток), спустя 2 часа после приема пищи, в тихой комнате, с постоянной температурой около +20°C, в состоянии спокойного бодрствования. Перед началом исследования необходим период адаптации к окружающим условиям (5-10 минут).
Каждое исследование включает 5 составляющих по 256 R-R интервалов сердечного ритма и продолжается 4,5-5 минут:
- 1-й - регистрация исходного (фонового) состояния; для сравнения с фоновой записью в дальнейшем используют аналогичные по длительности записи;
- 2-й - первая функциональная проба (ментальный тест). Выполняют математический счет в уме - последовательное вычисление из 500 по 7. Во время выполнения данной функциональной пробы не рекомендуется произносить числа вслух в связи с влиянием речи на характер спектрограммы;
- 3-й - восстановление после первой функциональной пробы; запись проводится через 5 минут после окончания нагрузки с предварительным контрольным измерением артериального давления;
- 4-й - вторая функциональная проба (гипервентиляция); глубина и частота дыхания регулируется в зависимости от состояния беременной;
- 5-й - восстановление после второй функциональной пробы; регистрация сердечного ритма проводится через 5 минут после окончания нагрузки с предварительным контрольным измерением артериального давления.
С целью устранения артефактов, связанных с изменениями напряжения в сети, движениями во время дыхания, излишним волнением женщины, а также устранением функциональных экстрасистол используют функцию «фильтр», которая по возможности устраняет возникшие отклонения.
Оценку показателей регуляторных и адаптационных процессов матери и плода осуществляют по результатам анализа вариабельности сердечного ритма [24; 25; 26].
Оценивают следующие параметры:
1. Статистические методы (временные):
- SDNN (стандартное отклонение полного массива кардиоинтервалов) - характеризует суммарный показатель вариабельности величин интервалов RR за весь рассматриваемый период (короткие 5-минутные записи). В коротких 5-минутных записях нормальные значения SDNN находятся в пределах 40-80 мс;
- RMSSD - квадратный корень из суммы разностей последовательного ряда кардиоинтервалов, который отражает высокочастотные колебания и активность автономного контура регуляции. В норме значения этого показателя находятся в пределах 20-50 мс;
- pNN50 (%) - количество пар кардиоинтервалов с разностью более 50 мс от числа всех анализируемых кардиоинтервалов в процентах. Показатель указывает на степень преобладания парасимпатического звена регуляции над симпатическим (относительное значение);
- CV (коэффициент вариации полного массива кардиоинтервалов) - нормированный показатель суммарного эффекта регуляции представляет собой нормированную оценку дисперсии (D), отражающую величину затраченной энергии на колебания в разных диапазонах спектра. Снижение дисперсии указывает на малый разброс значений в ряду по отношению к средней величине. По отношению к ритму сердца снижение дисперсии указывает на его ригидность, что связывают с процессами регуляции из центра (сегментарных структур).
2. Математические методы:
- мода (Мо) - наиболее часто встречающееся значение RR-интервалов;
- амплитуда моды (АМо) - доля кардиоинтервалов, соответствующая значению моды;
- диапазон вариации сердечного ритма (ДВ) - разность между длительностью наибольшего и наименьшего R-R интервала.
Для определения степени адаптации сердечно-сосудистой системы используют математический индекс напряжения по Баевскому P.M. [11]:
- ИН - индекс напряжения, ИН = АМо (%) / 2Мо × ДВ (сек); выражается в условных единицах; степень централизации управления сердечным ритмом указывает на степень напряжения регуляторных систем. Увеличение колебаний интервалов R-R (ДВ) и замедление ритма сердца (увеличение Мо, снижение АМо) приводит к уменьшению значения ИН и свидетельствует о повышении парасимпатической активности. Противоположные сдвиги указывают на увеличение симпатического тонуса.
3. Спектральные методы анализа ВСР:
- VLF (Very Low Frequency) - медленные волны 2-го порядка (метабологуморальные волны) в диапазоне частот 0,003-0,04 Гц (25-333 с). Характеризуют надсегментарный уровень регуляции, поскольку амплитуда тесно связана с психоэмоциональным напряжением, отражая состояние гипофизарно-гипоталамического и коркового уровней [27]. Существуют данные, что VLF является чувствительным индикатором управления метаболическими процессами, хорошо отражает энергодефицитные состояния [13]. В норме в условиях покоя мощность VLF составляет 15-35% суммарной мощности спектра.
- LF (Low Frequency) - медленные волны 1-го порядка (вазомоторные или симпатоадреналовые волны) в диапазоне частот 0,05-0,15 Гц (6,5-25 с). Увеличение амплитуды волн в этом диапазоне может указывать на снижение активности вазомоторного центра или на замедление процессов барорефлекторной регуляции [13].
- HF (High Frequency) - медленные волны (дыхательные) в диапазоне частот 0,16-0,5 Гц (2,5-6,5 с). Основной характеристикой этого компонента спектра является вагусная (парасимпатическая) активность. В норме мощность HF составляет 15-25% суммарной мощности спектра.
- LF/HF - симпато-вагальнй индекс - производная величина, свидетельствующая о преобладании того или иного компонента в регуляции сердечного ритма.
Изучение показателей вариабельности сердечного ритма плода осуществлялось по методике Г.А. Ушаковой, Ю.В. Рец [28; 29; 30].
Запись и оценку состояния плода проводят следующим образом: с помощью допплерометрического кардиотокографа «Fetalgard-2000» механически производят регистрацию ритма сердечных сокращений плода в количестве не менее 256 ударов (ЧСС). Полученные данные вносят в протокол биоритмологической компьютерной программы «Pulsar», затем данные переводят в программу «Converter»; в программе «Нейрософт» осуществляют обработку показателей плода в масштабе реального времени. Данная программа адаптирована для оценки эффективности регуляторных механизмов сердечного ритма плода и определяет состояние его защитно-приспособительных механизмов по аналогии с материнскими спектральными характеристиками [31].
На спектрограмме внутриутробного плода также выделяют три основных компонента регуляции: VLF - метабологуморальный компонент, характеризующий систему регуляции обменных процессов, этот контур представлен в диапазоне от 0,01 до 0,05 Гц; LF - симпатоадреналовый компонент, характеризующий колебания собственного осциллятора в системе регуляции давления плода, этот контур представлен в диапазоне 0,05-0,14 Гц; HF - парасимпатический компонент, часто вызывающийся дыхательными движениями матери и отражающий реакцию сердечно-сосудистой системы плода в ответ на синхронное изменение давления внутри околоплодного пузыря. Этот контур может отражать и функционирование собственной сосудистой системы плода, регуляция которой имеет свои особенности в антенатальном периоде развития, представлен в диапазоне 0,14-0,5 Гц.
На основе динамики спектральной плотности мощности VLF-спектров ВСР на нагрузку по А.Н. Флейшману (1999, 2009, 2011) выделяют следующие типы энергоизмененных состояний: 1. Нормоадаптивное состояние; 2. Энергодефицитное (гипоадаптивное) состояние; 3. Гиперадаптивное состояние; 4. Гиперадаптивная реакция; 5. Нагрузочный (постнагрузочный) энергодефицит; 6. Энергетическая складка [13].
Для определения факторов риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании проводят логистический регрессионный анализ. В качестве независимых факторов в регрессионном анализе идентифицируют: наличие энергодефицитных состояний матери, энергодефицитных состояний плода, совокупного показателя энергодефицитных состояний матери и плода.
Для расчетов используют качественные признаки, поэтому количественные показатели кодируют по уровню медианы. Прогностически значимым признаком считают уровень CV плода в исходном состоянии ниже 5,4 (3,2-7,1), индекс резистентности артерии пуповины ниже 0,58 (0,49-0,75), CV матери в исходном состоянии ниже 7,8 (4,2-10,4), интервал RRmin матери в период восстановления после ментального теста ниже 531 (259-684) с.
После получения комплекса данных пациентки и плода рассчитывают вероятность отнесения ее к группе с высоким, средним и низким риском развития неблагоприятных перинатальных исходов. При этом используют сумму найденных коэффициентов значимых показателей (коэффициента вариации полного массива кардиоинтервалов плода в исходном состоянии CV менее 5,4; индекса резистентности артерии пуповины ИР менее 0,58; коэффициента вариации полного массива кардиоинтервалов матери в исходном состоянии CV менее 7,8; интервала RRmin матери в период восстановления после ментального теста менее 531).
Для прогнозирования неблагоприятных перинатальных исходов на основании состояния матери производят расчет по формуле:
∑1=2 (при CV П I менее 5,4) + 3 (при ИР более 0,58) + 3 (при CV М I менее 7,8) + 2 (при RRmin М I менее 531).
При значениях ∑1 от 0 до 2 прогнозируют низкий; от 3 до 5 баллов - средний, а от 6 до 10 баллов - высокий риск развития неблагоприятных перинатальных исходов.
Для прогнозирования неблагоприятных перинатальных исходов на основании состояния плода производят расчет по формуле:
∑2=2 (при CV П I менее 5,4) + 3 (при ИР более 0,58) + 2 (при CV М I менее 0,78) + 4 (при RRmin M I менее 531).
При значениях ∑2 от 0 до 2 прогнозируют низкий; от 3 до 5 баллов - средний, а от 6 до 11 баллов - высокий риск развития неблагоприятных перинатальных исходов.
Для прогнозирования неблагоприятных перинатальных исходов на основании совокупного состояния матери и плода производят расчет по формуле:
∑3=3 (при CV П I менее 5,4) + 3 (при CV М I менее 7,8) + 3 (при ИР более 0,58).
При значениях ∑3 от 0 до 3 прогнозируют низкий риск, а от 4 до 9 баллов - высокий риск развития неблагоприятных перинатальных исходов.
Внутриутробное инфицирование чрезвычайно сложно для диагностики, лечения и прогнозирования перинатальных исходов. Это обусловлено рядом причин: полиэтиологичностью, многофакторным воздействием инфекционного агента на плод, трудностью антенатальной диагностики, отсутствием четких связей тяжести инфекционного заболевания матери и степенью поражения плода, неоднозначным подходом к лечебным и профилактическим мероприятиям у беременных и новорожденных (иммуномодуляция, антибиотикопрофилактика, антибактериальная терапия и др.) [32; 33]. Внутриутробные инфекции часто формируют процессы, практически не различимые по результатам объективного обследования и сходные клинически. Тем не менее, у инфицированного плода могут отмечаться как локальные, так и генерализованные поражения [34]. Информативными клиническими симптомами инфицирования плодного яйца являются многоводие, стойкая тахикардия у плода, гипотрофия плода, реже - маловодие. При изучении перинатальных исходов у женщин с высоким риском развития внутриутробной инфекции было отмечено осложненное течение родового акта, обусловленное аномалиями родовой деятельности (слабость родовой деятельности - 20,4%, быстрые роды - 16,4%), хроническая внутриутробная гипоксия плода - 34,5% [35; 36]. У этих беременных во время родов проводилось кардиомониторное наблюдение за состоянием сердечной деятельности плода. Изменения сердечной деятельности плода варьировали от легкого нарушения реактивности сердечно-сосудистой системы (54,5%) до умеренного (21,4%). У всех детей ведущим диагнозом было гипоксически-ишемическое поражение ЦНС, при этом реализация внутриутробного инфицирования наблюдалось в 63,6% случаев, синдром массивной аспирации мекониальными околоплодными водами - в 36,4%, морфофункциональная незрелость - в 16,4% случаев [36; 37].
Ряд исследователей [38], изучавшие отдаленные последствия неблагоприятного влияния ВУИ на развитие ребенка, отмечали нейровегетативные и психические нарушения, отставание в физическом развитии. У 85% детей может быть длительная вирусная персистенция: вначале бессимптомная с дальнейшим появлением отсроченной патологии (аллергических и аутоиммунных заболеваний, гипертензионно-гидроцефального синдрома) [39]. При этом в зависимости от поражающего инфекционного агента, развиваются многообразные клинические проявления: атеросклероз, тугоухость (ЦМВ) [40], сахарный диабет и рак прямой кишки (краснуха), конъюнктивиты (хламидийная инфекция) [41], поражения легких (микоплазменная инфекция) и т.д. [38; 42].
Таким образом, клинические проявления ВУИ чрезвычайно разнообразны, поэтому в современной медицине особое значение имеет разработка наиболее информативных методов ее диагностики и прогнозирование неблагоприятных исходов [43; 44; 45; 46].
Предлагаемый способ основан на анализе данных экспериментальных и клинических наблюдений. Выполнялось ретроспективное исследование случай - контроль. Первоначально в исследование было включено 7680 беременных женщин. Всем беременным было проведено общеклиническое, стандартное акушерское обследование, УЗИ фетоплацентарного комплекса, бактериоскопический, бактериологический анализ содержимого влагалища, ИФА сыворотки крови с определением инфекций TORCH-комплекса, ПЦР-диагностика микоплазменной, уреаплазменной, хламидийной и других инфекций, грибов. На этом этапе из исследования были исключены женщины с соматической патологией в стадии субкомпенсации и декомпенсации, крайне отягощенным акушерско-гинекологическим анамнезом, многоплодием, имеющие вредные привычки (курение, алкоголизм, наркомания), пациентки с нарушением влагалищного биоценоза, ВИЧ-инфицированные, позитивные на вирус гепатита В и С.
При дальнейшем наблюдении за течением беременности в 30 недель 1624 пациенткам были проведены в динамике УЗИ фетоплацентарного комплекса, допплерометрия сосудов МПК и ФПК, КТГ, анализ вариабельности сердечного ритма матери и плода, бактериоскопический, бактериологический анализ содержимого влагалища, ИФА сыворотки крови с определением инфекций TORCH-комплекса, ПЦР-диагностика микоплазменной, уреаплазменной, хламидийной и других инфекций, грибов. На этом этапе из исследования были исключены женщины с преэклампсией, изосенсибилизацией по АВО или резус-фактору, тяжелой анемией, нарушением влагалищного биоценоза, наличием в организме матери очагов хронической инфекции (гестационного пиелонефрита, бронхита, пневмонии, инфекций кожи и т.д.), родоразрешенные в сроках до 37 недели беременности.
После обследования все беременные (375 человек) были разделены на группы: в первую группу были включены женщины, имеющие риск трансплацентарного инфицирования (клиническая картина, обнаружение возбудителей трансплацентарных инфекций методом ПЦР или титра иммуноглобулинов классов М, G методом ИФА) - 239 пациенток; во вторую группу включены женщины, у которых отсутствовал риск инфицирования - 136 пациенток. Пациентки первой группы в зависимости от клинической картины и результатов обследования были разделены на три подгруппы: 1А - 56 беременных с первичным инфицированием трансплацентарными инфекциями во время беременности; 1Б - 98 беременных с обострением хронических инфекций во время беременности; 1B - 85 беременных с носительством хронических инфекций без обострения процесса. Беременным 1А и 1Б групп было назначено этиологическое лечение в зависимости от выявленного возбудителя согласно принятым протоколам. Пациентки, отказавшиеся от лечения по каким-либо причинам, прошедшие неполный курс терапии, составили основную группу исследования.
После родоразрешения всем пациенткам было проведено исследование последа. В результате в основную группу были включены 187 женщин и их плоды, у которых диагностированы трансплацентарные инфекции и при гистологическом исследовании последа обнаружены морфологические признаки гематогенного инфицирования последа.
Критериями включения в основную группу являлись: срок гестации 37-41 неделя, наличие трансплацентарных инфекций, морфологические признаки гематогенного поражения плаценты. Критериями исключения из основной группы являлись: наличие влагалищного дисбиоза, хронические заболевания внутренних органов в стадии субкомпенсации и декомпенсации, крайне отягощенный акушерско-гинекологический анамнез, осложненное тяжелой преэклампсией течение настоящей беременности, наличие изосенсибилизации по системе АВО и резус-фактору, вредные привычки (курение, наркомания, алкоголизм).
Таким образом, в процессе обследования в основной группе сформировались три подгруппы:
1А - с первичным инфицированием во время беременности (n=34);
1Б - с обострением хронических инфекций во время беременности (n=68);
1В - с носительством хронических инфекций (n=85).
Группу сравнения составили 136 беременных женщин, у которых на протяжении беременности не было выявлено трансплацентарных инфекций, сохранялся нормоценоз влагалища. Критериями включения в группу сравнения являлись: срок родов 37-41 неделя, отсутствие трансплацентарных инфекций, нормоценоз влагалища во время беременности, отсутствие морфологических признаков воспаления последа. Критериями исключения из группы сравнения являлись: наличие дисбиоза влагалища, хронические заболевания внутренних органов в стадии субкомпенсации и декомпенсации, крайне отягощенный акушерско-гинекологический анамнез, тяжелые акушерские осложнения в течение беременности, вредные привычки (курение, наркомания, алкоголизм).
Всем пациенткам проведен анализ ВСР. При всех видах клинического течения трансплацентарного инфицирования развивается плацентарная недостаточность, адаптационные нарушения представлены гипоадаптацией (от 23,53 до 38,23%), феноменом «функциональной ригидности» (от 11,77 до 38,24%), «энергетической складки» (от 16,18 до 35,29%), нарушением баланса регуляции сердечного ритма за счет автономного или центрального контура регуляции (от 47 до 60,29%), снижением уровня компенсаторных реакций в восстановительный период (100%), ригидностью вариабельности сердечного ритма (CV от 6,22±2,1 до 7,1±2,5%).
На основании полученных данных были построены прогностические модели развития неблагоприятных перинатальных исходов (тяжелой асфиксии, реализации ВУИ). Для оценки связи факторов риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании был проведен логистический регрессионный анализ. В качестве независимых факторов в регрессионном анализе идентифицированы: наличие энергодефицитных состояний матери, энергодефицитных состояний плода, совокупного показателя энергодефицитных состояний матери и плода.
В результате регрессионного анализа для каждого независимого прогностического признака получены значения относительного риска с 95% доверительным интервалом (ОР (95% ДИ)). Каждому независимому прогностическому признаку присвоен вес, равный величине его ОР, и разработана балльная система для подсчета риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании при энергодефицитных состояниях матери (табл.1), энергодефицитных состояниях плода (табл.2), совокупного показателя энергодефицитных состояний матери и плода (табл.3).
Для практического использования шкалы определены пограничные значения суммы баллов, разделяющие пациенток на группы низкого, промежуточного и высокого риска развития неблагоприятных перинатальных исходов при внутриутробном инфицировании с помощью ROC-анализа (ROC - Receive Operative Curve). В таблицах 4, 5, 6 представлены прогностические чувствительность и специфичность оценки новых шкал риска развития неблагоприятных перинатальных исходов у пациенток с внутриутробным инфицированием.
Признак с высокой специфичностью чаще дает истинный результат при наличии отрицательного исхода (обнаруживает отрицательные примеры, т.е. неблагоприятные исходы). Специфичный диагностический тест диагностирует доподлинно больных с высоким риском развития неблагоприятных перинатальных исходов при внутриутробном инфицировании при значении специфичности более 50%. При показателе специфичности ближе к 100% риск развития события считается очень высоким.
Таким образом, получены:
А) три группы риска развития неблагоприятных перинатальных исходов (НПИ) при наличии энергодефицитных состояний матери:
I - группа низкого риска развития НПИ: 0-2 баллов;
II - группа среднего риска развития НПИ: 3-5 баллов;
III - группа высокого риска развития НПИ: 6-10 баллов.
Б) три группы риска развития неблагоприятных перинатальных исходов при наличии энергодефицитных состояний плода:
I - группа низкого риска развития НПИ: 0-2 баллов;
II - группа среднего риска развития НПИ: 3-5 баллов;
III - группа высокого риска развития НПИ: 6-11 баллов.
В) две группы риска развития неблагоприятных перинатальных исходов при наличии энергодефицитных состояний и у матери и у плода:
I - группа низкого риска развития НПИ: 0-3 баллов;
II - группа высокого риска развития НПИ: 4-9 баллов.
В дальнейшем, в ходе исследования, проведена проверка работоспособности моделей на независимой выборке пациенток с внутриутробной инфекцией (n=70).
Значение χ2 полученной модели при энергодефицитных состояниях матери составило 51,956 при уровне достоверности p<0,0001. Вероятность правильной классификации модели составила 78,33%.
Значение χ2 полученной модели при энергодефицитных состояниях плода составило 51,151 при уровне достоверности p<0,0001. Вероятность правильной классификации модели составила 81,11%.
Значение χ2 полученной модели при энергодефицитных состояниях матери и плода составило 48,408 при уровне достоверности p<0,0001. Вероятность правильной классификации модели составила 77,64%.
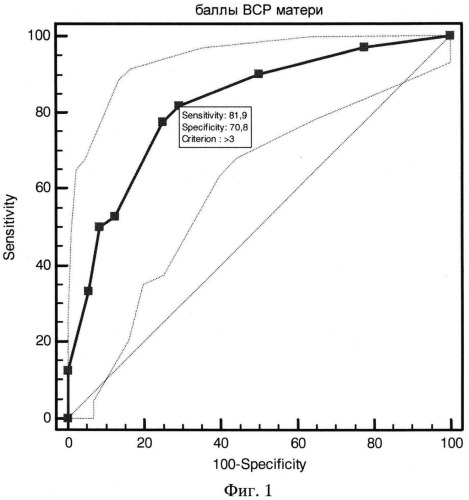
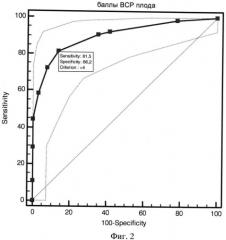
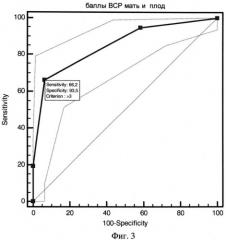
Для наглядного изображения прогностической эффективности новых шкал построены характеристические кривые с оценкой площади под ROC-кривой. У новых прогностических шкал площадь под ROC-кривой составила:
А) при энергодефицитных состояниях матери - 0,763 (Фиг.1);
Б) при энергодефицитных состояниях плода - 0,768 (Фиг.2);
В) при сочетании энергодефицитных состояний матери и плода - 0,744 (Фиг.3).
На основании анализа данных был сделан вывод о том, что совместное использование параметров анализа ВСР матери и плода и данных допплерометрии артерии пуповины позволяет повысить коэффициент корректной классификации до 77,64-81,11%, p<0,0001.
Пример 1.
Пациентка М., 21 год, первобеременная, первородящая. Беременность вне брака. Соматический и акушерско-гинекологический анамнезы не отягощены. С 12 недель состояла на «Д» учете по беременности. Течение беременности на фоне анемии с 29 недель (гемоглобин ПО г/л), ОРВИ в 31 неделю. В 32 недели по КТГ диагностирован антенатальный дистресс плода средней степени тяжести, по УЗИ - обвитие шеи плода пуповиной. Прибавка массы тела за беременность 14 кг. Госпитализирована в ОПБ родильного дома №1 МБУЗ ГКБ №3 им. М.А. Подгорбунского с целью подготовки к родам в связи гипоксией плода.
В отделении проведено обследование: УЗИ - ПМП 3200 г, патологии не выявлено; КТГ - 7-8 баллов по Фишеру.
Прогноз?
По анализу вариабельности сердечного ритма: у матери исходное гиперадаптивное состояние с правильным соотношением компонентов спектра, при проведении нагрузочных проб - переход на автономный контур регуляции с преобладанием парасимпатического компонента регуляции.
У плода - исходное нормоадаптивное состояние с правильным соотношением компонентов спектра, при проведении нагрузочных проб у матери - выраженная гипоадаптивная реакция с постнагрузочной активацией преимущественного симпатического и парасимпатического компонентов спектра, что расценено как феномен «энергетической складки».
Проведено исследование согласно предлагаемому способу
При использовании разработанной математической модели получены следующие данные:
1. ∑1=2 (CV=3,2 - менее 5,4) + 3 (ИР=0,5 - менее 0,58) + 3 (CV=7,6 - менее 7,8) + 0 (RRmin=636 - более 531)=8 - высокий риск развития неблагоприятных перинатальных исходов.
2. ∑2=2 (CV=3,2 - менее 5,4) + 3 (ИР=0,5 - менее 0,58) + 2 (CV=7,6 - менее 0,78) + 0 (RRmin=636 - более 531)=7 - высокий риск развития неблагоприятных перинатальных исходов.
3. ∑3=3 (CV=3,2 - менее 5,4) + 3 (CV=7,6 - менее 7,8) + 3 (ИР=0,5 - менее 0,58)=9 - высокий риск развития неблагоприятных перинатальных исходов на основании совокупного состояния матери и плода.
Таким образом, по всем трем шкалам пациентка отнесена к группе высокого риска развития неблагоприятных перинатальных исходов (реализации ВУИ и тяжелой асфиксии).
При последующем наблюдении отмечалось отсутствие готовности родовых путей к родам, вследствие чего проводилась подготовка шейки матки ламинариями и дважды с интервалом 24 часа мифепристоном 200 мг перорально. Проведена индукция в роды. В родах развилась первичная дискоординация родовой деятельности, с которой не удалось справиться консервативными методами. Пациентка родоразрешена путем операции кесарево сечение. Продолжительность первого периода 6 часов, безводного периода - 8 часов.
На операции извлечен мальчик 3660 г длиной 55 см с оценкой по Апгар 6/8 баллов. Плацента размерами 22×20×2 см, массой 685 г, плацентарно-плодовый индекс 0,187. Гистологическое заключение: хроническая субкомпенсированная плацентарная недостаточность. Очаговый децидуит, интервиллузит.
Послеродовый период осложнился у пациентки обострением генитального герпеса на 2-е сутки послеоперационного периода (локализация веко, лицо).
У ребенка через 45 минут после рождения диагностирована нарастающая дыхательная недостаточность, акроцианоз, сатурация кислородом крови составила 42%. В связи с подозрением на внутриутробную аспирацию околоплодными водами, внутриутробную пневмонию начата искусственная вентиляция легких аппаратом «Servo-i», назначено комплексное лечение. Экстубирован на 3-й сутки. Через 7 дней переведен в ОПН с диагнозом внутриутробная инфекция (пневмония, гепатит, неспецифический энтероколит).
Пример 2. Пациентка П., 34 года, повторнобеременная, повторнородящая. Беременность в зарегистрированном браке. Соматический анамнез не отягощен. Акушерско-гинекологический анамнез отягощен рождением первого ребенка с ВУИ (внутриутробная пневмония, задержка роста), интранатальной гибелью второго ребенка. Патологоанатомический диагноз: внутриутробный сепсис, антенатальная двухсторонняя тотальная аспирационная гнойная пневмония; интранатальная гипоксия плода: полнокровие внутренних органов, отсутствие гликогена в гепатоцитах и кардиомиоцитах; морфофункциональная незрелость: очаги кроветворения в печени. Патология последа: восходящая инфекция III степени (париетальный хориодецидуит, субхориальный интравиллузит, сосудистый фуникулит). Вторичная субкомпенсированная хроническая плацентарная недостаточность, персистенция промежуточных дифференцированных ворсин. Однократное тугое обвитие пуповины вокруг шеи плода.
С 4-5 недель состояла на диспансерном учете по беременности. Течение беременн