Соединения хиназолина
Иллюстрации
Показать всеИзобретение относится к (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамиду или его фармацевтически приемлемой соли, а также к фармацевтической композиции для лечения ракового заболевания, чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, содержащей указанное соединение, способу лечения ракового заболевания, способу ингибирования и к применению указанного соединения для приготовления лекарственного средства. Технический результат - (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид, проявляющий ингибирующую активность к гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста. 5 н. и 7 з.п. ф-лы, 4 табл., 7 пр.
Реферат
Область техники
Настоящее изобретение относится к фармацевтической области и, в частности, к некоторым соединениям хиназолина, композиции, содержащей указанные соединения, и их применению. Предложенные соединения хиназолина способны эффективно ингибировать гиперэкспрессиию и/или гиперактивность рецептора эпидермального фактора роста (EGFR).
Уровень техники
Связывание эпидермального фактора роста (EGF) с рецептором эпидермального фактора роста (EGFR) может запускать активность тирозинкиназы и тем самым может вызывать реакции, которые приводят к пролиферации клеток. Гиперэкспрессия и/или гиперактивность EGFR может приводить к неконтролируемому делению клеток, которые имеют предрасположенность к раковому заболеванию. Поэтому соединения, которые могут ингибировать гиперэкспрессию и/или гиперактивность EGFR, являются потенциальными кандидатами для лечения рака.
Краткое описание изобретения
Предложено по меньшей мере одно соединение, выбранное из:
(3aR,6aR)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-Н-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида; и
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида,
и/или по меньшей мере одна фармацевтически приемлемая соль указанных соединений.
Также предложена фармацевтическая композиция, содержащая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанные в настоящей заявке.
Также предложен способ лечения ракового заболевания, восприимчивого к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий введение пациенту, нуждающемуся в лечении, эффективного количества по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения, описанных в настоящей заявке.
Также предложено применение соединения согласно настоящему изобретению и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения для получения медикамента для лечения ракового заболевания. В предпочтительном варианте реализации настоящего изобретения раковое заболевание выбрано из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
Далее предложен способ ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий приведение в контакт рецептора эпидермального фактора роста с эффективным количеством по меньшей мере одного соединения и/или по меньшей мере одной фармацевтической соли указанного соединения.
Подробное описание изобретения
Согласно настоящему описанию следующие слова, фразы и символы, как правило, используются в значениях, указанных ниже, за исключением тех случаев, когда из контекста, в котором они используются, следует иное. Следующие сокращения и термины имеют указанные значения на протяжении всего описания.
Соединения, описанные в настоящей заявке, включают, но не ограничиваются ими, их оптические изомеры, рацематы и другие смеси. Отдельные энантиомеры или диастереомеры, т.е. оптически активные формы, можно получать путем асимметрического синтеза или разделения рацематов или смесей диастереомеров. Разделения рацематов или смесей диастереомеров можно достигать, например, общепринятыми способами, такими как кристаллизация в присутствии разделяющего агента или хроматография с использованием, например, колонки хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ).
В случаях если соединения, описанные в настоящей заявке, существуют в различных таутомерных формах, термин "соединение" включает все таутомерные формы соединения. Такие соединения также включают кристаллические формы, включая полиморфы и клатраты. Аналогичным образом термин "соль" включает все изомеры, рацематы, другие смеси, Z- и Е-формы, таутомерные формы и кристаллические формы соли соединения.
"Фармацевтически приемлемые соли" включают, но не ограничиваются ими, соли неорганических кислот, такие как гидрохлорат, фосфат, дифосфат, гидробромат, сульфат, фульфинат, нитрат и схожие соли; а также соли органических кислот, такие как малат, малеат, фумарат, тартрат, сукцинат, цитрат, ацетат, лактат, метансульфонат, n-толуолсульфонат, 2-гидроксиэтилсульфонат, бензоат, салицилат, стеарат и алканоат, такой как ацетат, HOOC-(CH2)N-COOH, где n составляет от 0-4, и схожие соли. Кроме того, фармацевтически приемлемые катионы включают, но не ограничиваются ими, натрий, калий, кальций, алюминий, литий и аммоний.
Кроме того, если соединение, описанное в настоящей заявке, получается в виде соли присоединения кислоты, свободное основание можно получать подщелачиванием раствора кислой соли. И, наоборот, если продукт является свободным основанием, соль присоединения, в частности фармацевтически приемлемую соль присоединения, можно получать растворением свободного основания в подходящем органическом растворителе и обработкой раствора кислотой в соответствии с общепринятыми способами приготовления солей присоединения кислоты из основных соединений. Специалистам в данной области известны различные методики синтеза, которые можно использовать для получения нетоксичных фармацевтически приемлемых солей присоединения.
"Сольват", такой как "гидрат", образуется в результате взаимодействия растворителя и соединения. Термин "соединение" включает сольваты соединений, в том числе гидраты. Аналогичным образом, "соли" включают сольваты солей, в том числе гидраты. Подходящие растворители представляют собой фармацевтически приемлемые сольваты, такие как гидраты, включая моногидраты и гемигидраты.
"Хелаты" образуется в результате координации соединения и иона металла в двух (или более) точках. Термин "соединение" включает хелаты соединений. Аналогичным образом "соли" включают хелаты солей.
"Нековалентный комплекс" образуется в результате взаимодействия соединения и другой молекулы, где ковалентная связь не образуется между соединением и молекулой. Например, комплексообразование может происходить за счет ван-дер-ваальсовских взаимодействий, водородных связей или электростатических взаимодействий (также называемых ионными связями). Получают такие нековалентные комплексы, включенные в термин "соединение".
Термин "активный агент" используется для обозначения химического вещества, которое имеет биологическую активность. В некоторых вариантах реализации, "активный агент" представляет собой химическое вещество, имеющее фармацевтическое применение.
"Проведение лечения", или "лечение", или "облегчение" относятся к введению по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, пациенту, имеющему заболевание или нарушение, или имеющему симптом заболевания или нарушения, или имеющему предрасположенность к заболеванию или нарушению, с целью исцеления, лечения, облегчения, уменьшения, изменения, исправления, улучшения, усовершенствования или воздействия на заболевание или нарушение, симптомы заболевания или нарушения или предрасположенность к заболеванию или нарушению. Заболеванием или нарушением может быть, например, раковое заболевание.
Термин "ингибирование" указывает на уменьшение исходной активности биологической активности или процесса. "Ингибирование гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста" относится к снижению экспрессии и/или активности EGFR, в виде прямого или косвенного ответа на присутствие по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, по отношению к активности EGFR в отсутствие по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли. Снижение активности может быть связано с прямым взаимодействием, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли указанного соединения, описанной в настоящей заявке, с EGFR или взаимодействием по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли указанного соединения, описанной в настоящей заявке, с одним или более другими факторами, которые, в свою очередь, влияют на активность EGFR. Например, присутствие по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, может снижать активность EGFR путем прямого связывания с EGFR, путем вызывания (прямого или косвенного) снижения активности EGFR при помощи другого фактора или снижением (прямым или косвенным) количества EGFR в клетке или организме.
Термин "эффективное количество" относится к количеству по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке, эффективного при "лечении" заболевания или нарушения у пациента. В случае ракового заболевания эффективное количество может вызывать любые наблюдаемые или измеряемые изменения у пациента, как описано выше при определении терминов "обработка", "лечение" или "облегчение". Например, эффективное количество может уменьшать количество раковых или опухолевых клеток; уменьшать размер опухоли; ингибировать или останавливать инфильтрацию опухолевых клеток в периферические органы, включая, например, распространение опухоли в мягкие ткани и кости; ингибировать или останавливать метастазирование опухоли; ингибировать или останавливать рост опухоли; облегчать в некоторой степени один или более симптомов, связанных с раком, снижать заболеваемость и смертность; улучшать качество жизни; или приводить к комбинации этих эффектов. Эффективное количество может составлять количество, достаточное для уменьшения симптомов заболевания, реагирующих на ингибирование гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста. Для лечения ракового заболевания эффективность in vivo можно, например, измерять путем определения продолжительности выживаемости, времени до прогрессирования заболевания (ТТР), скорости ответа (RR), длительности ответа и/или качества жизни. Как понятно специалистам в данной области, эффективные количества можно варьировать в зависимости от способа введения, используемого вспомогательного вещества и совместного использования с другими агентами.
Термин "эффективное количество" может также относиться к количеству, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке, эффективного при ингибировании гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста.
Ниже более подробно описан один или более вариант реализации настоящего изобретения.
Предложено по меньшей мере одно соединение, выбранное из:
(3aR,6aR)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида;
(3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида; и
(3aR,6aR)-Н-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамида,
и/или по меньшей мере их одна фармацевтически приемлемая соль.
Соединения хиназолина и/или их фармацевтически приемлемые соли, описанные в настоящей заявке, можно получать из коммерчески доступных исходных материалов способами, хорошо известными специалистам в данной области. Подробные описание способов приведены в разделе Примеры настоящей заявки.
Способы синтетической химии, используемые при получении целевых соединений хиназолина, также описаны, например, в R.Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W.Greene and P.G.M.Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L.Fieser and M.Fieser, Fieser and Fieser′s Reagents for Organic Synthesis, John Wiley and Sons (1994); и L.Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующих изданий.
По меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно очищать с помощью колоночной хроматографии, высокоэффективной жидкостной хроматографии, кристаллизации или других подходящих способов.
По меньшей мере одно соединение хиназолина и/или по меньшей мере одна его фармацевтически приемлемая соль, описанная в настоящей заявке, может взаимодействовать с EGFR киназой и/или ингибировать активность EGFR.
Также предложена композиция, включающая по меньшей мере один фармацевтически приемлемый носитель и по меньшей мере одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке.
Композицию, включающую по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно вводить различными известными способами, такими как пероральный, парентеральный, ингаляционный или с помощью имплантированного резервуара. Термин "парентеральный", используемый в настоящей заявке, включает подкожные, внутрикожные, внутривенные, внутримышечные, внутрисуставные, внутриартериальные, внутригрудинные, внутриоболочечные, внутриочаговые и внутричерепные способы инъекции или инфузии.
Пероральная композиция может представлять собой любую перорально приемлемую лекарственную форму, включая, но, не ограничиваясь ими, таблетки, капсулы, эмульсии и водные суспензии, дисперсии и растворы. Широко используемые носители для таблеток включают лактозу и кукурузный крахмал. Смазывающие агенты, такие как стеарат магния, также обычно добавляют в таблетки. Для перорального введения в форме капсул используют растворители, включая лактозу и сухой кукурузный крахмал. При пероральном введении водных суспензий или эмульсий активный ингредиент можно суспендировать или растворять в масляной фазе в сочетании с эмульгирующими или суспендирующими агентами. При желании, можно добавлять определенные подсластители, ароматизаторы или красители.
Стерильные инъекционные композиции (например, водные или масляные суспензии) можно изготавливать в соответствии со способами, известными в данной области при использовании подходящих диспергирующих или смачивающих агентов (таких как, например, Tween 80) и суспендирующих агентов. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, как раствор 1,3-бутандиола. В число фармацевтически приемлемых носителей и растворителей, которые можно использовать, входят маннитол, вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно используют в качестве растворителя или суспензионной среды (например, синтетические моно- и диглицериды). Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные пригодны для получения инъекционных препаратов, так же как и натуральные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в полиоксиэтилированном виде. Эти масляные растворы или суспензии могут также содержать спиртовой разбавитель или диспергатор с длинной цепью, карбоксиметилцеллюлозу или аналогичные диспергирующие агенты.
Ингаляционные композиции можно изготавливать в соответствии со способами, хорошо известными в области приготовления фармацевтических средств, и можно получать в виде солевых растворов с использованием бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для повышения биологической доступности, фторуглеродов и/или других известных солюбилизаторов или диспергирующих агентов.
Композицию для наружного применения можно изготавливать в виде масла, крема, лосьона, мази и т.д. Подходящие носители для композиции включают, но не ограничиваются ими, растительные или минеральные масла, белый вазелин (белый мягкий парафин), жиры или масла с разветвленной цепью, животные жиры и высокомолекулярные спирты (более С12). В некоторых вариантах реализации активный ингредиент является растворимым в фармацевтически приемлемом носителе. При желании эмульгаторы, стабилизаторы, увлажнители и антиоксиданты также могут включать красители или ароматизаторы. Кроме того, в этих препаратах для наружного применения могут содержаться усилители проникновения через кожу. Примеры таких усилителей можно найти в патентах США №3,989,816 и №4,444,762.
Крема можно изготавливать из смеси минерального масла, самоэмульгирующегося пчелиного воска и воды, к которой добавлен активный ингредиент, растворенный в небольшом количестве масла, такого как миндальное масло. Пример такого крема включает около 40 частей воды, около 20 частей пчелиного воска, около 40 частей минерального масла и около 1 части миндального масла. Мази можно изготавливать смешиванием раствора активного ингредиента в растительном масле, таком как миндальное масло, с теплым мягким парафином и с последующим охлаждением смеси. Пример такой мази включает около 30% по весу миндаля и около 70% по весу белого мягкого парафина.
Фармацевтически приемлемый носитель относится к носителю, совместимому с активными ингредиентами композиции (и, в некоторых вариантах реализации, способному стабилизировать активные ингредиенты) и не оказывающему вредного воздействия на пациента. Например, солюбилизирующие агенты, такие как циклодекстрины (которые образуют определенные, более растворимые комплексы с, по меньшей мере, одним соединением и/или, по меньшей мере, одной фармацевтически приемлемой солью, описанной в настоящей заявке), можно использовать в качестве фармацевтических вспомогательных веществ для доставки активных ингредиентов. Примеры других носителей включают коллоидный диоксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Yellow #10. Гидрофобные вспомогательные вещества, такие как синтетические и натуральные полимеры (например, альбумин и его производные), также представляют собой примеры фармацевтически приемлемых носителей.
Подходящие in vitro тесты можно использовать для предварительной оценки эффективности, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке, при ингибировании активности EGFR. По меньшей мере, одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно дополнительно проверить на эффективность при лечении раковых заболеваний в in vivo тестах. Например, соединения, описанные в настоящей заявке, и/или их фармацевтически приемлемые соли можно вводить животным (например, мышам), больным раком, и оценивать их терапевтические эффекты. На основе результатов также можно определять подходящие диапазоны дозировки и способы введения лекарств животным, в том числе людям.
Также предложен способ лечения ракового заболевания чувствительного к ингибированию гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий введение пациенту, нуждающемуся в лечении, эффективного количества по меньшей мере одного соединения и/или по меньшей мере одной фармацевтически приемлемой соли, описанной в настоящей заявке.
По меньшей мере одно соединение и/или, по меньшей мере, одну фармацевтически приемлемую соль, описанную в настоящей заявке, можно использовать для достижения полезного терапевтического или профилактического эффекта, например, у пациентов страдающих раковым заболеванием. Согласно настоящему описанию, термин "раковое заболевание" относится к клеточным нарушениям, характеризующимся неконтролируемой или нарушенной клеточной пролиферацией, снижением клеточной дифференцации, ненормальной способностью вторгаться в окружающие ткани и/или способности формировать область нового роста в эктопической области. Термин "раковое заболевание" включает, но не ограничивается ими, солидные опухоли и переносимые кровью опухоли. Термин "раковое заболевание" охватывает заболевания кожи, тканей, органов, костей, хрящей, крови или сосудов. Термин "раковое заболевание " также охватывает первичные и метастатические раковые заболевания.
Неограничивающие примеры солидных опухолей включают рак поджелудочной железы; рак мочевого пузыря; колоректальный рак; рак молочной железы, включая метастатический рак молочной железы; рак предстательной железы, включая андроген-зависимый и андроген-независимый рак предстательной железы; рак почек, включая, например, метастатическую почечно-клеточную карциному; гепатоцеллюлярный рак; рак легких, включая, например, немелкоклеточный рак легких (НМРЛ), бронхиолоальвеолярную карциному (БАК) и аденокарциному легких; рак яичников, включая, например, нарастающий эпителиальный или первичный перитонеальный рак; рак шейки матки; рак желудочно-кишечного тракта; желудочный рак; рак головы и шеи, включая, например, плоскоклеточную карциному головы и шеи; рак кожи, включая, например, злокачественную меланому; нейроэндокринный рак, включая метастатические нейроэндокринные опухоли; опухоли мозга, включая, например, глиомы, анапластическую олигодендроглиому, мультиформную глиобластому и анапластическую астроцитому; рак костей; саркому мягких тканей и рак щитовидной железы.
Не ограничивающие примеры гематологических злокачественных опухолей включают острую миелоцитарную лейкемию (ОМЛ), хроническую гранулоцитную лейкемию (ХГЛ), включая фазы акселерации и бластного криза ХГЛ (ХГЛ-БК); острую лимфобластную лейкемию (ОЛЛ); хроническую лимфоцитарную лейкемию (ХЛЛ); болезнь Ходжкина (БХ); неходжкинскую лимфому (НХЛ), включая фолликулярную лимфому и лимфому из клеток мантии; В-клеточную лимфому; Т-клеточную лимфому; множественную миелому (ММ); макроглобулинемию Вальденстрема; миелодиспластический синдром (МДС), включая рефракторную анемию (РА), рефракторную анемию с кольцевидными сидеробластами (РАКС), рефракторную анемию с избытком бластов (РАИБ) и РАИБ в трансформации (РАИБ-Т) и миелопролиферативные синдромы.
В некоторых вариантах реализации примеры подвергаемого лечению ракового заболевания включают, но не ограничиваются ими, рак легких, рак головы и шеи, колоректальный рак, рак поджелудочной железы, рак толстой кишки, рак молочной железы, рак яичников, рак предстательной железы, рак желудка, рак почек, рак печени, рак мозга, рак костей и лейкемию. В некоторых вариантах реализации примеры подвергаемого лечению ракового заболевания выбирают из рака легких, рака головы и шеи, колоректального рака, рака глотки, эпидермоидного рака и рака поджелудочной железы.
В некоторых вариантах реализации по меньшей мере одно соединение и/или по меньшей мере одну фармацевтически приемлемую соль, описанную в настоящей заявке, вводят в сочетании с эффективным количеством другого терапевтического агента, который отличается от указанных по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящей заявке. В некоторых вариантах реализации другой терапевтический агент представляет собой противораковый агент. В некоторых вариантах реализации другой терапевтический агент представляет собой одно из веществ, которые обычно вводят пациентам с заболеванием или состоянием, которое подвергается лечению. По меньшей мере, одно соединение и/или, по меньшей мере, одну его фармацевтически приемлемую соль, описанную в настоящей заявке, можно вводить с другим терапевтическим агентом в виде одной или раздельных лекарственных форм. В случае раздельного введения другой терапевтический агент можно вводить до, в то же время или после введения по меньшей мере одного соединения и/или по меньшей мере одной его фармацевтически приемлемой соли, описанной в настоящей заявке.
В некоторых вариантах реализации по меньшей мере одно соединение и/или, по меньшей мере, одну его фармацевтически приемлемую соль, описанную в настоящей заявке, вводят в сочетании с противораковым агентом. Согласно настоящей заявке термин "противораковый агент" относится к любому агенту, который вводят пациенту с раковым заболеванием с целью лечения ракового заболевания. Не ограничивающие примеры противораковых агентов включают: радиотерапию; иммунотерапию; химиотерапевтических агентов, вызывающих повреждение ДНК, и химиотерапевтических агентов, которые разрушают клетки репликации.
Неограничивающие примеры химиотерапевтических агентов, вызывающих повреждение ДНК, включают ингибиторы топоизомеразы I (например, иринотекан, топотекан, камптотецин и его аналоги или метаболиты и доксорубицин); ингибиторы топоизомеразы II (например, этопозид, тенипозид и даунорубицин); алкилирующие агенты (например, мелфалан, хлорамбуцил, бусульфан, тиотепа, ифосфамид, кармустин, ломустин, семустин, стрептозоцин, декарбазин, метотрексат, митомицин С и циклофосфамид); интеркаляторы ДНК (например, цисплатин, оксалиплатин и карбоплатин); интеркаляторы ДНК и генераторы свободных радикалов, такие как блеомицин; миметики нуклеозидов (например, 5-фторурацил, капецитабин, гемцитабин, флударабин, цитарабин, меркаптопурин, тиогуанин, пентостатин и гидроксимочевина).
Химиотерапевтические агенты, которые разрушают клетки репликации, включают: паклитаксел, доцетаксел и аналоги; винкристин, винбласти и аналоги; талидомид и аналоги (например, СС-5013 и СС-4047); ингибиторы протеин-тирозин киназы (например, иматиниб и гефитиниб); ингибиторы протесом (например, бортезомиб); ингибиторов NF-kappa В, включая ингибиторы I kappa В киназы; антитела, которые связываются с белками, гиперэкспрессивными при раковых заболеваниях, и тем самым подавляют репликацию клеток (например, трастузумаб, ритуксимаб, цетуксимаб и бевацизумаб); и другие ингибиторы белков или ферментов, проявляющих повышение регуляции, гиперэкспрессию или активацию при раковых заболеваниях, ингибирование которых приводит к подавлению репликации клеток.
Также предложен способ ингибирования гиперэкспрессии и/или гиперактивности рецептора эпидермального фактора роста, включающий контактирование рецептора эпидермального фактора роста с эффективным количеством, по меньшей мере, одного соединения и/или, по меньшей мере, одной фармацевтически приемлемой соли, описанной в настоящей заявке.
ПРИМЕРЫ
Следующие примеры представлены исключительно для иллюстрации и не ограничивают настоящее изобретение.
В следующих примерах используются приведенные ниже сокращения:
| АсОН | уксусная кислота |
| КМЦ-Na | натрий-карбоксиметилцеллюлоза |
| DELFIA | усиленный диссоциацией лантанидный флуоресцентный иммуноанализ |
| DMEM | модифицированная по способу Дульбекко среда Игла |
| ДМФА | N,N-диметилформамид |
| ДМСО | диметилсульфоксид |
| ДТТ | дитиотреитол |
| ЭДТА | этилендиаминтетрауксусная кислота |
| EtOAc | этилацетат |
| ФБС | фетальная бычья сыворотка |
| ч | час(ы) |
| мл | миллилитр(ы) |
| мин | минута(ы) |
| PBS | физиологический раствор с фосфатным буфером |
| ПЭ | петролейный эфир |
| ФМСФ | фенилметилсульфонилфторид |
| Ру | пиридин |
| ТГФ | тетрагидрофуран |
| Трис-Cl | гидроксиметиламинометан гидрохлорид |
Пример 1: (3aR,6aR)-N-(4-(1-(3 -фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
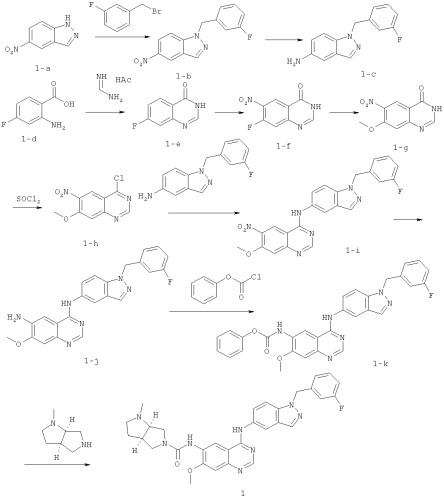
Соединение 1 получали согласно нижеприведенной схеме.
Смесь 5-нитро-1Н-индазола (1-а, 5 г, 30,65 ммоль), 1-(бромметил)-3-фторбензола (3,76 мл, 30,65 ммоль) и порошка карбоната калия (4,66 г, 30,65 ммоль) в ДМФА (3 мл) перемешивали при 80°C в течение 3 ч, а затем вливали в воду (100 мл). Осадок получали путем фильтрации и дальнейшей очистки путем хроматографии на силикагеле (ПЭ/EtOAc=3:1) с получением 1-b (5,3 г, 19,7 ммоль).
Никель Ренея (0,53 г сырой массы) в атмосфере азота добавляли к раствору 1-b (5,3 г, 19,7 ммоль) в метаноле (20 мл), смесь дегазировали и перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Катализатор тщательно отфильтровывали и фильтрат концентрировали под вакуумом с получением 1-е (4,65 г, 19,3 ммоль).
Смесь 2-амино-4-фторбензойной кислоты (1-d, 7,75 г, 50 ммоль) и метанимидамид ацетата (15,6 г, 150 ммоль) в этаноле перемешивали при температуре кипения в течение ночи, а затем охлаждали до температуры окружающей среды. Осадок отфильтровывали и сушили под вакуумом с получением 1-е (8,0 г, 48 ммоль).
7-Фторхиназолин-4(3Н)-он (1-е, 8,0 г, 48 ммоль) растворяли в концентрированной H2SO4 (24 мл) и раствор охлаждали до 0°C на ледяной бане. Затем к раствору по каплям добавляли HNO3 (24 мл) с поддержанием температуры реакции ниже 0°C. После этого смесь медленно нагревали до 100°C и перемешивали в течение 3 дней. Полученную смесь охлаждали до температуры окружающей среды и погружали в ледяную воду. Осадок получали путем фильтрации и последующей рекристаллизации из АсОН с получением 1-f (3,25 г, 15,53 ммоль).
Металлический натрий (0,71 г, 31 ммоль) в атмосфере азота осторожно добавляли к метанолу (безводный, 100 мл) и перемешивали в течение 10 минут с получением свежего раствора метоксида натрия. К раствору добавляли 7-фтор-6-нитрохиназолин-4(3Н)-он (1-f, 3,25 г, 15,53 ммоль) и смесь нагревали до кипения в течение 3 ч. Полученную смесь охлаждали до температуры окружающей среды и подкисляли HCl (2 N) до рН=3~4. Летучие компоненты удаляли при пониженном давлении. Остаток суспендировали в воде, твердое вещество отфильтровывали и сушили под вакуумом с получением 1-g (3,17 г, 14,4 ммоль).
К раствору 7-метокси-6-нитрохиназолин-4(3Н)-она (1-g, 1,23 г, 5,56 ммоль) в SOCl2 (8 мл) добавляли ДМФА (0,5 мл) и смесь нагревали до кипения в течение 4 ч. Летучие компоненты удаляли при пониженном давлении с получением (1-h, 1,2 г, 5,0 ммоль).
Смесь 4-хлор-7-метокси-6-нитрохиназолина (1-h, 1,2 г, 5,02 ммоль) и 1-(3-фторбензил)-1Н-индазол-5-амина (1-е, 1,2 г, 4,98 ммоль) в диоксане (40 мл) нагревали до кипения в течение 3 ч. Смесь охлаждали до температуры окружающей среды. Осадок получали путем фильтрации и очистки путем хроматографии на силикагеле с получением 1-i (1,7 г, 3,88 ммоль) в виде желтого твердого вещества.
Никель Ренея (0,13 г сырой массы) в атмосфере азота добавляли к раствору 1-i (1,5 г, 3,7 ммоль) в метаноле (20 мл). Смесь дегазировали и трижды продували Н2, а затем перемешивали в атмосфере водорода при комнатной температуре в течение 4 ч.
Катализатор тщательно отфильтровывали. Фильтрат концентрировали под вакуумом с получением 1-j (1,36 г, 3,29 ммоль) в виде желтого твердого вещества.
К раствору 1-j (1,36 г, 3,29 ммоль) и пиридина (0,78 г, 9,86 ммоль) в ДМФА (3 мл) добавляли фенилхлорформиат (1,53 г, 9,86 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Осадок получали путем фильтрации и сушили с получением 1-k (1,40 г, 2,63 ммоль).
Раствор 1-k (1,1 г, 2,2 ммоль), пиридина (0,2 г, 2,6 ммоль) и (3aR,6aR)-l-метилоктагидропирроло[3,4-b]пиррола (0,33 г, 2,6 ммоль) в ДМФА (3 мл) перемешивали при 80°C в течение 1 ч, а затем погружали в ледяную воду и экстрагировали с EtOAc (3×40 мл). Объединенные экстракты промывали солевым раствором, сушили над Na2SO4 (безводный), фильтровали и концентрировали. Остаток очищали путем хроматографии на силикагеле (EtOAc/метанол=2:1) с получением соединения 1 (0,79 г, 1,4 ммоль). МС (m/е): 567,1 (M+1)+.
Пример 2: (3aS,6aS)-N-(4-(1-(3-фторбензил)-1Н-индазол-5-иламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 2 получали в соответствии со способом из Примера 1 при тех же условиях с использованием (3aS,6aS)-1-метилоктагидропирроло[3,4-b]пиррола. МС (m/е): 566,8 (М+1)+.
Пример 3: (3aR,6aR)-N-(4-(3-этинилфениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
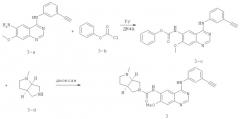
К раствору Соединения 3-а (40 г, 0,138 ммоль, приготовленному в соответствии со способом, описанным в WO 2010002845), пиридина (40 мл, 0,495 ммоль) и ДМФА (безводный, 22 мл) в безводном ТГФ (500 мл) по каплям при -10°C добавляли фенилхлорформиат 3-b (22 мл, 0,175 ммоль). Смесь перемешивали при комнатной температуре в течение 12 часов. Осадок отфильтровывали, а затем суспендировали в насыщенном растворе NaHCO3 (500 мл). Твердое вещество отфильтровывали, промывали водой и EtOAc и сушили под вакуумом с получением соединения 3-е (46 г). Смесь соединения 3-е (1 г, 2,44 ммоль) и соединения 3-d (369 мг, 2,92 ммоль) в диоксане (30 мл) перемешивали при 70°C в течение 5 часов, а затем охлаждали до температуры окружающей среды. Осадок отфильтровывали, промывали EtOAc и сушили под вакуумом с получением соединения 3 (0,8 г). МС (m/е): 443,4 (М+1)+.
Пример 4: (3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло [3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 4 получали в соответствии со способом из Примера 2. МС (m/e): 576,9 (М+1)+.
Пример 5: (3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)-7-метоксихиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 5 получали в соответствии со способом из Примера 1. МС (m/e): 576,7 (М+1)+.
Пример 6: (3aS,6aS)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 6 получали в соответствии со способом из Примера 2. МС (m/e): 546,8 (M+1)+.
Пример 7: (3aR,6aR)-N-(4-(3-хлор-4-(3-фторбензилокси)фениламино)хиназолин-6-ил)-1-метилгексагидропирроло[3,4-b]пиррол-5(1Н)-карбоксамид
Соединение 7 получали в соответствии со способом из Примера 1. МС (m/e): 546,8 (М+1)+.
Фармакологические исследования
Исследование ингибирования активирования EGFR
Высеивание и истощение клеток: клетки А431 (эпидермоидная карцинома у людей), разбавленные в 10% ФБС, содержащей DMEM, были посеяны в количестве 1,3×104 клеток/лунку в 96-луночные планшеты и инкубировали в течение ночи. Затем среду клеточной культуры заменяли на бессывороточную DMEM среду в количестве 90 мкл/лунка. Планшеты инкубировали в течение ночи для истощения.
Разбавление соединения и лечение: исследуемые соединения трижды разбавляли в бессывороточной среде, содержащей 5% ДМСО. Разбавленное соединение в количестве 10 мкл/лунку добавляли в клетки, в контрольные лунки добавляли 5% ДМСО без исследуемого соединения в количестве 10 мкл/лунку. Повторное исследование выполняли для каждой контрольной точки. Затем планшеты инкубировали 37°C в течение 60 минут в инкубаторе с 5%-ным содержанием СО2.
Получение лизата: среду удаляли и в каждую лунку к клеткам, подвергающимся лизису, добавляли 100 мкл/лунка 50 мМ Трис-Cl, рН 8,0 клеточного лизирующего буфера (содержащего 0,5 М NaCl, 0,2 мМ ЭДТА, 0,1% Triton Х-100, 1 мкг/мл апротинина, 0,