Мембрана ионоселективного электрода для определения ионных поверхностно-активных веществ в сточных водах и синтетических моющих средствах
Иллюстрации
Показать всеИзобретение относится к мембране ионоселективного электрода, состоящей из поливинилхлорида в качестве матрицы, дибутилфталата в качестве пластификатора и электродно-активного соединения, содержащего медь и додецилсульфат натрия. Мембрана характеризуется тем, что электродно-активное соединение дополнительно содержит пиридин, причем медь Сu2+, пиридин и додецилсульфат взяты в соотношении 1:2:2 соответственно, а компоненты мембраны находятся в следующем соотношении, мас. %: поливинилхлорид 24,88 - 24,73; дибутилфталат 74,61 - 74,25; электродно-активное соединение 0,51 - 1,02. Использование мембраны позволяет снизить предел обнаружения ионных ПАВ в водных средах, снизить погрешности определения результата, уменьшить время отклика электрода в разбавленных растворах. 5 табл., 11 ил.
Реферат
Изобретение относится к области аналитической химии и может быть использовано в контрольно-аналитических лабораториях для определения концентрации анионных (гомологов алкилсульфатов натрия) и катионных (гомологов солей алкилпиридиния и тетраалкиламмония) поверхностно-активных веществ в исследуемых жидких средах, для стандартизации и контроля качества синтетических моющих средств, для определения ионных поверхностно-активных веществ (ПАВ) в сточных водах с целью контроля загрязнения окружающей среды.
Актуальным вопросом контроля качества выпускаемой продукции, охраны окружающей среды и здоровья человека является контроль содержания компонентов в производимых синтетических моющих средствах, а также загрязняющих веществ в бытовых и производственных сточных водах. Эффективность контроля качества синтетических моющих средств обеспечивается внедрением в практику химических и технологических производств современных физико-химических методов анализа, среди которых важное место занимает потенциометрический метод с ионоселективными электродами.
Объектами настоящего исследования являются гомологи алкилсульфатов, алкилпиридиния, четвертичных аммониевых оснований, которые являются основой различных синтетических моющих средств (стиральных порошков, таблеток и жидкостей для посудомоечных машин, шампуней, бальзамов для волос, кондиционеров для белья и др.).
Известны различные методы определения ионных ПАВ в сточных водах и синтетических моющих средствах: спектроскопические, электрофоретические, хроматографические, например, высокоэффективная жидкостная хроматография; электрохимические.
Для определения гомологов алкилсульфатов натрия, солей алкилпиридиния и тетраалкиламмония используют спектрофотометрию (детергенты, шампуни, мыла, природные, промывочные и сточные воды), сорбционно- и экстракционно-фотометрический метод (природные и питьевые воды), хемилюминесценцию (модельные растворы, речная и питьевая вода, шампуни-кондиционеры), капиллярный электрофорез (продукты бытовой химии, зубная паста, косметические и фармацевтические препараты, природные и сточные воды, ил сточных вод), высокоэффективную жидкостную хроматографию (природные воды), ион-парная обращенно-фазовая хроматография (сточные воды предприятий), жидкостную хроматографию с масс-спектрометрическим детектором (речные и сточные воды, осадки сточных вод) [Кулапин А. И., Аринушкина Т. В. Методы раздельного определения синтетических поверхностно-активных веществ (обзор) //Заводская лаборатория. Диагностика материалов - 2001 - Т.67, №11, - с.3; Ланге К.Р. Поверхностно-активные вещества: синтез, свойства, анализ, применение. Санкт-Петербург: Профессия, 2005].
Однако многие из этих методов требуют дорогостоящего оборудования, реактивов, высококвалифицированных операторов, отличаются длительностью эксперимента.
Одним из перспективных методов определения ионных поверхностно-активных веществ в сточных водах и синтетических моющих средствах является потенциометрия с использованием различных сенсоров, например, ионоселективных электродов (ИСЭ). Метод отличается экспрессностью, селективностью, простотой и доступностью оборудования.
Известен ионоселективный электрод с мембранами, содержащими в качестве электродно-активных веществ (ЭАВ) ионные ассоциаты анионных ПАВ с алкиламмониевыми катионами или красителями трифенилметанового ряда [Чернова Р. К., Кулапина Е.Г., Чернова М.А., Матерова Е.А. Аналитические возможности пленочных алкилсульфатных электродов.//Журн. аналит. химии. - 1988 - Т. 43, №12 - c. 2179].
Однако данные ИСЭ не дают отклик на катионные ПАВ и используются только для определения анионных поверхностно-активных веществ с интервалом концентраций от ККМ до 10-6 М.
Известен ионоселективный электрод, состоящий из электропроводящей проволоки, покрытой полупроницаемой мембраной на основе труднорастворимого ионного ассоциата димидиум бромид - дисульфин голубой [см. патент EP №0382958, МПК G01N27/30]. Такая мембрана дает отклик на анионные, катионные и амфотерные ПАВ, такие как алкоксилированные неионные поверхностно-активные вещества.
Однако не используется классический ионоселективный электрод, состоящий из поливинилхлоридной трубки с графитовым или серебряным токоотводом, предел обнаружения указанных ПАВ достаточно высок.
Известны твердоконтактные сенсоры для определения ионных ПАВ на основе ионных ассоциатов n-гексадецилтриметиламмония 1-пентансульфоната и тетрабутиламмония додецилсульфата. Данные ИСЭ могут количественно определять алкилбензолсульфонаты, алкилсульфаты, эфиры алкилсульфатов, четвертичные аммониевые соли и жирные аминоксиды [патент EP №0300662, МПК G01N27/30, G01N27/00].
Однако электроды отличаются достаточно высоким пределом обнаружения и временем отклика.
Известна мембрана [см. патент GB №2076545, МПК G01N27/333, G01N27/40], сформированная из нерастворимого в воде полиэлектролита и поверхностно-активного вещества, к которому чувствителен электрод. Полиэлектролиты сформированы из мономеров: олефины, акрилаты, стиролы или виниловые эфиры. Cомономеры, которые могут быть использованы в дополнение к перечисленным выше, включают стирол, винилпиридин, винилацетат, винилхлорид, алкилакрилаты и метакрилаты. Катионные группы сомономеров могут содержать третичный атом азота, который переходит в четвертичный в процессе комплексообразования: пиридин, имидазол, хинолин, изохинолин, пиримидин, фенантролин, бензтиазол, пурин, пиразол, акридин или пиколин; анионные содержат карбоциклические или сульфогруппы. В качестве примеров электродноактивных компонентов мембраны были представлены комплексы поли(этилакрилат)10 - ко - (1-винилимидазол) и поли(этилакрилат)10 - ко -(3-бензил-1-винилимидазола хлорид).
Однако мембраны отличаются сложностью изготовления, а также высоким пределом обнаружения ПАВ.
Известен ионоселективный электрод с мембраной для ионометрического определения ионных ПАВ, содержащий в качестве ЭАВ ионные ассоциаты алкилсульфатов натрия с солями алкилпиридиния. [Кулапин А.И., Михайлова А.М., Матерова Е.А. Селективные твердоконтактные электроды для определения ионогенных поверхностно-активных веществ //Электрохимия. 1998.- Т.34.- №4. -c.421].
Известен твердоконтактный селективный электрод на основе ионного ассоциата цетилпиридиний-тетрафенилборат, который дает возможность определения как индивидуальных анионных, катионных, неионных ПАВ, так и их раздельного определения при совместном присутствии [патент RU №2141110, МПК G01N27/42].
Однако в последних двух работах интервал определяемых содержаний солей алкилсульфатов и алкилпиридиния у таких ИСЭ составляет 10-6(10-5) - 10-2(10-3) моль/л. Время отклика таких электродов в разбавленных растворах составляет 2-3 мин, делая анализ длительным.
Развитие ионометрии органических соединений предполагает использование в составе активных компонентов мембран заряженных комплексов определяемых веществ с ионами металлов. Этот прием позволяет существенно повысить чувствительность определения органических веществ.
Известен комплекс [Co(2,2´-бипиридил)2(C14H29NH2)]2+Cl2·3H2O, в котором изучали антимикробные свойства против грамм-положительных и грамм-отрицательных бактерий и грибов [Kumar R. S., Arunachalam S. Synthesis, micellar properties, DNA binding and antimicrobial studies of some surfactant-cobalt(III) complexes //Biophysical Chemistry. 2008. - V.136. - P.136].
Однако в потенциометрии такое комплексное соединение не было применено и внешняя сфера комплекса не содержит длинноцепочечного противоиона, что способствовало бы меньшему вымыванию ионного ассоциата из структуры мембраны во время работы, а также позволило определять анионные ПАВ.
Известны комплексы рутения (II) и кобальта (III) с полипиридилом, используемые в качестве электродноактивной пробы в циклической вольтамперометрии для изучения комплексообразования додецилсульфата натрия с циклодекстрином [Raj C.R., Ramaraj R. Study of surfactant-cyclodextrin complexation by cyclic voltammetry using polyPyrridyl metal complexes as electroactive probes //Electrochimica Acta. 1998.- V.44.- P.279].
Однако в потенциометрии такие комплексы не были использованы.
Наиболее близкой к заявляемому патенту является полимерная мембранная композиция на основе ассоциата комплекса меди с N,N'-диалкилэтилендиамином и додецилсульфатом, предложенная авторами [Щипунов Ю.А., Шумилина Е.В. Ассоциаты додецилсульфата с комплексами меди с алкильными производными диаминов. Оптические свойства и ионселективные электроды //Журн. аналит. химии. 1996. - Т.51. - №7. - С.758]. Ассоциаты додецилсульфата и комплекса меди с производными диаминов получают смешиванием разбавленных водных растворов исходных компонентов. Мембранная композициия для изготовления ИСЭ получена растворением в тетрагидрофуране поливинилхлорида, дибутилфталата и ассоциата додецилсульфата с комплексом меди соответствующего диамина, взятых в соотношении 50:47:3. Суммарная концентрация вещества в растворе варьировалась от 5 до 10 мас. %. Электроды позволяют проводить ионометрическое определение додецилсульфата натрия в воде в диапазоне концентраций от 10-6 до 8·10-3 М. Срок эксплуатации электродов составляет 7-8 месяцев; время отклика - 1 мин в концентрированных растворах (>3·10-4 М) 3 мин в разбавленных растворах (<1·10-4 М).
Однако у электродов высокий предел обнаружения, небольшой срок службы электрода и большое время отклика в разбавленных растворах.
Задачей изобретения является создание мембраны ИСЭ для экспрессного определения гомологов солей алкилпиридиния, тетраалкиламмония и алкилсульфатов в сточных водах и синтетических моющих средствах, и создание на основе полученной мембраны ионоселективного электрода, чувствительного к ионным ПАВ, для их количественного определения в водных средах.
Техническим результатом является понижение предела обнаружения ионных ПАВ в водных средах, снижение погрешности определения результата, уменьшения времени отклика электрода в разбавленных растворах.
Указанный технический результат достигается тем, что мембрана ионоселективного электрода, состоящая из поливинилхлорида в качестве матрицы, дибутилфталата в качестве пластификатора и электродно-активного соединения, содержащего медь и додецилсульфат натрия, согласно решению электродно-активное соединение дополнительно содержит пиридин, причем медь Сu2+, пиридин и додецилсульфат взяты в соотношении 1:2:2 соответственно, а компоненты мембраны находятся в следующем соотношении, мас.%:
| Поливинилхлорид | 24,88-24,73 |
| Дибутилфталат | 74,61-74,25 |
| Электродно-активное соединение | 0,51-1,02 |
Изобретение поясняется чертежами.
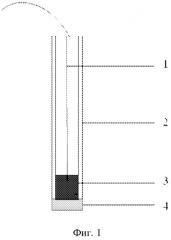
На фиг.1 представлена конструкция твердоконтактного электрода, где позициями обозначены:
1 - токоотвод;
2 - поливинилхлоридная трубка;
3 - графитовый стержень;
4 - ионоселективная мембрана.
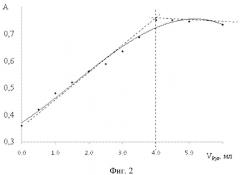
На фиг. 2 изображена кривая насыщения (зависимости оптической плотности от объема пиридина) для определения состава комплекса медь-пиридин.
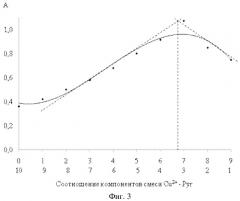
На фиг. 3 приведено определение состава комплекса медь-пиридин методом изомолярных серий.
На фиг. 4 представлена кривая титрования 10 мл 1·10-2 М раствора додецилсульфата натрия 5·10-2 М раствором комплекса меди (II) с пиридином.
На фиг. 5 приведен график зависимости ЭДС (мВ) от времени эксперимента (с) при скачкообразном изменении концентрации раствора ДДС.
На фиг. 6 представлен график зависимости ЭДС (мВ) от отрицательного логарифма концентрации (рС) анионных поверхностно-активных веществ: тетрадецилсульфата (ТТДС) (1), додецилсульфата (ДДС) (2) и гексадецилсульфата (ГДС) (3) натрия.
На фиг. 7 представлен график зависимости ЭДС (мВ) от отрицательного логарифма концентрации (рС) катионных ПАВ: цетилтриметиламмония бромида (ЦТМА) (1), октадецилиридиния (ОДП) (2), бензилдиметилтетрадециламмония (БДМТДА) (3) и цетилпиридиния (ЦП) (4) хлоридов.
На фиг. 8 представлена кривая титрования анионных ПАВ в промывной воде стиральной машины. Синтетическое моющее средство (СМС) - порошок «Ушастый нянь».
На фиг. 9 представлена кривая титрования анионных ПАВ в СМС порошке «Ушастый нянь».
На фиг. 10 представлена кривая титрования анионных ПАВ в шампуне «Nivea».
На фиг. 11 представлена кривая титрования катионных ПАВ в лекарственном препарате «Хлоргексидин».
Заявляемая мембрана может быть использована для определения ионных ПАВ в сточных водах, промывных водах стиральных машин, синтетических моющих средствах, косметико-гигиенических препаратах, лекарственных средствах.
Как правило, для измерения ЭДС используют стандартный и индикаторный ионоселективные электроды (ИСЭ). Конструкция индикаторного ИСЭ содержит корпус, представляющий собой поливинилхлоридную трубку 2 с графитовым стержнем 3 и токоотводом 1.
Заявляемая мембрана 4 представляет собой эластичную пленку, содержащую порошок поливинилхлорида, предварительно растворенный в циклогексаноне, растворитель-пластификатор - дибутилфталат и ЭАВ - комплексное соединение меди (II) с пиридином и додецилсульфатом.
Выполнение мембраны с использованием в качестве электродно-активного вещества сочетания меди с пиридином и додецилсульфатом обеспечивает универсальность электрода, который может быть использован для определения гомологов как катионных, так и анионных ПАВ. Выбор в качестве комплексообразователя катионов меди (II) обусловлен тем, что соли меди не токсичны и комплекс меди и пиридина хорошо известен. В качестве лиганда выбран пиридин, так как в его структуре находится третичный атом азота, прочно связанный в ароматический цикл, благодаря которому осуществляется отклик электрода на соединения, содержащие в структуре четвертичный атом азота, такие как соли алкилпиридиния и тетраалкиламмония.
Авторами разработана методика получения комплексного соединения. В химический стакан емкостью 100 мл помещают 25 мл раствора додецилсульфата натрия С=1·10-2 М и 25 мл раствора сульфата меди (II) С=1·10-1 М, добавляют 0,6 мл пиридина. К полученной смеси добавляют еще 25 мл раствора додецилсульфата натрия С=1·10-2 М. Полученный осадок темно-синего цвета отфильтровывают на фильтре Шотта (диаметр пор 40 нм) и промывают этиловым спиртом. Полученный осадок сушат при температуре 50-60°С (с целью избежания разложения электродно-активного вещества) в течение 5-6 часов для удаления влаги.
Изучен состав полученного комплекса меди с пиридином и додецилсульфатом. Предварительно было проведено спектрофотометрическое исследование комплексообразования в системе медь (II) - пиридин в данных условиях эксперимента. Мольное соотношение меди (II) и пиридина в комплексе устанавливали методами насыщения и изомолярных серий. На графике (фиг. 2) изображена кривая насыщения (зависимости оптической плотности от объема пиридина) для определения состава комплекса медь-пиридин,
CCu=CPyr=5·10-2 М, VCu(II)=2 мл.
Из графика видно, что на каждый моль Cu2+приходится 2 моль пиридина.
На фиг. 3 приведено определение состава комплекса медь-пиридин методом изомолярных серий: в пробирки наливают 0-9 частей пиридина (0-4,5 мл) СPyr=5·10-2 М и 10-1 часть сульфата меди (II) (5-0,5 мл) СCu=5·10-2 М.
Максимумы изомолярных серий лежат в области мольных отношений 6,6:3,3, что соответствует составу комплекса Cu(II) - пиридин 1:2.
Состав электродно-активного вещества определяли путем обработки кривых потенциометрического титрования 1·10-2 М додецилсульфата натрия раствором комплекса меди с пиридином.
На фиг. 4 представлена кривая титрования 10 мл 1·10-2 М раствора додецилсульфата натрия 5·10-2 М раствором комплекса меди (II) с пиридином.
Таким образом, было установлено, что стехиометрические соотношения реагирующих компонентов ионного ассоциата [Cu(Pyr)2]2+ДДС- составляют 1:2.
Изучались электродные и динамические свойства мембран на основе комплексного соединения [Cu(Pyr)2]ДДС2. Сочетание меди с пиридином во внутренней сфере комплексного соединения препятствует вымыванию пиридина и обеспечивает устойчивость всего соединения, его малую растворимость, высокую ионообменную способность, что подтверждают экспериментальные исследования и сравнение свойств ионообменника с другим электродно-активным веществом (см. Таблицы 1, 2).
В результате проведенных экспериментов и изучения свойств компонентов ЭАВ сделан вывод о том, что введение в состав мембран комплекса меди с пиридином и додецилсульфатом приводит к снижению предела обнаружения ПАВ.
Таблица 1.
Электродные свойства мембран на основе органических ионообменников
(СЭАВ=1%, n=4, p=0,95)
| ЭАС | Определяемое ПАВ | Ks | Линейность, М | Предел обнаружения, | Угловой коэффициент, мВ/рС | |
| моль/л | мг/л | |||||
| [Cu(Pyr)2] ДДС2 | Цетилпиридиний хлорид | (2,9±0,4)·10-13 | 1·10-4 - 4·10-7 | 4·10-7 | 0,12 | 57-59 |
| Додецилсульфат натрия | 1·10-3 - 2·10-7 | 2·10-7 | 0,06 | 54-55 | ||
| ЦП-ДДС | Цетилпиридиний хлорид | (2,1±0,4)·10-12 | 1·10-3 - 1·10-6 | 8·10-7 | 0,27 | 54-56 |
| Додецилсульфат натрия | 1·10-2 - 1·10-6 | 7·10-7 | 0,24 | 57-58 | ||
| [CuL2]ДДС2 L=N,N'-диалкилэтилендиамин | Додецилсульфат натрия | 8·10-3 -1·10-6 | 55-61 | |||
| где Ks - произведение растворимости ионообменников. |
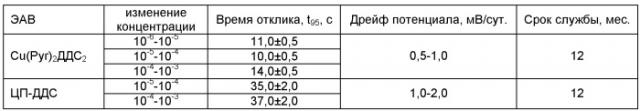
Исследованы динамические характеристики мембраны на основе комплекса Cu(Pyr)2ДДС2 при скачкообразном изменении концентрации. Время установления стационарного потенциала (время отклика) сенсора во всем исследованном диапазоне концентраций не превышало 15 сек, что подтверждает приведенный график (фиг. 5) зависимости ЭДС (мВ) от времени эксперимента (с) при скачкообразном изменении концентрации раствора ДДС.
Полученный сенсор на основе комплекса меди с пиридином и додецилсульфатом характеризуется небольшим временем отклика, следовательно, обладает высокой ионно-обменной способностью.
Время отклика исследуемого сенсора значительно ниже, чем для электрода на основе ионного ассоциата ЦП-ДДС, причем оно несколько меньше в разбавленных растворах ПАВ (см. Таблицу 2).
Таблица 2.
Динамические свойства мембраны на основе ассоциатов Cu(Pyr)2ДДС2
и ЦП-ДДС (сравнительная характеристика) (СЭАК=1%, n=4, p=0,95)
При использовании комплекса меди с пиридином и додецилсульфатом время отклика уменьшается, следовательно, происходит быстрый обмен ионами как с внутренней фазой комплекса (пиридин), так и с внешней фазой (додецилсульфат-анион) по сравнению с ранее изученным ионным ассоциатом додецилсульфата цетилпиридиния.
Ниже приведены примеры выполнения мембраны с различной концентрацией ЭАВ:
ЭАВ с=0,51%.
В бюкс емкостью 10 мл помещали 1,0327 г или 74,61% дибутилфталата, 2-3 мл тетрагидрофурана и при постоянном перемешивании на магнитной мешалке при небольшом нагревании 50-60°С добавляли 0,0071 г или 0,51% комплексного соединения меди (II) с пиридином и додецилсульфатом и 0,3443 г или 24,88% поливинилхлорида. Перемешивание продолжали до полной гомогенизации смеси. Мембранную композицию выливали в чашку Петри диаметром 95 мм и оставляли на воздухе до полного удаления тетрагидрофурана.
| Поливинилхлорид | 24,88% |
| Дибутилфталат | 74,61% |
| Электродно-активное вещество | 0,51% |
ЭАВ с=1,02%.
В бюкс емкостью 10 мл помещали 1,0327 г или 74,25% дибутилфталата, 2-3 мл тетрагидрофурана и при постоянном перемешивании на магнитной мешалке при небольшом нагревании 50-60°С добавляли 0,0142 г или 1,02% комплексного соединения меди (II) с пиридином и додецилсульфатом и 0,3443 г или 24,73% поливинилхлорида. Перемешивание продолжали до полной гомогенизации смеси. Мембранную композицию выливали в чашку Петри диаметром 95 мм и оставляли на воздухе до полного удаления тетрагидрофурана.
| Поливинилхлорид | 24,73% |
| Дибутилфталат | 74,25% |
| Электродно-активное вещество | 1,02% |
Полученную мембранную композицию использовали для изготовления твердоконтактных электродов: вырезали диск диаметром 7 мм и приклеивали к зачищенному и отполированному поливинилхлоридному корпусу клеем, содержащим 0,5 г поливинилхлорида, 0,25 г дибутилфталата и 5 мл циклогексанона. Изготовленные таким образом электроды кондиционировали в течение суток в 1·10-3 М растворе соответствующего ионного ПАВ.
При ионометрическом измерении концентрации ионных ПАВ используют индикаторный электрод, который размещают в растворе поверхностно-активного вещества, а затем калибруют путем измерения электродных потенциалов (ЭДС) электрохимической цепи, составленной из индикаторного ИСЭ и стандартного хлоридсеребряного электрода по растворам ионных ПАВ с известной концентрацией.
Измеряли зависимость величины ЭДС от концентрации растворов гомологов алкилпиридиния, тетраалкиламмония, алкилсульфатов.
На фиг. 6 представлен график зависимости ЭДС (мВ) от отрицательного логарифма концентрации (рС) анионных поверхностно-активных веществ: тетрадецилсульфата (ТТДС) (1), додецилсульфата (ДДС) (2) и гексадецилсульфата (ГДС) (3) натрия. ЭАВ: Cu(Pyr)2ДДС2.
График зависимости ЭДС (мВ) от отрицательного логарифма концентрации (рС) катионных ПАВ: цетилтриметиламмония бромида (ЦТМА) (1), октадецилиридиния (ОДП) (2), бензилдиметилтетрадециламмония (БДМТДА) (3) и цетилпиридиния (ЦП) (4) хлоридов представлен на фиг. 7. ЭАВ: Cu(Pyr)2ДДС2.
Анионные функции выполняются в интервале концентраций 1·10-3 - 2·10-7 (1·10-7) М с угловыми коэффициентами 55±5 мВ/рС, катионные в интервале 5·10-4 (1·10-4) - 5·10-7 (4·10-7) М с угловыми коэффициентами 60±7 мВ/рС. Эти характеристики свидетельствуют, что электрод проявляет чувствительность к ионным ПАВ согласно уравнению Нернста, лежащему в основе потенциометрического метода анализа.
Чувствительность (селективность) электрода к неионным ПАВ, гомологам ионных ПАВ и неорганическим ионам, входящим в состав сточных вод и синтетических моющих средств, поясняется Таблицей 3, в которой представлены коэффициенты потенциометрической селективности к различным веществам для мембраны на основе Cu(Pyr)2ДДС2.
Таблица 3.
| Основной ион | Мешающий ион | Ксел |
| Цетилпиридиний | Нонилфенол-12 | (7,9±0,4)·10-3 |
| Cu2+ | (1,0±0,1)·10-2 | |
| Ba2+ | (1,0±0,1)·10-2 | |
| Na+ | (3,2±0,2)·10-2 | |
| NH4 + | (8,9±0,4)·10-3 | |
| ОДП | (8,9±0,4)·10-2 | |
| ЦТМА | (2,0±0,1)·10-1 | |
| БДМТДА | (1,3±0,1)·10-1 | |
| Додецилсульфат | Нонилфенол-12 | (6,3±0,3)·10-3 |
| SO4 2- | (1,1±0,1)·10-2 | |
| Cl- | (1,1±0,2)·10-2 | |
| NO3 - | (7,4±0,4)·10-3 | |
| CO3 2- | (8,9±0,4)·10-3 | |
| CH3COO- | (1,9±0,1)·10-1 | |
| ГДС | (2,5±0,2)·10-1 | |
| ТТДС | (1,7±0,1)·10-1 |
Данные таблицы 3 свидетельствуют о возможности применения электрода на основе выбранного ЭАВ для определения ионных ПАВ в сточных водах, промывных водах стиральных машин, синтетических моющих средствах, косметических препаратов и лекарственных средств. Ниже приведены примеры применения электрода с заявляемой мембраной для определения ионных ПАВ в различных объектах.
Рассмотрим пример применения электрода с заявляемой мембраной для определения ионных ПАВ в сточных водах и промывных водах стиральных машин.
В стакан для титрования пипеткой отбирают 30-50 мл сточной воды или 20-50 мл промывной воды от стиральных машин и помещают твердоконтактный селективный электрод. Хлоридсеребряный электрод сравнения помещают непосредственно в электрохимическую ячейку или соединяют с исследуемым раствором посредством солевого мостика, представляющего собой трубку, заполненную насыщенным раствором хлорида калия.
Пробу титруют 1·10-3 М раствором цетилпиридиния хлорида (для определения АПАВ) или додецилсульфатом натрия (для определения КПАВ), прибавляя по 0,1-0,2 мл титранта. Строят кривую титрования в координатах E, мВ - V, мл и определяют точку эквивалентности (для анионных ПАВ) (фиг. 8).
Суммарное содержание анионных ПАВ пересчитывают на додецилсульфат натрия, катионных ПАВ - на цетилпиридиния хлорид.
Содержание ПАВ рассчитывают по формуле:
x = C т и т · V т . э . · М V а л · 1000 , м г / л
где Cтит - концентрация раствора титранта, моль/л;
Vт.э - объем титранта в точке эквивалентности, мл;
Vал - объем аликвотной части раствора образца, мл;
М - молярная масса додецилсульфата натрия (для определения анионных ПАВ) или цетилпиридиния хлорида (для определения катионных ПАВ), г/моль.
Относительное стандартное отклонение по данным методикам не превышает 0,03.
В табл.4 представлены результаты определения анионных ПАВ в образце промывной воды стиральной машины.
Таким образом, применение в качестве ЭАВ комплексного соединения Cu(Pyr)2ДДС2 позволяет проводить определение анионных и катионных ПАВ в сточных водах ниже уровня ПДК (ПДК для ДДС в водах водных объектов рыбохозяйственного значения составляет 0,5 мг/дм3 [Приказ Федерального агентства по рыболовству от 18 января 2010 г. №20 «Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения»]).
Пример применения электрода с заявляемой мембраной для определения анионных ПАВ в синтетических моющих средствах.
0,2-0,5 г СМС (например, стиральный порошок «Ушастый нянь») растворяют в дистиллированной воде в мерной колбе на 100 мл при нагревании на водяной бане. Отбирают аликвоту объемом 2-5 мл и титруют раствором цетилпиридиния хлорида для определения анионных ПАВ (Cтит=1·10-2 М). Строят кривую титрования в координатах E, мВ - V, мл и определяют точку эквивалентности (фиг. 9).
Суммарное содержание анионных ПАВ пересчитывается на додецилсульфат натрия.
Массовую долю анионных ПАВ в СМС рассчитывают по формуле:
ω А П А В = С т и т · V т . э . · V к · М V а л · m н а в е с к и · 1000 · 100, % ,
где CТИТ - концентрация раствора титранта, моль/л;
Vт.э - объем титранта в точке эквивалентности, мл;
Vк - объем колбы, мл;
М - молярная масса поверхностно-активного вещества, г/моль.
Vал - объем аликвотной части раствора образца, мл;
mнавески - масса навески СМС, г.
В табл.4 представлены результаты определения анионных ПАВ в образце стирального порошка «Ушастый нянь».
Относительное стандартное отклонение по данным методикам не превышает 0,01.
Пример применения электрода с заявляемой мембраной для определения ионных ПАВ в косметических препаратах.
2-3 г косметического препарата (например, шампунь «Nivea») растворяют в теплой дистиллированной воде в мерной колбе на 100 мл. Отбирают аликвоту объемом 2-5 мл и титруют раствором цетилпиридиния хлорида для определения анионных ПАВ (Cтит=1·10-2 М) или додецилсульфатом натрия для определения КПАВ (Cтит=1·10-3 М), прибавляя по 0,1 - 0,2 мл титранта. Строят кривую титрования в координатах E, мВ - V, мл и определяют точку эквивалентности (для анионных ПАВ в шампуне) (фиг. 10).
Суммарное содержание анионных ПАВ пересчитывается на додецилсульфат натрия, катионных - на цетилприметиламмоний бромид.
Массовую долю ионных ПАВ в СМС рассчитывают по формуле:
ω А П А В ( К П А В ) = С т и т · V т . э . · V к · М V а л · m н а в е с к и · 1000 · 100, % ,
где CТИТ - концентрация раствора титранта, моль/л;
Vт.э - объем титранта в точке эквивалентности, мл;
Vк - объем колбы, мл;
М - молярная масса поверхностно-активного вещества, г/моль.
Vал - объем аликвотной части раствора образца, мл;
mнавески - масса навески СМС, г.
В табл.4 представлены результаты определения анионных ПАВ в образце шампуня «Nivea» и катионных ПАВ в средстве по уходу за окрашенными волосами «LOREAL».
Относительное стандартное отклонение по данным методикам не превышает 0,04.
Разработанная методика может использоваться для определения ионных поверхностно-активных веществ в других косметических препаратах (бальзамах и витаминных средствах по уходу за окрашенными волосами).
Пример применения электрода с заявляемой мембраной для определения катионных ПАВ в лекарственном препарате «Хлоргексидин».
В стакан для титрования пипеткой отбирают 10 мл лекарственного препарата антисептика «Хлоргексидина» и помещают твердоконтактный селективный электрод. Хлоридсеребряный электрод сравнения соединяют с исследуемым раствором посредством солевого мостика, представляющего собой трубку, заполненную насыщенным раствором хлорида калия.
Пробу титруют 5·10-3 М раствором додецилсульфата, прибавляя по 0,1-0,2 мл титранта. Строят кривую титрования в координатах E, мВ - V, мл и определяют точку эквивалентности (фиг. 11).
Суммарное содержание катионных ПАВ пересчитывается на хлоргексидин.
Содержание катионного ПАВ рассчитывают по формуле:
x = C т и т · V т . э . · М V а л , м г / м л
где Cтит - концентрация раствора титранта, моль/л;
Vт.э - объем титранта в точке эквивалентности, мл;
Vал - объем аликвотной части раствора образца, мл;
М - молярная масса хлоргексидина, г/моль.
В табл.4 и 5 представлены результаты определения катионных ПАВ (хлоргексидина) в лекарственном препарате «Хлоргексидин».
Относительное стандартное отклонение по данным методикам не превышает 0,05.
Разработанная методика может использоваться для определения катионных поверхностно-активных веществ в других ПАВ-содержащих лекарственных препаратах.
Правильность контролировали методом «введено-найдено».
Таблица 4
Результаты определения содержания ионных ПАВ в различных объектах
(n=3, Р=0,95)
| Объект | ПАВ | Содержание ω ¯ ± Δ ω , масс. % | Sr | Введено, мг | Найдено m ¯ ± Δ m , мг | Относительная погрешность,% |
| Промывная вода от стиральной машины | Анионные | 9,12±0,72* | 0,03 | 0,58 | 0,56±0,05 | 3,4 |
| Порошок «Ушастый нянь» | Анионные | 15,12±0,30 | 0,01 | 0,86 | 0,87±0,03 | 1,2 |
| Шампунь«Nivea» | Анионные | 6,25±0,25 | 0,02 | 4,3 | 4,4±0,5 | 2,3 |
| Средство по уходу за окрашенными волосами «LOREAL» | Катионные | 0,95±0,09 | 0,04 | 0,73 | 0,74±0,05 | 1,4 |
| Хлоргексидин | Катионные | 0,056±0,004 | 0,05 | - | - | - |
| * мг/л |
Таблица 5
Результаты определения катионных ПАВ в лекарственных препаратах
(n=3, Р=0,95)
| Объект | ОпределяемыеКПАВ | Содержание ПАВ(декларированное) | Найдено m ¯ ± Δ m | Sr |
| Хлоргексидин | хлоргексидин | 0,05%(0,5 мг/мл) | (0,056±0,004)% | 0,05 |
Подводя итог вышесказанному, полученные значения коэффициентов потенциометрической селективности позволили сделать прогноз о возможности применения разработанного потенциометрического сенсора на основе комплексного соединения меди (II) с пиридином и додецилсульфатом для определения ионных ПАВ в сточных водах и синтетических моющих средствах при высоких концентрациях неионных ПАВ и неорганических ионов: Cu2+, Ba2+, Na+, NH4 +, SO4 2-, Cl-, NO3 -, CO3 2-, CH3COO-.
Полученная мембрана ИСЭ на основе соединения Cu(Pyr)2ДДС2 обладает высокой чувствительностью к ионным ПАВ благодаря его устойчивости и низкой растворимости (произведение растворимости составляет (2,9±0,4)·10-13. Чем ниже растворимость ЭАВ, тем выше чувствительность электрода.
Мембранная композиция обеспечивает широкий диапазон определяемых содержаний ПАВ: 1·10-3 (1·10-4) - 2·10-7 (4·10-7) М. При этом высокие свойства используемого в мембране ЭАВ обеспечивают низкий предел обнаружения ПАВ: 2·10-7 (4·10-7) М. Это позволяет использовать электрод для анализа ионных ПАВ в сточных водах ниже уровня ПДК в водах водных объектов рыбохозяйственного значения.
Угловой коэффициент электродных функций ИСЭ в растворах ионных ПАВ составляет 54-59 мВ/рС.
Время отклика полученного электрода составляет 5-7 с, причем в разбавленных растворах (10-6-10-4 М) потенциал устанавливается быстрее, чем в более концентрированных.
Таким образом, полученная мембранная композиция для ИСЭ расширяет функциональные возможности экспрессного определения ионных ПАВ в различных водных объектах и синтетических моющих средствах.
Мембрана ионоселективного электрода, состоящая из поливинилхлорида в качестве матрицы, дибутилфталата в качестве пластификатора и электродно-активного соединения, содержащего медь и додецилсульфат натрия, отличающаяся тем, что электродно-активное соединение дополнительно содержит пиридин, причем медь Сu2+, пиридин и додецилсульфат взяты в соотношении 1:2:2 соответственно, а компоненты мембраны находятся в следующем соотношении, мас. %:
| Поливинилхлорид | 24,88 - 24,73 |
| Дибутилфталат | 74,61 - 74,25 |
| Электродно-активное соединение | 0,51 - 1,02 |