Циклические ингибиторы 11бета-гидроксистероид-дегидрогеназы 1
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к новому соединению формулы или к его фармацевтически приемлемой соли, где R1 представляет собой (C1-C6)алкил; оксодигидропиридильное кольцо в Формуле необязательно замещено 1-3 группами, независимо выбранными из фтора, (C1-C6)алкила, гидрокси(C1-C6)алкила, (C3-C6)циклоалкила, (C4-C7)циклоалкилалкила, гало(C1-C6)алкила и (C1-C6)алкокси(C1-C6)алкокси; R2 представляет собой (C1-C6)алкил, фенил, или тетрагидропиранил, необязательно замещенные группой в числе вплоть до 1, независимо выбранными из фтора, гидрокси(C1-C6)алкила и (C3-C6)циклоалкила; R3 выбран из (C1-C6)алкила, необязательно замещенного группами в числе вплоть до 3, независимо выбранных из фтора, циано, R4, R4O-, (R4)2N-, R4C(=O)NR4-, (R4)2NC(=O)-, R4OC(=O)NR4-, R4S(=O)2NR4- и оксадиазолила, необязательно замещенного (C1-C6)алкилом; R4 независимо представляет собой H или (C1-C6)алкил. Также изобретение относится к способу лечения субъекта, основанному на использовании указанного соединения, способу подавления 11β-ГСД1, фармацевтической композиции на основе указанного соединения. Технический результат: получены новые соединения, полезные при заболеваниях, связанных с активностью или экспрессией 11β-ГСД1. 6 н. и 9 з.п. ф-лы, 6 табл., 101 пр.
Реферат
Область изобретения
Настоящее изобретение относится к ингибиторам 11β-гидроксистероид-дегидрогеназы 1 типа (11β-ГСД1), их лекарственным препаратам и методам их применения.
Уровень техники
Глюкокортикоиды (например, кортизол (гидрокортизон)) представляют собой стероидные гормоны, обеспечивающие регулировку обмена, функционирования и распределения жиров, а также принимающие участие в обмене углеводов, белков и жиров. Также известно, что глюкокортикоиды оказывают физиологическое воздействие на развитие, нейробиологию, воспалительные процессы, кровяное давление, обмен веществ, а также апоптоз. Кортизол и другие кортикостероиды связываются с глюкокортикоидными рецепторами (ГР) и минералокортикоидными рецепторами (MP), которые являются членами одного суперсемейства ядерных гормональных рецепторов и обусловливают действие кортизола in vivo. Данные рецепторы непосредственно модулируют транскрипцию посредством ДНК-связывающих доменов "цинковые пальцы", а также вызывающих транскрипцию доменов.
До недавнего времени считалось, что действие глюкокортикоидов определяется тремя основными факторами: (1) уровнем циркулирующих глюкокортикоидов (определяемым, в основном, гипоталамо-гипофизарно-надпочечниковой (ГПА) осью); (2) уровнем связывания глюкокортикоидов с белком в кровотоке; а также (3) количеством внутриклеточных рецепторов в тканях-мишенях. Однако недавно был обнаружен четвертый фактор, определяющий действие глюкокортикоидов: тканеспецифический метаболизм активирующими и инактивирующими глюкокортикоиды ферментами на пререцепторном уровне: Данные ферменты, контролирующие действие 11β-гидроксистероид-дегидрогеназы (11β-ГСД) на пререцепторном уровне, модулируют активацию ГР и MP путем регулирования глюкокортикоидных гормонов. В настоящее время было осуществлено клонирование и составлена полная характеристика двух различных изоферментов 11-β-ГСД: 11β-ГСД1 (так же известного как 11-β-ГСД 1 типа, 11βГСД1, ГСД11 В1, ЛВП (липопротеин высокой плотности), а также ГСД11L) и 11β-ГСД2. 11β-ГСД1 представляет собой двустороннюю оксидоредуктазу, обеспечивающую регенерацию активного кортизола из неактивных 11-кето-форм, в то время как 11β-ГСД2 представляет собой одностороннюю дегидрогеназу, обеспечивающую инактивацию биологически активного кортизола путем его преобразования в кортизон.
Обе изоформы экспрессируются определенным тканеспецифическим образом в соответствии с различиями в их физиологической роли. 11β-ГСД1 широко распределяется в тканях крысы и человека; признаки присутствия ферментов и соответствующие информационные РНК были обнаружены в печени человека, жировых тканях, легких, мужских половых железах, костях и реснитчатом эпителии. В жировой ткани повышенная концентрация кортизола стимулирует дифференциацию адпипоцитов и может играть роль в стимуляции висцерального ожирения. 11β-ГСД1 может обеспечивать контроль внутриглазного давления, а также способствовать возникновению глаукомы; некоторые данные свидетельствуют о том, что ингибирование 11β-ГСД1 может вызывать снижение внутриглазного давления у пациентов с внутриглазной гипертензией (Kotelevstev et al. (1997), Proc. Natl. Acad. Sci. USA 94(26): 14924-9). Несмотря на то что 11β-ГСД1 стимулирует 11-бета-дегидрогенизацию, а также обратную реакцию 11-оксоредукции, 11β-ГСД1 действует, в основном, как НАДФН-зависимая оксоредуктаза в здоровых клетках и тканях, стимулируя формирование активного кортизола из инертного кортизола (Low et al. (1994) J. Mol. Endocrin. 13: 167-174). Однако экспрессия 11β-ГСД2 обнаружена в основном в тканях-мишенях минералокортикоидов, таких как почки (кортекс и мозговой слой), плацента, сигмовидная и прямая кишка, слюнная железа и клеточные линии прямой кишки. 11β-ГСД2 действует как НАД-зависимая дегидрогеназа, которая активизирует преобразование кортизола в кортизон (Albiston et al. (1994) Mol. Cell. Endocrin. 105: R11-R17), а также защищает MP от избытка глюкокортикоида (например, при высоком уровне активного по отношению к рецепторам кортизола) (Blum, et al. (2003) Prog. Nucl. Acid Res. Mol. Biol. 75:173-216).
Мутации в генах 11β-ГСД1 или 11β-ГСД2 приводят к патологии человека. Например, у отдельных пациентов с мутациями в 11β-ГСД2 наблюдался дефицит активности по инактивации кортизола, который, в свою очередь, приводил к развитию синдрома кажущегося избытка минералокортикоидов (также упоминается как "СКИМ"), сопровождаемого гипертензией, гипокалиемией и задержкой натрия (Edwards et al. (1988) Lancet 2: 986-989; Wilson et al. (1998) Proc. Natl. Acad. Sci. 95: 10200-10205). Аналогичным образом мутации в 11β-ГСД1, а также в гене, кодирующем колокализированный НАДФН-продуцирующий фермент, глюкозо 6-фосфат дегидрогеназе (Г6ДГ), могут вызвать недостаточность кортизон-редуктазы (НКР); у пациентов с данными мутациями наблюдается избыток андрогенного гормона, обусловленный адренокортикотропным гормоном (гирсутизм, нерегулярность менструальных циклов, гиперандрогенизм), а также синдром поликистоза яичников (СПЯ) сходного фенотипа (Draper et al. (2003) Nat. Genet. 34: 434-439).
В значительной степени нарушение гомеостаза в ГПА оси по причине недостаточной или избыточной секреции или действия приводит к развитию синдрома Иценко-Кушинга и болезни Аддисона, соответственно (Miller and Chrousos (2001) Endocrinology and Metabolism, eds. Felig and Frohman (McGraw-Hill, New York), 4th Ed.: 387-524). У пациентов с синдромом Иценко-Кушинга, а также у пациентов, принимающих глюкокортикоиды, может наблюдаться развитие обратимого висцерального ожирения. Фенотип пациентов, страдающих от синдрома Иценко-Кушинга, обладает значительным сходством с фенотипом метаболического синдрома Равена (также известен как синдром X или синдром инсулинорезистентности), симптомы которого включают висцеральное ожирение, нарушение толерантности к глюкозе, инсулинорезистентность, гипертензию, диабет 2 типа и гиперлипидемию (Reaven (1993) Ann. Rev. Med. 44: 121-131). Несмотря на отсутствие полной характеристики роли глюкокортикоидов в ожирении человека все большее количество данных указывает на то, что активность 11(3-ГСД1 играет важную роль в процессе ожирения и развития метаболического синдрома (Bujalska et al. (1997) Lancet 349: 1210-1213); (Livingstone et al. (2000) Endocrinology 131: 560-563; Rask et al. (2001) J. Clin. Endocrinol. Metab. 86: 1418-1421; Lindsay et al. (2003) J. Clin. Endocrinol. Metab. 88: 2738-2744; Wake et al. (2003) J. Clin. Endocrinol. Metab. 88: 3983-3988).
Данные, полученные в ходе проведения испытаний на моделях трансгенных мышей, поддерживают гипотезу о том, что активность 11β-ГСД1 в отношении адипоцитов играет основную роль в процессе висцерального ожирения и развития метаболического синдрома (Alberts et al. (2002) Diabetologia. 45(11): 1526-32). Сверхэкспрессия 11β-ГСД1 в жировой ткани под контролем промотора аР2 у трансгенных мышей вызвала образование фенотипа, удивительно похожего на фенотип метаболического синдрома человека (Masuzaki et al. (2001) Science 294: 2166-2170; Masuzaki et al. (2003) J. Clinical Invest. 112: 83-90). Более того, повышенная активность 11β-ГСД1 у данных мышей обладает значительным сходством с активностью, наблюдаемой при ожирении человека (Rask et al. (2001) J. Clin. Endocrinol. Metab. 86: 1418-1421). Кроме того, данные, полученные в ходе испытаний на мышах с дефицитом 11β-ГСД1, вызванным гомологической рекомбинацией, свидетельствуют о том, что нехватка 11β-ГСД1 вызывает снижение чувствительности к инсулину и нарушение толерантности к глюкозе по причине тканеспецифического снижения уровня активного глюкокортикоида (Kotelevstev et al. (1997) Proc. Natl. Acad. Sci. 94: 14924-14929; Morton et al. (2001) J. Biol. Chem. 276: 41293-41300; Morton et al. (2004) Diabetes 53: 931-938).
Опубликованные данные поддерживают гипотезу о том, что повышенная экспрессия 11β-ГСД1 способствует преобразованию кортизона в кортизол в жировой ткани, вследствие чего 11β-ГСД1 играет определенную роль в патогенезе центрального типа ожирения, а также в развитии метаболического синдрома у человека (Engeli, et al., (2004) Obes. Res. 12: 9-17). Следовательно, с фармацевтической точки зрения 11β-ГСД1 является многообещающим объектом воздействия при лечении метаболического синдрома (Masuzaki, et al., (2003) Curr. Drug Targets Immune Endocr. Metabol. Disord. 3: 255-62). Кроме того, ингибирование активности 11β-ГСД1 может оказаться благоприятным при лечении многочисленных связанных с глюкокортикоидами нарушений. Например, ингибиторы 11β-ГСД1 могут быть эффективны при лечении ожирения и(или) аспектов кластера метаболического синдрома, включающих нарушение толерантности к глюкозе, резистентность к инсулину, гипергликемию, гипертензию и(или) гиперлипидемию (Kotelevstev et al. (1997) Proc. Natl. Acad. Sci. 94: 14924-14929; Morton et al. (2001) J. Biol. Chem. 276: 41293-41300; Morton et al. (2004) Diabetes 53: 931-938). Ингибирование активности 11р-ГСД1 может оказывать благоприятное воздействие на поджелудочную железу, включающее усиление секреции инсулина, стимулируемой глюкозой (Billaudel and Sutter (1979) Horm. Metab. Res. 11: 555-560; Ogawa et al. (1992) J. Clin. Invest. 90: 497-504; Davani et al. (2000) J. Biol. Chem. 275: 34841-34844).
Помимо этого, учитывая связь межличностных отличий общей когнитивной функции с различной длительностью воздействия глюкокортикоидами (Lupien et al. (1998) Nat. Neurosci. 1: 69-73), а также то, что дисрегуляция ГПА-оси, вызывающая хронический избыток глюкокортикоидов в определенных подобластях мозга, теоретически, способствует нарушению когнитивной функции (McEwen and Sapolsky (1995) Curr. Opin. Neurobiol. 5: 205-216), можно предположить, что ингибирование 11β-ГСД1 позволит уменьшить воздействие глюкокортикоидов на мозг и, следовательно, защитить нейрональную активность от вредного воздействия глюкокортикоидов, вызывающего нарушение когнитивных функций, слабоумие и(или) депрессию. В частности, известно, что стресс и глюкокортикоиды оказывают воздействие на когнитивную функцию (de Quervain et al. (1998) Nature 394: 787-790); также наблюдения показали, что 11β-ГСД1 посредством контроля действия глюкокортикоидов на мозг, также может оказывать воздействие на нейротоксичность (Rajan et al. (1996) Neuroscience 16: 65-70; Seckl (2000) Neuroendocrinol. 18:49-99).
Кроме того, существуют данные, подтверждающие участие глюкокортикоидов и 11β-ГСД1 в изменении уровня внутриглазного давления (ВГД) (Stokes et al. (2000) Invest. Ophthalmol. Vis. Sci. 41: 1629-1683; Rauz et al. (2001) Invest. Ophthalmol. Vis. Sci. 42: 2037-2042); при отсутствии лечения повышенное ВГД может привести к частичной скотоме и последующей слепоте. Таким образом, ингибирование глазного 11β-ГСД1 может вызвать снижение местной концентрации глюкокортикоидов и ВГД. Следовательно, 11β-ГСД1 теоретически может применяться для лечения глаукомы и прочих нарушений зрения.
У трансгенных мышей с аР2-11β-ГСД1 наблюдается высокое кровяное давление, а также повышенная чувствительность к пищевой соли. Кроме того, у трансгенных мышей был отмечен повышенный уровень ангиотензина, ангиотензина II и альдостерона в плазме крови; лечение мышей при помощи антагонистов ангиотензина II способствует снижению гипертензии (Masuzaki et al. (2003) J. Clinical Invest. 112: 83-90). Данный эффект свидетельствует о том, что активность 11β-ГСД1 может вызывать или усиливать гипертензию. Следовательно, ингибиторы 11β-ГСД1 могут быть полезны при лечении гипертензии, а также связанных с гипертензией сердечно-сосудистых нарушений. Ингибирование 11β-ГСД1 в зрелых адипоцитах, предположительно, также может ослаблять секрецию ингибитора активатора плазминогена 1 (ИАП-1), являющегося независимым фактором сердечно-сосудистого риска (Halleux et al. (1999) J. Clin. Endocrinol. Metabl. 84: 4097-4105).
Глюкокортикоиды могут оказывать нежелательное воздействие на ткани скелета; длительное воздействие глюкокортикоидов даже в умеренных дозах может вызвать развитие остеопороза (Cannalis (1996) J. Clin. Endocrinol. Metab. 81: 3441-3447). Помимо этого 11β-ГСД1 была обнаружена в первичных культурах остеобластов человека, а также в клетках костей взрослых пациентов (Cooper et al. (2000) Bone 27: 375-381), в то время как ингибитор 11β-ГСД1, карбеноксолон, согласно полученным данным, способствует снижению неблагоприятного воздействия глюкокортикоидов на формирование островков окостенения (Bellows et al. (1998) Bone 23: 119-125). Таким образом, ингибирование 11β-ГСД1, предположительно, вызывает снижение местной концентрации глюкокортикоидов в остеобластах и остеокластах, тем самым оказывая благоприятное воздействие на различные формы заболеваний костей, включая остеопороз.
Ингибиторы 11β-ГСД1 также могут быть полезны при иммуномодуляции. Считается, что глюкокортикоиды оказывают иммуносупрессивное воздействие, на самом деле между ГПА-осью и иммунной системой наблюдается сложное динамическое взаимодействие (Rook (1999) Baillier's Clin. Endocrinol. Metabl. 13: 576-581). Глюкокортикоиды могут принимать участие в модулировании баланса между клеточным иммунным ответом и гуморальным иммунным ответом. При этом высокая активность глюкокортикоидов, как правило, связана с гуморальным ответом. Следовательно, ингибирование 11β-ГСД1 может использоваться в качестве средства смещения иммунного ответа в сторону клеточного иммунного ответа. Определенные болезненные состояния, включающие туберкулез, лепру (болезнь Хансена) и псориаз, вызывают иммунный ответ, смещенный в сторону гуморального ответа, однако, наиболее эффективным видом иммунного ответа может быть клеточный иммунный ответ. Таким образом, ингибиторы 11β-ГСД1 также могут быть полезны при лечении подобных заболеваний.
Согласно полученным отчетам глюкокортикоиды препятствуют заживлению ран, особенно у пациентов с диабетическими язвами (Bitar et al. (1999) J. Surg. Res. 82: 234-243; Bitar et al. (1999) Surgery 125: 594-601; Bitar (2000) Surgery 127: 687-695; Bitar (1998) Am. J. Pathol. 152: 547-554). Среди пациентов с нарушенной толерантностью к глюкозе и(или) диабетом 2 типа также часто наблюдается нарушение заживления ран. Глюкокортикоиды также способствуют повышению риска заболевания и задержки заживления ран (Anstead (1998) Adv. Wound Care 11:277-285). Кроме того, установлена взаимосвязь между повышением уровня кортизола в раневой жидкости и незаживающими ранами (ЕР Patent Арр. No. О 902 288). Последние опубликованные заявки на патент содержат предположение о благоприятном воздействии определенных ингибиторов 11β-ГСД1, способствующем заживлению ран (PCT/US2006/043,951).
Представленная в данном изобретении информация свидетельствует о возрастающей необходимости в разработке новых и более эффективных лекарственных препаратов, ингибирующих 11β-ГСД1. Новые соединения, представленные в данном изобретении, являются эффективными ингибиторами 11β-ГСД1.
Сущность изобретения
На данный момент установлено, что соединения Формулы Im1 или их фармацевтически приемлемые соли являются эффективными ингибиторами 11β-ГСД1.
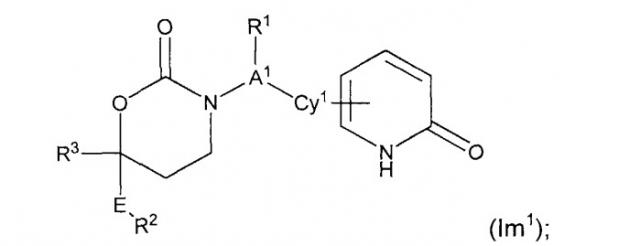
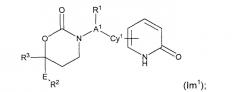
Изобретение представляет собой соединение Формулы (Im1)
;
или его фармацевтически приемлемую соль, энантиомер или диастереомер.
В первом варианте осуществления настоящего изобретения Формула Im1 и ее компоненты указаны в данном документе в соответствии со следующими определениями:
R1 - (а) отсутствует или (b) выбран из (C1-C6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, (С1-С3)алкокси(С1-С3) алкокси, или (С1-С3) алкокси (С1-С3)алкила, возможные заместители включают в себя не более четырех групп, независимо выбранных из фтора, циано, оксо, R4, R4O-, (R4)2N-, R4O2C-, R4S, R4S(=O)-, R4S(=O)2-, R4C(=O)NR4-, (R4)2NC(=O)-, (R4)2NC(=O)O-, (R4)2NC(=O)NR4-, R4OC(=O)NR4-, (R4) 2NC(=NCN)NR4-, (R4O)2P(=O)O-, (R4O)2P(=O)NR4-, R4OS(=O)2NR4-, (R4)2NS(=O)2O-, (R4)2NS(=O)2NR4-, R4S(=O)2NR4-, R4S(=O)2NHC(=O)-, R4S(=O)2NHC(=O)O-, R4S(=O)2NHC(=O)NR4-, R4OS(=O)2NHC(=O)-, R4OS(=O)2NHC(=O)O-, R4OS(=O)2NHC(=O)NR4-,
(R4)2NS(=O)2NHC(=O)-, (R4)2NS(=O)2NHC(=O)O-, (R4)2NS(=O)2NHC(=O)NR4-, R4C(=O)NHS(=O)2-, R4C(=O)NHS(=O)2O-, R4C(=O)NHS(=O)2NR4-, R4OC(=O)NHS(=O)2-, R4OC(=O)NHS(=O)2O-, R4OC(=O)NHS(=O)2NR4-, (R4)2NC(=O)NHS(=O)2-, (R4)2NC(=O)NHS(=O)2O-, (R4)2NC(=O)NHS(=O)2NR4-, гетероциклила, гетероарила, ариламино и гетероариламино;
А1 представляет собой (а) связь или (b) (С1-С3)алкилен, CH2CH2O, в котором кислород присоединен к Cy1, или СН2С(=O), в котором карбонильный углерод присоединен к Сн1;
Cy1 представляет собой арил, гетероарил, моноциклический циклоалкил или моноциклический гетероциклил, возможные заместители которого включают в себя от 1 до 4 групп, независимо выбранных из фтора, хлора, брома, йода, циано, нитро, амино, гидрокси, карбокси, (C1-C6)алкила, гидрокси(C1-C6)алкила, (С3-С6)циклоалкила, гидрокси(С3-С6)циклоалкила, (С4-С7)циклоалкилалкила, (С2-С6)алкенила, гало(С2-С6)алкенила, гидрокси(С2-С6)алкенила, (С2-С6)алкинила, (С3-С6)циклоалкил(С2-С4)алкинила, гало(С1-С6)алкила, гало(С3-С6)циклоалкила, гало(С4-С7)циклоалкилалкила, (С1-С6)алкокси, (С3-С6)циклоалкокси, (С4-С7)циклоалкилалкокси, гало(С1-С6)алкокси, гало(С3-С6)циклоалкокси, гало(С4-С7)циклоалкилалкокси, (С1-С6)алкилтио, (С3-С6)циклоалкилтио, (С4-С7)циклоалкилалкилтио, гало(C1-C6)алкилтио, гало(С3-С6)циклоалкилтио, гало(С4-С7)циклоалкилалкилтио, (C1-C6)алкансульфинила, (С3-С6)циклоалкансульфинила, (С4-С7)циклоалкилалкансульфинила, гало(C1-C6)алкансульфинила, гало(С3-С6)циклоалкансульфинила, гало(С4-С7)циклоалкилалкансульфинила, (C1-C6)алкансульфонила, (С3-С6)циклоалкансульфонила, (С4-С7)циклоалкилалкансульфонила, гало(С1-С6)алкансульфонила, гало(С3-С6)циклоалкансульфонила, гало(С4-С7)цикло-алкилалкансульфонила, (C1-С6)алкиламино, ди(C1-C6)алкиламино, (C1-C6)алкокси(C1-C6)алкокси, гало(C1-C6)алкокси(С1-С6)алкокси, (C1-C6)алкоксикарбонила, H2NCO, H2NSO2, (C1-C6)алкиламинокарбонила, ди(С1-С6)алкиламинокарбонила, (С1-С3)алкокси(С1-С3)алкиламинокарбонила, гетероциклилкарбонила, (C1-С6)алкиламиносульфонила, ди(С1-С6)алкиламиносульфонила, гетероциклилсульфонила, (C1-C6)алкилкарбониламино, (C1-C6)алкил-карбониламино(C1-C6)алкила, (C1-C6)алкилсульфониламино, (С1-С6)алкил-сульфониламино(С1-С6)алкила, (С1-С6)алкоксикарбонил(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, гало(C1-C6)алкокси(С1-С6)алкила, гидрокси(C1-C6)алкокси, гетероарил, оксо, амино(C1-C6)алкила, (С1-С6)алкиламино(С1-С6)алкила, ди(C1-C6)алкиламино(C1-C6)алкила амино(С2-С6)алкокси, (C1-C6)алкиламино(С2-С6)алкокси, ди(С1-С6)алкиламино(С2-С6)алкокси, (C1-С6)алкилкарбонила, (С3-С6)циклоалкилкарбонила, (С3-С6)циклоалкиламинокарбонила, {(С3-С6)циклоалкил}{(C1-C6)алкил}аминокарбонила, ди(С3-С6)циклоалкиламинокарбонила, (С3-С6)циклоалкиламиносульфонила, {(С3-С6)циклоалкил}{(С C1-C6)алкил}аминосульфонила, ди(С3-С6)циклоалкиламиносульфонила, циано(С1-С6)алкила, аминокарбонил(C1-C6)алкила, (C1-C6)алкиламинокарбонил(C1-C6)алкила, ди(C1-C6)алкиламинокарбонил(C1-C6)алкила, (С3-С6)циклоалкиламинокарбонил(C1-C6)алкила, {(С3-С6)циклоалкил}{(C1-C6)алкил}аминокарбонил(С1-С6)алкила и ди(С3-С6)циклоалкиламинокарбонил(C1-C6)алкила.
Возможные заместители оксодигидропиридилового кольца Формулы Im1 включают от 1 до 4 групп, независимо выбранных из фтора, хлора, брома, йода, циано, нитро, амино, гидрокси, карбокси, (C1-C6)алкила, гидрокси(C1-C6)алкила, (С3-С6)циклоалкила, гидрокси(С3-С6)циклоалкила, (С4-С7)циклоалкилалкила, (С2-С6)алкенила, гало(С2-С6)алкенила, гидрокси(С2-С6)алкенила, (С2-С6)алкинила, (С3-С6)циклоалкил(С2-С4)алкинила, гало(С1-С6)алкила, гало(С3-С6)циклоалкила, гало(С4-С7)циклоалкилалкила, (C1-C6)алкокси, (С3-С6)циклоалкокси, (С4-С7)циклоалкилалкокси, гало(С1-С6)алкокси, гало(С3-С6)циклоалкокси, гало(С4-С7)циклоалкилалкокси, (C1-C6)алкилтио, (С3-С6)циклоалкилтио, (С4-С7)циклоалкилалкилтио, гало(C1-C6)алкилтио, гало(С3-С6)циклоалкилтио, гало(С4-С7)циклоалкилалкилтио, (С1-С6)алкансульфинила, (С3-С6)циклоалкансульфинила, (С4-С7)циклоалкилалкансульфинила, гало(С1-С6)алкансульфинила, гало(С3-С6)циклоалкансульфинила, гало(С4-С7)циклоалкилалкансульфинила, (C1-C6)алкансульфонила, (С3-С6)циклоалкансульфонила, (С4-С7)циклоалкилалкансульфонила, гало(С1-С6)алкансульфонила, гало(С3-С6)циклоалкансульфонила, гало(С4-С7)цикло-алкилалкансульфонила, (C1-C6)алкиламино, ди(C1-C6)алкиламино, (C1-C6)алкокси(C1-C6)алкокси, гало(C1-C6)алкокси(C1-C6)алкокси, (C1-C6)алкоксикарбонила, H2NCO, H2NSO2, (C1-C6)алкиламинокарбонила, ди(С1-С6)алкиламинокарбонила, (С1-С3)алкокси(С1-С3)алкиламинокарбонила, гетероциклилкарбонила, (C1-C6)алкиламиносульфонила, ди(C1-C6)алкиламиносульфонила, гетероциклилсульфонила, (C1-C6)алкилкарбониламино, (C1-C6)алкил-карбониламино(C1-C6)алкила, (C1-C6)алкилсульфониламино, (C1-C6)алкил-сульфониламино(C1-C6)алкила, (C1-C6)алкоксикарбонил(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкила, гало(C1-C6)алкокси(C1-C6)алкила, гидрокси(C1-C6)алкокси, гетероарил, оксо, амино(C1-C6)алкила, (C1-C6)алкиламино(C1-C6)алкила, ди(С1-С6)алкиламино(С1-С6)алкила амино(С2-С6)алкокси, (С1-С6)алкиламино(С2-С6)алкокси, ди(С1-С6)алкиламино(С2-С6)алкокси, (С1-С6)алкилкарбонила, (С3-С6)циклоалкилкарбонила, (С3-С6)циклоалкиламинокарбонила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминокарбонила, ди(С3-С6)циклоалкиламинокарбонила, (С3-С6)циклоалкиламиносульфонила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминосульфонила, ди(С3-С6)циклоалкиламиносульфонила, циано(С1-С6)алкила, аминокарбонил(С1-С6)алкила, (С1-С6)алкиламинокарбонил(С1-С6)алкила, ди(С1-С6)алкиламинокарбонил(С1-С6)алкила, (С3-С6)циклоалкиламинокарбонил(С1-С6)алкила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминокарбонил(С1-С6)алкила и ди(С3-С6)циклоалкиламинокарбонил(С1-С6)алкила;
Е представляет собой (а) связь или (b) (С1-С3)алкилен или (С1-С2)алкиленилокси, где О присоединен к R2, возможные заместители каждого из которых включают от 1 до 4 групп, независимо выбранных из метила, этила, трифторметила или оксо;
R2 представляет собой (С1-С6)алкил, арил, гетероарил, циклоалкил или гетероциклил, возможные заместители которого включают от 1 до 4 групп, независимо выбранных из фтора, хлора, брома, йода, циано, нитро, амино, гидрокси, карбокси, (С1-С6)алкила, гидрокси(С1-С6)алкила, (С3-С6)циклоалкила, гидрокси(С3-С6)циклоалкила, (С4-С7)циклоалкилалкила, (С2-С6)алкенила, гало(С2-С6)алкенила, гидрокси(С2-С6)алкенила, (С2-С6)алкинила, (С3-С6)циклоалкил(С2-С4)алкинила, гало(С1-С6)алкила, гало(С3-С6)циклоалкила, гало(С4-С7)циклоалкилалкила, (С1-С6)алкокси, (С3-С6)циклоалкокси, (С4-С7)циклоалкилалкокси, гало(С1-С6)алкокси, гало(С3-С6)циклоалкокси, гало(С4-С7)циклоалкилалкокси, (С1-С6)алкилтио, (С3-С6)циклоалкилтио, (С4-С7)циклоалкилалкилтио, гало(С1-С6)алкилтио, гало(С3-С6)циклоалкилтио, гало(С4-С7)циклоалкилалкилтио, (С1-С6)алкансульфинила, (С3-С6)циклоалкансульфинила, (С4-С7)циклоалкилалкансульфинила, гало(С1-С6)алкансульфинила, гало(С3-С6)циклоалкансульфинила, гало(С4-С7)циклоалкилалкансульфинила, (С1-С6)алкансульфонила, (С3-С6)циклоалкансульфонила, (С4-С7)циклоалкилалкансульфонила, гало(С1-С6)алкансульфонила, гало(С3-С6)циклоалкансульфонила, гало(С4-С7)цикло-алкилалкансульфонила, (С1-С6)алкиламино, ди(С1-С6)алкиламино, (С1-С6)алкокси(С1-С6)алкокси, гало(С1-С6)алкокси(С1-С6)алкокси, (С1-С6)алкоксикарбонила, H2NCO, H2NSO2, (С1-С6)алкиламинокарбонила, ди(С1-С6)алкиламинокарбонила, (С1-С3)алкокси(C1-С3)алкиламинокарбонила, гетероциклилкарбонила, (С1-С6)алкиламиносульфонила, ди(С1-С6)алкиламиносульфонила, гетероциклилсульфонила, (С1-С6)алкилкарбониламино, (С1-С6)алкилкарбониламино(С1-С6)алкила, (С1-С6)алкилсульфониламино, (С1-С6)алкилсульфониламино(С1-С6)алкила, (С1-С6)алкоксикарбонил(С1-С6)алкокси, (С1-С6)алкокси(С1-С6)алкила, гало(С1-С6)алкокси(С1-С6)алкила, гидрокси(С1-С6)алкокси, гетероарил, оксо, амино(С1-С6)алкила, (С1-С6)алкиламино(С1-С6)алкила, ди(С1-С6)алкиламино(С1-С6)алкила амино(С2-С6)алкокси, (С1-С6)алкиламино(С2-С6)алкокси, ди(С1-С6)алкиламино(С2-С6)алкокси, (С1-С6)алкилкарбонила, (С3-С6)циклоалкилкарбонила, (С3-С6)циклоалкиламинокарбонила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминокарбонила, ди(С3-С6)циклоалкиламинокарбонила, (С3-С6)циклоалкиламиносульфонила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминосульфонила, ди(С3-С6)циклоалкиламиносульфонила, циано(С1-С6)алкила, аминокарбонил(С1-С6)алкила, (С1-С6)алкиламинокарбонил(С1-С6)алкила, ди(С1-С6)алкиламинокарбонил(С1-С6)алкила, (С3-С6)циклоалкиламинокарбонил(С1-С6)алкила, {(С3-С6)циклоалкил}{(С1-С6)алкил}аминокарбонил(С1-С6)алкила и ди(С3-С6)циклоалкиламинокарбонил(С1-С6)алкила;
R3 выбран из (С1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, (С3-С5)циклоалкил(С1-С4)алкила, (С1-С3)алкокси(С1-С3)алкокси или (С1-С3)алкокси(С1-С3)алкила, возможные заместители включают до четырех групп, независимо выбранных из фтора, циано, оксо, R4, R4O-, (R4)2N-, R4O2C-, R4C(=O)O-, R4S, R4S(=O)-, R4S(=O)2-, R4C(=O)NR4-, (R4)2NC(=O)-, (R4)2NC(=O)O-, (R4)2NC(=O)NR4-, R4OC(=O)NR4-, (R4) 2NC(=NCN)NR4-, (R4O)2P(=O)O-, (R4O)2P(=O)NR4-, R4OS(=O)2NR4-, (R4)2NS(=O)2O-, (R4)2NS(=O)2NR4-, R4S(=O)2NR4-, R4S(=O)2NHC(=O)-, R4S(=O)2NHC(=O)O-, R4S(=O)2NHC(=O)NR4-, R4OS(=O)2NHC(=O)-, R4OS(=O)2NHC(=O)O-, R4OS(=O)2NHC(=O)NR4-, (R4)2NS(=O)2NHC(=O)-, (R4)2NS(=O)2NHC(=O)O-, (R4)2NS(=O)2NHC(=O)NR4-, R4C(=O)NHS(=O)2-, R4C(=O)NHS(=O)2O-, R4C(=O)NHS(=O)2NR4-, R4OC(=O)NHS(=O)2-, R4OC(=O)NHS(=O)2O-, R4OC(=O)NHS(=O)2NR4-, (R4)2NC(=O)NHS(=O)2-, (R4)2NC(=O)NHS(=O)2O-, (R4)2NC(=O)NHS(=O)2NR4-, спироциклоалкила; гетероциклила (возможные заместители которого, в свою очередь, включают алкил, галоалкил, галоген или оксо), гетероарила (возможные заместители которого, в свою очередь, включают алкил, галоалкил, алкокси, алкилтио, алкилсульфонил, галоген, трифторметил, диалкиламино, нитро, циано, CO2H, CONH2, N-моноалкил-замещенный амидо, N,N-диалкил- замещенный амидо или оксо), ариламино (возможные заместители которого, в свою очередь, включают алкил, алкокси, алкилтио, алкилсульфонил, галоген, трифторметил, диалкиламино, нитро, циано, CO2H, CONH2, N-моноалкил-замещенный амидо и N,N-диалкил-замещенный амидо) и гетероариламино (возможные заместители которого, в свою очередь, включают алкил, галоалкил, алкокси, алкилтио, алкилсульфонил, галоген, трифторметил, диалкиламино, нитро, циано, CO2H, CONH2, N-моноалкил-замещенный амидо, N,N-диалкил- замещенный амидо или оксо); а также
R4 независимо выбран из Н, (С1-С6)алкила, гало(С1-С6)алкила амино(С1-С6)алкила, (С1-С6)алкиламино(С1-С6)алкила, ди(С1-С6)алкиламино(С1-С6)алкила, гидрокси(С1-С6)алкила и (С1-С6)алкокси(С1-С6)алкила.
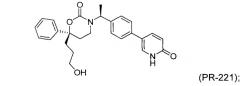
В качестве альтернативы первый вариант осуществления настоящего изобретения, описанный выше, не включает соединения со структурными Формулами PR-221 и PR-313 или их фармацевтически приемлемые соль, энантиомер или диастереомер.
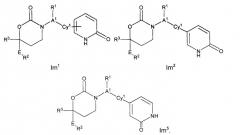
Следующий вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, включающую i) фармацевтически приемлемый носитель или растворитель, а также и) соединение с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемые соль, энантиомер или диастереомер.
Следующий вариант осуществления настоящего изобретения представляет собой способ ингибирования активности 11β-ГСД1, включающий этап введения млекопитающим, нуждающимся в подобном лечении, эффективного количества соединения с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемых соли, энантиомера или диастереомера.
Следующий вариант осуществления настоящего изобретения представляет собой способ лечения пациента, страдающего от заболевания, связанного с активностью или экспрессией 11β-ГСД1, включающий этап приема пациентом эффективного количества соединения с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемых соли, энантиомера или диастереомера.
Следующий вариант осуществления настоящего изобретения представляет собой способ применения соединения с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемых соли, энантиомера или диастереомера при производстве медикаментов, предназначенных для ингибирования активности 11β-ГСД1 у млекопитающих, нуждающихся в подобном лечении,
Следующий вариант осуществления настоящего изобретения представляет собой способ применения соединения с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемых соли, энантиомера или диастереомера при производстве лекарственных препаратов, предназначенных для лечения пациентов, страдающих от заболевания, связанного с активностью или экспрессией 11β-ГСД1.
Следующий вариант осуществления настоящего изобретения представляет собой соединение с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемые соль, энантиомер или диастереомер, предназначенные для ингибирования активности 11β-ГСД1 у млекопитающих, нуждающихся в подобном лечении,
Следующий вариант осуществления настоящего изобретения представляет собой соединение с Формулами Ik, Im1, Im2, Im5, In1, In2, In5, Io1, Io2, Io5, Ip1, Ip3 или его фармацевтически приемлемые соль, энантиомер или диастереомер, предназначенные для лечения пациентов, страдающих от заболевания, связанного с активностью или экспрессией 11β-ГСД1.
Подробное описание настоящего изобретения
Настоящее изобретение представляет собой соединение Формулы Ik:
или его фармацевтически приемлемые соль, энантиомер или диастереомер; где
R1a отсутствует или представляет собой метил или этил;
Cy2 представляет собой 2-оксо-1,2-дигидропиридил, возможные заместители которого включают от 1 до 4 групп, независимо выбранных из гало, гидрокси, метокси, гидроксиметила, метоксикарбонила, амино, карбамоила, метил карбамоила, диметил карбамоила, (2-метоксиэтил)аминокарбонила, ацетиламинометила, метилсульфонила, метилсульфониламино, метиламиносульфонила, изопропиламиносульфонила, диметиламиносульфонила, пирролидин-1-сульфонила, метилсульфониламинометила, тетразолила, метила, трифторметила, ацетила, 2-гидроксиэтила и 1-аминоэтила;
R2 представляет собой фенил, тиенил, пиридил или изопропил, возможные заместители каждого из которых включают гало, метил, метилтио или (4-морфолино)метил; а также
R3 представляет собой метил, этил, пропил, бутил, винил, аллил или этоксиэтил, возможные заместители каждого из которых включают до двух групп, независимо выбранных из метила, НО-, MeO-, H2N-, MeC(=O)NH-, MeS(=O)2NH-, H2NC(=O)-, MeNHC(=O)-, HO2C-, (HO)2P(=O)O-, H2NS(=O)2O-, H2NS(=O)2NH-, MeNHC(=O)NH-, MeNHC(=O)O-, оксо, циано, HO2C-, HOCH2CH2NH-, 4-морфолино, HOCH2C(=O)NH-, H2NCH2C(=O)NH-, EtNHC(=O)NH, MeOC(=O)NH-, MeNHC(=NC=N)NH-, Me-, MeS-, MeSO2- MeSO2N(Me)-, MeS(=O)2NHO(=O)-, имидазолиламино-, имидазолила, тетразолила, H2NCONH-, H2NCO2-, HOCH2CH2O-, MeNH-, Me2N- и MeCONMe.
Следующий вариант осуществления настоящего изобретения представляет собой соединение с любой из Формул Im1, Im2 и Im5 или его фармацевтически приемлемые соль, энантиомер или диастереомер;:
Возможные заместители оксодигидропиридилового кольца (включая также замещение атомов углерода в кольце, присоединенных к атомам водорода, и атомов азота в кольце, присоединенных к атомам водорода, т.е. включая "замещаемый атом азота в кольце") в Формулах Im1, lm2 и lm5 включают до четырех заместителей, описанных выше. Подходящие заместители оксодигидропиридилового кольца, а также подходящие значения R1, R2, R3, А1, Cy1 и Е представлены выше в первом варианте осуществления настоящего изобретения. В качестве альтернативы подходящие заместители Cy1 и оксодигидропиридилового кольца в Формулах Im1, Im2 и Im5 могут быть независимо выбраны из фтора, хлора, брома, йода, циано, нитро, амино, гидрокси, карбокси, (C1-C6)алкила, гидрокси(C1-C6)алкила, (С3-С6)циклоалкила, гидрокси(С3-С6)циклоалкила, (С4-С7)циклоалкилалкила, (С2-С6)алкенила, гало(С2-С6)алкенила, гидрокси(С2-С6)алкенила, (С2-С6)алкинила, (С2-С6)циклоалкил(С2-С4)алкинила, гало(С1-С6)алкила, гало(С3-С6)циклоалкила, гало(С4-С7)циклоалкилалкила, (C1-C6)алкокси, (С3-С6)циклоалкокси, (С4-С7)циклоалкилалкокси, гало(C1-C6)алкокси, гало(С3-С6)циклоалкокси, гало(С4-С7)циклоалкилалкокси, (C1-C6)алкилтио, (С3-С6)циклоалкилтио, (С4-С7)циклоалкилалкилтио, гало(C1-C6)алкилтио, гало(С3-С6)циклоалкилтио, гало(С4-С7)циклоалкилалкилтио, (C1-C6)алкансульфинила, (С3-С6)циклоалкансульфинила, (С4-С7)циклоалкилалкансульфинил