Рекомбинантная плазмидная днк pcpbh для биосинтеза полипептида со свойствами карбоксипептидазы б человека, и рекомбинантный штамм метилотрофных дрожжей pichia pastoris - продуцент полипептида со свойствами карбоксипептидазы б человека
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Представлена рекомбинантная плазмида рСНВН для экспрессии в Pichia pastoris последовательности, кодирующей прокарбоксипептидазу Б, имеющая размер 10466 т.п.о и состоящая из XhoI/EcoRI - фрагмента ДНК вектора рР1С9К размером 9246 т.п.о. и XhoI/EcoRI - фрагмента ДНК размером 1220 т.п.о., включающего участок, кодирующий сигнальный пептид α-фактора Saccharomyces cerevisiae, и синтетический ген прокарбоксипептидазы Б человека с нуклеотидной последовательностью, соответствующей последовательности, представленной на фиг.2. Кроме того, описан рекомбинантный штамм Pichia pastoris GS115СРВН - продуцент прокарбоксипептидазы Б человека, который получен в результате трансформации родительского штамма указанной плазмидой. Изобретение позволяет получить прокарбоксипептидазу Б человека и соответствующую ей активную форму в увеличенном количестве, составляющем не менее 9,0 ед/мл, по сравнению с прототипом. 2 н.п. ф-лы, 4 ил., 4 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии и, в частности, к генетической инженерии и может быть использовано в микробиологической и биофармацевтической промышленности для крупномасштабного производства карбоксипептидазы Б человека.
Уровень техники
Карбоксипептидаза Б (ЕС 3.14.17.2) - фермент, относящийся к классу металлозависимых протеиназ, который осуществляет специфический гидролиз пептидной связи с отщеплением С-концевых положительно заряженных остатков аминокислот, таких как лизин или аргинин. In vivo данный энзим вовлечен в процессинг гормонов, таких как инсулин, и различных белковых факторов, является участником каскада реакций системы свертывания крови и тромбоцитарного гемостаза. Последние исследования показали, что фермент играет значительную роль в развитии воспалительных и аутоиммунных процессов, тромбоэмболии и канцерогенезе (Guimarães А.Н.С., Laurens N., Weijers E.M. et al., 2011), а разработка лекарственных препаратов, селективно ингибирующих активность карбоксипептидаз, является одним из перспективных направлений для лечения таких заболеваний. Однако в настоящее время структурные особенности и функции фермента недостаточно изучены. К тому же, существует острая потребность в карбоксипептидазе Б для производства препаратов рекомбинантного инсулина, которая вызвана использованием природного энзима, выделенного из поджелудочной железы животных. Применение технологии рекомбинантной ДНК позволит получать целевой фермент в любых необходимых количествах и, кроме того, обеспечит базис для проведения белковоинженерных исследований, направленных на улучшение характеристик фермента путем введения направленных мутаций в его структуру.
Использование бактериальной системы экспрессии Е. coli позволяет получить достаточно большие количества карбоксипептидазы, однако, сложная пространственная структура белка, высокая молекулярная масса и наличие трех дисульфидных связей является причиной агрегации гетерологичного белка и накопления преимущественно в тельцах включения. Длительность, трудоемкость и дороговизна методов - характерная черта экспрессии при использовании клеточных линий млекопитающих. Клетки дрожжей, в частности P. pastoris, сочетают в себе преимущества данных систем. Эти низшие эукариоты обладают развитой системой ЭПР для осуществления разнообразных посттрансляционных модификаций белков, а также просты и удобны в культивировании. Следует отметить тот факт, что биосинтез рекомбинантного фермента осуществляется в виде неактивной проформы. Активным энзим становиться после удаления пропептида путем расщепления трипсином.
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе [Kim Mi-Jin, Kim Sang-Hyuk et al. High-Level Secretory Expression of Human Procarboxypeptidase В by Fed-Batch Cultivation of Pichia pastoris and its Partial Characterization. J. Microbiol.Biotechnol., 2008]. Рекомбинантная плазмидная ДНК содержит ген искусственного предшественника прокарбоксипептидазы Б человека, который состоит из последовательности, кодирующей сигнальный пептид α-фактора Saccharomyces cerevisiae и кДНК профермента, находящихся под контролем индуцибельного промотора АОХ1. Биосинтез рекомбинантного белка осуществляется при культивировании клеток на среде BMMY, содержащей 0,5% (v/v) метанола. Культивирование проводится в течение 60 часов, при этом целевой профермент секретируется в культуральную жидкость. Анализ уровня экспрессии белка производится при помощи иммуновестерн-блотинга. Недостатком способа-прототипа является относительно низкий уровень синтеза и секреции рекомбинантного фермента, который для лабораторных условий составляет около 3,5 ед/мл культуральной среды.
Раскрытие изобретения
Изобретение решает задачу получения карбоксипептидазы Б человека в клетках Pichia pastoris (назначение изобретения) с высоким (по сравнению с прототипом) выходом целевого продукта (технический результат).
Поставленная задача решается путем конструирования рекомбинантной интегративной плазмиды рСРВН, обеспечивающей синтез полипептида со свойствами прокарбоксипептидазы Б человека, с уровнем экспрессии порядка 20-40 мг рекомбинантного белка на литр культуры, и рекомбинантного штамма Pichia pastoris GS115CPBH, полученного путем транформации дрожжевых клеток и последующих отбора и выращивания трансформированных клонов с максимальной продуктивностью.
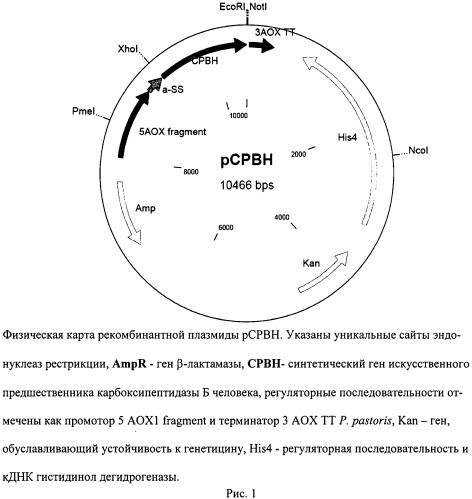
Рекомбинантная плазмидная ДНК рСРВН, кодирующая полипептид со структурой прокарбоксипептидазы, характеризуется следующими признаками:
предназначается для интегрирования в геном и экспрессии гена предшественника карбоксипептидазы Б человека;
имеет молекулярную массу 7,78 МДа (10,466 т.п.о.);
состоит из XhoI/EcoRI - фрагмента ДНК плазмиды pPIC9K длиной 9,246 т.п.о.
и XhoI/EcoRI фрагмента длиной 1,220 т.п.о., включающего участок, кодирующий сигнальный пептид α-фактора Saccharomyces cerevisiae, и синтетический ген прокар-боксипептидазы Б человека с последовательностью, соответствующей последовательности, представленной на фиг.2
Особенностью предложенной плазмидной конструкции является то, что встраиваемый в вектор-носитель фрагмент представляет нуклеотидную последовательность, кодирующую предшественник карбоксипептидазы Б человека, в котором участок, кодирующий собственную сигнальную последовательность белка заменен участком, кодирующим сигнальный пептид α-фактора Saccharomyces cerevisiae, а остальная (кодирующая прокарбоксипептидазу Б) часть последовательности сконструирована путем разработки конкретного дизайна гена (фиг.2).
Для получения штамма-продуцента полипептида со структурой и свойствами карбоксипептидазы Б человека трансформируют клетки Pichia pastoris штамма GS115 (his4, mut+) рекомбинантной плазмидой рСРВН, предварительно линеаризованной по 5′-участку АОХ1-промотора.
Краткое описание фигур
На рис.1 представлена физическая карта рекомбинантной плазмиды рСРВН; на рис.2 - нуклеотидная последовательность синтетического гена искусственного предшественника карбоксипептидазы Б человека. Жирной линией подчеркнут сайт рестриктазы EcoRI, терминирующий кодон выделен жирным шрифтом; на рис.3 - аминокислотная последовательность фермента, кодируемого синтетическим геном. Жирным шрифтом и подчеркиванием показан пропептид фермента; на рис.4 - результаты денатурирующего ПААГ-гель электрофореза образцов культуральной жидкости трансформантов при определении уровня экспрессии продукта. Слева расположен маркер молекулярных весов (10; 18,4; 25; 35; 62; 90 КДа), далее трансформанты (номер подписан снизу).
Осуществление изобретения
Изобретение иллюстрируется следующими примерами.
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, использовали хорошо известные специалистам методики, описанные в руководствах по молекулярной биологии и генетической инженерии [Sambrook J., Fritsch E,F, and Maniatis T. Molecular Cloning; A Laboratory Manual, 1989, 2nd ed. Cold Spring Harbor Laboratory Press, New York; Ausubel F.M., Brent R., Kingston R.E., Moore D.D., Seidman J.G., Smith J.A., & Struhl, K. Current Protocols in Molecular Biology, 1997, John Wiley and Sons, New York; Cregg J.M, Higgins D.R. Production of foreign proteins in the yeast Pichia pastoris, 1995, Canadian J. Botany Supp.73, 5981-5987.
Пример 1. Создание экспрессионного вектора рСРВН.
А) Дизайн варианта синтетического гена прокарбоксипептидазы Б разрабатывали на основе известной аминокислотной последовательности прокарбоксипептидазы Б человека при помощи программы DNA Builder, руководствуясь информацией о составе кодонов сильно экспрессирующихся генов P. pastoris [Bai J, Swartz DJ, Protasevich II, Brouillette CG, Harrell PM, Hildebrandt E, Gasser B, Mattanovich D, Ward A, Chang G, Urbatsch IL. A gene optimization strategy that enhances production of fully functional P-glycoprotein in Pichia pastoris. PLoS One.6(8), 2011].
Полученный вариант гена анализировали и заменяли нуклеотидные триплеты так, чтобы содержание G+C нуклеотидов было на уровне 42%, так как именно это соотношение наблюдается в природных генах, сильно экспрессирующихся в Pichia pastoris [De Schutter K, Lin YC, Tiels P, Van Hecke A, Glinka S, Weber-Lehmann J, Rouze P, Peer Y Van de, Callewaert N. Genome sequence of the recombinant protein production host Pichia pastoris. Nat Biotechnol. 2009 Jun; 27(6):561-6].
При помощи программы Vienna RNA Websuite проверяли структуру получающейся мРНК гена прокарбоксипептидазы Б на наличие обширных вторичных структур и при необходимости вносили замены в кодоновый состав гена.
При помощи программы Clone Manager полученную нуклеотидную последовательность гена проверяли на наличие рестрикционных сайтов, используемых в дальнейшей работе. Найденные рестрикционные сайты удаляли с помощью замены соответствующего нуклеотидного триплета с использованием таблицы кодонов P. pastoris.
Составленную таким образом нуклеотидную последовательность гена прокарбоксипептидазы Б, оптимизированную для экспрессии в клетках P. pastoris, разбивали на олигонуклеотиды длиной 50 н.п. с помощью программы DNA Builder для последующей сборки полного гена методом рекомбинантной ПЦР. При дизайне 5′ фланкирующего праймера к его 5′-концевой последовательности добавляли сайт рестриктазы XhoI, а при дизайне 3′ фланкирующего праймера - сайт рестриктазы EcoRI. Эти сайты были необходимы для последующего создания экспрессионной конструкции.
Исходя из известности нуклеотидной последовательности, кодирующей сигнальный пептид альфа-фактора S. cerevisiae и разработанного дизайна гена прокарбоксипептидазы Б, были сконструированы олигонуклеотидные последовательности праймеров для наработки полного (включающего лидерную последовательность) искусственного гена прокарбоксипептидазы Б человека с необходимыми концевыми сайтами рестрикции для последующего встраивания фрагмента в плазмидную конструкцию.
ПЦР-амплификацию проводили в два этапа. В реакцию вносили эквимолярную смесь (5 мкМ каждого) олигонуклеотидных праймеров (всех, кроме крайних), составляющих ген, взаимно перекрывающихся между собой на 15-20 нуклеотидов, 0.2 мкМ раствора dNTP, 1/10 часть реакционного 10х буфера и 1 ед. термостабильной ДНК-полимеразы PfuI. Температуру отжига праймеров рассчитывали по стандартной формуле:
Tm(°C)=2·[NA+NT]+4·[NC+NG]-10,
где NX - количество соответствующих оснований. Реакцию проводили по следующей схеме: денатурация ДНК при 95°C, 5 минут; затем 10 циклов: денатурация ДНК при 95°C, 1 минута; отжиг праймеров при 55°C, 1 минута; синтез ДНК при 74°C, 2,5 минуты. Вторую амплификацию проводили, используя в качестве матрицы раствор первой реакции и крайние праймеры, обеспечивающие синтез гена с необходимыми сайтами рестриктаз, по следующей схеме: денатурация ДНК при 95°C, 5 минут; затем 30 циклов: денатурация ДНК при 95°C, 1 минута; отжиг праймеров при 55°C, 1 минута; синтез ДНК при 74°C, 2,5 минуты.
Смесь для ПЦР (50 мкл):
5 мкл 10-кратного буфера для PfuI-полимеразы («Евроген»);
5 мкл реакции 1;
0,5 мкл 100 мкМ праймера CPBH_f;
0,5 мкл 100 мкМ праймера СРВН_r;
1 мкл 10 мМ dNTP каждого вида («Fermentas»);
43 мкл деионизованной воды;
0,5 мкл PfuI ДНК-полимеразы («Fermentas»).
После амплификации 5 мкл ПЦР смеси анализировали электрофорезом в 1%-ном агарозном геле и выявляли гомогенный фрагмент размером около 1230 пн. Фрагмент выделяли из геля с помощью набора GelElute Plasmid Miniprep Kit (Sigma, США) в соответствии с инструкцией производителя.
Б) В качестве вектора-носителя использовали интегративную плазмиду pPIC9K (In-vitrogen, США). С целью накопления плазмиды, проводили трансформацию компетентных клеткок штамма Escherichia coli XL1-Blue recA1 endA1 gyrA96 thi-1 hsdR17 supE44 relA1 lac [F′proAB lacIqZ□M15 Tn10 (Tetr)] (Stratagene, США), затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя.
В) 200 нг исходной плазмиды pPIC9K и 100 нг полученного фрагмента (полной последовательности искусственного гена proCPBH) гидролизовали 20 единицами рестрик-таз XhoI (New England Biolabs, США) и EcoRI (New England Biolabs, США). Выделенный из агарозного геля XhoI/EcoRI фрагмент клонировали в XhoI/EcoRI вектор pPIC9K - лигировали с помощью Т4 ДНК лигазы (на 20 нг вектора 1,5 нг фрагмента). Полученной лигазной смесью трансформировали компетентные клетки штамма Escherichia coli XL1-Blue, затем из полученных ампициллин-устойчивых трансформантов выделяли препараты плазмидной ДНК с использованием набора QIAprep Spin Miniprep Kit (QIAGEN, Германия) в соответствии с инструкцией изготовителя. Полученные образцы ДНК анализировали совместным гидролизом рестриктазами EcoRI/XhoI, NotI/NcoI, и отбирали «положительные» клоны, содержащие EcoRI/XhoI фрагменты размером 1220 и 9246 п.н., а также NotI/NcoI фрагменты размером 2397 и 8069 п.н, а на наличие мутаций плазмиды анализировали методом секвенирования ДНК. В конечном счете отбирали экспрессионный вектор, представленный на фиг.1 и обозначенный как рСРВН.
Пример 2. Создание экспрессионных кассет и отбор трансформантов для синтеза карбоксипептидазы Б в клетках метилотрофных дрожжей Pichia Pastoris.
Необходимым условием стабильной экспрессии генов в составе генома дрожжей является создание экспрессионной кассеты. Для этого линеаризуют векторную молекулу по 5′-участку алкогольоксидазного промотора. После электропорации, в результате гомологичной рекомбинации идентичных участков промотора генома дрожжей и линеаризованного вектора, происходит включение интересующего гена в геном Pichia pastoris.
Для электропорации получали 5 мкл раствора ДНК (рСРВН), предварительно линеаризованной путем гидролитического расщепления рестриктазой PmeI (Fermentas, Литва), с рабочей концентрацией не менее 2 мкг/мкл. 20 мкг плазмиды гидролизовали 100 единицами рестриктазы PmeI в течение 3 часов. К 1 объему реакционной смеси добавляли равный объем фенол-хлороформа (1:1). Перемешивали 30 сек на вортексе. Центрифугировали в течение 3 мин. Отбирали водную фазу и переносили в новую пробирку. Добавляли в пробирку с фенол-хлороформом 100 мкл ТЕ-буфера, затем перемешивали 30 сек на вортексе и центрифугировали в течение 3 мин. Отбирали водную фазу при помощи пипетки и объединяли с той частью раствора, которая была отобрана ранее. Добавляли к раствору ДНК 1/10 объема 3М раствора ацетата Na, pH 6.0 и 3 объема этанола. Перемешивали, переворачивая пробирку несколько раз, и оставляли на 10 минут. Затем центрифугировали в течение 15 мин. Супернатант сливали, пробирку с осадком ДНК центрифугировали в течение 2 мин. Супернатант тщательно удаляли и добавляли 1 мл 70%-ного этанола. Центрифугировали в течение 2 мин. Супернатант сливали. Снова повторяли центрифугирование в течение 2 мин и отбирали оставшуюся жидкость. Осадок высушивали в течение 5 мин и растворяли в 5 мкл ТЕ-буфера.
Культуру дрожжей штамма P. pastris GS115 (his 4, mut+) растили на среде YPD в колбах Эйрленмейера объемом 500 мл до оптической плотности 1-2 единицы. Центрифугировали при 3000 х g в течение 5 минут. Биомассу суспендировали в 1 мМ DTT и 0,1 М HEPES, инкубировали на шейкере в течение 30 минут. Затем культуру снова центрифугировали. Биомассу промывали холодной деионизированной водой 2 раза и суспендировали в 1 мл 1 М сорбитола. Полученные клетки разливали по эппендорфам (по 40 мкл в каждый) и хранили при -70°C. Электропорацию проводили на электропораторе 2510 (Eppendorf, Германия) в специальных кюветах с зазором 2 мм. Рабочие характеристики - напряжение: 1500 В; емкость: 25 мкФ; сопротивление: 600 Ом. После электропорации быстро добавляли 1 мл холодного раствора 1 М сорбитола и ставили в термостат на 1 час при температуре 30°C.
Отбор трансформантов проводили на минимальной среде, не содержащей гистидина. После электропорации культуру клеток рассевали на чашки с плотной питательной средой MD agar. Полученные трансформанты переносили на плотный питательный агар YPD, содержащей генетицин в концентрациях 0,01; 0,02; 0,05; 0,1; 0,5 мг/мл. Полученные клоны проверяли с помощью ПЦР-скрининга. Готовили ПЦР-смесь объемом 20 мкл по следующей схеме:
2 мкл 10-кратного буфера для Taq-полимеразы («Евроген»);
0,15 мкл 120 мкМ праймера AOX1_f;
0,15 мкл 150 мкМ праймера YC1_r;
0,4 мкл 10 мМ dNTP каждого вида («Fermentas»);
17 мкл деиопизованной воды;
0,2 мкл Taq ДНК-полимеразы («Евроген»).
В каждую пробирку добавляли клетки трансформантов с плотной среды. Тщательно суспендировали и амплифицировали по следующей схеме: 95°, 5′ (денатурация), 95°, 30″; 45°, 30″; 74°, 1′30″ (амплификация).
«Положительные» клоны отбирали для определения уровня экспрессии рекомбинантного белка.
Пример 3. Культивирование трансформантов и определение уровня экспрессии гена proCPBH.
Трансформанты с чашек переносили на среду YPD (10 мл) и растили при 30°C до оптической плотности 2-4 единицы. Затем культурой клеток инокулировали среду BMGY (25 мл) (разведение в 100 раз) и инкубировали в течение 48 часов при 30°C в колбах объемом 250 мл. Полученную биомассу собирали центрифугированием при 2000×g в течение 5 минут и переносили в среду BMMY (10 мл), содержащую 1% (v/v) метанола. Выращивание проводили в колбах на 100 мл в течение 72 часов, добавляя каждые 24 часа в среду 1% (v/v) метанола. После выращивания культуральную жидкость отделяли от биомассы центрифугированием при 3000×g в течение 5 минут при 4°C. Полученные образцы смешивали с 1/6 объема «Sample Loading Buffer 6×» и анализировали при помощи денатурирующего ПААГ-электрофореза в стандартном режиме (фиг.4). Клон с максимальным уровнем экспрессии отобрали для получения рекомбинантного штамма, который был обозначен как P. pastoris GS115CPBH.
Полученный штамм характеризуется следующими признаками:
Морфологические признаки. Клетки крупные округлой формы, почкующиеся, 1х 4-7 мкм, подвижные.
Культуральные признаки. При росте на плотной среде YPD колонии круглые, гладкие, блестящие, кремовые, край ровный, диаметр колоний 3-6 мм; консистенция пастообразная. Рост в жидкой среде YPD характеризуется ровным помутнением с образованием легкого осадка.
Физиолого-биохимические признаки. Клетки растут при температуре 4-30°C при оптимуме pH 4,0-6,2. В качестве источника азота используют как минеральные соли в виде смеси, так и органические соединения в виде пептона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют глицерин, глюкозу, метанол. В отличие от исходного штамма не является ауксотрофом по гистидину.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы, а также к генетицину (до 100 мкг/мл), обусловленную наличием в плазмиде гена Kan.
Штамм P. pastoris GS115CPBH обеспечивает синтез полипептида со свойствами прокарбоксипептидазы Б человека в количестве примерно 40 мг целевого белка на литр культуры. Совокупность перечисленных свойств штамма обусловливает большую технологичность процесса получения рекомбинантного фермента.
Пример 4. Определение продуктивности полученного рекомбинантного штамма.
Пример 4. Определение уровня экспрессии прокарбоксипептидазы Б у полученного рекомбинантного штамма.
Определение активности СРВ в культуральной жидкости проводили, как описано в работе [Kim MJ, Kim SH, Lee JH, Seo JH, Lee JH, Kim JH, Kim YH, Nam SW. High-level secretory expression of human procarboxypeptidase В by Fed-Batch cultivation of Pichia pastoris and its partial characterization. J Microbiol Biotechnol. 2008 Dec; 18(12):1938-44]:
1. Активация СРВ. 100 мкл супернатанта культуральной жидкости обрабатывали трипсином 5 Ед/л при 37°C в течение 1 часа. Затем реакцию останавливали добавлением PMSF до 1 мМ.
2. Определение активности. К 900 мкл активационного буфера (50 мМ Tris-HCl, 1 мкМ ZnCl2, pH 7.5), содержащего 1 мМ гиппурил-L-аргинин, добавляли 100 мкл раствора активированной СРВ и проводили измерение поглощения на спектрофотометре при длине волны 254 нм.
3. Расчет. За одну единицу активности СРВ принимается количество фермента гидролизующего 1 мкМ гиппурил-L-аргинин за 1 минуту при pH 7,5 и температуре 25°C.
Активность СРВ (Ед/мл)=ΔA254/(0,349*Δt)*10,
где ΔА254 - приращение оптической плотности,
Δt - время измерения,
0,349 - коэффициент экстинкции гиппуровой кислоты, образующейся в результате реакции расщепления субстрата ферментом,
10 - коэффициент разбавления образца.
Измеренная активность образцов культуральной жидкости, полученной при выращивании штамма-продуцента P. pastoris GS115CPBH, составила не менее 9,0 ед/мл (при 3,5 ед/мл в прототипе).
1. Рекомбинантная плазмида рСНВН для экспрессии в Pichia pastoris последовательности, кодирующей прокарбоксипептидазу Б, имеющая размер 10466 т.п.о и состоящая из- XhoI/EcoRI - фрагмента ДНК вектора рР1С9К размером 9246 т.п.о. и- XhoI/EcoRI - фрагмента ДНК размером 1220 т.п.о., включающего участок, кодирующий сигнальный пептид α-фактора Saccharomyces cerevisiae, и синтетический ген прокарбоксипептидазы Б человека с нуклеотидной последовательностью, соответствующей последовательности, представленной на фиг.2.
2. Рекомбинантный штамм Pichia pastoris GS115СРВН - продуцент прокарбоксипептидазы Б человека, который получен в результате трансформации родительского штамма плазмидой по п.1, линеаризованной по 5'-участку АХО-1 промотора, и содержит синтетический ген прокарбоксипептидазы Б человека с нуклеотидной последовательностью, соответствующей последовательности, представленной на фиг.2.