Конъюгаты этопозида и доксорубицина для доставки лекарственных средств
Иллюстрации
Показать всеИзобретение относится к полипептидам, имеющим гидролизуемые ковалентные связи с терапевтическими агентами, для доставки лекарственных средств. Эти полипептидные конъюгаты могут быть использованы в качестве векторов для транспортировки терапевтических препаратов через гематоэнцефалитический барьер (ГЭБ) или для доставки в четко определенные виды клеток, такие как яичники, печень, легкие или почки. Изобретение также относится к фармацевтическим композициям, которые включают соединения по изобретению, и к их применению в способах лечения рака. 3 н. и 3 з.п. ф-лы, 16 ил., 8 табл., 6 пр.
Реферат
Область техники
Данное изобретение относится к способам улучшения доставки лекарственных средств. В частности, изобретение относится к полипептидам, которые при помощи гидролизуемых ковалентных связей связываются с терапевтическим препаратом, таким как подофиллотоксин-производные (напр., этопозид или его производные, такие как этопозид 4'-диметилглицин), либо с доксорубицином или его производными. Эти полипептидные конъюгаты могут быть использованы в качестве векторов для транспортировки терапевтических препаратов через гематоэнцефалитический барьер (ГЭБ) или для доставки в четко определенные виды клеток, такие как яичники, печень, легкие или почки. Эти конъюгаты могут способствовать улучшению физико-химических (например, увеличению растворимости) и фармацевтических свойств (например, расширению спектра целевых органов и тканей, что позволяет применять субтерапевтические дозы, или понижению токсичности, что позволяет применять сверхтерапевтические дозы) по сравнению с неконъюгированными терапевтическими препаратами. Изобретение также относится к фармацевтическим композициям, которые включают соединения по настоящему изобретению, и их применению в различных способах лечения.
Уровень техники
Многие терапевтические препараты (в т.ч. химиотерапевтические) против таких заболеваний оказывают нежелательные побочные эффекты либо, по причине in vivo стабильности, транспорта или других фармакокинетических свойств, представляют затруднения при введении в достаточно высоких концентрациях в целевую ткань, или при длительной продолжительности лечения, без которой невозможно достичь максимального терапевтического эффекта в целевой ткани. Следовательно, возникает необходимость в поиске новых способов и композиций, которые позволили бы увеличить концентрацию терапевтических и диагностических агентов в целевых органах и тканях, таких как головной мозг, яичники, печень или легкие.
Сущность изобретения
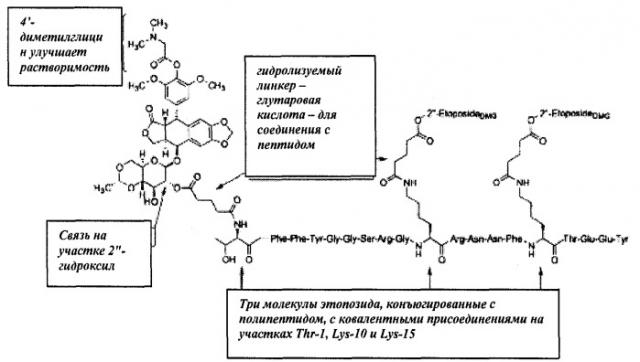
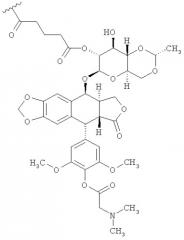
Нами разработаны пептидные терапевтические конъюгаты и их фармацевтически приемлемые соли, где этопозид с помощью ковалентной связи присоединен к полипептиду Angiopep-2 (SEQ ID NO:97) на участке 2"-гидроксил посредством гидролизуемого линкера - глутаровой кислоты (напр., Соединение (1), Схема 1). Также был получен подобный пептидный терапевтический конъюгат, в котором вместо этопозида использовался этопозид 4'-диметилглицин, причем в этом случае удалось добиться улучшенных свойств (напр., растворимости).
Схема 1
Доксорубицин также был присоединен ковалентной связью на участке 14-гидроксил к полипептиду Angiopep-2 с помощью линкера - янтарной кислоты (напр., треххлористоводородная соль Соединения (2), Схема 2). Ковалентное присоединение хлористоводородной соли доксорубицина также позволяет улучшить свойства (напр., растворимость).
Схема 2
Эти конъюгаты демонстрируют улучшенные свойства по сравнению с соответствующими неконъюгированными терапевтическими препаратами, а именно: улучшенные физико-химические (например, увеличенная растворимость) и фармацевтические (например, расширенный спектр целевых органов и тканей, что позволяет применять субтерапевтические дозы, или пониженная токсичность, что позволяет применять сверхтерапевтические дозы) свойства. Растворимость этопозидаDMG и конъюгатов доксорубицин гидрохлорида также может быть полезна при корректировке режимов дозирования. Поэтому настоящее изобретение охватывает такие соединения, а также родственные им соединения. Кроме того, предоставляются способы получения и применения этих соединений.
Соответственно, в одном аспекте данное изобретение предоставляет соединение или его фармацевтически приемлемую соль, включающие последовательность аминокислот, в значительной мере идентичную последовательности аминокислот, выбранной из группы, которая состоит из SEQ ID NOS: 1-105 и 107-116, или их функциональных производных, где последовательность аминокислот включает ковалентную связь от аминокислоты из последовательности аминокислот до подофиллотоксин-производного. В некоторых вариантах осуществления подофиллотоксин-производное представляет собой соединение, имеющее структуру согласно Формуле (I):
,
или его стереоизомер или фармацевтически приемлемая соль, где каждый R1, R2, и R3 независимо выбраны из: Н, произвольно замещенный C1-6 алкил, C(O)R8, P(O)(OR9)(OR10), S(O)2(OR9) или гидролизуемый линкер Y, который содержит ковалентную связь с аминокислотой полипептида;
Х является О или NR7;
каждый R4, R5 и R7 независимо выбраны из Н, произвольно замещенного C1-6 алкила, C(O)R8 или гидролизуемого линкера Y, который содержит ковалентную связь с аминокислотой полипептида;
R6 - это Н, произвольно замещенный C1-6 алкил, произвольно замещенный арил, произвольно замещенный гетероарил;
R8 выбран из: произвольно замещенный C1-6 алкил или произвольно замещенный арил;
каждый R8 и R10 независимо выбраны из: Н, произвольно замещенный C1-6 алкил или произвольно замещенный арил; и
n равно 1, 2, 3, 4, 5, 6, 7 или 8;
где один из R1, R2, R3, R4, R5 и R7 является Y и не более чем один из R1, R2, R3, R4, R5 и R7 является Y.
В некоторых вариантах осуществления Y является -С(O)(СН2)nC(O)- и n равно 2, 3 или 4. В определенных вариантах осуществления n равно 3.
В некоторых вариантах осуществления фармацевтически приемлемая соль соединения представляет собой моно-, ди- или три- соль добавления кислоты (напр., моно-, ди- или тригидрохлоридную соль).
В некоторых вариантах осуществления каждое соединение согласно Формуле (I) независимо выбрано из:
и ,
где каждый R2 независимо является Н, Р(O)(ОН)2 или C(O)CH2N(CH3)2; каждый R6 независимо является СН3 или 2-тиофеном; каждый Y выбран из -С(O)(СН2)nC(O)-; -[C(O){OCH2CH2}nOC(O)]-; -S(O)2(CH2)nS(O)2-; -[S(O)2{OCH2CH2}nOS(O)2]-[{P(O)(OR9)}(CH2)n{P(O)(OR9)}]-; и -[{P(O)(OR9)}(OCH2CH2)nO{P(O)(OR9)}]-; каждый n независимо равен 1, 2, 3, 4, 5 или 6; и где каждый Y ковалентно связан с аминокислотой. В некоторых вариантах осуществления каждый Y является -С(O)(СН2)nC(O)- или -[С(O){ОСН2СН2}nOC(O)]- и n равен 2, 3 или 4. В некоторых вариантах осуществления каждый R2 является С(O)CH2N(СН3)2. В некоторых вариантах осуществления каждое соединение согласно Формуле (I) представляет собой:
или
В некоторых вариантах осуществления соединение согласно настоящему изобретению имеет структуру:
где каждая группа согласно (-(Формуле(I)) представляет произвольную ковалентную связь между указанной аминокислотой и соединением по Формуле (I) и где существует по меньшей мере одна ковалентная связь между аминокислотой полипептида и указанным соединением согласно Формуле (I). В некоторых вариантах осуществления два соединения согласно Формуле (I) присоединены к последовательности аминокислот. В других вариантах осуществления треонин в позиции 1 и лизины на позициях полипептида 10 и 15, каждый включает ковалентную связь с соединением, имеющим структуру согласно Формуле (I).
В некоторых вариантах осуществления R2 является Н или -C(O)CH2N(CH3)2 (напр., С-связанный N,N-диметилглицин). В других вариантах осуществления каждый R2 является Н. Еще в некоторых вариантах осуществления каждый R2 является -С(O)CH2N(СН3)2.
В некоторых вариантах осуществления произвольно замещенный C1-6 алкил независимо выбран из: метил, этил, n-пропил, изопропил, n-бутил, изобутил, втор-бутил, втор-пентил, изо-пентил, трет-бутил, n-пентил, неопентил, n-гексил или втор-гексил. В некоторых вариантах осуществления C1-6 алкил замещен по меньшей мере одной произвольно замещенной аминогруппой (напр., NH2 или N(СН3)2) на любом атоме углерода.
В некоторых вариантах осуществления произвольно замещенный С3-10 циклоалкил независимо выбран из циклопропила, циклобутила, циклопентила, циклогексила и циклогептила.
В некоторых вариантах осуществления произвольно замещенная арильная группа независимо выбрана из фенила, нафтила, тетрагидронафтила, инданила или инденила.
В некоторых вариантах осуществления произвольно замещенная гетероциклильная группа независимо выбрана из: азациклопропанил, азациклобутанил, 1,3-диазатидинил, пирролидинил, пиперидинил, пиперазинил, тиранил, тиэтанил, тетрагидротиофенил, дитиоланил, тетрагидротиопиранил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксанил, оксатиоланил, морфолинил, тиоморфолинил, тиоксанил и хинуклидинил.
В некоторых вариантах осуществления произвольно замещенная гетероциклильная группа выбрана из: пирролил, пиразолил, имадазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил, тетразинил, прииролизинил, индолил, хинолинил, изохинолинил, бензимидазолил, индазолил, хинолизинил, циннолинил, хиназолинил, фталазинил, нафтиридинил, хиноксалинил, тиофенил, тиэпинил, фуранил, бензофуранил, тиазолил, изотиазолил, тиадиазолил, оксазолил, изоксазолил и оксадиазолил.
В некоторых вариантах осуществления замещенный алкил, циклоалкил, арил, гетероциклил или гетероарил замещен 1, 2, 3, 4, 5 или 6-ю заместителями, выбранными из: С1-6 алкил; галоген; азидо(-N3), нитро (-NO2), пиано (-CN), ацилокси, ацил (-C(O)R), (-OC(O)R), алкокси (-OR), амидо (-NRC(O)R' или -C(O)NRR'), амино (-NRR'), арил, карбоновая кислота (-СО2Н), сложный эфир карбоновой кислоты (-CO2R), карбамоил (-OC(O)NRR' или -NRC(O)OR'), циклоалкил, гетероциклил, гидрокси (-ОН), изоциано (-NC), фосфат (-P(O)(OR)(OR')), сульфонат (-SO2OR) или сульфонил (-SO2R), где каждый R или R' независимо выбраны из Н, С1-6 алкила, циклоалкила, гетероциклила, арила или гетероарила, согласно данным выше определениям. В некоторых вариантах осуществления эти заместители в дальнейшем не замещаются. В других вариантах осуществления заместители, в свою очередь, и сами могут в дальнейшем замещаться 1, 2, 3, 4, 5 или 6-ю группами заместителей.
В некоторых вариантах осуществления R4 является Y. В других вариантах осуществления R5 является Y.
В других вариантах осуществления последовательность аминокислот ковалентно связана с дополнительными производными подофиллотоксина посредством второй, третьей, четвертой или пятой аминокислоты указанной последовательности аминокислот. В некоторых вариантах осуществления производное подофиллотоксина представляет собой соединение по Формуле (I).
В определенных вариантах осуществления соединение по Формуле I имеет структуру:
,
где Y - это -C(O)(CH2)nC(O)- или -[С(O){ОСН2СН2}nOC(O)]- и n равно 2, 3 или 4. В других вариантах осуществления соединение по Формуле (I) имеет структуру:
,
где Y - это -С(O)(СН2)nC(O)- или -[С(O){ОСН2СН2}nOC(O)]- и n равно 2, 3 или 4. Еще в некоторых вариантах осуществления соединение по Формуле (I) имеет структуру:
,
где Y - это -С(O)(СН2)nC(O)- или -[С(O){ОСН2СН2}nOC(O)]- и n равно 2, 3 или 4.
В других вариантах осуществления каждое соединение по Формуле (I) независимо выбрано из:
или ,
где каждые R8A и R8B независимо являются Н или произвольно замещенным C1-6 алкилом, или R8A и R8B объединяются, образуя произвольно замещенное 3-7-членное кольцо. В некоторых вариантах осуществления каждый R8A и R8B представляет собой произвольно замещенный C1-6 алкил. В других вариантах осуществления каждое соединение по Формуле (I) имеет структуру:
В дальнейших вариантах осуществления соединение имеет такую структуру:
В отдельных вариантах осуществления соединение имеет структуру:
(I), или его фармацевтически приемлемая соль (напр., треххлористоводородная соль), где в Соединении (I) этопозид относится к этопозид 4'-диметилглицину.
В определенных вариантах осуществления каждая аминокислота, ковалентно связанная с гидролизуемым линкером Y, присоединяется посредством амино-, гуанидино-, гидроксил-, фенол- или тиольной функциональной группы указанной аминокислоты. В некоторых вариантах осуществления аминокислота, ковалентно связанная с гидролизуемым линкером Y, является лизином, тирозином, серином, треонином или аргинином.
Во втором аспекте, изобретение предоставляет соединение или его фармацевтически приемлемую соль, которое включает последовательность аминокислот, в значительной степени идентичную последовательности аминокислот, выбранной из группы, которая состоит из SEQ ID NOS: 1-105 и 107-116 или их функциональных производных, где указанная последовательность аминокислот включает ковалентную связь от аминокислоты с указанной последовательностью аминокислот до доксорубицин-производного и где указанное доксорубицин-производное представляет собой соединение, имеющее структуру согласно Формуле (II):
(II), либо его стереоизомер или фармацевтически приемлемая соль, где каждый X1, X2, Х3, Х4 и Х5 независимо выбран из ковалентной связи, О или NR25;
каждый R17, R18, R19, R20, R20, R21, R22, R23, R24 и R25 независимо выбран из: Н, произвольно замещенный C1-6 алкил, произвольно замещенный С2-6 алкенил, произвольно замещенный C2-6 алкинил, произвольно замещенный циклоалкил, произвольно замещенный гетероциклил или он является гидролизуемым линкером Y; и
где один и только один из R17, R18, R19, R20, R20, R21, R22, R23, R24 и R25 является Y.
В некоторых вариантах осуществления фармацевтически приемлемая соль соединения представляет собой моно-, ди- или три-соль добавления кислоты (напр., моно-, ди- или треххлористоводородная соль).
В определенных вариантах осуществления соединение по Формуле (II) имеет структуру:
,
где X2R18 - это Н или NH2; X3R19 - это Н или ОН; X4R20 - это Н или произвольно замещенный C1-3 алкил; и Y является гидролизуемым линкером согласно данному выше определению. В дальнейших вариантах осуществления соединение по Формуле (II) имеет структуру:
,
или его фармацевтически приемлемая соль.
В дальнейших вариантах осуществления соединение по Формуле (II) имеет структуру:
или
.
В определенных вариантах осуществления соединение имеет структуру:
,
где каждая (-(Формула(II)) представляет произвольную ковалентную связь между указанной аминокислотой и соединением по Формуле (II) и где существует по меньшей мере одна ковалентная связь между аминокислотой полипептида и вышеназванным соединением по Формуле (II). В некоторых вариантах осуществления треонин на позиции 1 и лизины на позициях 10 и 15 полипептида, каждый содержит ковалентную связь с соединением, имеющим структуру согласно Формуле (II).
В некоторых вариантах осуществления Y является -С(O)(СН2)nC(O)- и n равно 2, 3 или 4. В определенных вариантах осуществления n равно 2. В других вариантах осуществления последовательность аминокислот ковалентно связана с соединением, имеющим структуру согласно Формуле (II), с помощью второй, третьей, четвертой или пятой аминокислот последовательности аминокислот. В другом варианте осуществления каждая аминокислота, ковалентно связанная с указанным гидролизуемым линкером Y, присоединена посредством амино-, гуанидино-, гидроксил-, фенол- или тиоловой функциональной группы аминокислоты. В определенных вариантах осуществления аминокислота является лизином или треонином,
В некоторых вариантах осуществления соединение по Формуле (II) имеет структуру:
,
или его фармацевтически приемлемая соль.
В других вариантах осуществления соединение имеет структуру:
(2), или его фармацевтически приемлемая соль (напр., треххлористоводородная соль).
В другом аспекте, изобретение предоставляет следующее соединение:
(«этопозид 4'-диметилглицин» или «этопозидDMG») либо любой его стереоизомер или любая фармацевтически приемлемая соль или растворитель этого соединения.
В любом из вышеупомянутых аспектов последовательность аминокислот может быть в значительной степени идентична любой из последовательностей, перечисленных в Табл. 1 либо их фрагментам или их фармацевтически приемлемым солям. В определенных вариантах осуществления последовательность аминокислот имеет последовательность Angiopep-1 (SEQ ID NO: 67), Angiopep-2 (SEQ ID NO: 97), Angiopep-3 (SEQ ID NO: 107), Angiopep-4a (SEQ ID NO: 108), Angiopep-4b (SEQ ID NO: 109), Angiopep-5 (SEQ ID NO: 110), Angiopep-6 (SEQ ID NO: 111) или Angiopep-7 (SEQ ID NO: 112). Последовательность аминокислот или соединений изобретения может быть эффективно транспортирована в конкретный вид клеток (напр., в любой один, два, три, четыре или пять таких видов клеток: печень, яичники, легкие, почки, селезенка и мышцы) либо может эффективно пересекать ГЭБ млекопитающих (напр., Angiopep-1, -2, -3, -4а, -4b, -5 и -6). В некоторых вариантах осуществления клетки являются клетками яичника. В других вариантах осуществления конъюгат способен внедряться в конкретный вид клетки (напр., в любой один, два, три, четыре или пять таких видов клеток: печень, яичники, легкие, почки, селезенка и мышцы), но не пересекая при этом ГЭБ эффективно (напр., конъюгат, включающий Angiopep-7). В некоторых вариантах осуществления клетки являются клетками яичников. Длина полипептида может быть любой, например, по меньшей мере 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 25, 35, 50, 75, 100, 200 или 500 аминокислот. В определенных вариантах осуществления длина полипептида составляет от 10 до 50 аминокислот. Конъюгат может быть практически чистым. Полипептид может быть получен с помощью рекомбинантной генетической технологии или химического синтеза. Конъюгат может быть сформулирован с фармацевтически приемлемым носителем.
Полипептиды с номерами Nos 5, 67, 76 и 91 включают последовательности SEQ ID NOs: 5, 67, 76 и 91 соответственно и амидируются на С-конце.
Полипептиды с номерами Nos 107,109 и 110 включают последовательности SEQ ID NOs: 97, 109 и 110 соответственно и ацетилируются на N-конце.
В любом из вышеперечисленных аспектов полипептид может включать последовательность аминокислот, которая имеет Формулу:
Х1-Х2-Х3-Х4-Х5-Х6-Х7-Х8-Х9-Х10-Х11-Х12-Х13-Х14-Х15-Х16-Х17-Х18-Х19,
где каждый из Х1-Х19 (напр., Х1-Х6, Х8, Х9, Х11-Х14 и Х16-Х19) независимо является любой аминокислотой (напр., встречающейся в природе аминокислотой, такой как Ala, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr и Val) или отсутствует, и по меньшей мере один (напр., 2 или 3) из X1, Х10 и X15 является аргинином. В некоторых вариантах осуществления Х7 является Ser или Cys; либо X10 и X15 каждый независимо являются Arg или Lys. В некоторых вариантах осуществления остатки с X1 по X19 включительно являются в значительной степени идентичными любой последовательности аминокислот из любой SEQ ID NOS: 1-105 и 107-116 (напр., Angiopep-1, Angiopep-2, Angiopep-3, Angiopep-4a, Angiopep-4b, Angiopep-5, Angiopep-6 и Angiopep-7). В некоторых вариантах осуществления по меньшей мере одна (напр., 2, 3, 4 или 5) из аминокислот Х1-Х19 является Arg. В некоторых вариантах осуществления полипептид имеет один или более дополнительных цистеиновых остатков на N-конце полипептида, С-конце полипептида или на них обоих,
В определенных вариантах осуществления любого из вышеупомянутых аспектов полипептид является модифицированным (как описано в данной публикации). Полипептид может быть амидированным, ацетилированным либо и тем и другим. Такие модификации полипептида могут иметь место как на амино-, так и на карбокси-конце полипептида. Конъюгаты изобретения могут также включать пептидомиметики (напр., как описано в данной публикации) любого из полипептидов, описанных в данной публикации. Полипептид может быть в мультимерной форме, например, димерной форме (напр., образованной посредством дисульфидных связей с помощью цистеиновых остатков).
В определенных вариантах осуществления полипептид имеет последовательность аминокислот, описанную в данной публикации, с по меньшей мере одним аминокислотным замещением (напр., 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 замещений). Полипептид может содержать, например, от 1 до 12, от 1 до 10, от 1 до 5 или от 1 до 3 аминокислотных замещений, например, от 1 до 10 (напр., до 9, 8, 7, 6, 5, 4, 3, 2) аминокислотных замещений. Аминокислотное(ые) замещение(я) могут быть консервативными или неконсервативными. Например, полипептид может содержать аргинин на одной, двух или трех позициях, соответствующих позициям 1, 10 и 15 последовательности аминокислот любого из SEQ ID NO: 1, Angiopep-1, Angiopep-2, Angiopep-3, Angiopep-4a, Angiopep-4b, Angiopep-5, Angiopep-6 и Angiopep-7.
В любом из вышеупомянутых аспектов конъюгат может специфически исключать полипептид, который включает или состоит из любой из SEQ ID NOS: 1-105 и 107-116 (напр., Angiopep-1, Angiopep-2, Angiopep-3, Angiopep-4a, Angiopep-4b, Angiopep-5, Angiopep-6 и Angiopep-7). В некоторых вариантах осуществления полипептиды и конъюгаты по настоящему изобретению исключают полипептиды с последовательностями SEQ ID NOs: 102, 103, 104 и 105.
В некоторых вариантах осуществления последовательность аминокислот по меньшей мере на 35%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности аминокислот, выбранной из группы, которая состоит из SEQ ID NOS: 1-105 и 107-116 или их функциональных производных, В определенных вариантах осуществления последовательность аминокислот по меньшей мере на 35%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности аминокислот, выбранной из группы, которая состоит из Angiopep-2 (SEQ ID NO: 97), Angiopep-4b, Angiopep-5, Angiopep-6 и Angiopep-7 (SEQ ID NOS: 109-112). Еще в некоторых вариантах осуществления последовательность аминокислот по меньшей мере на 35%, 40%, 50%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% идентична последовательности аминокислот Angiopep-2 (SEQ ID NO: 97).
В некоторых вариантах осуществления последовательность аминокислот содержит последовательность аминокислот, выбранную из группы, которая состоит из SEQ ID NOS: 1-105 и 107-116 или их функциональных производных. В определенных вариантах осуществления последовательность аминокислот соответствует Angiopep-2 (SEQ ID NO: 97), Angiopep-4b, Angiopep-5, Angiopep-6 или Angiopep-7 (SEQ ID NOS: 109-112).
В других вариантах осуществления последовательность аминокислот состоит из последовательности аминокислот, выбранной из группы, которая включает SEQ ID NOS: 1-105 и 107-116 или их функциональные производные. В определенных вариантах осуществления последовательность аминокислот соответствует Angiopep-2 (SEQ ID NO: 97), Angiopep-4b, Angiopep-5, Angiopep-6 или Angiopep-7 (SEQ ID NOS: 109-112).
В некоторых вариантах осуществления соединения по настоящему изобретению могут изменять аккумуляцию биологически активного агента (напр., подофиллотоксин-производных, таких как соединения по Формуле (I), или доксорубицин-производные, такие как соединения по Формуле (II)) в целевых типах клеток и тканей, по сравнению с соответствующим неконъюгированным биологически активным агентом. Еще в некоторых вариантах осуществления соединение по настоящему изобретению ускоряет аккумуляцию биологически активного агента в целевых типах клеток или тканей. В определенных вариантах осуществления концентрация биологически активного агента возрастает на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100%, 150%, 200%, 250%, 300%, 350%, 400%, 450%, 500%, 550%, 600%, 650%, 700%, 750%, 800%, 850%, 900%, 950%, 1 000%, 2 000%, 3 000%, 4 000%, 5 000%, 6 000%, 7 000%, 8 000%, 9 000%, 10 000%, 12 500%, 15 000%, 17 500% или 20 000% по сравнению с этим показателем, наблюдаемым при применении неконъюгированного биологически активного агента. В некоторых вариантах осуществления целевыми типами клеток или тканей являются головной мозг, яичники, печень, легкие, почки, селезенка или мышцы. В некоторых вариантах осуществления целевыми типами клеток являются головной мозг или яичники. В определенных вариантах осуществления биологически активный агент выбран из этопозида, этопозид фосфата, этопозидаDMG, тенипозида, доксорубицина или эпирубицина. В других вариантах осуществления соединение по настоящему изобретению содержит последовательность аминокислот Angiopep-2 (SEQ ID NO: 97), Angiopep-4b, Angiopep-5, Angiopep-6 или Angiopep-7 (SEQ ID NOS: 109-112) или их функциональные производные.
В третьем аспекте изобретение предоставляет фармацевтическую композицию, куда входят любое соединение по настоящему изобретению, описанному в данной публикации (напр., соединение, содержащее последовательность аминокислот, в значительной степени идентичную последовательности аминокислот, выбранной из группы, которая включает SEQ ID NOS: 1-105 и 107-116, или его функциональные производные, или фармацевтически приемлемые соли, где последовательность аминокислот содержит ковалентную связь между аминокислотой из последовательности аминокислот и соединением Формул (I) или (II) (напр., Соединение (1) или (2)) и фармацевтически приемлемый носитель. В четвертом аспекте изобретение предоставляет способ лечения или профилактического лечения рака, где способ включает введение пациенту терапевтически эффективного количества любого соединения по настоящему изобретению, описываемого в данной публикации (напр., соединения, содержащего последовательность аминокислот, в значительной степени идентичную последовательности аминокислот, выбранной из группы, которая включает SEQ ID NOS: 1-105 и 107-116 или их функциональные производные, где последовательность аминокислот содержит ковалентную связь между аминокислотой последовательности аминокислот и соединением Формул (I) или (II)).
В некоторых вариантах осуществления соединение представляет собой Соединение (1) или (2). В некоторых вариантах осуществления подофиллотоксин-производное выбрано из:
и ,
где
Y является Н; каждый R2 независимо является Н или Р(O)(ОН)2 или -C(O)R8; каждый R6 независимо является СН3 или 2-тиофеном; каждый Y является -С(O)(СН2)nC(O)-; каждый R8 независимо является произвольно замещенным C1-6 алкилом; и каждый n независимо равен 2, 3 или 4. В некоторых вариантах осуществления n равен 3. В некоторых вариантах осуществления каждый R2 является -C(O)R8. В некоторых вариантах осуществления R8 представляет собой С1-6 алкил, содержащий по меньшей мере одну произвольно замещенную аминогруппу (напр., NH2 или N(СН3)2). В определенных вариантах осуществления -C(O)R8 - это С-связанная аминокислота. В некоторых вариантах осуществления подофиллотоксин-производное - это этопозид, этопозид фосфат, этопозид 4'-диметилглицин (этопозидDMG) или тенипозид. Еще в некоторых вариантах осуществления соединение представляет собой доксорубицин или любое доксорубицин-производное (напр., соединение по Формуле (II)), описываемое в данной публикации.
В некоторых вариантах осуществления способ также включает введение второго агента. В других вариантах осуществления агент является терапевтическим препаратом. В определенных вариантах осуществления второй терапевтический препарат также ковалентно связан с соединением по настоящему изобретению. Еще в некоторых вариантах осуществления второй терапевтический препарат не связан ковалентно с соединением по настоящему изобретению. В некоторых вариантах осуществления терапевтический препарат представляет собой лекарственное вещество, готовый лекарственный препарат; агент, излучающий радиацию, клеточный токсин, их биологически активный фрагмент или их смесь, предназначенные для лечения болезни. В других вариантах осуществления введение лекарственного препарата производится параллельно с другим терапевтическим режимом. В некоторых вариантах осуществления терапевтический режим представляет собой радиационную терапию, химиотерапию, трансплантацию стволовых клеток, трансплантацию костного мозга, хирургическое вмешательство или лечение гипертермии. В некоторых вариантах осуществления второй терапевтический препарат - это полипептид, который включает или состоит из последовательности Angiopep-2 (SEQ ID NO: 97), предпочтительно где Angiopep-2 конъюгирован с противораковым агентом (напр., паклитакселом), напр., ANG1005, который имеет структуру:
ANG1005:
TxlAn2 (3:1 конъюгат)
Еще одним примером второго терапевтического препарата может служить вещество, описанное в Патенте США №7,557,182, который включен в данную публикацию посредством ссылки.
В некоторых вариантах осуществления рак является раком головного мозга. В других вариантах осуществления рак головного мозга - это глиобластома, глиома, невринома слухового нерва, аденома, астроцитома, папиллома хороидального сплетения, лимфома ЦНС, эпендимома, ганглиоцитома, ганглиоглиома, медуллобластома (mdl), анапластическая (злокачественная) менингиома или нейрофиброматоз. Еще в других вариантах осуществления рак - это острый лимфолейкоз, острый миелобластный лейкоз, адренокортикальный рак, внутривенный и внутрипузырный рак мочевого пузыря, костная саркома, рак молочной железы, карциноид синдром (тонкой кишки), рак эндометрия, саркома Юинга, гинекологические саркомы, рак головы и шеи (плоскоклеточный рак), рак печени, болезнь Ходжкина, рак островковых клеток, лейкемия, рак легких, злокачественная лимфома, множественная миелома, нейробластома, неходжкинская лимфома, рак поджелудочной железы, рак предстательной железы, остеогенная саркома, рак яичников, ретинобластома, рабдомиосаркома, рак желудка, рак яичек, рак щитовидной железы, переходно-клеточный рак мочевого пузыря, саркома мягких тканей или опухоль Вильмса.
Согласно любому терапевтическому способу, описываемому в данной публикации, соединение по настоящему изобретению (Соединение (1) или (2)) либо их фармацевтически приемлемые соли могут вводиться пациенту в виде субтерапевтических или сверхтерапевтических доз, по сравнению с неконъюгированным терапевтическим препаратом (напр., этопозидом, этопозид фосфатом, этопозид 4-диметилглицином или доксорубицином).
В другом аспекте, изобретение предоставляет способ изготовления любого из соединений по настоящему изобретению, описываемых в данной публикации, где способ включает шаг по ковалентному связыванию подофиллотоксин-производного с любой последовательностью аминокислот, описываемой в данной публикации, или их функциональными производными, с использованием дифункциональной гидролизуемой связывающей группы. В некоторых вариантах осуществления последовательность аминокислот выбрана из SEQ ID NOS: 1-105 и 107-116 или их функциональных производных. В других вариантах осуществления последовательность аминокислот содержит последовательность аминокислот Angiopep-2 (SEQ ID NO: 97), Angiopep-4b, Angiopep-5, Angiopep-6 или Angiopep-7 (SEQ ID NOS: 109-112).
В некоторых вариантах осуществления способ изготовления любого из соединений по настоящему изобретению включает такие шаги:
(a) комбинирование упомянутого соединения по Формуле (I) с вышеуказанной дифункциональной гидролизуемой связывающей группой с целью образования ковалентного аддукта; и
(b) комбинирование аддукта по пункту (а) с упомянутой последовательностью аминокислот; и где аддукт по пункту (а) произвольно может быть очищен перед использованием в пункте (b).
В некоторых вариантах осуществления 1.0-10.0 эквиваленты дифункциональной гидролизуемой связывающей группы используются по отношению к соединению по Формуле (I). Например, могут быть использованы эквиваленты 1.1; 1.2; 1.3; 1.4; 1.5; 1.6; 1.7; 1.8; 1.9; 2.0. 2.1; 2.2.; 2.3; 2.4; 2.5; 2.6; 2.7; 2.8; 2.9 или 3.0. В других вариантах осуществления используются эквиваленты дифункциональной гидролизуемой связывающей группы 3.5; 4,0; 4.5; 5.0; 5.5; 6.0; 6.5; 7.0. 7.5; 8.0; 8.5; 9.0; 9.5 или 10.0. В определенных вариантах осуществления способ включает применение пептидного агента реакции сочетания. В некоторых вариантах осуществления пептидный агент реакции сочетания представляет собой N,N,N',N'-Тетраметил-O-(бензотриазол-1-ил)уроний тетрафтороборат (TBTU). В некоторых вариантах осуществления дифункциональная гидролизуемая связывающая группа выбрана из бикарбоновой кислоты, бикарбоната, карбонового ангидрида, диизоцианата или дифосфоновой кислоты. В определенных вариантах осуществления дифункциональная гидролизуемая связывающая группа выбрана из янтарной кислоты, глутаровой кислоты, глутарового ангидрида или масляной кислоты.
В некоторых вариантах осуществления подофиллотоксин-производное выбрано из:
и
где Y является Н; каждый R2 независимо является Н или Р(O)(ОН)2, либо -C(O)R8; каждый R6 независимо является СН3 или 2-тиофеном; каждый Y является -С(O)(СН2)nC(O)-; каждый R8 независимо является произвольно замещенным С1-6 алкилом; и каждый n независимо равен 2, 3 или 4. В некоторых вариантах осуществления n равен 3. В некоторых вариантах осуществления каждый R2 является -C(O)R8. В некоторых вариантах осуществления R8 представляет собой С1-6 алкил, содержащий по меньшей мере одну произвольно замещенную аминогруппу (напр., NH2 или N(СН3)2). В определенных вариантах осуществления -C(O)R8 - это С-связанная аминокислота. В некоторых вариантах осуществления подофиллотоксин-производное - это этопозид, этопозид фосфат, этопозидDMG или тенипозид.
В любых способах или композициях, описываемых в данной публикации, фармацевтически приемлемая соль соединения может быть моно-, ди-, три- или тетра-соль добавления кислоты (напр., треххлористоводородная соль). В любых вариантах осуществления, описываемых в данной публикации, любые соединения по Формуле (I) или (II) (напр., этопозид, этопозидDMG или доксорубицин), которые ковалентно связаны с полипептидом, являются сайтом протонирования. Например, в Соединении (1), протонируются (присоединяется протон) 1, 2 или 3 части молекулы этопозидаDMG, либо в Соединении (2), протонируются 1, 2 или 3 части молекулы доксорубицина с образованием соли добавления кислоты (напр., моно-, ди- или треххлористоводородной соли).
Термин «C1-6 алкил» или «алкил» в данном документе относится к произвольно замещенной C1-6 насыщенной группе углеводородов. Алкильная группа может быть линейной или разветвленной. Примеры алкильных радикалов включают, помимо прочего, метил, этил, n-пропил, изопропил, n-бутил, изо-бутил, втор-бутил, втор-пентил, изо-пентил, трет-бутил, n-пентил, неопентил, n-гексил, втор-гексил, n-гептил, n-октил, n-децил, n-ундецил, додецил и т.п., которые могут нести один или более заместителей. Например, замещенные алкильные группы могут иметь 1, 2, 3, 4, 5 или 6 заместителей.
Термин «арил» в данном документе относится к произвольно замещенной моно- или полициклической, ароматической, углеродной (без заместителей в цикле) части молекулы, имеющей 5-14 атомов углерода. В определенных вариантах осуществления настоящего изобретения «арил» относится к замещенной или незамещенной моноц