Новые лекарственные средства для ингибирования агрегации белков, вовлеченных в заболевания, связанные с агрегацией белков, и нейродегенеративные заболевания
Иллюстрации
Показать всеИзобретение относится к соединению, представленному формулой (Е)
где X, Y и L независимо ненаправленно выбраны из -C(R1)(R2)-, -C(R3)=, -N(R4)-, -N= и -O-;
M и Z независимо ненаправленно выбраны из ;
---- означает необязательную двойную связь; R1, R2, R3, R4 и R6 независимо выбраны из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; Hal выбран из F, Cl, Br и I; RE1 и RE2 присоединены к соседним атомам углерода, и RE1 и RE2 вместе ненаправленно образуют структуру -T-(CRE7RE8)n-V-, где T выбран из CRE9RE10 и O или NH и V выбран из CRE9RE10 и O или NH, а также соответствующие структуры, в которых присутствует двойная связь, причем по меньшей мере один из T или V представляет собой O или N; RE7 и RE8 представляют собой H или F; RE9 и RE10 представляют собой H; n принимает значения от 1 до 2; RE3 представляет собой C1-6 алкильную группу; m принимает значения 0 или 1; RE4 представляет собой атом галогена; p принимает значения 0 или 1; а также к фармацевтическим и диагностическим композициям указанного соединения. 15 н. и 26 з.п. ф-лы.,17 ил, 2 табл., 17 пр.
Реферат
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединению, представленному формулой (Е). Настоящее изобретение относится также к соединению, представленному формулой (Е), для применения при лечении или предотвращения заболеваний, связанных с агрегацией белков, и/или нейродегенеративных заболеваний. Кроме того, настоящее изобретение относится к фармацевтическим и диагностическим композициям, включающим соединение согласно настоящему изобретению, а также к набору, включающему соединение согласно изобретению. Изобретение относится также к способу визуализации скоплений агрегированных белков. Также раскрыт набор для получения соединения с обнаруживаемой меткой согласно настоящему изобретению.
В тексте настоящего изобретения упоминаются некоторые документы. Содержание документов, цитированных в данном изобретении (включая любые описания, инструкции производителей и т.д.), введено в данное изобретение в виде ссылки.
УРОВЕНЬ ТЕХНИКИ
M. Ono et al. (Bioorganic & Medicinal Chemistry 16 (2008) 6867-6872) описывают некоторые бета-амилоидные зонды на основе 3,5-дифенил-1,2,4-оксадиазолов.
В US 2007/02760034 описываются некоторые бис- и трис-дигидроксиарильные соединения и их метилендиокси-аналоги и фармацевтически приемлемые сложные эфиры, которые, как утверждается, подходят для лечения синуклеопатий.
В WO 2008/131148 описываются специфические дифенилгетероарильные производные и их применение для связывания и визуализации амилоидных бляшек.
Гетероциклические соединения, которые применимы в качестве NURR-1 активаторов, описаны в WO 2004/072050.
Этиленгликоль или пропиленгликоль с радиоактивной меткой применяются в качестве группы-метки в соединениях, которые могут применяться для визуализации тканей, как описано в WO 2007/002540.
В WO 98/17652 описываются некоторые производные оксадиазола, которые, как заявлено, подходят для лечения нейродегенеративных расстройств и церебральной ишемии.
Известно большое количество неврологических и нейродегенеративных заболеваний, многие из которых в настоящее время не поддаются лечению. Эти заболевания включают такие болезненные состояния, как болезнь Паркинсона, хорея Хантингтона, болезнь Галлервордена-Шпатца, болезнь Альцгеймера, старческое слабоумие, болезнь Крейтцфельдта-Якоба, артериосклеротическое слабоумие, облитерирующий церебральный тромбангиит, деменция с тельцами Леви (DLB), множественная системная атрофия (MSA) и множество других болезненных состояний.
Прионные болезни, которые включают такие заболевания, как болезнь Крейтцфельдта-Якоба (CJD), скрейпи и коровий губчатый энцефалит (BSE), патологически характеризуются спонгиформной дегенерацией мозга. Прионные болезни вызываются особым возбудителем инфекции, который состоит главным образом из неправильно сложенной в виде бэта-листов агрегированной изоформы PrPSc мембранного бета-гликопротеида PrPC.
Прионные болезни вызывали большой интерес в общественном здравоохранении вследствие появления BSE. Научные данные подтверждают, что BSE передавалась людям, вызывая новый вариант болезни Крейтцфельда-Якоба (nvCJD) (Will et al. 1996, Bruce et al. 1997). Не известно, сколько людей инфицировано и сколько еще подвергнется инфицированию vCJD в будущем. Имеющиеся на сегодняшний день данные не исключают возможность распространение эпидемии, затрагивающей большое количество пациентов (Andrews et al., 2000). Это повышает необходимость разработки эффективной терапии в дополнение к уже введенным в действие мерам, предупреждающим дальнейшее распространения заболевания. Кроме того, недавно полученные данные подтверждают, что может иметь место и вторичная передача болезни посредством переливания крови (LLewelyn et al., 2004).
Главным событием в патогенезе прионных болезней является превращение клеточного прионного белка PrPC в патологическую изоформу PrPSc, которая агрегируется в большие скопления белка. Такое формирование скоплений PrPSc является признаком патогенеза прионных болезней. Имеющиеся на сегодняшний день доказательства свидетельствуют о том, что PrPSc действует и как матрица этого превращения и как нейротоксическое средство, вызывающее нейронную дисфункцию и смерть клетки (Prusiner 1998, Giese и Kretzschmar 2001). Поэтому наиболее перспективным терапевтическим подходом к лечению прионных болезней является подавление PrPSc амплификации. Данные, полученные из исследований на клеточной культуре и живых организмах, говорят о том, что при ингибировании образования PrPSc может иметь место клиренс PrPSc (Mallucci 2003). Таким образом, данная терапевтическая стратегия также могла бы быть эффективной в конце инкубационноого периода и даже после проявления клинических признаков болезни и имеет большое значение при адресном применении для борьбы с прионной болезнью человека.
Было показано, что некоторые соединения эффективны в подавлении PrPSc амплификации in vitro, такие как, например, производные акридина, Congo Red, порфирины/фталоцианины, Ср-60, пептиды, разрушающие бета-слой, и разновидности PrP (Caughey et al. 1998, Chabry et al. 1998, Demaimay et al. 2000, Horiuchi et al. 2000, Perrier et al. 2000, Rudyk et al. 2000, Soto et al. 2000). Однако до настоящего времени ни одно из этих соединений не нашло применения в лечении болезни или в качестве исходного соединения для получения соединений с повышенной терапевтической эффективностью и фармакологическими свойствами.
Соединения, идентифицированные в качестве потенциальных терапевтических средств, были обнаружены, главным образом, случайно. Существует несколько методик испытаний in vitro, подходящих для высокопроизводительного скрининга больших библиотек соединений с целью выявления потенциальных антиприонных лекарственных средств. В недавно опубликованных исследованиях были предложены два различных подхода к системному скринингу: один основан на дрожжах (Bach et al. 2003), а в другом используются инфицированные ScN2a клеточные культуры (Kocisko et al. 2004, Kocisko et al. 2003). Однако эти подходы позволяли осуществлять скрининг в библиотеках, ограниченных 2500 и 2000 соединениями, соответственно, и оказались трудоемкими.
Помимо применения низкомолекулярных соединений в настоящее время испытано еще три возможных подхода. В первом подходе для подавления образования PrPSc используются антитела против PrP. Этот метод успешно использовался в испытании на клеточной культуре, а также в испытании на мышах при интраперитонеальных инъекциях (Enari et al., 2001; White et al., 2003). Другим подходом является применение CpG олигонуклеотидов, которые, как установлено, увеличивают продолжительность инкубационного периода у скрейпи-инфицированных мышей (Sethi et al., 2002). Однако механизм действия этого метода пока не объяснен. И наконец, изучается подавление экспрессии PrPC в нейронах инфицированных животных или людей с помощью siRNA. Было показано, что данный метод приводит к ингибированию образования PrPSc в клеточных культурах (Daude et al., 2003). Все три указанных метода имеют один и тот же недостаток, а именно - прохождение молекул через гематоэнцефалический барьер. Вследствие данного недостатка указанные подходы применимы только для профилактики установленной экспозиции в периферийных органах, но не подходят для терапевтического лечения заболевания центральной нервной системы.
Другой класс нейродегенеративных заболеваний, так называемые синуклеинопатии, характеризуется внутриклеточным аккумулированием белковых скоплений, олигомеров, протофиблилл и фибрилл, содержащих, главным образом, α-синуклеин. Считается, что в случаях синуклеинопатий патологическое воздействие на нервные клетки вызвано образованием олигомерных агрегатов α-синуклеина и последующим образованием мембранных пор. Примерами синуклеинопатий являются болезнь Паркинсона (PD), деменция с тельцами Леви (DLB) и множественная системная атрофия (MSA). До настоящего времени нет приемлемых терапевтических стратегий для подавления агрегации α-синуклеина.
Таким образом, существует потребность в идентификации новых соединений, подходящих для лечения заболеваний, связанных с агрегацией белков, таких как прионные болезни и синуклеинопатии.
Поэтому техническая задача, составляющая основу настоящего изобретения, заключается в создании соединений для лечения прионных болезней, синуклеинопатий и других болезней, характеризующихся агрегацией белков, в частности, болезни Паркинсона. Кроме того, существует необходимость создания соединений, которые являются подходящими зондами для визуализации скоплений агрегированных белков в упомянутых выше расстройствах.
ОПИСАНИЕ ФИГУР
Фиг.1: SAR-карта, составленная для DIVERSet 1 и 2, скрининг которых проводился методом 2D-SIFT и тестированием в клеточной культуре. На карте показаны кластеры структурно подобных соединений (обозначенные звездочками или квадратами), сформированные из 837 лучших соединений, выявленных первичным скринингом в клеточной культуре из DIVERSet 1 и 2. Кластеры, в свою очередь, расположены таким образом, что аналогичные кластеры находятся в непосредственной близости друг к другу. Символами, представляющими кластеры, являются масштаб, форма и окраска в соответствии с их размером и количественными соотношениями между активностями в SIFT-анализе и в клеточных структурах, соответственно, как указано в пояснениях. Таким образом, большие кластеры, содержащие большие соотношения SIFT-активностей и активностей в клеточных культурах, обозначены большими красными звездами. Выбрано пять кластеров, названных DPP_1-DPP_5, и показаны соединения-прототипы, представляющие эти кластеры.
Фиг.2: Все соединения, распределенные в кластеры, которые идентифицированы выше (фиг.1), представлены на фиг.2 (А-F) с их активностями в различных тестах. Все они относятся к химическому классу производных 3,5-дифенилпиразола (DPP) (структура DPP показана на Фиг.1). На фиг.2F показан дополнительный кластер DPP_6, который не содержится в SAR-карте, представленной на фиг.1, и включает единственное соединение, активное в отношении клеточной культуры, с атомом N, присоединенным к пиразольному циклу. На фиг.2F дополнительно показаны 4 соединения из 33 DPP из DIVERSet 1 и 2, которые, как установлено, не активны в клеточной культуре и которые, как определено DM программой, не сходны с шестью соединениями класса DPP. Заявителями изобретения идентифицированы эти соединения с помощью поиска в библиотеке структур DPP.
Фиг.3: Перечень соединений, которые были синтезированы согласно способам, описанным в примере 2, на основании результатов первичного скрининга и медицинских химических соображений. Эти соединения были испытаны с использованием различных способов анализа (т.е. SIFT, анализы в моделях клеточных культур прионных болезней, тесты in vivo на животных или биохимические анализы агрегации α-синуклеина).
Фиг.4: Влияние лечения на период выживания мыши после интрацеребрального инфицирования RML скрейпи. Соединения вводились ежедневно в течение 14 дней, начиная с 80 дня после инфицирования (50 мкл 10 мМ соединения). На схеме (А) показано, что лечение соединением 10353_F11 увеличивает продолжительность периода выживания интрацеребрально инфицированных мышей (р<0,05). На схеме (В) показаны средние продолжительности периодов выживания после лечения различными соединениями. Ежедневная интраперитонеальная инъекция соединений anle138b и sery149 значительно увеличивает продолжительность периодов выживания после заражения RML скрейпи (anle138b: p<0,01; sery149: p<0,05). Средние значения времени выживания выражены в днях ± среднеквадратическое отклонение.
Фиг.5: Влияние лечения на уровень содержания PrPSc в селезенке мышей, интраперитонеально инфицированных RML скрейпи. (А) После инокуляции скрейпи-прионами мышей лечили один раз в день соединением (25 мкл 100 мМ соединения для интраперитонеального введения и 50 мг/кг для перорального введения). (В) Денситометрический анализ уровня содержания PrPSc в селезенке в дот-блот анализе. Лечение с помощью anle138b вызывает стойкое снижение уровней содержания PrPSc по сравнению с контролем (р=0,001). (С) Иммуногистологические анализы селезенок скрейпи-инфицированных мышей. После лечения anle138b процент селезенок с низкими PrPSc скоплениями возрастает (качество +) и прочные PrPSc скопления отсутствуют (качество +++). На (D) показаны два образца окрашенных PrPSc скоплений (стрелки) в селезенках. На фигуре слева показано сильно окрашенное PrPSc скопление (качество +++), в то время как справа показано PrPSc скопление с незначительным окрашиванием (качество +). Планки погрешностей в блок-схемах показывают среднее значение PrPSc ± стандартное отклонение.
Фиг.6: Иммуноблот и гистологический анализ мозга мышей. (А) Лечение мышей после интрацеребральной инокуляции RML скрейпи начинали через 80 дней после инфицирования. Соединения вводили в указанных временных точках (25 мкл 100 мМ соединения для i.p. введения и 50 мг/кг для перорального введения). (В) Количественное определение уровней содержания PrPSc в гомогенатах мозга прион-инокулированных мышей в различных временных точках. Лечение с помощью anle138b полностью блокирует аккумулирование PrPSc в мозге. Количество PrPSc в 106 день еще находится на уровне количества, выявленного в день 80. Лечение с помощью anle186b приводит к снижению аккумулирования PrPSc в мозге мышей. (С) Изменение относительных уровней содержания PrPSc после лечения соединениями по сравнению с необработанным контролем на день 80. (D) Гистологическое исследование апоптотических клеток (стрелка в (Е)) в Н&Е окрашенных тонких срезах мозга в указанных временных точках. На графике показаны средние количества апоптотических клеток ± среднеквадратическая ошибка. На (Е) показана окрашенная область с апоптотической клеткой (стрелка).
Фиг.7: Увеличение продолжительности периода выживания при ежедневном введении соединений согласно настоящему изобретению. Мыши, которые были интрацеребрально инфицированы штаммом RML скрейпи, показывают более продолжительный период выживания до достижения конечной стадии скрейпи-инфекции.
Фиг.8: Подавление агрегации α-синуклеина соединениями согласно настоящему изобретению. (А) DPP-соединение 351F11 способно ингибировать образование мультимерных комплексов α-синуклеина зависимым от дозы образом. (В)(С) Зависимое от дозы ингибиторное действие на агрегацию α-синуклеина, выявленное для других DPP-родственных соединений.
Фиг.9: Культуры клеток, инфицированных прионами, обрабатывают DPP-родственными соединениями согласно настоящему изобретению. DPP-родственные соединения проявили высокоэффективное снижение PrPSc в клеточной культуре при низких микромолярных и даже субмикромолярных концентрациях.
Фиг.10: Влияние ежедневного лечения соединением anle138b на аккумуляцию PrPSc и прионную патологию у мышей, инфицированных RML скрейпи. (А) Срезы мозга, подкрашенные для PrPSc (верхний ряд: кора и гиппокапм, нижний ряд: мозжечок), показывают, что лечение соединением 138b аккумулированием PrPSc по сравнению с животными, обработанными ДМСО. (В) Квантификация содержания PrPSc в мозговых гомогенатах прион-инокулированных мышей в указанные моменты времени показывает, что аккумулирование PrPSc в anle138b-обработанных мышах значительно снижается даже после начала лечения на последней стадии болезни (120 дней после инфицирования). (С) Гистологическое определение количества апоптотических клеток в мозжечке в Н&Е окрашенных срезах показывает, что ингибирование PrPSc аккумуляции приводит к ингибированию гибели нейронных клеток. (D) Контрольные мыши, обработанные смесью ДМСО+арахисовое масло без соединения, показывают прогрессирующую потерю массы. Лечение с помощью anle138b, начиная с 80 дня после инфицирования, предотвращает потерю массы на ~100 дней. Лечение, начиная со 120 дня после инфицирования, ингибирует потерю массы на ~70 дней. Планки погрешностей на В и С показывают стандартную ошибку (n=4 мыши). Подрисуночные подписи к фиг.В также применимы к фиг.С и D.
Фиг.11: Сравнение различных методик лечения. Лечение с помощью anle138b в разное время и по различным схемам, как показано на данной фигуре, значительно увеличивает продолжительность периодов выживания после введения RML скрейпи (р<0,01). Средний период выживания представлен в днях ± среднеквадратическое отклонение.
Фиг.12: Зависимое от дозы действие введения anle138b на уровни содержания PrPSc в мозге. C57BL/6 мышей инокулировали интрацеребрально (i.c.) 30 мкл 1% мозгового гомогената (RNL скрейпи). Лечение начинали на дни 80 после инфицирования различными количествами anle138b (как показано на фигуре), вводимыми перорально в смеси с буфером ДМСО + арахисовое масло. На дни 120 животных забивали и определяли количество PrPSc в мозге в сравнении с животными, забитыми на день 80 после инфицирования. Планки погрешностей показывают среднеквадратическую ошибку (n=4 мыши).
Фиг.13: Количественное определение содержания PrPSc иммуноблоттингом ткани мозга от неинфицированных мышей, обрабатываемых 1 мг в день соединения anle138b в смеси с буфером ДМСО + арахисовое масло в течение 1 недели. Каждая планка погрешности показывает погрешность для группы из четырех мышей.
Фиг.14: Фармакокинетический анализ anle138b. Разовую дозу anle138b вводили неинфицированным C57BL/6 мышам, как было показано. В различные моменты времени после введения соединения количество соединения определяли в мозге и сыворотке крови у 2 животных для каждой временной точки и экспериментальной группы с помощью ЖХ-МС.
Фиг.15: Ингибирование образования α-синуклеиновых скоплений с помощью различных соединений. Представлены структуры соединений, результаты испытаний которых представлены в таблице 2.
Фиг.16: Количественное определение потери нейронов у МРТР-обработанных мышей по сравнению с МРТР-необработанными мышами с помощью тирозингидроксилаза-(ТН)-положительных клеток substantia nigra pars compacta (SNpc) в 50 мкм срезах, иммуноокрашенных антителом против ТН. Каждый второй срез SNPc анализировали с использованием программного обеспечения Stereo investigator (MicroBrightfield, Colchester, VT, USA). Иммуноокрашенные клетки подсчитывались с помощью фракционного метода с использованием 20× объектива. Стереологические подсчеты проводились «вслепую» двумя независимыми исследователями.
Фиг.17: Влияние anle138c на Abeta агрегацию. Abeta агрегацию анализировали с помощью динамического рассеяния света. Мономерная и олигометрическая Abeta в отсутствие (верхний график) и в присутствии anle138C (средний график). Нижний график показывает распределение по размерам амилоидного фибриллярного состояния Abeta40, количественно определенное после центрифугирования образца.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение описано с помощью вариантов осуществления, представленных в формуле изобретения. Следует представлять, что сочетания всех предпочтительных вариантов осуществления изобретения, приведенных далее и в формуле изобретения, должны рассматриваться как часть области настоящего изобретения.
Настоящее изобретение относится к соединению, представленному общей формулой (Е)
X, Y и L в цикле D независимо ненаправленно выбраны из -C(R1)(R2)-, -C(R3)=, -N(R4)-, -N=, -N+(R5)=, -O- и -S-;
М и Z независимо ненаправленно выбраны из
- - - - означает необязательную двойную связь,
Разумеется, что X, Y, Z, L и M будут выбираться в соответствии с подходящей валентностью и стабильностью соединений.
R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из водорода, C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси; -C(O)-C1-4 алкила; и C6-10 арила, где арильный цикл может быть необязательно замещен C1-4 алкилом или галогеном. C6-10 арильная группа конкретно ограничена и может быть выбрана, например, из фенила и нафтила. Атом галогена может представлять собой F, Cl, Br или I и обычно представляет собой F или Cl.
Предпочтительно R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси; и -C(O)-C1-4 алкила. Более предпочтительно R1, R2, R3, R4, R5, R6 и R7 выбраны из водорода; C1-4 алкила; и группы -C1-4 алкилен-галоген.
Выбор заместителя может зависеть от предполагаемого применения соединений формулы (E). В одном предпочтительном варианте осуществления изобретения, по меньшей мере, один из R1, R2, R3, R4, R5, R6 и R7 (более предпочтительно, по меньшей мере, один из R4, R5 и R7) представляет собой группу -C1-4 алкилен-галоген. Это в особенности применимо, если соединения должны применяться в качестве зонда для визуализации скоплений агрегированных белков, поскольку в эту группу можно быстро и рационально ввести обнаруживаемую метку, такую как обнаруживаемый изотоп галогена. Примеры различимых изотопов галогена включают 18F, 125I, 123I, 131I, 77Br и 76Br, в частности 18F. Разумеется, можно использовать обнаруживаемый изотоп галогена в качестве любых других атомов галогена, присутствующих в соединениях согласно настоящему изобретению, таких как атомы галогенов, присоединенные к фенильному циклу.
Альтернативно, 11C может использоваться в качестве обнаруживаемой метки в соединениях согласно настоящему изобретению. 11C может присутствовать, по меньшей мере, в одном из R1, R2, R3, R4, R5, R6 и R7 (более предпочтительно, по меньшей мере, в одном из R4, R5 и R7) или в любой другой части соединения согласно настоящему изобретению.
В альтернативном предпочтительном варианте осуществления изобретения R1, R2, R3, R4, R5, R6 и R7 независимо выбраны из водорода и C1-4 алкила, предпочтительно водорода.
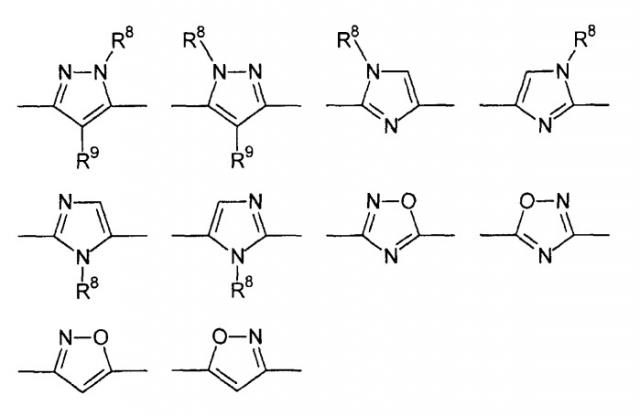
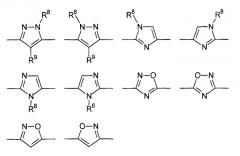
Цикл D конкретно не ограничен. Типичные примеры цикла D включают
Особенно предпочтительными примерами цикла D являются
В приведенных выше формулах R8 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси; -C(O)-C1-4 алкила; и C6-10 арила, где арильный цикл может быть необязательно замещен C1-4 алкилом или галогеном. Предпочтительно R8 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси; и -C(O)-C1-4 алкила. Более предпочтительно, R8 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген. В одном варианте осуществления изобретения R8 выбран из водорода; и C1-4 алкила, более предпочтительно представляет собой водород. В альтернативном варианте осуществления изобретения R8 представляет собой группу -C1-4 алкилен-галоген. Как указано выше, R8 может быть помечен обнаруживаемой меткой, если это необходимо.
В приведенных выше формулах R9 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси; -C(O)-C1-4 алкила; и C6-10 арила, где арильный цикл может быть необязательно замещен C1-4 алкилом или галогеном. Предпочтительно R9 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген; группы -C1-4 алкилен-OH; группы -C1-4 алкилен-C1-4 алкокси и -C(O)-C1-4 алкила. Более предпочтительно, R9 выбран из водорода; C1-4 алкила; группы -C1-4 алкилен-галоген. В одном варианте осуществления изобретения R9 выбран из водорода; и C1-4 алкила, более предпочтительно представляет собой водород. В альтернативном варианте осуществления изобретения R9 представляет собой -C1-4 алкилен-галоген. Как указано выше, R9 может быть помечен различимой обнаруживаемой меткой, если это необходимо.
В дополнительном варианте осуществления изобретения R8 и R9 представляют собой водород. В еще одном варианте осуществления изобретения R8 представляет собой группу -C1-4 алкилен-галоген и R9 представляет собой водород.
Hal выбран из F, Cl, Br и I и предпочтительно представляет собой F, Cl или Br, более предпочтительно Cl или Br, более предпочтительно Br.
RE1 выбран из гидроксильной группы, C1-6 алкокси и -NRE5RE6.
RE2 выбран из водорода, галогена, гидроксильной группы, C1-6 алкокси и -NRE5RE6, предпочтительно RE2 выбран из водорода, гидроксильной группы, C1-6 алкокси и -NRE5RE6.
В альтернативном варианте осуществления изобретения RE1 и RE2 вместе могут ненаправленно образовывать структуру -T-(CRE7RE8)n-V-, а также соответствующие структуры, в которых присутствует двойная связь, если они присоединены к соседним атомам углерода. В данной структуре Т выбран из CRE9RE10, NH и О, V выбран из CRE9RE10, NH и О. Предпочтительно по меньшей мере один из Т и V представляет собой NH или О. Примеры таких структур включают -O-(CH2)n-O-, -O-(CF2)n-O-, -O-(CH2)n-CH2-, -NH-(CH2)n-NH-, -NH-(CF2)n-NH-, -NH-(CH2)n-CH2- или соответствующую структуру, в которой присутствует двойная связь. Например, если n=1, то -N=CH-NH- представляет собой структуру, в которой присутствует двойная связь и которая соответствует -NH-CH2-NH-. Предпочтительно RE1 и RE2 вместе образуют структуру -O-(CH2)n-O-. Подразумевается, что данная группа также может подвергаться гидролизу in vivo до соответствующих гидроксильных групп.
n принимает значения от 1 до 3; предпочтительно n равно 1 или 2, более предпочтительно n равно 1.
RE5 и RE6 независимо выбраны из водорода и С1-6 алкила; предпочтительно RE5 и RE6 независимо выбраны из водорода и С1-4 алкила.
RE7 и RE8 независимо представляют собой Н или F, предпочтительно представляют собой Н.
RE9 и RE10 независимо представляют собой Н или F, предпочтительно представляют собой Н.
Положение, в котором RE1 и RE2 присоединены к фенильному циклу, может изменяться.
В одном варианте осуществления изобретения RE1 и RE2 независимо представляют собой гидроксильную группу или алкоксигруппу и присоединены в мета- или пара-положение относительно атома углерода, который связывает фенильное кольцо с циклом D.
В другом варианте осуществления изобретения RE1 и RE2 представляют собой структуру -T-(CRE7RE8)n-V- или соответствующую структуру, в которой присутствует двойная связь, и присоединены в мета- и пара-положении относительно атома углерода, который связывает фенильный цикл с циклом D. Приведенные выше предпочтительные определения структуры -T-(CRE7RE8)n-V- аналогично применимы к данному варианту осуществления.
В третьем варианте осуществления изобретения RE1 представляет собой -NRE5RE6 и присоединен в пара-положении относительно атома углерода, который связывает фенильный цикл с циклом D.
Помимо RE1 и RE2 на фенильном цикле могут необязательно присутствовать дополнительные заместители RE3. RE3 может представлять собой С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно С1-6 алкильную группу, более предпочтительно С1-4 алкильную группу. Число заместителей m конкретно не ограничено и обычно находится в интервале от 0 до 2, предпочтительно от 0 до 1, обычно равно 0.
Могут также присутствовать дополнительные заместители RE4. Обычно они представляют собой атом галогена, С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно атом галогена или С1-6 алкильную группу, более предпочтительно С1-6 алкильную группу, наиболее предпочтительно С1-4 алкильную группу. Число заместителей р конкретно не ограничено и обычно находится в интервале от 0 до 2, предпочтительно равно 0 или 1, обычно равно 0.
В некоторые варианты осуществления не включены следующие соединения:
3(5)-(2-гидрокси-5-метилфенил)-5(3)-(4-хлорфенил)пиразол (DE 4126543: соединение 26 в таблице 1);
орто-гидроксифенил-5 дихлор-3'-4'-фенил-3 метил-2 пиразол (FR 2.104.932: Пример IV);
орто-гидроксифенил-5 дихлор-3'-4'-фенил-3-фенил-2 пиразол (FR 2.104.932: Пример IV);
Данные соединения описаны как соединения IA-44, IA-47, IA-81, IA-106 и IA-115 в WO 2004/080972.
В других вариантах осуществления изобретения данные соединения не исключаются.
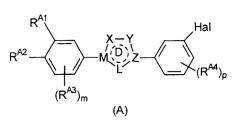
Предпочтительные примеры соединения, представленного формулой (Е), включают соединения, представленные формулой (А)
Определения Х, Y, Z, M, L, цикла D, m, p и Hal, приведенные выше для формулы (Е), аналогично применимы к формуле (А).
RA1 и RA2, каждый независимо, выбран из водорода, галогена, гидроксильной группы, С1-6 алкоксигруппы и -NRA5RA6 при условии, что по меньшей мере один из RA1 и RA2 представляет собой гидроксильную группу, С1-6 алкоксигруппу или -NRA5RA6. Предпочтительно, RA1 и RA2 независимо выбраны из водорода, гидроксильной группы, С1-6 алкоксигруппы и -NRA5RA6.
Альтернативно, RA1 и RA2 могут вместе ненаправленно образовывать структуру -T-(CRE7RE8)n-V-. Определения, приведенные для RE1 и RE2, входящих в состав такой структуры, и в частности, приведенные выше определения RE7, RE8, T, n и V, аналогично применимы к RA1 и RA2, образующим такую структуру.
В одном варианте осуществления изобретения RA1 и RA2 независимо представляют собой гидроксильную или алкоксигруппу.
Во втором варианте осуществления изобретения RA1 и RA2 представляют собой структуру -T-(CRE7RE8)n-V- или соответствующую структуру, в которой присутствует двойная связь. Приведенные выше предпочтительные определения для структуры -T-(CRE7RE8)n-V- аналогично применимы к данному варианту осуществления изобретения.
В третьем варианте осуществления изобретения RA1 представляет собой -NRA5RA6 и RA2 представляет собой водород.
Помимо RA1 и RA2 на фенильном цикле могут необязательно присутствовать дополнительные заместители RA3. RA3 может представлять собой С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно С1-6 алкильную группу, более предпочтительно С1-4 алкильную группу.
Также могут присутствовать дополнительные заместители RA4. Обычно они представляют собой атом галогена, С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно атом галогена или С1-6 алкильную группу, более предпочтительно С1-6 алкильную группу, наиболее предпочтительно С1-4 алкильную группу.
RA5 и RA6 независимо выбраны из водорода и С1-6 алкила; предпочтительно RA5 и RA6 независимо выбраны из водорода и C1-4 алкила.
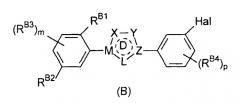
Предпочтительные примеры соединения, представленного формулой (Е), включают соединения, представленные формулой (В)
Определения Х, Y, Z, M, L, цикла D, m, p и Hal, приведенные выше для формулы (Е), аналогично применимы к формуле (В).
RB1 выбран из гидроксильной группы, С1-6 алкоксигруппы и -NRB5RB6. Предпочтительно, RB1 представляет собой гидроксильную группу или С1-6 алкоксигруппу.
RB2 выбран из водорода, галогена, гидроксильной группы, С1-6 алкоксигруппы и -NRA5RA6, предпочтительно, RB2 выбран из водорода, гидроксильной группы, С1-6 алкоксигруппы и -NRA5RA6.
В одном варианте осуществления изобретения RB1 представляет собой гидроксильную или С1-6 алкоксигруппу и RB2 представляет собой водород.
RB5 и RB6 независимо выбраны из водорода и С1-6 алкила, предпочтительно RB5 и RB6 независимо выбраны из водорода и С1-4 алкила.
На фенильном цикле помимо RB1 и RB2 могут присутствовать дополнительные заместители RB3, RB3 могут представлять собой С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно С1-6 алкильную группу, более предпочтительно С1-4 алкильную группу.
Также могут присутствовать дополнительные заместители RB4. Обычно они могут представлять собой атом галогена, С1-6 алкильную группу или С5-10 арильную группу (такую как фенильная или нафтильная группа), предпочтительно атом галогена или С1-6 алкильную группу, более предпочтительно С1-6 алкильную группу, наиболее предпочтительно С1-4 алкильную группу.
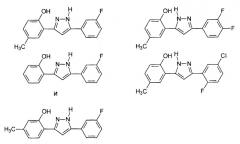
Предпочтительные соединения согласно настоящему изобретению включают
Определения, приведенные выше для RE7, RE8 и Hal, аналогично применимы и к данным соединениям.
R выбран из водорода; С1-4 алкила; группы -С1-4 алкилен-галоген; и С6-10 арила (такого как фенил и нафтил), где арильный цикл может быть необязательно замещен С1-4 алкилом или галогеном. Предпочтительно R выбран из водорода, С1-4 алкила; группы -С1-4 алкилен-галоген. В одном варианте осуществления изобретения R выбран из водорода; и С1-4 алкила, более предпочтительно представляет собой водород. В альтернативном варианте осуществления изобретения R представляет собой группу -С1-4 алкилен-галоген. Как было пояснено выше, R может содержать обнаруживаемую метку, если это необходимо.
RA7 представляет собой H или С1-6 алкил, предпочтительно H или С1-4 алкил.
RA8 представляет собой H или С1-6 алкил, предпочтительно H или C1-4 алкил.
RA9 представляет собой H или С1-6 алкил, предпочтительно H или С1-4 алкил.
RA10 представляет собой H или С1-6 алкил, предпочтительно H или С1-4 алкил.
RB7 представляет собой H или С1-6 алкил, предпочтительно H или C1-4 алкил.
Приведенные далее соединения особенно предпочтительны, поскольку, как установлено, обладают высокой эффективностью ингибирования агрегации белков или визуализации агрегированных белков:
где Hal представляет собой Cl или Br, предпочтительно Hal представляет собой Br.
Наиболее предпочтительны следующие соединения
Соединения согласно настоящему изобретению также могут быть представлены в форме пролекарств, сложных эфиров, сольватов или солей.
Соединения согласно настоящему изобретению образуют соли, которые также относятся к области данного изобретения. Следует представлять, что ссылка в описание на соединение согласно настоящему изобретению включает ссылку на его соли, если не указано иного. Термин «соль(и)», когда применяется в данном описании, означает кислотные и/или основные соли, образованные с неорганическими и/или органическими кислотами и основаниями. Кроме того, когда соединение содержит основный и кислотный фрагмент, могут образовываться цвиттерионы («внутренние соли»), которые также включены в область значений термина «соль(и)», используемого в данном описании. Фармацевтически приемлемые (т.е. нетоксичные, физиологически приемлемые) соли являются предпочтительными, хотя также могут использоваться и другие соли, например, на стадиях выделения или очистки в процессе получения. Соли соединений согласно настоящему изобретению могут быть получены, например, взаимодействием соединения с количеством кислоты или основания, таким как эквивалентное количество, в среде, такой как среда, в которой соль выпадает в осадок, или в водной среде с последующей лиофилизацией.
Соединения, которые содержат основный фрагмент, могут образ