Двухвалентные и гетероциклические производные никотина с оксо-мостиком и способы их получения
Иллюстрации
Показать всеИзобретение относится к гетероциклическому производному никотина с оксо-мостиком, выбранному из соединений, имеющих структуру, описываемую формулами (А) или (В), либо к их оптическому изомеру:
,
где R1 представляет собой азото-, кислородо- и/или серосодержащий пяти- или шестичленный гетероцикл; галогенированный азото-, кислородо- и/или серосодержащий пяти- или шестичленный гетероцикл; либо замещенный или незамещенный фенил, где заместитель представляет собой галоген; R3 и R4 вместе образуют -CH2-CH2- или -CH2-CH2-CH2-; R5, R6, R7, R8 и R9 представляют собой водород; и Y представляет собой нитро. Также раскрываются агрохимические композиции для уничтожения или профилактики вредителей сельского хозяйства, содержащие указанные соединения. Технический результат: получены новые соединения формул (А) и (В), которые могут найти применение в сельском хозяйстве для уничтожения ряда вредителей сельского хозяйства, включая равнокрылых и чешуекрылых вредителей, таких как тли, носатки, белокрылки, цикады, большинство трипсов, хлопковых коробочных червей, капустных гусениц, капустную совку, хлопковых гусениц и гусениц. 5 н. и 15 з.п. ф-лы, 2 табл., 13 пр.
Реферат
Область техники
Настоящее изобретение относится к новому производному никотинового инсектицида, и способам его получения и применения. В частности, настоящее изобретение относится к нитрометиленовым аналогам имидаклоприда и двухвалентным гетероциклическим производным никотина с оксо-мостиком (или соединениям неоникатиноидам), созданным при помощи диальдегидов и способам их получения.
Предшествующий уровень техники
Новые производные никотиновых пестицидов, представленные имидаклопридом, обладают высокой инсектицидной активностью, широким инсектицидным спектром и низкой токсичностью для млекопитающих и водных животных, благоприятными систематическими свойствами и подходящей полевой стабильностью, а также экологичностью; поэтому стали важными стартовыми точками для новых агрохимических открытий. Впоследствии была последовательно обнаружена серия производных никотиновых инсектицидов, таких как тиаклоприд, клотианидин, тиаметоксам, ацетамиприд, нитенпирам и динотефуран (см. европейские патенты 247477, 296453, 685477, 235725, 235725, 315826, 192060, 244777, 0386565, 580553 и 1031556, а также японские патенты 62292765, 8259568, 8291171 и 7242633).
Однако, поскольку частое и чрезмерное использование имидаклоприда вызывало серьезные проблемы устойчивости и структурное сходство среди производных никотина привело к перекрестной устойчивости, применение этого класса соединений было, в определенной степени, ограничено и ограничена разработка новых соединений этого класса. Между тем, производные никотина прежде всего являются инсектицидами против равнокрылых и жесткокрылых, и их относительно узкий инсектицидный спектр также ограничивает их применение в борьбе с вредителями.
Поэтому в области структурной модификации соединений нитрометилена с высокой активностью для получения новых, еще более эффективных инсектицидов актуальным является решение проблемы устойчивости никотиновых производных инсектицидов, расширение инсектицидного спектра и применение тех же самых инсектицидных составов.
Краткое описание изобретения
Настоящее изобретение относится к новым, более эффективным инсектицидам и, таким образом, решает проблемы устойчивости производных никотиновых инсектицидов, расширяет инсектицидный спектр и решает проблемы предыдущего уровня техники.
Целью настоящего изобретения является обеспечение соединения, которое весьма эффективно в борьбе с вредителями, а также способ его получения.
Другой целью настоящего изобретения является обеспечение защиты для предотвращения зерновых культур от атак и вторжения насекомых в период роста и сбора урожая.
В одном из аспектов настоящее изобретение предлагает гетероциклическое производное никотина с оксо-мостиком, которое выбрано из соединений формулы (А) или (Б), или их оптического изомера, или агрохимически приемлемой соли:
где:
R1 представляет собой азото-, кислородо- и/или серосодержащий пяти- или шестичленный гетероцикл; галогенированый азото-, кислородо- и/или серосодержащий пяти- или шестичленный гетероцикл; или, замещенный или незамещенный фенил, где заместитель выбран из одной или нескольких следующих групп: галоген, C1-4 галогенированные алкильные или C1-4 хлорированные алкокси;
R3 и R4 представляют собой независимо друг от друга: водород, C1-6 алкил, аллил, бензил, C1-4 алкокси-С1-4 алкил, С1-4 алкокси-карбонил; феноксикарбонил, С3-6 алкинил-карбонил, C2-3 алкенил-карбонил, С3-6 циклоалкил-карбонил, бензоил; или бензоил, фуранилкарбонил или N,N-диметилкарбонил, замещенный одним или несколькими заместителями, выбранными из атомов галогена, C1-4 алкила, C1-4 гало-алкила, C1-4 алкокси и С1-4 алкил-карбонила, или R3 и R4 коллективных форм -СН2-СН2-, -СН2-СН2-СН2- или -CH2-XR-CH2, где Х представляет собой гетероатом и R является заместителем у гетероатома, выбранным из водорода, C1-6 алкила, аллила, бензила, фенила; C1-4 алкокси - C1-4 алкила; C1-4 алкокси-карбонила; феноксикарбонила, С2-6 алкинил-карбонила, C2-3 алкенил-карбонила, С3-6 циклоалкил-карбонила; бензоила; или бензоила, фуранилкарбонила, или N,N-диметилкарбонила, замещенного одним или несколькими заместителями, выбранными из атомов галогена, C1-4 гало-алкила, C1-8 насыщенных или ненасыщенных алкилов или алкокси и C1-4 алкил-карбонила;
R5, R6, R7, R8 и R9 представляют собой водород, насыщенный или ненасыщенный C1-4 алкил, галоген, C1-8 насыщенный или ненасыщенный алкокси, C1-4 галогенированный насыщенный или ненасыщенный алкокси, C1-4 алкил-карбонил, C1-8 алкил-эфир, C1-4 алкил-сульфонат, фенил или бензил и
Y представляет собой нитро, циано, трифторметил, трифторацетил или трифторметансульфонил.
В предпочтительном варианте гетероциклическое производное никотина с оксо-мостиком выбирают из следующих групп:
, ,
, ,
, ,
, ,
, и .
В другом предпочтительном варианте, гетероциклическое производное никотина с оксо-мостиком выбирают из следующих групп:
и .
В другом предпочтительном варианте гетероциклическое производное никотина с оксо-мостиком является антагонистом никотиновых ацетилхолиновых рецепторов у насекомых.
В другом предпочтительном варианте активность гетероциклических производных никотина с оксо-мостиком (1а) и (1b) против устойчивых к имидаклоприду коричневых цикадок и табачной белокрылки в от 2 до 30 раз выше, чем имидаклоприда.
В другом аспекте настоящее изобретение предлагает агрохимическую композицию, которая включает в себя:
(а) от 0,001 до 99,99 масс.% вышеупомянутого гетероциклического производного никотина с оксо-мостиком, его оптического изомера, или агрохимически приемлемой соли, или их комбинации, а также
(б) агрохимически приемлемый носитель и/или эксципиент.
В другом аспекте настоящее изобретение относится к применению указанной агрохимической композиции для уничтожения или профилактики вредителей сельского хозяйства, санитарных вредителей и вредителей, угрожающих здоровью животных, или в качестве инсектицидной композиции для уничтожения или профилактики вредителей сельского хозяйства, санитарных вредителей и вредителей, угрожающих здоровью животных.
В другом аспекте настоящее изобретение предлагает способ уничтожения и/или профилактики вредителей, включающий применение вышеупомянутой агрохимической композиции для страдающих растений, или которые могут пострадать от вредителей, а также для окружающей их почвы и окружающей среды.
В другом аспекте настоящее изобретение относится к применению вышеупомянутого соединения, оптического изомера, или их агрохимически приемлемой соли, или их комбинации для получения инсектицидной композиции.
В еще одном аспекте настоящее изобретение предлагает способ получения вышеупомянутого соединения, или оптического изомера, или их агрохимически приемлемой соли, включающий следующие стадии:
получение соединения формулы (А) или (Б) реакцией соединения формулы (а) с соединением формулы (б) или (с) при комнатной температуре в присутствии каталитического количества кислоты
где R1, R3, R4, R5, R6, R7, R8, R9 и Y приведены выше.
В предпочтительном варианте вышеупомянутый способ включает в себя следующие стадии:
получение соединения формулы (1а) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (1b) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (1с) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (1d) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (2а) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (2b) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (2с) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (2d) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
получение соединения формулы (1е) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
;
и получение соединения формулы (2е) путем проведения следующей реакции от 2 до 24 часов в ацетонитриле при комнатной температуре в присутствии каталитического количества кислоты:
.
Примеры
Через экстенсивные и интенсивные исследования, основанные на структуре нитрометилена имидаклоприда существующих производных нитрометилена имидаклоприда никотиновых инсектицидов, изобретатели настоящего изобретения при взаимодействии диальдегида с соединением нитрометилена имидаклоприда синтезировали новое производное никотина, которое имеет заметно улучшенную инсектицидную активность и обладает широким инсектицидным спектром. Авторы настоящего изобретения осуществили данное изобретение на основе вышеописанного.
Определения функциональных групп
Используемый здесь термин "С1-6 алкил" относится к алкилу с нормальной или разветвленной цепью, имеющему от одного до шести атомов углерода, такому как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил или аналогичным группам.
Термин "C1-4 алкокси" относится к нормальному или разветвленному алкоксилу, имеющему от одного до четырех атомов углерода, такому как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси или аналогичным группам.
Термин "галоген" относится к фтору, хлору, брому или йоду. Термин "галогенированный" относится к группе, замещенной одним или более, различными или одинаковыми атомами вышеупомянутых галогенов, такой, как трифторметил, пентафторэтил или аналогичным группам.
Термин "пяти- или шестичленный гетероцикл" относится к пяти- или шестичленному кольцу, содержащему один или несколько гетероатомов, выбранных из азота, кислорода или серы, таких, как пиридил, тиазолил, пиримидил, тетрагидрофуранил, оксазолил и т.п.
Способ получения соединения по настоящему изобретению Соединение по настоящему изобретению может быть синтезировано по стадиям реакции, описанным выше.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (1а) выглядит следующим образом:
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (1b) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения, способ синтеза соединения формулы (1с) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (1d) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (2а) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (2b) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (2с) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (2d) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (1е) выглядит следующим образом:
.
В одном конкретном варианте осуществления настоящего изобретения способ синтеза соединения формулы (2е) выглядит следующим образом:
.
В одном из вариантов изобретения соединения формул (1а) - (1е) могут быть получены в следующих реакциях:
смешанный раствор 2,5-диэтокси тетрагидрофурана (2 г, 12,5 ммоль) и водного раствора соляной кислоты (0,1 М, 10 мл) нагревали до 90°С и проводили реакцию в течение одного часа, а затем охлаждали до комнатной температуры. Ацетонитрил (40 мл) и нитрометиленовый аналог имидаклоприда (10 ммоль) добавляли в реакцию и перемешивали систему при комнатной температуре.
Реакцию контролировали с помощью тонкослойной хроматографии, а после завершения реакции нейтрализовали смесь насыщенным водным раствором бикарбоната натрия. Систему экстрагировали, удаляли растворитель при пониженном давлении и осуществляли разделение с помощью колоночной хроматографии (элюент: дихлорметан/ацетон = 3/1 (V/V)), чтобы получить бледно-желтый порошок, т.е. продукт.
В другом варианте соединения по формулам (2а)-(2е) могут быть получены в следующих реакциях.
Нитрометиленовый аналог имидаклоприда (5 ммоль), 30 мл безводного ацетонитрила, 3 мл 25% водного раствора глутарового альдегида и каталитическое количество соляной кислоты помещали в 50 мл круглодонную колбу. Реакцию перемешивали при комнатной температуре и контролировали с помощью тонкослойной хроматографии. После завершения реакции, систему нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали. Растворитель удаляли при пониженном давлении и осуществляли разделение путем колоночной хроматографии (элюент: дихлорметан/ацетон = 3/1 (V/V)), чтобы получить бледно-желтый порошок, т.е. продукт.
Инсектицидная активность действующего вещества настоящего изобретения
Термин "активное вещество по настоящему изобретению" или "активное соединение по настоящему изобретению" означает соединение по настоящему изобретению, или оптический изомер, или их агрохимически приемлемую соль, обладающие значительно улучшенной инсектицидной активностью и широким инсектицидным спектром.
Термин "агрохимически приемлемая соль" означает, что анион такой соли, формирующий агрохимически приемлемые соли инсектицидов, известен или приемлем. Предпочтительно, чтобы такая соль растворялась в воде. Подходящие соли присоединения кислоты образуются из соединений формул (А) и (Б), включают соль, образованную неорганической кислотой, такую как гидрохлорид, фосфат, сульфат и нитрат, и соль, образованную органической кислотой, такую как ацетат или бензоат.
Активное вещество по настоящему изобретению может быть использовано для контроля и уничтожения различных вредителей растений сельского и лесного хозяйства, вредителей зерновых хранилищ, вредителей, которые наносят ущерб общественному здравоохранению, вредителей, которые наносят ущерб здоровью животных, и тому подобных. В настоящем описании "инсектицид" представляет собой любое вещество, которое обладает эффектом профилактики или контроля всех вышеупомянутых вредителей. Примеры вредителей включают, но не ограничиваются, жесткокрылых насекомых: Sitophilus zeamais, Tribolium castaneum, Henosepilachna vigintioctomaculata, Henosepilachna sparsa, Agriotes fuscicollis, Anomala cupripes, Popillia quadriguttata, Monolepta hieroglyphica, Monochamus alternatus, Echinocnemus squameus, Basiprionota bisignata, Anoplophora chinensis, Apriona germari, Scolytus schevy, или Agriotes fuscicollis; чешуекрылых насекомых: Lymantha dispar, Malacosoma neustria testacea, Diaphania perspectalis, Clania variegata, Cnidocampa flavescens, Dendrolimus punctatus, Orgyia gonostigma, Paranthrene tabaniformis, Spodoptera litura, Chilo suppressalis, Ostrinia nubilalis, Ephestia cautella, Adoxophyes orana, Laspeyresia splendana, Agrotis fucosa, Galleria mellonella, Plutella xylostella, Phyllocnistis citrella, Mythimna separata; равнокрылых насекомых: Nephotettix cincticeps, Nilaparvata lugens, Pseudococcus comstocki, Unaspis yanonensis, Myzus persicae, Aphis gossypii, Lipaphis erysimi pseduobrassicae, Stephanitis nashi или Bemisia tabaci; прямокрылых насекомых: Blattella germanica, Periplaneta americana, Gryllotalpa afhcana, или Locus migratoria; или термитов: Solenopsis invicta или Coptotermes formasanus; двукрылых насекомых: Musca domestica, Aedes aegypti, Delia platura, Culex sp. или Anopheles sinensis. Вредители, которые наносят ущерб здоровью животных, включая Boophilus microplus, Haemaphysalis longicomis, Hyalomma anatolicum, Hypoderma spp., Fasciola hepatica, Moniezia benedeni, Ostertagia spp., Trypanosoma evansi, Babes/a bigemina и тому подобные.
Соединение настоящего изобретения является особенно эффективным в отношении насекомых сельского и лесного хозяйства, имеющих колюще-сосущий или режуще-сосущий ротовой аппарат, таких как тля, цикады, носатки, трипсы, белокрылки и тому подобные.
Инсектицидные композиции, содержащие активное вещество по настоящему изобретению
Обычный метод может быть использован для получения инсектицидных композиций из активных веществ по настоящему изобретению. Такие активные соединения могут быть превращены в обычные препараты, такие как растворы, эмульсии, суспензии, порошки, пены, пасты или гранулы, аэрозоли, пропитанные активным веществом натуральные или синтетические материалы, микрокапсулы в полимере, комплекс, используемый для покрытия семян; препараты, которые будут использоваться вместе с устройством сгорания, таким как картридж фумигатора, фумигаторный флакон или фумигаторная пластина, и генераторы холодного и горячего тумана сверхнизких объемов.
Эти препараты могут быть получены с использованием известных методов, например, путем смешивания действующего вещества(веществ) и наполнителей, где наполнителями являются разбавители или носители в виде жидкости, сжиженного газа или твердого, при необходимости с поверхностно-активными веществами, т.е. эмульгаторами, и/или диспергирующими агентами, и/или пенообразующими агентами. Например, если вода используется в качестве наполнителя, в качестве вспомогательного растворителя также может быть использован органический растворитель.
Как правило, обычно используют жидкие растворители в качестве разбавителей или носителей, например: ароматические углеводороды, такие как ксилол, толуол, или алкилнафталины, хлорированные ароматические и хлорированные алифатические углеводороды, такие как хлорбензол, винилхлорид или дихлорметан, алифатические углеводороды, такие, как циклогексан или парафин, такой как фракция минерального масла; спирты, такие как этанол, этиленгликоль, а также простые и сложные эфиры; или кетоны, такие как ацетон, метилэтилкетон, метилизобутилкетон и циклогексанон, или реже используемые полярные растворители, такие какдиметилформамид, диметилсульфоксид и вода. Разбавитель или носитель в виде сжиженного газа относится к жидкостям, которые являются газообразными при нормальной температуре и атмосферном давлении, например, аэрозольные пропелленты, такие как галогенированные углеводороды, также как и пропан, бутан, азот и углекислый газ.
Твердые носители включают измельченные природные минералы, такие как: каолин, глина, тальк, кварц, активированная глина, монтмориллонит или кизельгур, или измельченные синтетические минералы, такие как мелкодисперсная кремниевая кислота, оксид алюминия и силикаты. Твердым носителем, используемым для гранул, служат дробленый и отсортированный природный циркон, такие как кальцит, мрамор, пемза, сепиолит и доломит, а также гранулы, синтезированные из неорганического или органического крупного порошка, и органические материалы, такие как гранулы из опилок, скорлупы кокосового ореха, початков кукурузы, табака или стеблей и тому подобного.
Неионные или анионные эмульгаторы могут быть использованы как эмульгаторы и/или пенообразующие агенты. Примеры включают в себя: полиоксиэтилены - эфиры жирных кислот и полиоксиэтилены - эфиры жирных спиртов, таких как эфиры алкиларилполиэтиленгликоля, эфиры алкилсульфонатов, эфиры алкилсульфатов, эфиры арилсульфонатов и продуктов гидролиза альбумина. Дисперсионные вещества включают, к примеру, отходы лигнин-сульфита и метилцеллюлозу.
В препаратах можно использовать клей, такой как карбоксиметилцеллюлоза и природные или синтетических полимеры (например, гуммиарабик, поливиниловый спирт и поливинилацетат), в виде порошков, гранул или эмульсий. Также может быть использован краситель, например неорганический краситель (к примеру, оксид железа, оксид кобальта или берлинская лазурь), или органический краситель (такой как азокраситель или металлической фталоцианиновый краситель), а также микроэлементы, такие как соли железа, марганец, бор, медь, кобальт, алюминий и цинк и тому подобные.
Эти активные соединения по настоящему изобретению могут, вместе с другими активными веществами, изготавливаться в смеси современного коммерческого препарата или лекарственной формы, изготовленной из коммерческого препарата; вышеупомянутые другие активные вещества включают, но не ограничиваются ими: инсектициды, приманки, бактерициды, акарициды, нематоциды, фунгициды, регуляторы роста и тому подобные. Инсектициды включают, к примеру, фосфатные эфиры, карбаминовые эфиры, эфир пиретрума, хлорированные углеводороды, бензоилмочевину, нейротоксины и вещества, вырабатываемые микроорганизмами, такими как абамектин.
Кроме того, эти активные соединения по настоящему изобретению могут также, вместе с синергистом, быть в смеси современного коммерческого препарата или лекарственной формы, приготовленной из этих коммерческих препаратов. Синергистом является соединение, которое усиливает действие активных веществ; синергисты не обязательны, так как активные вещества активны по своей природе.
Как правило, препараты содержат 0,001 до 99,99 масс.% от веса активных соединений настоящего изобретения, предпочтительнее от 0,01 до 99,9 масс.%, более предпочтительно от 0,05 до 90 масс.%, по массе вышеупомянутого инсектицидного состава. Концентрация активных веществ в лекарственной форме, полученной из коммерческого препарата, может варьироваться в широких пределах. Концентрация активных веществ в лекарственной форме может быть между 0,0000001 до 100% (г/об), предпочтительно от 0,0001 до 1%.
Примеры
Изобретение будет проиллюстрировано ниже со ссылкой на следующие примеры. Следует понимать, что эти примеры лишь иллюстрируют настоящее изобретение, но не ограничивают объем изобретения. Экспериментальные способы без указания конкретных условий, описанные в следующих примерах, как правило, выполняются в обычных условиях или в соответствии с инструкцией производителя. Если не указано иное, проценты и части рассчитываются по массе. При этом "к.т." обозначает "при комнатной температуре".
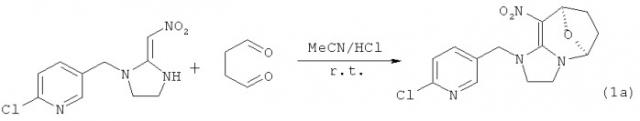
Пример 1: Синтез 9-((6-хлоропирид-3-ил)метил)-4-нитро-8-оксо-10,11-дигидроимидазо-[2,3-а]-бицикло-[3,2,1]-окт-3-ена (соединение 1а)
Смешанный раствор 2,5-диэтилтетрагидрофурана (2 г, 12,5 ммоль) и водный раствор соляной кислоты (0,1 М, 10 мл) нагревали до 90°С и проводили реакцию в течение одного часа, а затем охлаждали до комнатной температуры. В ходе реакции добавляли ацетонитрил (40 мл) и 2-хлор-5-(2-нитрометилен-имидазолидин-1-ил метил)-пиридин (2,54 г, 10 ммоль) и перемешивали систему при комнатной температуре. За реакцией следили при помощи тонкослойной хроматографии, а после завершения реакции, систему нейтрализовали насыщенным водным раствором бикарбоната натрия. Систему экстрагировали, растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (об./об.)) с получением бледно-желтого порошка. Выход: 53%; Т.пл. = 149,0-150,0°С, ЯМР (ЯМР - ядерно-магнитный резонанс) 1H (400 Мгц, ДМСО-d6): δ 8,35 (d, J=2,4 Гц, 1Н), 7,81 (dd, J1=2,4 Гц, J2=8,4 Гц, 1Н), 7,51 (d, J=8,4 Гц, 1Н), 5,36-5,39 (s, 2H), 5,00 (d, J=15,6 Гц, 1Н), 4,68 (d, J=15,6 Гц, 1Н), 3,57-3,73 (m, 4H), 1,94-2,04 (m, 4H) м.д., ЯМР 13С (100 Мгц, ДМСО-d6}: δ 155,6, 149,7, 149,6, 139,7, 132,6, 124,5, 109,6, 87,0, 75,1, 51,2, 50,3, 46,6, 31,9, 31,7 м.д.; расчетное значение в HRMS (High-resolution mass spectrometry - масс-спектрометрия высокого разрешения)(ES+): C14H16N4O3 35Cl (M+H)+, 323,0911; измеренное значение 323,0912. Расчетное значение: C14H16N14O3 37Cl (М+Н)+, 325,0811; измеренное значение 325,0895. Расчетное значение: C14H16N4O3 37Cl (M+H)+ 345,0730, вычисленное значение 345,0722. Расчетное значение: C14H15 N4O3 37ClNa (М+Na)+ 347,0701; вычисленное значение 347,0692.
Пример 2: синтез 9-((2-хлоротиазол-5-ил)метил)-4-нитро-8-оксо-10,11-дигидроимидазо-[2,3-а]-бицикло-[3,2,1]-окт-3-на (соединение 1b)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (V/V)) для получения твердого порошка светло-желтого цвета. Выход: 56%; Т.пл. = 136,5-138,0°С, ЯМР 1H (400 Мгц, ДМСО-d6); δ 7,47 (s, 1H), 5,61 (d, J=5,2 Гц, 1Н), 5,28 (d, J=15,4 Гц, 1H), 5,16 (d, J=5,00 Гц, 1H), 4,70 (d, J=15,4 Гц, 1H), 3,66-3,82 (m, 3H), 3,54-3,61 (m, 1H), 2,22-2,29 (m, 1H), 2,12-2,21 (m, 2H), 1,99-2,07 (m, 1H) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 154,6, 154,3, 140,6, 135,1, 110,4, 87,4, 75,4, 49,6, 47,9, 46,5, 31,8, 31,8 м.д.; расчетное значение в HRMS (ES+): C12H14N4O3S35Cl (M+H)+, 329,0475, вычисленное значение 329,0475. Расчетное значение: C12H14N4O3S37Cl (M+Н)+, 331,0446, вычисленное значение 331,0461.
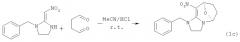
Пример 3: Синтез 9-бензил-4-нитро-8-оксо-10,11-дигидроимидазо-[2,3-а]-бицикло-[3,2,1]окт-3-ена (соединение 1с)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении, и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (V/V)) для получения твердого порошка светло-желтого цвета. Выход: 58%, т.пл. = 149,0-149,8°С, ЯМР 1H (400 Мгц, ДМСО-d6); δ 7,28-7,39 (m, 5H), 5,66 (d, J=4,3 Гц, 1H), 5,14 (d, J=4,5 Гц, 1H), 4,92-5,01 (m, 2H), 3,57-3,74 (m, 3H), 3,47-3,53 (m, 1H), 2,30-2,34 (m, 1H), 2,13-2,22 (m, 2H), 2,00-2,07 (m, 1H) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 155,5, 135,9, 128,9, 128,2, 128,1, 87,7, 75,6, 54,4, 48,9, 47,2, 31,8, 31,6 м.д.; расчетное значение в HRMS (ES+): C15H17N3O3 (М+H)+, 287,1270; вычисленное значение 287,1272.
Пример 4: синтез 9-(4-хлор-бензил)-4-нитро-8-оксо-10,11-дигидроимидазо-[2,3-а]-бицикло-[3,2,1]окт-3-ена (соединение 1d)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (V/V)) для получения твердого порошка светло-желтого цвета. Выход: 38%; Т.пл. = 140,0-140,9°С, ЯМР 1H (400 Мгц, ДМСО-d6); δ 7,27-7,34 (m, 4H), 5,63 (d, J=5,4 Гц, 1Н), 5,14 (d, J=5,2 Гц, 1Н), 5,04 (d, J=15,1 Гц, 1Н), 4,78 (d, J=15,1 Гц, 1Н), 3,62-3,73 (m, 3Н), 3.45-3.51 (m, 1Н), 2,26-2,31 (m, 1Н), 2,11-2,21 (m, 2H), 1,98-2,07 (m, 1Н) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 155,3, 134,4, 133,9, 129,6, 129,0, 110,2, 87,6, 75,5, 53,9, 49,2, 47,0, 31,8, 31,7 м.д.; расчетное значение в HRMS (ES+): C15H17N3O3 37Cl (M+H)+, 322,0958; вычисленное значение: 322,0972. Расчетное значение: C15H17N3O3 37Cl (М+Н)+, 324,0929; вычисленное значение 324,0938.
Пример 5: Синтез 9-((тетрагидрофуран-3-ил) метил)-4-нитро-8-оксо-10,11-дигидроимидазо-[2,3-а]-бицикло-[3,2,1]-окт-3-ена (соединение 1е)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (V/V)) для получения твердого порошка светло-желтого цвета. Выход: 57%. м = 126,3-127,9°С; 1Н-ЯМР (400 Mг, ДМСО-d6) δ 5,11 (s, 1Н), 5,00-5,03 (m, 1Н), 4,18 (d, J=3,2 Гц, 2H), 4,05-4,25 (m, 2H), 3,85-3,96 (m, 4H), 2,25 (m, 1Н), 1,66-1,81 (m, 4H), 2,35-2,40 (m, 1Н), 2,17-2,21 (m, 2H), 1,93-2,01 (m, 1Н) м.д.; ЯМР 13С (100 Мг, ДМСО-d6): δ 81,9, 81,6, 77,9, 68,2, 53,1, 49,9, 48,0, 44,1, 36,4, 33,9, 29,5, 23,2, 19,8 м.д., расчетное значение в HRMS (EI+): C13H19N3O4(М+), 281,1376; измеренное значение 281,1365.
Пример 6: Синтез 10-((6-хлоропирид-3-ил)метил)-4-нитро-9-оксо-11,12-дигидроимидазо-[2,3-а]-бицикло-[3,3,1]-нон-3-ена (соединение 2а)
1,27 г 2-хлор-5-(2-нитрометилен-имидазолидин-1-ил метил)-пиридина (0,005 моль), 30 мл безводного ацетонитрила, 3 мл водного 25% раствора глутарового альдегида и каталитического количества HCl помещали в 50 мл круглодонную колбу. Систему перемешивали при комнатной температуре. За реакцией следили при помощи тонкослойной хроматографии. После того как реакция была завершена, систему нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали. Растворитель удаляли при пониженном давлении, и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ ацетон = 3/1 (об/об)), для получения светло-желтого порошка. Выход: 76%; Т.пл. = 174,7-175,4°С, ЯМР 1H (400 Mг, ДМСО-d6): δ 8,38 (dd, J1=0,6 Гц, J2=2,4 Гц, 1Н), 7,84 (dd, J1=2,4 Гц, J2=8,4 Гц, 1Н), 7,52 (dd, J1=0,6 Гц, J2=8,4 Гц, 1Н), 5,12 (s, 1Н), 5,04-5,05 (m, 1Н), 4,97 (d, J=15,6 Гц, 1Н), 4,71 (d, J=15,6 Гц, 1Н), 3,62-3,74 (m, 4H), 1,66-1,81 (m, 4H), 1,51-1,55 (m, 1Н), 1,32-1,44 (m, 1Н) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 156,6, 149,7, 149,6, 139,7, 132,9, 124,5, 105,8, 81,7, 68,9, 51,7, 50,0, 46,3, 28,8, 27,2, 14,8 м.д.; расчетное значение в HRMS (EI+): C15H17N4O3 35Cl(M+), 336,0989; вычисленное значение 336,0988. Расчетное значение: C15H17N4O3 37Cl(M+), 338,0960; вычисленное значение 338,0968.
Пример 7: Синтез 10-((2-хлоротиазол-5-ил)метил)-4-нитро-9-оксо-11,12-дигидроимидазо-[2,3-а]-бицикло-[3,3,1]-нон-3-ена (соединение 2b)
Способ получения похож на способ, описанный выше. Растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон=3/1 (об/об)), для получения твердого порошка белого цвета. Выход: 62%; Т.пл. = 159,1-160,5°С, ЯМР 1H (400 Mг, ДМСО-d6): δ 7,48 (s, 1Н), 5.30 (d, J=3,2 Гц, 1Н), 5,24 (d, J=15,4 Гц, 1Н), 4,98 (s, 1Н), 4,78 (d, J=15,4 Гц, 1Н), 3,76-3,87 (m, 1Н), 3,60-3,71 (m, 3H), 2,12 (d, J=14,0 Гц, 1Н), 1,82-1,96 (m, 2H), 1,64-1,77 (m, 2H), 1,48-1,60 (m, 1Н) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 155,7, 154,1, 140,5, 135,6, 107,0, 82,7, 69,4, 49,4, 48,3, 46,2, 29,4, 26,5, 14,9 м.д.; расчетное значение в HRMS (EI+): C13H15N4O3S35Cl(M+), 342,0553; расчетное значение: 342,0548. Расчетное значение C13H15N4O3S37Cl(M+), 344,0524; вычисленное значение 344,0564.
Пример 8: Синтез 10-бензил-4-нитро-9-оксо-11,12-дигидроимидазо-[2,3-а]-бицикло-[3,3,1]-нон-3-ена (соединение 2с)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (об/об)) для получения твердого порошка светло-желтого цвета. Выход: 77%; Т.пл. = 180,5-181,2°С; 1H ЯМР (400 Mг, ДМСО-d6): δ 7,29-7,37 (m, 5H), 5,33 (d, J=3,1 Гц, 1Н), 5,02 (d, J=15,0 Гц, 1Н), 4,95 (s, 1Н), 4,85 (d, J=15,0 Гц, 1Н), 3,68-3,75 (m, 1Н), 3,48-3,64 (m, 3H), 2,14 (d, J=13,1 Гц, 1Н), 1,81-1,93 (m, 2H), 1,51-1,70 (m, 3H) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 156,6, 136,4, 128,8, 128,3, 128,0, 106,7, 83,0, 69,7, 54,8, 48,6, 46,7, 29,5, 26,5, 15,0 м.д.; расчетное значение в HRMS (EI+): C16H19N3O3(М+), 301,1426; вычисленное значение: 301,1429.
Пример 9: Синтез 10 - (4-хлорбензил)-4-нитро-9-оксо-11, 12-дигидроимидазо-[2,3-а]-бицикло-[3,3,1]-нон-3-ена (соединение 2d)
Способ подготовки похож на способ, описанный выше. Растворитель удаляли при пониженном давлении, и выполняли разделение колоночной хроматографией (элюент: дихлорметан/ацетон = 3/1 (об./об.)) для получения твердого порошка светло-желтого цвета. Выход: 70%; Т.пл. = 156,9-158,3°С, ЯМР 1H (400 Мгц, ДМСО-d6): δ 7,29-7,34 (m, 4H), 5,33 (d, J=4,0 Гц, 1Н), 5,05 (d, J=15,1 Гц, 1Н), 4,96 (s, 1Н), 4,75 (d, J=15,1 Гц, 1Н), 3,66-3,73 (m, 1Н), 3,55-3,60 (m, 3Н), 2,14 (d, J=13,6 Гц, 1Н), 1,82-1,95 (m, 2H), 1,51-1,71 (m, 3H) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 156,5, 134,9, 133,8, 129,7, 129,0, 106,8, 83,0, 69,6, 54,4, 48,9, 46,6, 29,6, 26,5, 15,0 м.д.; расчетное значение в HRMS (EI+): C16H18N3O3 35Cl(M+), 335,1037; вычисленное значение 335,1044. Расчетное значение: C16H18N3O3 37Cl(M+), 337,1007; вычисленное значение 337,1036.
Пример 10: Синтез 10-((тетрагидрофуран-3-ил) метил)-4-нитро-9-оксо-11,12-дигидроимидазо-[2,3-а]-бицикло-[3,3,1]-не-3-ена (соединение 2е)
1,065 г 1-((тетрагидрофуран-3-ил) метил)-2-(-нитрометилен)-1-имидазолина (0,005 моль), 3 мл 25% водного раствора глутарового альдегида и каталитического количества HCl помещали в 50-мл колбу. Систему перемешивали при комнатной температуре и контролировали реакцию при помощи ТСХ. После того, как реакцию завершали, растворитель удаляли и проводили разделение колоночной хроматографией с целью получения чистого продукта в виде порошка светло-желтого цвета. Выход составил 36%. Т.пл. = 115,3-116,9°С, ЯМР 1H (400 Мгц, ДМСО-d6): δ 5,11 (s, 1Н), 5,00-5,03 (m, 1Н), 4,18 (d, J=3,2 Гц, 2H), 4,05-4,25 (m, 2H), 3,85-3,96 (m, 4H), 2,25 (m, 1Н), 1,66-1,81 (м, 4H), 1,63-1,64 (m, 2H), 1,57-1,59 (m, 2H), 1,51-1,55 (m, 1Н), 1,32-1,44 (m, 1Н) м.д., ЯМР 13С (100 Mг, ДМСО-d6): δ 81,7, 80,6, 78,5, 68,9, 50,0, 49,7, 46,9, 44,6, 36,8, 33,9, 28,8, 27,2, 17,8, 14,8 м.д.; расчетное значение в HRMS (EI+): C14H21N3O4(M+), 295,1532; измеренное значение 295,1598.
Пример 11: Измерение инсектицидной активности соединений настоящего изобретения
(1) Инсектицидная активность против тлей
Тли, которые относятся к равнокрылым и имеют колюще-сосущий ротовой аппарат, являются основными вредителями сельскохозяйственных культур. Aphis craccivora использовали в качестве субъекта и для испытания использовали метод погружения.
Способ испытания: точно взвешивали каждый образец и добавляли 2 мл ДМСО (ДМСО - Диметилсульфоксид) и 18 мл воды соответственно, далее добавляли три капли эмульсии агента 200I, чтобы сделать тестовую жидкость; холостой контроль также получали путем добавления трех капель эмульсии агента 220I в 2 мл ДМСО и 18 мл воды. Широкие листья бобов, облепленные определенным количеством насекомых, погружали в тестируемую жидкость на три-пять секунд, затем доставали и высушивали на воздухе; насекомых перемещали в чистый контейнер вместе с кормом, а контейнер помещали в сухую, термостатируемую комнату. После 24 часов проверяли количество мертвых насекомых. Результаты показаны в таблице 1.
(2) Инсектицидная активность в отношении Nilaparvata lugens Nilaparvata lugens, которая относится к равнокрылым и имеет колюще-сосущий ротовой аппарат, является распространенным вредителем сельскохозяйственных культур. Nilaparvata lugens была использована в качестве субъекта, и для тестирования использовали описанный Нагатой метод микрокапельного измерения.
Порядок работы: в качестве испытуемых выбрали бесплодных крылатых самок двух-трех дней посл