Способ прогнозирования хронического течения вирусного гепатита в у детей с пищевой аллергией
Иллюстрации
Показать всеПредлагаемое изобретение относится к области медицины, а именно к исследованию физических и химических свойств биологических жидкостей, и может быть использовано для прогнозирования хронического течения вирусного гепатита В у детей с пищевой аллергией в острый период заболевания. Способ прогнозирования хронического течения вирусного гепатита В у детей с пищевой аллергией, включающий клинические и лабораторные исследования, в том числе биохимический анализ крови на содержание билирубина, ферментов и иммуноферментный анализ на маркеры гепатита В при поступлении больного в стационар. Сущность способа: радиоиммунным анализом в сыворотке крови определяют уровень HBs-антигенемии и показания гастрина, трипсина, общего IgE, кортизола и при уровне HBs-антигенемии выше 15000 р.им./мл, показаниях гастрина - выше 50,0 нг/мл, трипсина - выше 450,0 нг/мл, общего IgE - выше 400,0 МЕ/мл и кортизола - ниже 400,0 нг/мл прогнозируют хроническое течение заболевания. Изобретение, во-первых, обеспечивает получение прогноза хронического течения гепатита В на ранних сроках заболевания, что позволяет рекомендовать эффективные лечебные мероприятия и повысить частоту выздоровления данной категории детей; во-вторых, позволяет диагностировать функциональную активность органов верхнего отдела пищеварительной системы и своевременно проводить превентивные мероприятия развития ее патологии. 13 табл., 5 ил., 1 пр.
Реферат
Предлагаемое изобретение относится к области медицины, а именно к исследованию физических и химических свойств биологических жидкостей, и может быть использовано для прогнозирования хронического течения вирусного гепатита B у детей с пищевой аллергией в острый период заболевания.
Вирусные гепатиты у детей являются распространенными инфекционными заболеваниями. В настоящее время констатируется снижение заболеваемости острым гепатитом B (ГB) и увеличение частоты его хронического течения [Лобзин Ю.В., Скрипченко Н.В., Бехтерева М.К. и соавт. Проблемы детских инфекций на современном этапе. // Инфекц. бол. 2009. - Т.7. - №.2. - С.7-12.]. Прогнозирование хронического течения ГВ у заболевших является одной из актуальных задач практического здравоохранения, так как позволяет на ранних сроках болезни рекомендовать проведение эффективных лечебных мероприятий (противовирусную терапию) и снижать его частоту.
Общеизвестно, что состояние реактивности организма существенно влияет на течение инфекционного процесса. Данные литературы свидетельствуют о значительном влиянии на формирование неблагоприятных исходов ГB у детей их возраста, пола, хронических заболеваний родителей, патологии беременных и новорожденных, раннего искусственного вскармливания, перенесенных ребенком и сопутствующих гепатиту заболеваний, а также факторов загрязнения окружающей среды [Бондаренко А.Л. Клинико-биохимические особенности острого и затяжного гепатита В у подростков. // пид. и инфекц. бол. - 1998. - №1. - С.37-41].
По данным официальной статистики аллергия стала одной из актуальных медико-социальных проблем последнего десятилетия в связи с глобальной распространенностью и интенсивным ростом аллергической заболеваемости [Макарова И.В. Актуальные вопросы лечения и профилактики аллергических заболеваний. // Вопр. совр. педиатр. 2005. - Т. 4. - №.4. - С.33-36]. Наиболее тревожными являются данные о росте аллергических заболеваний у детей, среди которых лидирует пищевая аллергия - ПА [Балаболкин И.И., Терлецкая Р.Н., Дыбунова Е.Л. Влияние экологических факторов на аллергическую заболеваемость детского населения Российской Федерации. // Сиб. мед. обозрение. 2008. - №6. - С.64-67]. Удельный вес ПА среди больных атопией колеблется от 15% до 40% [Борисова И.В., Смирнова С.В. Пищевая аллергия у часто болеющих детей. // Вопр. дет. диетол. 2007. Т.5. №4. - С.11-14].
Аллергические болезни в настоящее время рассматриваются с позиций измененной иммунологической реактивности и существенно влияют на увеличение частоты формирования хронического гепатита B. [Наговицына Е.А. Клинико-лабораторные особенности хронического вирусного гепатита B у детей с аллергическими заболеваниями. Автор, дис. канд. мед. наук. - Пермь. - 2003. - 22 с.].
За прототип предлагаемого изобретения выбран известный способ прогнозирования хронического ГB, включающий анамнестические, клинические и лабораторные исследования, в том числе биохимический анализ крови на содержание билирубина, ферментов и маркерный спектр вируса ГB - HBV [Соринсон С.Н. Вирусные гепатиты в клинической практике. С.-Петербург. - 1996. - 306 с.].
Известный способ осуществляют следующим образом: у ребенка в сыворотке крови иммуноферментным анализом (ИФА) определяют маркеры вирусных гепатитов: ГA (анти-HAV IgM); ГB (HBsAg, HBeAg, анти-НВе, анти-НВс IgM и анти-НВс суммарные, анти-HBs); ГC (анти-HCV суммарные) и ГD (анти-HDV IgM, анти-HDV IgG) в острый период болезни с интервалом 10-14 дней (2-3 раза) и при каждом диспансерном осмотре ребенка в течение двенадцати месяцев. При положительных результатах маркеров ГB учитываются сроки (дни от начала заболевания) обнаружения HBeAg (30 дней от начала заболевания - третья неделя пребывания на лечении в стационаре) и HBsAg (более 3-х месяцев - через 2 месяца после выписки из стационара) в сыворотке крови, которые являются признанными критериями прогнозирования хронического течения болезни.
Однако известный способ позволяет прогнозировать хроническое течение ГB, в том числе у детей с ПА, лишь по результатам повторной динамической индикации маркеров HBV (HBeAg и HBsAg) в сыворотке крови. Он предусматривает решение вопроса через месяц от начала заболевания (к 30-му дню болезни - третья неделя пребывания ребенка на лечении в стационаре), то есть на поздних сроках заболевания - в период реконвалесценции. Таким образом, при способе прогнозирования хронического течения ГB по продолжительности обнаружения маркеров HBV (HBeAg и HBsAg) в сыворотке крови, взятом за прототип предлагаемого изобретения, откладываются мероприятия, позволяющие снижать его частоту не менее чем на месяц от начала заболевания.
Задачей предлагаемого изобретения является создание способа прогнозирования хронического течения ГВ на более ранних сроках заболевания - с поступления ребенка на лечение в стационар (вторая неделя болезни), что обеспечивает более раннее назначение эффективных лечебных мероприятий, снижающих частоту его формирования.
Поставленная задача решается тем, что в известном способе прогнозирования хронического течения вирусного гепатита B у детей с пищевой аллергией, включающем клинические и лабораторные исследования, в том числе биохимический анализ крови на содержание билирубина, ферментов и иммуноферментный анализ на маркеры гепатита B при поступлении больного в стационар, радиоиммунным анализом в сыворотке крови определяют уровень HBs-антигенемии и показания гастрина, трипсина, общего IgE, кортизола и при уровне HBs-антигенемии выше 15000 р.им./мл, показаниях гастрина - выше 50,0 нг/мл, трипсина - выше 450,0 нг/мл, общего IgE - выше 400,0 МЕ/мл и кортизола - ниже 400,0 нг/мл прогнозируют хроническое течение заболевания.
Предлагаемое изобретение отвечает критерию «новизна», так как в процессе патентно-информационных исследований не выявлены источники патентной и научно-технической информации, порочащие новизну предлагаемого способа.
Предлагаемое изобретение отвечает критерию изобретения «изобретательский уровень», так как в источниках литературы не обнаружены способы прогнозирования хронического течения ГВ у детей с ПА с существенными признаками предлагаемого изобретения.
Маркеры ГB - HAV (HBsAg; HBeAg; анти-НВс - суммарные и анти- НВс IgM) определяют диагностику заболевания, а их продолжительность у заболевшего - характер течения болезни [[Соринсон С.Н. Вирусные гепатиты в клинической практике. С.-Петербург. - 1996. - 306 с.; Малый В.П., Лядова Т.И., Лавелин С.Б. Особенности иммунного ответа у больных острым вирусным гепатитом В. // Международ, науч. - практ. конф. Сб. науч. тр. - Харьков. - 2005. - С.133.].
Показания гастрина и пепсиногена-I в последние годы предлагаются как доступные и хорошо информативные тесты серологической диагностики функциональной активности слизистых оболочек желудка и двенадцатиперстной кишки, прогнозирования гастродуоденальной патологии и выделения групп риска ее развития - «серологическая гастробиопсия» - для последующего более углубленного обследования с использованием эндоскопии [Маев И.В., Мельникова И.В., Крюкова Т.В. и др. Новые методы серологической и эндоскопической диагностики хронического атрофического гастрита и раннего рака желудка. // Клинические перспективы гастроэнтерологии, гепатологии. - 2009. №6. - С.30-34; Kikuchi R, Abe Y, Iijima K, et al. Low serum levels of pepsinogen and gastrin 17 are predictive of extensive gastric atrophy with high-risk of early gastric cancer. // Tohoku J Exp Med. - 2011. - Vol.223. - №1. - P.35-44]. Осуществление неинвазивной диагностики изменений слизистой оболочки желудка с целью отбора больных для последующего более углубленного обследования с использованием эндоскопии особую значимость имеет у детей при инфекционной патологии.
Гастрин (один из кишечных гормонов) является объектом многочисленных исследований в гастроэнтерологии, что определяется, в основном, его способностью вызывать стимуляцию секреции соляной кислоты и пепсина слизистой оболочкой желудка. Большинство работ по изучению гастрина в клинике посвящено его участию в нейрогуморальной регуляции функций желудка в норме и при патологии [Климов П.К. Пептиды и пищеварительная система. - Л. - Наука. - 1983. - 272 с.; Климов П.К., Барашкова Г.М. Физиология желудка. Механизмы регуляции. - Л.: Наука. - 1991. - 256 с; Dockray G., Dimaline R., Varro A. Gastrin: old hormone, new functions. //Pflugers Arch. - 2005. - Vol.449. - №4. - P.344-355.].
Небольшое число работ посвящено изучению гастрина в сыворотке крови при заболеваниях печени и желчевыводящих путей. Отмечен клинически значимый эффект усиления кровотока в печени у больных сахарным диабетом на введение синтетического аналога гастрина - пентагастрина [Геллер Л.И., Геллер А.Л., Петренко В.Ф. и др. Эффекты пентагастрина у больных сахарным диабетом. // Пробл. эндокрин. - 1989. - Т.XXXV. - №1. - С.29-32]. В работах отечественных авторов отрицается повышение показаний гастрина в сыворотке крови у больных хроническим гепатитом [Шубина М.Э. Изменение и роль некоторых регуляторных пептидов при хронических гепатитах и циррозе печени. //Автореферат канд. дис. Петрозаводск. - 1996. - 22 с.]. Зарубежные исследователи констатируют повышение уровня гастрина в сыворотке крови при хроническом течении гепатита B [Konturek S.J., Gonciarz M., Gonciarz Z. et al.
Progastrin and its products from patients with chronic viral hepatitis and liver cirrhosis. //Scand J. Gastroenterol. - 2003. - Vol.38. - №6. - P.643-647.].
Известно, что под влиянием гастрина происходит увеличение секреции воды и электролитов поджелудочной железой и печенью, возбуждается ферментообразование в поджелудочной железе. По данным литературы, у больных хроническим панкреатитом имеют место нарушения выделения гастрина в желудочный сок и кровь [Геллер Л.И., Пашко М.М. Гастрин и экзокринно-инкреторная активность поджелудочной железы у больных хроническим панкреатитом. // Тер. архив. - 1991. - Т.63. - №10. - С.73-75; Me. Donald J.M., Longnecker D.S., Bell R.H. Effect of hypergastrinemia on pancreatic carcinogenesis. // Am. J. Surg. - 2002. - Vol.183. - №4. - P.441-444.; Morisset J., Laine J., Biemat M. et al. What are the pancreatic target cells for gastrin and its CCKB receptor? Is this a couple for cancerous cells? // Med. Sci Monit. - 2004. - Vol.10. - №10. - P.242-246.]. Большое значение придается изменениям гуморальной регуляции поджелудочной железы, в том числе через гастрин, в формировании панкреатитов у детей [Римарчук Г.В. Современные аспекты диагностики хронического панкреатита у детей. // Рос. пед. жур. - 1998. - №1. - С.43-49.].
Единичные работы посвящены изучению содержания гастрина в сыворотке крови при инфекционных заболеваниях. Установлено, что при снижении содержания гастрина в сыворотке крови отмечается хроническое течение опистархозной инфекции [Зверева Л.И., Озерецковская Н.Н., Кортев А.И. и др. Уровень сыворочного иммуноглобулина Е и внутрисекреторная деятельность желудка, двенадцатиперстной кишки и поджелудочной железы после излечения от описторхоза. // Мед. паразитол. и паразитар, бол. - 1990. - №4. - С.32-33.].
У здоровых людей установлена прямая взаимосвязь показаний гастрина сыворотки крови с параметрами гуморального иммунитета [Вчерашняя Н.Н. Корреляционная взаимосвязь некоторых иммунологических параметров, уровня гастрина в крови и кислотообразующей функции желудка у больных язвенной болезнью. // Мин. Здрав. УССР. Чередеев А.П., Вчерашняя Ю.А., Гайдар Т.П. Иммуномодулирующие свойства гастрина. // Иммунология. - 1988. - №5. - С.33-35. Гастроэнтерология. - Респ. сб. «Здоровье». - Киев. - 1989. - С.29-32.].
Как было указано выше, гастрин стимулирует секрецию слизистой оболочкой желудка, кроме соляной кислоты, пепсина. Пепсин образуется из предшественника - пепсиногена. Пепсин обеспечивает гидролиз белковых веществ, особенно коллагена - основного компонента волокон соединительной ткани, оказывает створаживающее действие на казеин. Выделяют две группы пепсиногенов: пепсиноген-I (ПГ-I), включающий белковые фракции с пепсиногена 1 по пепсиноген 5, и пепсиноген-II (ПГ-II), включающий фракции пепсиногена 6 и пепсиногена 7.
Установлено, что повышение уровня пепсиногена-I в крови увеличивает риск развития дуоденальной язвы, в то время как увеличение концентрации пепсиногена-II повышает риск развития язвенной болезни желудка [Kikuchi R, Abe Y, Iijima K, et al. Low serum levels of pepsinogen and gastrin 17 are predictive of extensive gastric atrophy with high-risk of early gastric cancer. // Tohoku J, Exp Med. - 2011. - Vol.223. - №1. - P.: 35-44.; Song H.J., Jang S.J., Yun S.C., et al. Low Levels of Pepsinogen I and Pepsinogen I/II Ratio are Valuable Serologic Markers for Predicting Extensive Gastric Corpus Atrophy in Patients Undergoing Endoscopic Mucosectomy. // Gut Liver. - 2010. - Vol.4. - №4. - P.475-480.].
В доступной литературе авторы предлагаемого способа не отметили работ по изучению пепсиногенов, в том числе пепсиногена-I, при инфекционных заболеваниях.
Диагностика поражений поджелудочной железы, особенно на ранних стадиях, до настоящего времени остается трудной задачей. Исследования отечественных и зарубежных авторов убедительно свидетельствуют о возрастающей частоте хронического панкреатита. Отмечается, что в последние годы он значительно «помолодел». Раннее выявление изменений поджелудочной железы у детей и назначение патогенетически обоснованного лечения имеют медико-социальное значение для предупреждения развития хронического панкреатита [Муратходжаева А.В., Даукш И.А., Хакимова У.Р. Поражение поджелудочной железы при хронических заболеваниях желчевыводящей системы у детей. // Вопр. дет. диетол 2010. - Т.8. - №2. - С.79-80.; Пак А.Г., Степаненко В.М. Курортные и физические факторы в реабилитации детей, больных вторичным хроническим панкреатитом. // Вопр. дет. диетол 2010. - Т.8. - №2. - С.81.)
Для выявления заболевания поджелудочной железы, в основном, определяется активность амилазы мочи, амилазы и липазы сыворотки крови. Повышение показаний выше указанных тестов не всегда свидетельствует о поражении поджелудочной железы, так как существует их экстра - панкреатическая продукция. В то же время, зарубежные исследователи описали серию случаев острого воспаления поджелудочной железы - панкреатита - с нормальными показаниями липазы сыворотки крови [Shah A.M., Eddi R., Kothari S.T., et al. Maksoud C., DiGiacomo W.S., Baddoura W. Acute pancreatitis with normal serum lipase: a case series. // JOP. - 2010. - Vol.11. - №4. - P.369-372.].
Оптимальным маркером для выявления функциональной активности поджелудочной железы и ее патологии является уровень трипсина, ибо он специфичен для этого органа [Губергриц Н.Б., Моногарова Н.Е., Штода Л.А. и др. Диагностическое значение растворимых комплексов фибринмономеров при обострении хронического рецидивирующего панкреатита. // Клин. лаб. диагн. - 1993. №5. - С.54-56].
Трипсину - одному из главных ферментов поджелудочной железы - отводится роль стартера всей энтеропротеазной системы, изменяющей реологические свойства и свертывающую систему крови [Вискунов В.Г., Фещенко A.M., Проценко С.И. и др. Применение сандостатина при панкреонекрозе (Экспериментальное исследование). // Анналы хирург, гепатол. 2007. - Т.12. - №2. - С.52-56.]. Сообщается об ускорении процессов перекисного окисления липидов (ПОЛ) под влиянием трипсина как in vitro, так и in vivo, которое объясняется протеолитическим эффектом трипсина [Насыров Х.М., Кондратенко Р.М. К прооксидантному действию медиаторов воспаления. // Пат. физиол. и эксперимент, тер. - 1992. - №3. - С.12-14.].
Особо следует отметить данные литературы об активации вируса гриппа [Жирнов О.П. Расщепление гемагглютинина трипсином повышает инфекционность вируса гриппа для мышей. // Вопр. вирусол. - 1990. - Т.35. - №2. - С.117-119.] и ротавируса [Огурцов С.И., Духанин А.С. Роль мембранного этапа во взаимодействии кортизола с гепатоцитами. // Бюл. Эксперимент, биол. и мед. - 2002. - Т.133. - №6. - С.659-661.] при воздействии трипсином.
Общий IgE (реагины) является диагностическим тестом аллергии. Уровень его повышения в сыворотке крови соответствует выраженности аллергической реакции [Soderstrom L., Kober A., Ahlstedt S. et al. A further evaluation of the clinical use of specific IgE antibody testing in allergic diseases. // Allergy. - 2003. - Vol.58. - №9 - P.921-928.].
Зарубежные исследователи отметили прямую взаимосвязь показаний общего IgE и гистамина в сыворотке крови [Budde I.K., Aalberse R.C. Histamine-releasing factors, a heterogeneous group of different activities. // Clin. Exp.Allergy. - 2003. - Vol.33. - №9. - P.1175-1182.]. Констатируется обратная взаимосвязь уровней общего IgE и IgA в сыворотке крови [Субботина О.А., Балаболкин И.И., Аруин Л.И. и др. Селективный дефицит иммуноглобулина А у детей с пищевой аллергией. // Педиатрия. - 1996. - №2. - С.15-18.]. На наш взгляд, особо следует обратить внимание на работы зарубежных исследователей, установивших обратную взаимосвязь уровней общего IgE и гамма-интерферона в сыворотке крови [Martinez F.D., Stem D.A., Wright A.L. et al. Association of non-wheezing lower respiratory tract illnesses in early life with persistently diminished serum IgE levels. Group Health Medical Associates. // Thorax. - 1995. - Vol.50. - №10. - P.1067-1072.].
В зарубежной литературе сообщается о повышении показаний общего IgE в сыворотке крови при паразитарных заболеваниях [Femandez de Corres L., Audicana M., Del Pozo MD. et al. Anisakis simplex induces not only anisakiasis: report on 28 cases of allergy caused by this nematode. // J. Investig. Allergol. Clin. Immunol. - 1996. - Vol.6. - №5. - P.315-319.] и при инфекционных заболеваниях: аспиргиллезной инфекции [Kaukonen К., Savolainen J., Nermes M. et al. IgE antibody response against Aspergillus umbrosus in farmer's lung disease. // Int. Arch. Allergy Immunol. - 1997. - Vol.112. - №3. - P.313-316.], инфекции, вызванной вирусом Эпштейна-Барра [Kuwabara N., Kondo N., Fukutomi O. et al. Methylation patterns of I epsilon region in В cells stimulated with interleukin 4 and Epstein-Barr virus in patients with a high level of serum IgE. // Eur. J. Immunogenet. - 1995. - Vol.22. - №3. - P.265-275].
Кортизол - важнейший стрессорный гормон, обладающий широким спектром действия на клетки - мишени, в том числе противовоспалительным [Blazejova К., Nevsimalova S., Illnerova H. et al. Sleep disorders and the 24-hour profile of melatonin and cortisol. // Sb. Lek. - 2000. - Vol.101. - №4. - P.347-351.].
Измерение утреннего уровня кортизола в сыворотке крови позволяет оценить функциональную реактивность гипоталамо-гипофизарной надпочечниковой (ГГН) системы организма, в том числе в условиях патологического процесса [Никитин Д.А., Монахов К.Н., Соколовский Е.В. Особенности фоновой секреции кортизола у больных атопическим дерматитом. // Вест. дерматол. и венерол. - 2000. - №1. - С.22-24].
Обобщение результатов большого числа работ, посвященных изучению кортизола как гормона адаптации, позволило сделать вывод, что негативные моменты жизни и здоровья людей, в том числе детей, сопровождаются снижением его показаний в сыворотке крови, а моменты стрессовых ситуаций здорового организма - повышением содержания кортизола в сыворотке крови. Низкие уровни кортизола в сыворотке крови зарубежными исследователями отмечаются при неблагоприятных исходах менингококковой инфекции [Bone M., Diver M., Selby A. et al. Assessment of adrenal function in the initial phase of meningococcal disease. // Pediatrics. - 2002. - Vol.110. - №3. - P.563-569.], гнойных менингитах неуточненной этиологии [Riordan F.A., Thomson A.P., Ratcliffe J.M. et al. Admission cortisol and adrenocorticotrophic hormone levels in children with meningococcal disease: evidence of adrenal insufficiency? // Crit. Care. Med. - 1999. - Vol.27. - №10. - P.2257-2261.].
Приведенные данные свидетельствуют о том, что легкие, неосложненные, и острые формы инфекционных заболеваний при отсутствии отягощенности преморбитного состояния протекают, в основном, при повышенных показаниях кортизола в сыворотке крови. В то же время, тяжелые, осложненные, затяжные и хронические формы инфекционных болезней, сочетающиеся с атопией, сопровождаются снижением показаний кортизола в сыворотке крови.
Вышеприведенные данные литературы констатируют связь показаний гастрина, трипсина, общего IgE и кортизола сыворотки крови с характером течения инфекционного процесса, что позволило в сочетании с уровнем HBs-антигенемии. рассматривать их как прогностические критерии хронического течения ГВ у детей с ПА.
Предлагаемое изобретение позволяет получить следующий технический эффект. Предлагаемый способ, во-первых, обеспечивает получение прогноза хронического течения ГB на ранних сроках заболевания - с поступления ребенка на лечение в стационар (вторая неделя болезни), что позволяет на две - три недели раньше, чем в прототипе, рекомендовать эффективные лечебные мероприятия (противовирусную терапию) и повысить частоту выздоровления данной категории детей. Во-вторых, он позволяет диагностировать функциональную активность органов верхнего отдела пищеварительной системы и своевременно проводить превентивные мероприятия развития ее патологии (гастритов, гастродуоденитов, панкреатитов).
Авторами предлагаемого способа обследовано 70 детей в возрасте от 3-х до 15-и лет, заболевших ГB. Около половины из них были девочки (44,00%). Диагноз ГB ставился по стандарту на основании клинических и лабораторных данных, дополняясь результатами радиоизотопного анализа (РИА) на маркеры ГB. Оценивались форма болезни, характер ее течения, исходы и осложнения болезни. У всех детей констатирована желтушная (легкая) форма заболевания. Хроническое течение болезни наблюдалось в 7,14% случаях, что согласуется с данными литературы [Дмитриева Т.Г. Хронические вирусные гепатиты у детей Якутии. // Инфекц. бол. - 2009. - Т.7. - №2. - С.66-68].
Установлено, что только у детей с пищевой аллергией (ПА) и с факторами риска развития атопии (наследственность, отягощенная аллергическими заболеваниями или реакция организма на введение докорма и прикорма) отмечалось затяжное течение болезни (соответственно: 32,00% и 16,67%) и сформировался хронический гепатит (16,00% и 5,55%). У детей без аллергии, с наследственностью, не отягощенной аллергическими и другими заболеваниями, и без реакции организма на введение докорма и прикорма (III группа) во всех случаях отмечалось острое течение заболевания, что статистически значимо отличало их от детей с ПА - I группа (АР=32,00% и р=0,001; АР=16,00% и р=0,05).
Таким образом, по результатам аллергологического анамнеза (схема НИАЛ РАМЫ, модифицированная применительно к детскому возрасту НИИ педиатрии РАМН) больные ГB были разделены на три группы:
I - дети с пищевой аллергией (ПА);
II - дети с наследственностью, отягощенной аллергическими заболеваниями или реакцией организма на введение докорма и прикорма, а также их сочетанием (группа риска развития атопии);
III - дети без клинических проявлений аллергии, с наследственностью, не отягощенной аллергическими и другими соматическими заболеваниями, и без реакции организма на введение докорма и прикорма (контрольная группа).
Пищевая аллергия у детей (I группа) была документирована результатами обследования в соответствии со стандартами аллергологического стационара и кабинета последующих наблюдений до заболевания вирусными гепатитами, подкрепленными во всех случаях данными специфических IgE к пищевым аллергенам ИФА, реже - РИА (радиоаллергосорбентный тест - RAST), что соответствует Международной классификации (Стокгольм, 1994 г.). Согласно данным амбулаторной карты, у всех детей ПА была манифестирована кожными проявлениями (100%), сочетающимися с бронхиальной астмой в единичных случаях (1,23%). Всего таких детей, больных легкой формой ГB, было 25. Наиболее часто ПА у детей была диагностирована на употребление сладкого, яйца и молока, реже - рыбы. У всех детей отмечалась сенсибилизация одновременно к двум или трем пищевым продуктам.
Вторую группу составили 18 детей. Наследственность, отягощенную аллергическими заболеваниями, имел каждый третий ребенок (33,33%). У 2/3 детей этой группы (78,79%), со слов матерей, отмечалась реакция организма на введение докорма и прикорма: небольшая гиперемия кожи лица с шелушением, не зарегистрированная в амбулаторной карте ребенка, вероятно, в связи с ее кратковременностью и незначительностью проявления и не подтвержденная результатами обследования у аллерголога.
В третью группу вошли 27 детей.
Все наблюдаемые больные получали терапию в соответствии со стандартами (базисная терапия: диета и режим; витамины per os; спазмолитики, после нормализации окраски кала и мочи - желчегонные препараты). У всех детей с ПА из питания исключались продукты, обозначенные аллергологом в амбулаторной карте ребенка как причинно-значимые аллергены.
Выписка детей из стационара проводилась по стандарту (клиническое выздоровление, нормализация билирубина, снижение аланинаминотрансферазы - АлАТ до трех норм; снижение титра HBsAg, исчезновение HBeAg). Последующие наблюдения детей (диспансеризация) также проводились по стандарту: дети наблюдались двенадцать месяцев после выписки из стационара, последовательно через один месяц, а затем ежеквартально.
В работе были применены общепринятые клинические, лабораторные и дополнительные (иммунологические, аллергологические) методы исследования. Общепринятые клинические лабораторные методы исследования при вирусных гепатитах: общий анализ крови, общий анализ мочи - проводились в динамике заболевания 2-3 раза; биохимический анализ крови: билирубина и аланинаминотрансферазы (АлАТ), кроме того, в период реконвалесценции - 5 раз. Копрологическое исследование у всех детей выполнялось однократно с поступления ребенка в стационар. Определение глюкозы, амилазы крови и мочи проводились при поступлении ребенка в стационар по показаниям (абдоминальный болевой симптом, рвота), повторно - при повышенных показателях результата. Протромбиновый индекс определялся по тяжести состояния ребенка при поступлении в стационар, повторно - при повышенных результатах. Общий белок и белковые фракции определялись при поступлении в стационар.
Специфическая диагностика у всех больных основывалась на данных ИФА с тест-системами «Диагностические системы» (г. Нижний Новгород). Исследования сыворотки ИФА на маркеры вирусных гепатитов проводили по стандарту: ГA (анти-HAV IgM), ГB (HBsAg с определением титра, HBeAg, анти-НВе, анти-НВс IgM и анти-НВс суммарные, анти-HBs), ГC (анти-HCV суммарные) и ГD (анти-HDV IgM и анти-HDV IgG) в острый период болезни с интервалом 10-14 дней (2-3 раза) и при каждом диспансерном осмотре ребенка в течение двенадцати месяцев после выписки из стационара.
Дополнительные методы обследования у всех больных, начиная с аллергологического анамнеза, предусматривали, прежде всего, дублирование специфической диагностики ИФА данными радиоиммунного анализа - РИА с тест-системами «РАДИОПРЕПАРАТ» (АН Узбекистана). Результаты РИА на маркеры HBV включали количественное определение: HBsAg, анти-НВс (суммарные) и анти-HBs (суммарные) в острый период болезни (вторая неделя заболевания) и при каждом диспансерном осмотре ребенка в течение двенадцати месяцев после выписки из стационара.
Кроме того, у половины больных (33 ребенка) были выполнены РИА по определению в сыворотке крови показаний утреннего уровня гастрина, пепсиногена-I, трипсина, кортизола и общего IgE. Данные исследования проводились в радиоизотопной лаборатории при Нижегородской областной больнице имени Н.А. Семашко (г. Н. Новгород). Для определения показаний гастрина и трипсина в сыворотке крови были использованы стандартные наборы GASK фирмы ORIS INDUSTRIE (Франция); пепсиногена-I - SORIN BIOMEDICA (Германия); общего IgE - Pharmacia Diagnostics (Швейцария). Определение кортизола в сыворотке крови проводилось с использованием стандартных наборов ГНУ «Институт биоорганической химии Национальной академии наук Беларуси». Исследования выполнялись по методу L. Wide (бумажный радиоиммуносорбентный тест - БРИСТ). Определение показаний гастрина, трипсина, пепсиногена-I и общего IgE по РИА в сыворотке крови проводили в острый период болезни и через 1, 3 месяца после выписки из стационара; определение показаний кортизола - однократно, в острый период болезни.
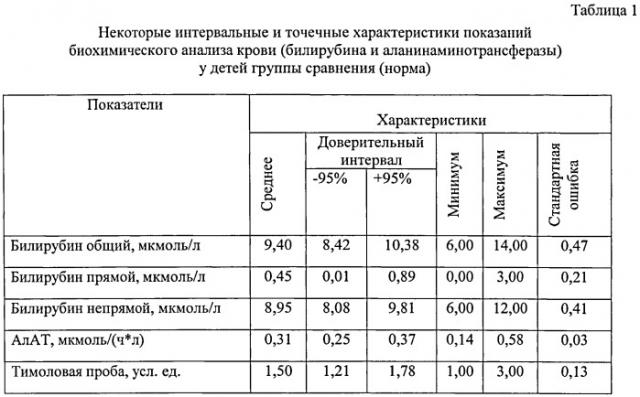
Аналогичное обследование, включая общепринятое при вирусных гепатитах, было проведено у 15-и детей, отобранных из 126-и здоровых детей в возрасте от 3-х до 15-и лет по данным аллергологического анамнеза. Они составили группу сравнения (норму). В таблице 1 приведены показания биохимического анализа крови (билирубина и аланинаминотрансферазы) у детей группы сравнения при отрицательных результатах маркерного спектра к вирусным гепатитам. В таблице 2 представлены данные РИА: некоторые интервальные и точечные характеристики показаний трипсина, гастрина, пепсиногена-I, общего IgE и кортизола сыворотки крови у детей группы сравнения (норма).
Все группы детей были идентичны по полу и возрасту.
Результаты исследования обработаны на компьютере с использованием пакета программ «Statistika 6.0», применен анализ дискриминантных функций, точный метод Фишера (ТМФ). В представлении параметров изучаемых показателей использованы общепринятые интервальные и точечные характеристики описательной статистики: среднее (М), доверительный интервал (ДИ), стандартная ошибка среднего (m). Выполнено определение относительного (ОР) и атрибутивного риска (АР) изучаемого явления в сравниваемых группах. Различия считались статистически значимыми при р=<0,05, что принято в медицине.
В таблице 3 приведены данные РИА: некоторые интервальные и точечные характеристики показаний маркеров HBV у наблюдаемых групп детей с ПА (I группа), с факторами риска развития атопии (II группа) и у детей контрольной группы - III группа.
Как видно из таблицы 4, согласно результатам анализа дискриминантных функций, по показаниям изучаемых переменных установлены статистически значимые различия сравниваемых групп больных (р<0,0000). Значимые различия групп, прежде всего, отмечены по показаниям HBs-антигенемии (р=0,000000). Согласно таблицы 5, из двух дискриминантных функций между тремя сравниваемыми группами больных обе были статистически значимы: первая (р=0,000000) и вторая (р=0,028669). Как видно из таблицы 6, наибольшее значение первой дискриминантной функции (корень) было по показаниям HBs-антигенемии (-1,04042), а второй дискриминантной функции - по показаниям анти-НВс - суммарных (0,673841). Согласно таблицы 7, наибольшее значение первой дискриминантной функции (корень) было у больных I-й группы (-0,987463), а второй дискриминантной функции (корень) - у больных II-й группы (-0,548068). Итак, из общей совокупности больных первая дискриминантная функция по уровню HBs-антигенемии отделила больных I-й группы, а вторая дискриминантная функция по уровню анти-НВс (суммарных) отделила больных II-й группы (Фиг.1). Согласно таблицы 8, по изучаемым переменным констатирована удовлетворительная значимость математического прогноза отличий больных с ПА (I группа) от больных с факторами риска развития атопии (II группа) и от больных III группы - контрольной (64,28%).
На фиг.2, представлены некоторые характеристики показаний HBs-антигенемии сыворотки крови у наблюдаемых групп больных ГВ: у больных с ПА констатированы их наивысшие показания. Таким образом, установлено статистически значимые отличия больных с ПА (I группа) от больных группы риска развития атопии (II группа) и контрольной группы (III группа) по показаниям HBs-антигенемии острого периода ГВ.
Изучены характеристики показаний HBs-антигенемии у детей с ПА в острый период ГB при затяжном течении болезни с переходом в хронический гепатит. Сравнив уровни HBs-антигенемии (средние значения) у больных с ПА (I группа) в зависимости от исхода заболевания с уровнем HBs-антигенемии (средним значением) у больных III-й группы - контрольной (10000 р.им./мл), которые во всех случаях имели острое течение заболевания, мы констатировали, что их наибольшее соотношение в I-й группе отмечалось при затяжном течении болезни с переходом в хронический гепатит (1,5), а наименьшие - при гепатомегалии и выздоровлении (соответственно: 1,3 и 1,2). Следовательно, уровень HBs-антигенемии - 15000 р.им./мл в острый период ГB у детей с ПА может быть рекомендован как критерий прогноза затяжного течения заболевания с переходом в хронический гепатит.
На фиг.3 представлены маркеры HBV (НВе-антигенемии и HBs-антигенемии) при ГB в динамике наблюдения по группам, отличающие детей с ПА (I группа) от контрольной группы и характеризующие течение болезни у данной категории больных.
Как видно на фиг.3 (А), при выписке из стационара HBs-антигенемия имела место у подавляющего большинства детей во всех наблюдаемых группах (соответственно: 92,00%; 88,89% и 85,18%) без статистически значимых различий (ОР=1,0-1,1; АР=3,11-6,82%; р=0,37-0,56). Через 1 и 3 месяца после выписки из стационара HBs-антигенемия определялась почти у половины детей с ПА (I группа), то есть у 10-й из 25-и детей (40,00%). В дальнейшем (через 6 месяцев после выписки из стационара) HBs-антигенемия определялась у каждого третьего ребенка с ПА - I группа (28,00%), через 9 и 12 месяцев после выписки из стационара она сохранилась у 16,00% детей этой группы. В тоже время, через месяц после выписки из стационара она имела место у 4-х из 27-и детей (14,81%) III-й группы, а через 3 месяца после выписки из стационара HBs-антигенемия сохранилась лишь у двух детей этой группы (7,41%). Через 6 месяцев после выписки из стационара она имела место у 1-го ребенка из 27-и детей (3,70%) III-й группы, в дальнейшем (через 9 и 12 месяцев после выписки из стационара) HBs-антигенемия у детей этой группы не регистрировалась. Таким образом, после выписки из стационара (через месяц) у детей I-й группы появились статистически значимые отличия частоты HBs-антигенемии от детей III-й группы. Их отличия сохранились через 3, 6, 9 и 12 месяцев после выписки из стационара (ОР=2,7-7,6; AP=16,00%-32,59%; р=0,006-0,05). Дети II-й группы по частоте HBs-антигенемии после выписки из стационара занимали промежуточное положение между детьми I-й и III-й групп и не имели с ними статистически значимых различий (ОР=1,2-2,5; АР=6,67-16,69%; р=0,17-0,56). Через 1 и 3 месяца после выписки из стационара HBs-антигенемия имела место у каждого третьего ребенка II-й группы (соответственно: 33,33% и 27,78%), через 6 месяцев - у 2-х детей (11,11%), а через 9 и 12 месяцев она сохранилась у 1-го из 18-и детей (5,55%).
Как видно на фиг.3 (Б), при выписке из стационара НВе-антигенемия у детей первых двух групп (соответственно: 36,00% и 33,33%) отмечалась статистически значимо чаще, чем у детей III-й группы - контрольной (7,41%), ОР=4,5-4,8; АР=25,92-28,59%; р=0,01-0,03. После выписки из стационара статистически значимые различия частоты НВе-антигенемии отмечались лишь у детей I-й и III-й группы однократно - через месяц после выписки из стационара (АР=20,00%; р=0,02). Она отмечалась у каждого пятого ребенка с ПА (I группа), то есть у 5-и из 25-и детей (20,00%) и не регистрировалась в III-й группе. В дальнейшем (через 3 месяца после выписки из стационара) НВе-антигенемии сохранилась у 2-х детей (8,00%), а через 6 месяцев - у 1-го ребенка I-й группы (4,00%). Через 9 и 12 месяцев после выписки из стационара у детей с ПА (I группа) она не определялась. Дети II-й группы по частоте обнаружения НВе-антигенемии после выписки из стационара, не имея статистически значимых различий с детьми I-й и III-й групп, занимали между ними промежуточное положение (ОР=1,2-1,4; АР=1,55-3,33%; р=0,40-0,64). Через 1 месяц после выписки из стационара НВе-антигенемия сыворотки крови определялась у 3-х из 18-и детей II-й группы (16,67%). В дальнейшем (через 3 и 6 месяцев после выписки из стационара) она сохранилась у 1-го ребенка (5,55%). Через 9 и 12 месяцев НВе-антигенемия у детей II-й группы не определялась.
Изучены серологические тесты функциональной активности поджелудочной железы (трипсина), слизистых оболочек желудка и двенадцатиперстной кишки (гастрина и пепсиногена-I), уровни общего IgE и кортизола сыворотки крови у детей в острый период ГB; установлена их связь с клиническими и лабораторными проявлениями болезни, включая маркеры HBV, характеризующие затяжное и хроническое течение заболевания.
В таблице 10 приведены данные РИА: некоторые интервальные и точечные характеристики показаний трипсина, гастрина, пепсиногена-I, общего IgE и кортизола в сыворотке крови у наблюдаемых групп больных ГB в острый период болезни. Как видно из таблицы, у больных с ПА - I группа - отмечались наивысшие средние значения трипсина, общего IgE (соответственно: 370,36 нг/мл и 318,57 МЕ/мл) и наименьший уровень кортизола в сыворотке крови (418,10 нмл). Уровень кортизола у больных с ПА (418,10 нг/мл) был ниже нормы (617,96 нг/мл), а уровень трипсина (370,36 нг/мл) превышал норму (35,59 нг/мл) в десять раз. Уровень общего IgE у больных с ПА (318,57 МЕ/мл) был выше нормы (39,47 МЕ/мл) в восемь раз, а уровень гастрина (40,81 нг/мл) превышал норму (30,00 нг/мл) в полтора раза.
Согласно результатам анализа дискриминантных функций, по показаниям вышеуказанных переменных констатированы статистически значимые различия сравниваемых групп больных (р<0,0003). Первой (ранговой) переменной различия наблюдаемых групп больных были показания кортизола (р=0,000004), второй - показания трипсина (р=0,450659), третьей - показания гастрина (0,581686), четвертой - показания общего IgE (0,905611), пятой (последней) - показания пепсиногена-I (0,986131), Таблица 11.
Из двух дискриминантных функций между тремя сравниваемыми группами лишь одна - первая - была статистически значимой (р=0,000294). Таблица 12.
Как видно из таблицы 13, наибольшее значение первой дискриминантной функции (корень) было у больных III-й группы - контрольной (-2,28856). Следовательно, из общей совокупности больных первая дискриминантная функция по показаниям вышеуказанных переменных, прежде всего, по показаниям кортизола и трипсина в сыворотке крови отделила больных III-й группы (фиг.4). По показаниям изучаемых переменных констатирована хорошая значимость математического прогноза отличий больных III-й группы (контрольной) от первых двух групп (66,67%), Таблица 14. Итак, больные с ПА (I группа) и группы риска развития атопии (II группа) по пока