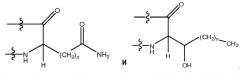
Миметики аполипопротеина а-i
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению пептида, являющегося миметиком ApoA-I, и может быть использовано в медицине. Указанный пептид характеризуется последовательностью Lys-Leu-Lys-Gln-Lys-Leu-Ala-Glu-Leu-Leu-Glu-Asn-Leu-Leu-Glu-Arg-Phe-Leu-Asp-Leu-Val-Inp (SEQ ID NO: 16). Изобретение также относится к пептид/липидному комплексу на основе вышеуказанного пептида, в котором фосфолипид представляет собой один или более из сфингомиелина, DPPC и DPPG, фармацевтической композиции, его включающей, и способам лечения дислипидемии, сердечно-сосудистого заболевания, эндотелиальной дисфункции, макрососудистых расстройств и микрососудистых расстройств с его использованием. Изобретение позволяет получить миметик ApoA-I более стабильный по сравнению с ApoA-I и простой в получении. 8 н. и 6 з.п. ф-лы, 21 ил., 14 табл., 24 пр.
Реферат
Перекрестная ссылка на родственные заявки
В настоящей заявке заявлен приоритет, соответствующий дате приоритета по предварительным заявкам США с серийными № 61/152962, поданной 16 февраля 2009, 61/152966, поданной 16 февраля 2009, и 61/152960, поданной 16 февраля 2009, полное содержание которых включено в настоящее описание в виде ссылки.
Область изобретения
Настоящее изобретение связано с пептидами, содержащими их композициями и способами лечения или предупреждение дислипидемии, сердечно-сосудистого заболевания, эндотелиальной дисфункции, макрососудистого расстройства или микрососудистого расстройства.
Предшествующий уровень техники
Холестерин, циркулирующий в организме человека, переносится липопротеинами плазмы, которые являются частицами комплексной липидной и белковой композиции, которые осуществляют транспорт липидов в крови. Двумя типами липопротеинов плазмы, которые переносят холестерин, являются липопротеины низкой плотности ("ЛПНП") и липопротеины высокой плотности ("ЛПВП"). Считается, что ЛПНП ответственны за доставку холестерина из печени (где он синтезируется или куда доставляется из пищевых источников) к тканям организма, находящимся вне пределов печени. С другой стороны, считается, что ЛПВП способствуют транспорту холестерина из внепеченочных тканей в печень, где холестерин катаболизируется и подвергается элиминации. Такой транспорт холестерина из внепеченочных тканей в печень называется "обратным транспортом холестерина".
Путь обратного транспорта холестерина ("RCT") имеет три основных стадии: (i) выход холестерина, то есть первоначальное удаление холестерина из различных пулов периферических клеток; (ii) этерификацию холестерина под действием лецитин-холестерин-ацилтрансферазы ("LCAT"), таким образом предотвращающую обратный вход вышедшего холестерина в клетку; и (iii) поглощение сложного эфира холестерина липопротеином высокой плотности и доставку комплекса сложного эфира холестерина с ЛПВП к клеткам печени.
Путь RCT опосредован частицами ЛПВП. Каждая частица ЛПВП имеет липидный компонент и белковый компонент. Липидный компонент ЛПВП может быть фосфолипидом, холестерином (или сложным эфиром холестерина) или триглицеридом. Белковый компонент ЛПВП первоначально состоит из ApoA-I. ApoA-I синтезируется печенью и тонким кишечником в виде пре-про-аполипопротеина, который секретируется в виде про-протеина, который быстро расщепляется с получением зрелого полипептида, имеющего 243 аминокислотных остатка. ApoA-I первоначально состоит из 6-8 различных повторяющихся элементов, состоящих из 22 аминокислотных остатков, пространственно разделенных линкерным фрагментом, которым часто служит пролин, а в некоторых случаях он образован несколькими остатками. ApoA-I образует три типа стабильных комплексов с липидами: малые, обедненные липидами комплексы, так называемые ЛПВП пре-β-1; уплощенные дискообразные частицы, содержащие полярные липиды (фосфолипид и холестерин), так называемые ЛПВП пре-β-2; и сферические частицы, содержащие как полярные, так и неполярные липиды, так называемые сферические или зрелые ЛПВП (ЛПВП3 и ЛПВП2).
Были сделаны попытки рекомбинантного продуцирования и введения ApoA-I пациентам с целью защиты от атеросклеротического заболевания. Однако с продуцированием и применением ApoA-I связано множество трудностей, что делает его менее чем идеальным в качестве лекарственного средства; например, ApoA-I является крупным белком, который трудно и дорого производить, и надо будет обойти значительные трудности, связанные с проблемами производства и воспроизведения, в том, что касается стабильности в процессе хранения, доставки активного продукта и времени полужизни in vivo.
С учетом указанных недостатков, были сделаны попытки получения пептидов, которые имитируют активность ApoA-I in vivo. В данной области есть потребность в разработке дополнительных пептидов, которые могли бы имитировать активность ApoA-I in vivo, продукция которых была бы простой и оправданной в отношении расходов.
Краткое описание изобретения
В одном из воплощений настоящее изобретение связано с пептидами, содержащими от 22 до 29 остатков, имеющими формулу I:
R1-Y1-X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20-X21-X22-X23-Y2-R2
Формула I
и их фармацевтически приемлемыми солями, в которых
X1 отсутствует или является ахиральным, D- или L-основным аминокислотным остатком;
X2 является ахиральным, D- или L-алифатическим аминокислотным остатком;
X3 является ахиральным, D- или L-алифатическим аминокислотным остатком;
X4 является ахиральным, D- или L-основным аминокислотным остатком;
X5 представляет собой Gln, Asn, D-Gln, D-Asn или основный ахиральный аминокислотный остаток, D- или L-основный аминокислотный остаток;
X6 является ахиральным, D- или L-основным аминокислотным остатком;
X7 является ахиральным, D- или L-гидрофобным аминокислотным остатком;
X8 является ахиральным, D- или L-гидрофобным аминокислотным остатком;
X9 является ахиральным, D- или L-гидрофобным аминокислотным остатком;
X10 представляет собой Leu, Trp, Gly, Nal, D-Leu, D-Trp или D-Nal;
X11 представляет собой Gly или ахиральный, D- или L-алифатический аминокислотный остаток;
X12 является ахиральным, D- или L-гидрофильным аминокислотным остатком;
X13 является ахиральным, D- или L-гидрофильным аминокислотным остатком;
X14 представляет собой Leu, Trp, Gly, D-Leu или D-Trp;
X15 представляет собой Leu, Gly или D-Leu;
X16 является ахиральным, D- или L-кислым аминокислотным остатком;
X17 является ахиральным, D- или L-гидрофильным аминокислотным остатком;
X18 представляет собой Leu, Phe, D-Leu или D-Phe;
X19 представляет собой Leu, Phe, D-Leu или D-Phe;
X20 является ахиральным, D- или L-кислым аминокислотным остатком;
X21 представляет собой Leu, Phe, D-Leu или D-Phe;
X22 является ахиральным, D- или L-алифатическим аминокислотным остатком; и
X23 представляет собой Inp, Nip, azPro, Pip, azPip, D-Nip или D-Pip;
Y1 отсутствует или является аминокислотной последовательностью, содержащей от 1 до 7 остатков;
Y2 отсутствует или является аминокислотной последовательностью, содержащей от 1 до 7 остатков;
R1 представляет собой H или аминозащитную группу;
R2 представляет собой OH или карбоксильную защитную группу; при этом
a) каждый хиральный аминокислотный остаток является L-аминокислотным остатком;
b) каждый хиральный аминокислотный остаток является D- аминокислотным остатком;
c) каждый хиральный аминокислотный остаток является L-аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является D-аминокислотным остатком; или
d) каждый хиральный аминокислотный остаток является D- аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является L-аминокислотным остатком.
В другом воплощении настоящее изобретение связано с пептидами, содержащими от 15 до 22 остатков, имеющими следующую формулу II:
R1-Y1-X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-Y2-R2
Формула II
и их фармацевтически приемлемыми солями, в которых
X1 является ахиральным, D- или L-основным аминокислотным остатком;
X2 представляет собой Leu или D-Leu;
X3 является ахиральным, D- или L-основным аминокислотным остатком;
X4 представляет собой Gln, Asn, D-Gln или D-Asn;
X5 представляет собой Leu, D-Leu или ахиральный, D- или L-основный аминокислотный остаток;
X6 представляет собой Leu, Trp, Phe, D-Leu, D-Trp или D-Phe;
X7 является ахиральным, D- или L-кислым аминокислотным остатком;
X8 представляет собой Asn, D-Asn или является ахиральным, D-или L-кислым аминокислотным остатком;
X9 представляет собой Leu, Trp, D-Leu или D-Trp;
X10 представляет собой Leu, Trp, D-Leu или D-Trp;
X11 представляет собой ахиральный, D- или L-кислый аминокислотный остаток;
X12 является ахиральным, D- или L-основным аминокислотным остатком;
X13 представляет собой Leu, Phe, D-Leu или D-Phe;
X14 представляет собой Leu, Phe, D-Leu или D-Phe;
X15 является ахиральным, D- или L-кислым аминокислотным остатком;
X16 представляет собой Leu или D-Leu;
X17 является ахиральным, D- или L-алифатическим аминокислотным остатком;
X18 представляет собой Inp, Nip, azPro, Pip, azPip, D-Nip или D-Pip;
Y1 отсутствует или является аминокислотной последовательностью, содержащей от 1 до 4 остатков;
Y2 отсутствует;
R1 представляет собой H или аминозащитную группу;
R2 представляет собой OH или карбоксильную защитную группу;
причем от нуля до трех остатков от X1 до X17 отсутствуют; и при этом
a) каждый хиральный аминокислотный остаток является L-аминокислотным остатком;
b) каждый хиральный аминокислотный остаток является D- аминокислотным остатком;
c) каждый хиральный аминокислотный остаток является L-аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является D-аминокислотным остатком; или
d) каждый хиральный аминокислотный остаток является D-аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является L-аминокислотным остатком.
В другом воплощении настоящее изобретение связано с пептидами, содержащими от 22 до 29 остатков, имеющими формулу III:
R1-Y1-X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19-X20-X21-X22-X23-Y2-R2
Формула III
и их фармацевтически приемлемыми солями, в которых
X1 отсутствует или является ахиральным, D- или L-основным аминокислотным остатком;
X2 является ахиральным, D- или L-основным аминокислотным остатком;
X3 представляет собой Leu или D-Leu;
X4 является ахиральным, D- или L-основным аминокислотным остатком;
X5 является ахиральным, D- или L-основным аминокислотным остатком;
X6 представляет собой Gln, Asn, D-Gln или D-Asn;
X7 представляет собой Leu или D-Leu;
X8 представляет собой Ala или D-Ala;
X9 представляет собой Asp или D-Asp;
X10 представляет собой Leu, Phe, Gly, D-Leu или D-Phe;
X11 представляет собой Gly, Leu или D-Leu;
X12 представляет собой Arg или D-Arg;
X13 является ахиральным, D- или L-кислым аминокислотным остатком;
X14 представляет собой Leu, Trp, Gly, D-Leu или D-Trp;
X15 представляет собой Leu или D-Leu;
X16 представляет собой Gln или D-Gln;
X17 представляет собой Glu, Leu, D-Glu или D-Leu;
X18 представляет собой Leu, Phe, D-Leu или D-Phe;
X19 является ахиральным, D- или L-алифатическим аминокислотным остатком;
X20 представляет собой Glu или D-Glu;
X21 представляет собой Leu, Phe, D-Leu или D-Phe;
X22 является ахиральным, D- или L-алифатическим аминокислотным остатком;
X23 представляет собой Inp, Nip, azPro, Pip, azPip, D-Nip или D-Pip;
Y1 отсутствует или является аминокислотной последовательностью, содержащей от 1 до 7 остатков;
Y2 отсутствует или является аминокислотной последовательностью, содержащей от 1 до 7 остатков;
R1 представляет собой H или аминозащитную группу;
R2 представляет собой OH или карбоксильную защитную группу; при этом
a) каждый хиральный аминокислотный остаток является L-аминокислотным остатком;
b) каждый хиральный аминокислотный остаток является D-аминокислотным остатком;
c) каждый хиральный аминокислотный остаток является L-аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является D-аминокислотным остатком; или
d) каждый хиральный аминокислотный остаток является D-аминокислотным остатком, за исключением того, что один или более из каждых хиральных концевых аминокислотных остатков и каждых хиральных аминокислотных остатков, непосредственно к ним примыкающих, является L-аминокислотным остатком.
Пептид формулы I, II или III, или его фармацевтически приемлемая соль ("миметик ApoA-I") применимы для лечения или предупреждения дислипидемии, сердечно-сосудистого заболевания, эндотелиальной дисфункции, макрососудистого расстройства или микрососудистого расстройства (каждое из которых является "Состоянием").
В другом воплощении настоящее изобретение связано с композициями, содержащими эффективное количество миметика ApoA-I и фармацевтически приемлемый носитель или наполнитель.
В другом воплощении настоящее изобретение связано со способами лечения или предупреждения состояния, предусматривающими введение в случае необходимости эффективного количества миметика ApoA-I млекопитающему.
Краткое описание графического материала
Фиг.1A представляет собой диаграмму Шиффера и Эдмундсона «helical wheel» (диаграмма «Спиральные колеса») идеализированной амфипатической α-спирали, в которой полыми кружочками обозначены гидрофильные аминокислотные остатки, а заполненными кружочками обозначены гидрофобные аминокислотные остатки.
Фиг.1В представляет собой схему-диаграмму спиральной сетки («helical net») идеализированной амфипатической спирали, изображенной на фиг.1A.
Фиг.1С представляет собой цилиндрическую диаграмму амфипатической спирали, изображенной на фиг.1A.
Фиг.2 представляет собой диаграмму Шиффера и Эдмундсона «helical wheel» 22-мерного консенсусного пептида Сегреста (SEQ ID NO:1).
На фиг.3A проиллюстрирована разветвленная сеть миметиков ApoA-I третьего порядка.
На фиг.3B проиллюстрирована разветвленная сеть миметиков ApoA-I четвертого порядка.
На фиг.3C проиллюстрирована разветвленная сеть миметиков ApoA-I смешанного порядка.
На фиг.3D проиллюстрированы примеры разветвленных сетей "Lys-tree" миметиков ApoA-I.
Фиг.4A представляет собой динамическое изображение различных состояний агрегации и пептид-липидных комплексов, которые могут быть получены с помощью миметиков ApoA-I согласно изобретению. Слева: процесс мультимеризации пептидов, происходящий в результате взаимодействия нескольких пептидных спиралей и ведущий к образованию олигомеров в условиях с определенной концентрацией пептида, значениями pH и ионной силы. В центре: взаимодействие миметиков ApoA-I (в любом из указанных состояний агрегации) с липидными компонентами (например, малыми униламеллярными везикулами ("SUV", small unilamellar vesicles)) приводит к реорганизации липидов. Справа: путем изменения липид-пептидного молярного отношения можно получить различные типы пептид-липидных комплексов, от липид-пептидных комицелл при низких липид-пептидных соотношениях до дискообразных частиц и, наконец, до крупных мультиламеллярных комплексов при все более возрастающих липид-пептидных соотношениях.
На фиг.4B проиллюстрирована общепринятая модель дискообразных комплексов миметик ApoA-I-липид, образуемых в определенном интервале соотношений миметик ApoA-I-липид. Каждый миметик ApoA-I, окружающий каемку диска, находится в тесном контакте с двумя своими ближайшими соседями.
Фиг.5 представляет собой репрезентативную хроматограмму проникновения в гель пептид 16/липидного комплекса (липиды представляют собой сфингомиелин, DPPC (дипальмитоилфосфатидилхолин) и DPPG (дипальмитоилфосфатидилглицерин)).
Фиг.6 представляет собой кривую повышения, над исходным уровнем, фракции ЛПВП общего холестерина после введения пептид 16/липидного комплекса (липиды представляют собой сфингомиелин, DPPC и DPPG, и указанные компоненты присутствуют в весовом соотношении пептид 16:сфингомиелин:DPPC:DPPG как 1:1,35:1,35:0,30) кроликам.
Фиг.7 представляет собой кривую повышения фракции ЛПВП свободного холестерина после введения пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам.
Фиг.8 представляет собой профиль элюции гельпроникающей хроматографии на исходном уровне (темная линия) и через 20 мин после введения 2,5 мг/кг пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам.
Фиг.9 представляет собой кривую повышения уровня фосфолипида в плазме после введения пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни фосфолипида в плазме. Исходные значения (варьирующие от 0,96 до 1,18 г/л для указанных четырех групп) вычитали для того, чтобы определить степень повышения уровней фосфолипида в плазме. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, равным или меньшим, чем исходный уровень.
Фиг.10A представляет собой кривую повышения уровня общего холестерина в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни общего холестерина в плазме. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина в плазме. Исходные значения варьировали от 0,59 до 0,77 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.10B представляет собой кривую повышения уровня свободного холестерина в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни свободного холестерина в плазме. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина в плазме. Исходные значения варьировали от 0,21 до 0,27 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.10C представляет собой кривую повышения уровня этерифицированного холестерина в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни этерифицированного холестерина в плазме. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения варьировали от 0,39 до 0,52 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11A представляет собой кривую повышения уровня общего холестерина ЛПВП в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни общего холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения общего холестерина ЛПВП варьировали от 0,33 до 0,38 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11B представляет собой кривую повышения уровня свободного холестерина ЛПВП в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни свободного холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения свободного холестерина ЛПВП варьировали от 0,11 до 0,13 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11C представляет собой кривую повышения уровня общего холестерина ЛПВП в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни общего холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения общего холестерина ЛПВП варьировали от 0,17 до 0,33 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11D представляет собой кривую повышения уровня свободного холестерина ЛПВП после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни свободного холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения свободного холестерина ЛПВП варьировали от 0,06 до 0,11 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11E представляет собой кривую повышения уровня общего холестерина ЛПВП после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни общего холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения свободного холестерина ЛПВП варьировали от 0,04 до 0,11 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.11F представляет собой кривую повышения уровня свободного холестерина ЛПВП после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни свободного холестерина ЛПВП. Исходные значения вычитали для того, чтобы определить степень повышения уровней холестерина. Исходные значения свободного холестерина ЛПВП варьировали от 0,02 до 0,04 г/л. Брали по 3 животных на группу. К 30-34-часовому сроку после введения дозы указанные уровни возвращались к значениям, меньшим, чем исходный уровень, или равным ему.
Фиг.12 представляет собой кривую повышения уровня триглицеридов в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 10 (треугольники), 20 (кружочки) или 30 (ромбики) мг/кг. Через различные промежутки времени после введения дозы измеряли уровни триглицеридов в плазме. Исходные значения (варьировавшие от 0,40 до 0,80 г/л для указанных четырех групп) вычитали для того, чтобы определить степень повышения уровней триглицеридов в плазме. Брали по 3 животных на группу.
Фиг.13 представляет собой кривую повышения уровней свободного холестерина ЛПВП в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозах 0 (квадратики), 2,5 (треугольники), 5 (кружочки) или 10 (ромбики) мг/кг. На исходном уровне и через 5, 20, 40, 60, 90 и 120 минут после инициации инфузии измеряли уровни свободного холестерина ЛПВП в плазме. Исходные значения вычитали для того, чтобы определить степень повышения уровней свободного холестерина ЛПВП в плазме. Брали по 4 животных на группу.
Фиг.14A представляет собой профиль элюции гельпроникающей ВЭЖХ-хроматографии на исходном уровне (темная линия) и через 20 мин после инфузии 2,5 мг/кг пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5). На оси Y отложено поглощение, полученное в результате непрерывного компьютерного анализа свободного холестерина липопротеиновых фракций, элюирующихся с колонки гельпроникающей ВЭЖХ-хроматографии. Пики слева направо соответствуют фракциям ЛПОНП, ЛПНП и ЛПВП.
Фиг.14B представляет собой профиль элюции гельпроникающей ВЭЖХ-хроматографии на исходном уровне (темная линия) и через 20 мин после инфузии 5,0 мг/кг пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5). На оси Y отложено поглощение, полученное в результате непрерывного компьютерного анализа свободного холестерина липопротеиновых фракций, элюирующихся с колонки гельпроникающей ВЭЖХ-хроматографии. Пики слева направо соответствуют фракциям ЛПОНП, ЛПНП и ЛПВП.
Фиг.15 представляет собой кривую повышения уровней свободного холестерина ЛПВП в плазме после инфузии пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) кроликам на голодный желудок в дозе 20 мг/кг со скоростью 1 мл/мин (треугольники) или 0,2 мл/мин (ромбики). Через различные промежутки времени после введения дозы измеряли уровни свободного холестерина ЛПВП в плазме. Исходные значения вычитали для того, чтобы определить степень повышения уровней свободного холестерина ЛПВП в плазме. Брали по 4 животных на группу, обрабатываемую пептид 16/липидным комплексом, и по 2 животных на группу, обрабатываемую наполнителем.
На фиг.16 проиллюстрированы кривые кинетических профилей пептида 16 (верхние панели), свободного холестерина (средние панели) и фосфолипида (нижние панели) у самцов и самок крыс после введения первой дозы пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) на день 0. Снижение уровней пептида 16 и фосфолипида в плазме со временем указывает на клиренс пептид 16/липидного комплекса. Представлены кинетики свободного холестерина. Данные в каждой точке представляют собой среднее ± SD (N=3 крысам/группу).
На фиг.17 проиллюстрированы кривые кинетических профилей пептида 16 (верхние панели), свободного холестерина (средние панели) и фосфолипида (нижние панели) у самцов и самок крыс после введения множественной дозы пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) на день 26. Указанные животные получали пептид 16/липидный комплекс через день в течение 4 недель. Снижение уровней пептида 16 и фосфолипида в плазме со временем указывает на клиренс пептид 16/липидного комплекса. Представлены кинетики свободного холестерина. Данные в каждой точке представляют собой среднее ± SD (N=3 крысам/группу).
На фиг.18 проиллюстрированы кривые кинетических профилей пептида 16 (верхние панели), свободного холестерина (средние панели) и фосфолипида (нижние панели) у самцов и самок макак-крабоедов после введения первой дозы пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) на день 0. Снижение уровней пептида 16 и фосфолипида в плазме со временем указывает на клиренс пептид 16/липидного комплекса. Представлены кинетики свободного холестерина. Данные в каждой точке представляют собой среднее ± SD (N=3 макакам/группу).
На фиг.19 проиллюстрированы кривые кинетических профилей пептида 16 (верхние панели), свободного холестерина (средние панели) и фосфолипида (нижние панели) у самцов и самок макак-крабоедов после введения множественной дозы пептид 16/липидного комплекса (указанные липиды представляют собой сфингомиелин, DPPC и DPPG в весовом соотношении 1:1,2125:1,2125:0,075, и весовое соотношение пептид:липид составляет 1:2,5) на день 26. Указанные животные получали пептид 16/липидный комплекс через день в течение 4 недель. Снижение уровней пептида 16 и фосфолипида в плазме со временем указывает на клиренс пептид 16/липидного комплекса. Представлены кинетики свободного холестерина. Данные в каждой точке представляют собой среднее ± SD (N=3 макакам/группу).
Фиг.20A представляет собой кривую, отражающую % возрастания, по сравнению с уровнем, наблюдавшимся перед введением дозы, суммарного холестерина плазмы у мышей C57B1/6J после обработки композицией A, B или C. В разных временных точках у животных последовательно отбирали пробы, по 6 животных/на группу.
Фиг.20B представляет собой кривую повышения уровней суммарного холестерина в плазме у мышей C57B1/6J после обработки композицией A, B или C. В разных временных точках у животных последовательно отбирали пробы, по 6 животных/на группу.
Фиг.21A представляет собой кривую, отражающую % возрастания, по сравнению с уровнем, наблюдавшимся перед введением дозы, этерифицированного холестерина у мышей C57B1/6J после обработки композицией A, B или C. В разных временных точках у животных последовательно отбирали пробы, по 6 животных/на группу.
Фиг.21B представляет собой кривую повышения уровней этерифицированного холестерина у мышей C57B1/6J после обработки композицией A, B или C. В разных временных точках у животных последовательно отбирали пробы, по 6 животных/на группу.
Подробное описание изобретения
I. Определения
Термин "приблизительно", который непосредственно предваряет числовое или количественное значение, означает, что указанное числовое или количественное значение имеет разброс величин, составляющий плюс или минус 10%. Например, "приблизительно 1:1" в диапазоне от 0,9:1 до 1,1:1.
Используемый здесь термин "алкил", если не оговорено иначе, относится к необязательно замещенному насыщенному углеводородному радикалу с разветвленной, прямой цепью или циклическому углеводородному радикалу. Типичными алкильными группами являются (C1-C6)-алкильные группы, которые включают в себя, но не ограничены перечисленным, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, гексил и т.п. В определенных воплощениях алкильные группы представляют собой (C1-C4)-алкил. Если не оговорено иначе, алкил является незамещенным.
Используемый здесь термин "алкенил", если не оговорено иначе, относится к ненасыщенному углеводородному радикалу с разветвленной, прямой цепью или циклическому неароматическому углеводородному радикалу, имеющему одну или более углерод-углеродных двойных связей. Указанные одна или несколько двойных связей могут быть либо в цис-, либо в транс-конформации. Обычно алкенильные группы включают в себя, но не ограничены перечисленным, этенил, пропенил, изопропенил, бутенил, изобутенил, трет-бутенил, пентенил, гексенил и т.п. В определенных воплощениях алкенильная группа представляет собой (C2-C6)-алкенил.
Используемый здесь термин "алкинил", если не оговорено иначе, относится к ненасыщенному углеводородному радикалу с разветвленной или прямой цепью, имеющему по меньшей мере одну углерод-углеродную тройную связь. Обычно алкинильные группы включают в себя, но не ограничены перечисленным, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил и т.п. В определенных воплощениях алкинильная группа представляет собой (C2-C6)-алкинил.
Используемый здесь термин "арил", если не оговорено иначе, относится к необязательно замещенной системе ароматических колец, в которых каждый атом внутри кольца представляет собой C, O, N или S, таким образом обслуживая гетероциклические ароматические кольца. Обычно арильные группы включают в себя, но не ограничены перечисленным, бензил, фенил, нафтил, антрацил, фуран, имидазол, индазол, индол, изохинолин, изотиазол, изоксазол, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тиазол и тиофен. В определенных воплощениях арильная группа представляет собой (C5-C26-арил). В определенных воплощениях гетероарильная группа представляет собой 5-20-членный гетероарил. Если не оговорено иначе, арил является незамещенным.
Используемый здесь термин "аралкил", если не оговорено иначе, относится к алкильной группе, замещенной арильной группой.
Используемый здесь термин "замещенный алкил или арил", если не оговорено иначе, относится к алкильной или арильной группе, в которой один или несколько ее атомов водорода заменены другим заместителем. Типичные заместители включают в себя ORa, -SRa, -NRaRa, -NO2, -CN, галоген, -SO2Ra, -C(O)Ra, -C(O)ORa и -C(O)NRaRa, где каждый Ra независимо является водородом, алкилом или арилом.
Используемый здесь термин "гидрофильная оболочка" если не оговорено иначе, относится к наружной поверхности спирали, имеющей в целом гидрофильный характер.
Используемый здесь термин "гидрофобная оболочка" если не оговорено иначе, относится к наружной поверхности пептида, имеющего в целом гидрофобный характер.
Здесь, когда речь идет о миметике ApoA-I, имеется в виду, что число концевых -NH2-групп равно нулю, когда R1 представляет собой аминозащитную группу, и равно 1, когда R1 является H.
Здесь, когда речь идет о миметике ApoA-I, имеется в виду, что число концевых -COOH-групп равно нулю, когда R1 представляет соб