Композиции и способы, используемые для оценки цитотоксичности отдельных клеток
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, генной инженерии и медицины. Способ оценки цитолитической активности единичных эффекторных клеток, при этом определяя профиль секретированного продукта, используя матрицы микролунок, включает мониторинг лизиса инфицированных клеток-мишеней с помощью эффекторных клеток в микролунках, где микролунки содержат в среднем одну эффекторную клетку и по меньшей мере одну инфицированную клетку-мишень на микролунку; где мониторинг включает стадию детекции лизиса указанных инфицированных клеток-мишеней с помощью эффекторных клеток, используя флуоресцентный индикатор, при этом определяя профиль одного или более секретированных продуктов. Способ может быть использован в медицине для крупномасштабного скрининга для определения профиля большого числа отдельных клеток в микромассивах. 19 з.п. ф-лы, 10 ил.,7 пр.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к способу анализа взаимодействий между парами «мишень-эффекторные клетки», используемыми в способах крупномасштабного скрининга для определения профиля большого числа отдельных клеток в микромассивах.
Предшествующий уровень техники
Несмотря на то что исследования по контактированию человека с вирусом иммунодефицита человека типа 1 (ВИЧ-1), проводятся уже более двадцати пяти лет, остается признать, что ВИЧ/СПИД являются одной из главных причин заболеваний, представляющих угрозу для здоровья людей во всем мире. В настоящее время специалистами было высказано предположение, что в следующие двадцать лет ВИЧ/СПИД будет занимать третье место после рака и сердечно-сосудистых заболеваний среди причин смертности людей во всем мире. Вакцина, которая позволяла бы предупреждать инфицирование или индуцировать действие природных механизмов против указанного заболевания, пока еще не найдена. Существующие несложные способы анализов не позволяют определить критические признаки, связанные с клетками иммунной системы, которые обеспечивают выработку иммунитета против данного вируса. Методы, такие как проточная цитометрия, и иммуноферментные анализы (ELISpot, ELISA) позволяют выявить определенные популяции клеток, но они обладают недостаточной чувствительностью для оценки редких событий. Другие важные функции, такие как цитотоксичность и пролиферация, в настоящее время могут быть определены лишь в совокупности. Эти ограничения в целом затрудняют или вообще не позволяют оценивать выработку у человека иммунитета на ВИЧ с достаточной степенью точности и тем самым определить факторы корреляции иммунитета. А поэтому необходимость в разработке новых стратегий для анализа защитного иммунного ответа против вируса, такого как ВИЧ, остается крайне актуальной.
Описание сущности изобретения
Настоящее изобретение относится к способам идентификации CD8+-клеток, способных лизировать CD4+-ВИЧ-инфицированные клетки у индивидуума, путем получения суспензии эффекторных CD8+-клеток и клеток-мишеней, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; культивирования указанной суспензии в условиях, позволяющих осуществлять лизис клетки-мишени под действием CD8+-клеток; детектирования лизиса клетки-мишени эффекторными клетками; и идентификации CD8+-клеток, способных лизировать CD4+-ВИЧ-инфицированные клетки. Эффекторные клетки, которые лизируют клетку-мишень, могут быть, но необязательно, выделены. Предпочтительно выделенные эффекторные клетки, которые лизируют клетку-мишень, культивируют. В одном из аспектов эффекторные клетки и клетки-мишени смешивают, а затем эти клетки помещают в микролунку. Альтернативно, эффекторные клетки и клетки-мишени смешивают после помещения клеток в микролунку. Лизис детектируют путем мониторинга изменения интенсивности флуоресценции меченых клеток. Альтернативно, лизис детектируют путем мониторинга изменений уровней внутриклеточного кальция в клетках-мишенях. Кальций детектируют с использованием флуоресцентного красителя, чувствительного к кальцию. Предпочтительно флуоресцентным красителем, чувствительным к кальцию, является Fura 2AM (Invitrogen).
В одном из аспектов микролуночный массив приводят в контакт с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством, которое позволяет специфически детектировать продукт эффекторных клеток с последующим детектированием указанного средства. Такими средствами являются антитело, цитокин или растворимый медиатор лизиса. Предпочтительным цитокином является TNF-α или IFN-γ. Необязательным растворимым медиатором лизиса является гранзим B (GzB) или перфорин. Способ по изобретению также предусматривает, но необязательно, мечение эффекторных клеток антигеном CD69.
Настоящее изобретение также относится к способам характеристики гуморального ответа у индивидуума путем получения суспензии В-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, предположительно, инфицирован ВИЧ, и где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведение в контакт указанного микролуночного массива с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством для детектирования В-клеток; и детектирования указанного средства с последующей характеристикой гуморального ответа. Предпочтительным средством для детектирования В-клеток является антитело, специфичное к эпитопу в gp120.
В одном из аспектов способ по изобретению также предусматривает приведение в контакт микролуночного массива со вторым субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним первым средством для детектирования В-клеток. Необязательным первым средством для детектирования В-клеток является антитело против gp120 ВИЧ. Предпочтительным средством является антитело против С-концевого gp120 ВИЧ. В одном из аспектов определяют изотип антитела, продуцируемого В-клеткой в микролуночном массиве. Затем выделяют, но необязательно, В-клетки, экспрессирующие антитело, реагирующее с ВИЧ. В другом аспекте выделяют и амплифицируют вариабельные области легкой цепи и тяжелой цепи антитела. В-клетки обрабатывают, но необязательно, средством, которое стимулирует продуцирование антител в клетке. Предпочтительными средствами являются CD40L или анти-BCR антитело. В другом аспекте B-клетки обрабатывают CD40L и анти-BCR антителом.
Настоящее изобретение также относится к способам характеристики перекрестной реактивности B-клеток с множеством ВИЧ-изолятов путем получения суспензии В-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, предположительно, инфицирован ВИЧ и где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведения в контакт указанного микролуночного массива с первым субстратом, где указанный субстрат предварительно обрабатывают антителом, продуцируемым В-клетками, по меньшей мере в одной микролунке; приведения в контакт указанного субстрата с первым меченым вирионом ВИЧ и со вторым меченым вирионом ВИЧ; и определения наличия связывания первого меченого вириона и второго меченого вириона с антителами, продуцируемыми той же самой клеткой в указанной микролунке. B-клетки, продуцирующие антитела, которые специфически связываются с первым меченым вирионом и со вторым меченым вирионом, могут быть, но необязательно, выделены. В одном из аспектов выделенные В-клетки культивируют. Предпочтительно, по меньшей мере один из вирионов подвергают мечению. Альтернативно, первый вирион и второй вирион метят различными средствами, то есть различными детектируемыми маркерами.
Настоящее изобретение также относится к способам создания функционального профиля для эффекторных клеток, чувствительных к ВИЧ-инфекциям у индивидуума, путем получения популяции эффекторных клеток, выбранных из группы, состоящей из клеток CTL (CD8+), NK-клеток (CD16+), NK-T-клеток (CD1d+,Vα24+) или γδ-T-клеток (Vγ9+,Vδ2+), где указанные эффекторные клетки, взятые у индивидуума, были нанесены на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; и где популяция эффекторных клеток нагружена совместно с популяцией когнатных клеток-мишеней; визуализации эффекторных клеток; оценки цитотоксичности эффекторных клеток; приведения в контакт микролуночного массива с первым субстратом, где указанный субстрат предварительно обрабатывают средством, которое позволяет специфически детектировать один или более из IL-2, IL-4, IL-10, TNF-α и IFN-γ; и определения связывания эффекторных клеток, находящихся в микролунках, с одним или несколькими средствами. В одном из аспектов цитотоксичность оценивают путем детектирования высвобождения кальцеина AM. Указанные клетки метят, но необязательно, одним или несколькими поверхность-специфическими маркерными белками. Предпочтительными поверхностными маркерными белками являются CD62L, CXCR3, CCR4 или CCR7. В другом аспекте эффекторную клетку выделяют из одной или нескольких микролунок. Затем выделенную клетку культивируют, но необязательно, до достижения клональной амплификации выделенных клеток. Затем охарактеризовывают, но необязательно, экспрессию одного или нескольких генов в выделенной клетке. Выделенными клетками предпочтительно являются CD8+-цитотоксические T-клетки (CTL), природные киллеры (NK), NK-T-клетки или γδ-T-клетки. В другом аспекте указанным индивидуумом является индивидуум с инфекцией в острой стадии, индивидуум, подвергаемый высокоинтенсивной антиретровирусной терапии (HAART), или индивидуум, являющийся «элит-контроллером».
Настоящее изобретение также относится к способам оценки природного иммунитета у индивидуума с ВИЧ-инфекцией путем получения суспензии NK-клеток, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанный индивидуум инфицирован или, вероятно, инфицирован ВИЧ, а указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную клетку; приведения в контакт указанного микролуночного массива с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством для детектирования NK-клеток, и детектирования указанного средства с последующей идентификацией NK-клеток и оценкой природного иммунного ответа. В одном из аспектов NK-клетки детектируют с использованием NKp46-Cy3, CD107a-Alexa647 и/или CD69-Alexa488. Средство для детектирования NK-клеток позволяет детектировать NK-клетки. Эти клетки совместно культивируют, но необязательно, перед их нанесением на сформованную пластину. Предпочтительно указанные клетки совместно культивируют с IL-12 и IL-18.
Настоящее изобретение также относится к способам оценки клонального разнообразия популяции NK-клеток путем получения суспензии NK-клеток и клеток-мишеней, взятых у индивидуума и нанесенных на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную эффекторную клетку; культивирования указанной суспензии в условиях, позволяющих осуществлять лизис клетки-мишени NK-клетками; детектирования лизиса клеток-мишеней эффекторными клетками; и идентификации эффекторных клеток с последующей оценкой клонального разнообразия популяции NK-клеток. В одном из аспектов эффекторные клетки, которые лизируют клетки-мишени выделяют и, необязательно, культивируют. В другом аспекте выделяют NK-клетки, которые лизируют клетки-мишени. NK-клетки и клетки-мишени смешивают, но необязательно, перед тем как их помещают в микролунку. Альтернативно, NK-клетки и клетки-мишени смешивают после того, как их помещают в микролунку. В одном из аспектов лизис клеток-мишеней определяют путем мониторинга изменения интенсивности флуоресценции меченых клеток. В еще одном аспекте NK-клетки, которые лизируют клетки-мишени, выделяют и детектируют ген иммуноглобулин-подобного рецептора клеток-киллеров (KIR) на NK-клетках. Микролуночный массив приводят в контакт, но необязательно, с субстратом, где указанный субстрат предварительно обрабатывают по меньшей мере одним средством, которое позволяет специфически детектировать продукт NK-клеток, и осуществляют детектирование указанного средства. Указанными средствами являются антитело, цитокин или растворимый медиатор лизиса. Предпочтительным цитокином является TNF-α или IFN-γ.
Настоящее изобретение также относится к способам оценки разнообразия популяции NK-клеток и В-клеток путем получения суспензии клеток, содержащих повышенное количество ВИЧ-инфицированных CD4+-Т-клеток, активированных NK-клеток, В-клеток и клеток-мишеней, где указанную суспензию наносят на сформованную пластину, содержащую по меньшей мере одну микролунку в микролуночном массиве, где указанная по меньшей мере одна микролунка в микролуночном массиве имеет отдельную Т-клетку; культивирования клеток в условиях, позволяющих антителам, продуцируемым В-клетками, связываться с поверхностью Т-клеток; идентификации лунок, содержащих В-клетки, NK-клетки и лизированные Т-клетки, и идентификации В-клеток или NK-клеток. В одном из аспектов NK-клетки активируют цитокином IL-2. В другом аспекте В-клетки активируют CD40L или анти-BCR антителом. В еще одном аспекте В-клетки активируют CD40L и анти-BCR антителом. NK-клетки активируют IL-2. В-клетки активируют анти-BCR антителом CD40L. B-клетки или NK-клетки выделяют, но необязательно, из лунок и охарактеризовывают одно или несколько свойств В-клеток. В другом аспекте охарактеризовывают гены антител в В-клетках. Затем анализируют, но необязательно, область VDJ генов, кодирующих антитела в B-клетках. Микролуночный массив приводят в контакт, но необязательно, с субстратом в условиях, стимулирующих связывание антител, продуцируемых В-клетками, с субстратом. В другом аспекте субстрат приводят в контакт с лизатами, выделенными из ВИЧ-инфицированных клеток и идентифицируют лунки с В-клетками, продуцирующими антитела, которые связываются с ВИЧ-лизатом, или анти-IgG3 антитело. Предпочтительно идентифицируют лунки с B-клетками, продуцирующими антитела, которые связываются с ВИЧ-лизатом, или анти-IgG3 антитело.
Другие признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов изобретения и из прилагаемой формулы изобретения. Если это не оговорено особо, все используемые здесь технические и научные термины имеют значения, в основном понятные среднему специалисту в области, к которой относится настоящее изобретение. Хотя для осуществления настоящего изобретения и для проведения тестов в соответствии с настоящим изобретением могут быть применены методы и материалы, аналогичные или эквивалентные описанным здесь методам и материалам, однако предпочтительными являются методы и материалы, описанные ниже. Все публикации, патентные заявки, патенты и другие упомянутые там работы во всей своей полноте приведены в настоящем описании в качестве ссылки. В случае возникновения противоречий они должны быть истолкованы так, как они трактуются в описании, включая определения терминов. Кроме того, такие материалы, методы и примеры носят лишь иллюстративный характер и не ограничивают настоящего изобретения.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания и формулы изобретения.
Краткое описание графического материала
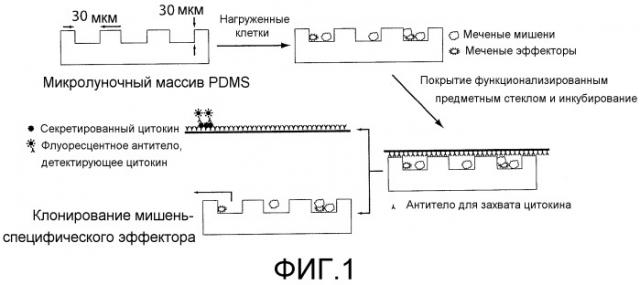
На фигуре 1 представлена схема анализа. Клетки, флуоресцентно меченные мишени (окрашенные кальцеином, зеленым) и эффекторы (окрашенные α-CD8 APC, розовым) загружают на ~30 мкм микролуночный массив и визуализируют на флуоресцентном микроскопе. Затем микролуночный массив покрывают предметным стеклом, предварительно функционализированным антителами для захвата, и инкубируют при 37°C, 5% CO2 в течение 2-6 часов. После инкубирования секретированные цитокины детектируют на предметном стекле с использованием специфических флуоресцентных антител, и мишени, лизированные под действием специфических эффекторов, визуализируют по потере интенсивности флуоресценции (лунка 1). В микролунках, содержащих только клетки-мишени (лунка 2), и в микролунках, содержащих эффекторы, которые неспособны лизировать мишень (лунка 3), должно наблюдаться очень незначительное изменение интенсивности флуоресценции мишени.
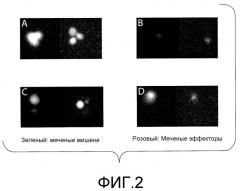
На фигуре 2 представлена серия репрезентативных флуоресцентных изображений меченых мишеней и эффекторов до и после инкубирования (0 и 4 ч.). (A) Окрашенные кальцеином (зеленый) и нагруженные пептидом (KK10) мишени (могут наблюдаться 3 отдельных клетки); (B) эффекторы, меченные (розовые) α-CD8-APC; (C) совместное инкубирование эффекторов (розовых) и ненагруженных мишеней (без добавления пептида KK10) (зеленых); (D) совместное инкубирование эффекторов (показано розовым) и мишеней (зеленых), нагруженных пептидом KK10. Лизис мишеней происходил только в том случае, когда эффекторы распознавали нагруженные пептидом мишени (показано в D).
На фигуре 3 представлена панель флуоресцентных изображений CD4-T-клеток, инфицированных GFP-экспрессирующим вирусом NL4-3. Наличие зеленых клеток указывает на инфекцию.
На фигуре 4 представлена серия флуоресцентных изображений, иллюстрирующих совместное культивирование ВИЧ-специфических CD8+-Т-клеточных клонов с В-клетками, меченными кальцеином AM и нагруженными ВИЧ-пептидом. CTL-опосредуемый лизиз определяют по отсутствию флуоресцентного сигнала.
На фигуре 5 представлена панель флуоресцентных изображений, иллюстрирующих совместное культивирование APC-меченных CTL (красным) и В-клеток, меченных кальцеином AM (зеленым). Гашение флуоресценции кальцеина AM указывает на CTL-опосредуемый лизиз.
На фигуре 6 схематически представлена серия анализов отдельных клеток, которые были разработаны с использованием массива микролунок. Измерения проводили последовательно или одновременно. Квадраты на каждом изображении имеют размер 50 мкм.
На фигуре 7 схематически представлен анализ методом захвата, проводимый для идентификации клеток, распознающих CD4-связывающую область gp120. Один массив В-клеток был использован для отпечатывания (а) на поверхности иммобилизованного gp120, а затем (b) на второй поверхности иммобилизованного gp120 после блокирования растворимым CD4.
На фигуре 8 схематически представлена экспериментальная модель для идентификации антител человека, продуцируемых B-клетками и связывающихся с множеством штаммов ВИЧ. Каждый кластер иммобилизованных антител (окрашенных) представляет один элемент микромассива, который соответствует клеткам, присутствующим в соответствующих микролуночных массивах.
На фигуре 9 проиллюстрировано создание функционального профиля исходя из данных для отдельных клеток. Были отобраны популяции клеток, а затем были оценены их цитотоксические свойства, цитокиновые профили и поверхностные маркеры. На этих картах показан характер изменения частоты встречаемости субпопуляций в процессе инфицирования. Аналогичные профили для CD4+-T-клеток дают базисные точки, указывающие на статус данной системы.
На фигуре 10 показан гель, иллюстрирующий результаты проведения ОТ-ПЦР с использованием вырожденных праймеров для отдельных B-лимфоцитов, выбранных из микролунок. B-клетки выделяли из пробы крови (в результате негативного отбора МКПК посредством сортинга на магнитных сферах) и загружали в микролунки. Клетки произвольно отбирали из двенадцати микролунок, помещали в буфер для лизиса и амплифицировали с помощью ОТ-ПЦР с использованием серии вырожденных праймеров для тяжелых и легких цепей. Было отобрано семь последовательностей белка, которые указаны внизу за гелем.
Подробное описание изобретения
Исчерпывающие знания механизмов, которые позволяют вирусу иммунодефицита человека (ВИЧ) уклоняться от «надзора» иммунной системы, крайне необходимы для разработки эффективных вакцин и методов терапии. На прогрессирование заболевания у индивидуумов, не подвергаемых лечению, указывает непрерывная репликация вируса и потеря CD4+-T-клеток (Kahn J.O., Walker BD (1998) Acute human immunodeficiency virus type I infection. N. Engl. J. Med. 339, 33; Hecht FM et al. (2002) Use of laboratory tests and clinical symptoms for identification of primary HIV infection. AIDS 16, 1119). Вирус-специфические CTL играют значительную роль в регуляции непрерывной репликации, и было показано, что первое появление ВИЧ-1-специфических CD8+-Т-клеток приводит к снижению вирусной нагрузки (Altfeld M et al. (2006) HLA Alleles Associated with delayed progression to AIDS contribute strongly to the initial CD8 + T cell response against HIV-I PLoS. Med. 3(10), 1851). Однако такое снижение репликации вируса у большинства индивидуумов («прогрессоров») является временным. И лишь у очень небольшой подгруппы индивидуумов, называемых LTΝP («элит-контроллерами»), поддерживаются низкие вирусные пороговые уровни на протяжении длительного периода времени, и было показано, что вирус-специфические CD8+-Т-клетки, обнаруженные у этих индивидуумов, обладают более высокой пролиферирующей способностью по сравнению с теми же самыми клетками, выделенными у «прогрессоров» (Migueles S.A. et al. (2002) HIV-specific CD8+ T cell proliferation is coupled to perforin expression and is maintained in nonprogessors Nat. Immun. 3(11), 1061).
До появления настоящего изобретения исследователи, изучающие взаимодействия между патогеном и иммунной системой человека, сталкивались с двумя проблемами, связанными с тем, что: 1) число клеток, присутствующих в большинстве клинических образцов, часто очень ограничено; и 2) уникальные клоны, такие как патоген-специфические B-клетки или Т-клетки, встречаются редко.
Существующие в настоящее время аналитические средства недостаточны для одновременной оценки одной и той же отдельной клетки на множество свойств (линии дифференцировки, функции, генотипа). Так, например, проточная цитометрия представляет собой общеизвестный метод, используемый для анализа популяций отдельных клеток на фенотипические маркеры, экспрессируемые на поверхности, а анализ профилей цитокинов, который позволяет определить некоторые функциональные фенотипы, требует фиксации клеток и придания им проницаемости. Такая потеря жизнеспособности клетки означает, что дополнительные функциональные свойства, такие как цитотоксичность, не могут быть оценены прямым методом, при этом также часто затрудняется и генетический анализ. Таким образом, до появления настоящего изобретения было невозможно однозначно и точно определить гетерогенность клеток в субпопуляциях исходя из природной и адаптивной иммунных систем, отвечающих на конкретный инфекционный агент. Также трудно было создать представление о статусе иммунной системы. Такое представление облегчило бы идентификацию механизмов, которые сообщают иммунитет против некоторых патогенов и являются диагностическими индикаторами устойчивых ответов. Поэтому настоящее изобретение относится к новым технологиям измерения и установления корреляции линий дифференцировки, функций и генотипов для многих отдельных клеток, разработанных в целях повышения эффективности исследований взаимодействий между иммунной системой человека и представляющими интерес патогенами, а в частности ВИЧ (Fauci, A.S., Johnston, M.I., Dieffenbach, C.W., Burton, D.R., Hammer, S.M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective -HIV vaccine research: The way forward. Science 321, 530-532 (2008)).
Настоящее изобретение относится к способам и композициям, используемым для характеристики иммунного ответа индивидуума на инфекции, включая инфекции, вызываемые вирусом иммунодефицита человека. Микромассивы и пластины могут быть сконструированы способами, известными специалистам, включая способы, описанные в заявке PCT/US 2006/036282 (опубликованной как WO 2007/035633) и в заявке США рег. № 61/057371. Содержание обеих заявок во всей своей полноте приведено в настоящем описании в качестве ссылки. Используемый в настоящем описании термин «сформованная пластина» означает устройство, которое может быть гибким, подвижным или может деформироваться по меньшей мере в одном направлении при его приведении в контакт с субстратом. Так, например, в некоторых конфигурациях сформованная пластина может быть получена, например, из эластомерного материала, так, чтобы при контакте этой сформованной пластины с субстратом они образовывали плотное, в основном водонепроницаемое, соединение, позволяющее задерживать или предотвращать утечку любой жидкости из сформованной пластины.
Противовирусная функция цитотоксических T-лимфоцитов (CTL) в ингибировании ВИЧ
Цитотоксические CD8+-Т-клетки (CTL) играют важную роль в подавлении острых вирусных инфекций и в регуляции резервуаров инфекции, вызываемой персистирующим вирусом. Истощение CD8+-лимфоцитов у SIV-инфицированных макак приводит к быстрому и заметному повышению виремии. Тем не менее, хронические ВИЧ-1-инфекции связаны с избыточным количеством ВИЧ-специфических CD8+-Т-клеток в отсутствие клиренса вируса или регуляции его уровня. Эти данные позволяют предположить, что именно функции, а не число CD8+-Т-клеток играет важную роль в эффективной регуляции уровня репликации вируса. До настоящего времени активность ВИЧ-специфических CD8+-Т-клеток определяли либо путем оценки частоты встречаемости ВИЧ-специфических CD8+-Т-клеток посредством мечения этих клеток тетрамерами комплексов «пептид-HLA класса I», либо по способности этих клеток секретировать IFN-γ после антигенной стимуляции. Однако недавно проведенные исследования показали, что частота встречаемости CD8+-Т-клеток и секреция IFN-γ под действием этих клеток не коррелирует с регуляцией виремии при хронических инфекциях, вызываемых вирусом ВИЧ-1.
Способность CTL подавлять репликацию ВИЧ измеряют путем совместного культивирования ВИЧ-инфицированных CD4+-Т-клеток и массы аутологичных CD8+-Т-клеток. Эти эксперименты давали неоднородные результаты в отношении способности индивидуумов к ингибированию ВИЧ. Недавно полученные результаты позволяют предположить, что CD8+-Т-клеточные ответы ex vivo не коррелируют со способностью этих клеток ингибировать репликацию ВИЧ-1 in vitro. Скорее всего CD8+-Т-клетки, которые могут пролифирировать в количествах, достаточных для борьбы с вирусом, способны осуществлять регуляцию уровня вируса, однако фенотип, функциональные свойства и генетический транскрипционный профиль (созревание/истощение) этих клеток пока неизвестны.
Хотя важная роль ВИЧ-специфических CD8+-Т-клеток в предотвращении прогрессирования заболевания не вызывает сомнений, однако их характеристика и выделение представляют значительные трудности. Для выделения CTL были применены различные методы, каждый из которых имеет свои достоинства и преимущества. Для выделения антиген-специфических клонов может быть проведен анализ методом лимитирующего разведения, однако результаты такого анализа зависят от способности этих клонов к размножению в тканевой культуре. Анализ ELISPOT позволяет определять способность активированных CTL секретировать отдельный цитокин, но не дает какой-либо информации относительно их литических свойств. Было также продемонстрировано, что антигенпрезентирующие клетки (АПК), обнаруживающие низкую плотность нагруженных пептидом MHC (pMHC), могут обладать цитотоксической функцией без одновременной секреции цитокинов (Valitutti S et al. (1996) Different responses are elicited in cytotoxic T lymphocytes by different levels of T cell receptor occupancy. J. Exp. Med. 183, 1917). Это ограничение оказалось особенно эффективным при попытке выделения ВИЧ-специфических CTL, поскольку вирусная инфекция ингибирует MHC класса I (Mangasarian A et al. (1999) Nef-Induced CD4 and Major Histocompatibility Complex Class I (MHC-I) Down-Regulation Are Governed by Distinct Determinants: N-Terminal Alpha Helix and Proline Repeat of Nef Selectively Regulate MHC-I Trafficking J. Virol. 73(3), 1964). Для выделения ангигенспецифических CTL использовали окрашивание нагруженным пептидом и флуоресцентно помеченным тетрамером HLA класса I в комбинации с проточной цитометрией, однако это также не дало какой-либо информации о литической способности этих клеток. Кроме того, было показано, что CTL, выделенные методом окрашивания тетрамером, не всегда распознают инфицированные вирусом клетки (Appay V et al. (2000) HIV-specific CD8+ T cells produce antiviral cytokines but are impaired in cytolytic function. J. Exp. Med. 192(1), 63). В литературе описан анализ лизиса методом проточной цитометрии, проводимый с использованием субстратов каспазы, однако такой анализ непригоден для скрининга большого числа эффекторных клеток (Liu L et al. (2002) Visualization and quantification of T cell-mediated cytotoxicity using cell-permeable fluorogenic caspase substrates Nat. Med. 8, 185). Таким образом, до появления настоящего изобретения не существовало какого-либо конкретного крупномасштабного метода, который позволял бы определять способность отдельных CTL к лизису отдельных инфицированных первичных клеток-мишеней и измерять число цитокинов и цитотоксических молекул, секретируемых этими клетками, а значит, и отобрать «живую» клетку в целях определения клональных линий для последующей функциональной характеристики и генетического анализа.
Сохранение высоких уровней CD8+-Т-клеток, которые способны распознавать и лизировать инфицированные CD4+-Т-клетки, непосредственно коррелирует с уровнем ингибирования репликации вируса у пациента. Определение уникального фенотипа, функции и профиля экспрессии генов в цитолитических и нецитолитических CTL на уровне отдельных клеток позволяет обнаруживать корреляты сообщаемого CD8+-Т-клетками противовирусного иммунитета, необходимого для разработки эффективной вакцины против ВИЧ. Настоящее изобретение относится к анализу на элиминацию отдельных CTL в комбинации с фенотипированием и генетическими анализами, позволяющими определять иммунологические и генетические корреляты эффективного опосредуемого CD8+-Т-клетками противовирусного иммунного ответа. Определение таких свойств на уровне отдельных клеток позволит определить прототипический ответ, который будет вырабатываться посредством иммунизации вакциной, сконструированной в целях увеличения числа CD8+-Т-клеток, способных эффективно подавлять репликацию вируса.
Разнообразие антител у ВИЧ-инфицированных пациентов
Первичным рецептором, экспрессируемым на поверхности ВИЧ, является gp120. Рецептор, презентируемый на поверхности некоторых Т-клеток, необходим для инфицирования и связывается с CD4. Было предпринято множество попыток разработки вакцин против ВИЧ в целях блокирования инфекции посредством вырабатывания NAb-ответа против gp120, однако в настоящее время все эти попытки оказались безуспешными, что обусловлено, главным образом, вариабельностью рецепторов у различных штаммов и предрасположенностью этих рецепторов к мутации в их хозяине. Однако в настоящее время имеются примеры инфицирования людей, у которых в естественных условиях образуются NAb, обладающие способностью нейтрализовать многие варианты вируса широкого ряда. Разнообразие этих антител трудно оценить стандартными методами, поскольку уникальные антитела присутствуют в сыворотке в ограниченном количестве, трудно поддаются очистке и не могут быть рекомбинантно продуцированы без соответствующих генов. Проблема заключается в том, что bNAb соответствуют клональной линии В-клеток, из которых они продуцируются. До настоящего времени наиболее успешной попыткой идентифицировать гены, кодирующие NAb, было применение пэннинга библиотек антител, продуцируемых рекомбинантными методами из большого числа В-клеток, присутствующих в кровотоке ВИЧ-положительных индивидуумов (Koefoed, K., Farnaes, L., Wang, M., Svejgaard, A., Burton, D.R. & Ditzel, H.J. Molecular characterization of the circulating anti-HIV-1 gp120-specific B cell repertoire using antibody phage display libraries generated from pre-selected HIV-I gp120 binding PBLs. J. Immunol Methods 297, 187-201 (2005)). Однако эти подходы не дают возможности точно определить природный репертуар антител у индивидуумов, поскольку такой способ приводит к нарушению уникальных клональных комбинаций тяжелых и легких цепей. Как описано ниже в примерах, необходимо решить две проблемы, а именно определить: (1) клональное разнообразие bNAb-продуцирующих В-клеток у индивидуума; и (2) свойства bNAb, которое связывается с первичными изолятами широкого ряда.
Клеточные иммунные ответы против ВИЧ
Есть надежда, что вакцина против ВИЧ будет эффективной для тех индивидуумов, у которых наблюдается естественное заметное подавление прогрессирования заболевания, у так называемых «элит-контроллеров», и у приматов, не являющихся человеком и обладающих иммунитетом к обезьяньему вирусу иммунодефицита (SIV), который был сообщен им путем вакцинации; однако решающие факторы, которые в данном случае коррелируют с иммунитетом, пока еще не ясны (Saez-Cirion, A., Pancino, G., Sinet, M., Venet, A., Lambotte, O. & Gr, A.E.H.C.S. HIV controllers: how do they tame the virus? Trends Immunol 28, 532-540 (2007); Deeks, S.G. & Walker, B.D. Human immunodeficiency virus controllers: Mechanisms of durable virus control in the absence of antiretroviral therapy. Immunity 27, 406-416 (2007); Koff, W.C., Johnson, P.R., Watkins, D.I., Burton, D.R., Lifson, J.D., Hasenkrug, K.J., McDermott, A.B., Schultz, A., Zamb, T.J., Boyle, R. & Desrosiers, R.C. HIV vaccine design: insights from live attenuated SIV vaccines. Nat Immunol 7, 19-23 (2006)). Особенно большого внимания заслуживает адаптивный иммунный ответ, и недавно проведенные исследования природной иммунной системы показали его важность в формировании адаптивного ответа (Pulendran, B. & Ahmed, R. Translating innate immunity into immunological memory: Implications for vaccine development. Cell 124, 849-863 (2006)). Имеющиеся в настоящее время анализы, проводимые путем мониторинга эффективной элиминации инфицированных клеток иммунными клетками, не позволяют в достаточной степени охарактеризовать гетерогенность в отношении их функций (Fauci, A. S., Johnston, M.I., Dieffenbach, C. W., Burton, D.R., Hammer, S. M., Hoxie, J.A., Martin, M., Overbaugh, J., Watkins, D.I., Mahmoud, A. & Greene, W.C. Perspective - HIV vaccine research: The way forward. Science 321, 530-532 (2008); Walker, B.D. & Burton, D.R. Toward an AIDS vaccine. Science 320, 760-764 (2008)). Настоящее изобретение относится к способам характеристики и корреляции множества иммунных функций отдельных клеток различных линий дифференцировки для анализа субпопуляций эффекторных клеток у пациентов различных групп, например у пациентов с острыми инфекциями, у пациентов с хроническим прогрессирующим заболеванием, у пациентов, подвергаемых интенсивной антиретровирусной терапии (HAART), и у «элит-контроллеров». Как описано в настоящей заявке, количественные анализы клеток позволяют идентифицировать клетки, имеющие специфические комбинации функций, необходимых для регуляции репликации вирусов.
Другим средством защиты от вирусных инфекций является природный иммунный ответ. NK-клетки представляют собой центральный компонент такого ответа (Alter, G., Teigen, N., Ahem, R., Streeck, H., Meier, A., Rosenberg, E.S. & Altfeld, M. Evolution of innate and adaptive effector cell functions during acute HIV-1 infection. J. Infect Dis 195, 1452-1460 (2007)). Такими клетками являются цитотоксические эффекторные клетки, которые также индуцируют адаптивные иммунные ответы посредством высвобождения цитокинов, таких как IFN-γ, MIP-1β, TNF-α и GM-CSF. В случае ВИЧ-1-инфекции данные эпидемиологических исследований со всей очевидностью продемонстрировали, что у индивидуумов, у которых имеются конкретные NK-клеточные рецепторы (рецептор цитотоксического иммуноглобулина 3DS1 (KIR3DS1) и некоторые аллели KIR3DL1) и их предполагаемые лиганды (аллели HLA-B с изолейцином в положении 80), СПИД прогрессирует более медленно, чем у пациентов, у которых имеется только один или из этих аллелей или вообще отсутствуют эти аллели (Martin, M.P., Qi, Y., Gao, X.J., Yamada, E., Martin, J.N., Pereyra, F., Colombo, S., Brown, E.E., Shupert, W.L., Phair, J., Goedert, J.J., Buchbinder, S., Kirk, G.D., Telenti, A., Connors, M., O'Brien, S.J., Walker, B.D., Parham, P., Deeks, S. G., McVicar, D. W. & Carrington, M. Innate partnership of HLA-B and KIR3DL1 subtypes against HIV-1. Nat Genet 39, 733-740 (2007)). Аналогичным образом, повышенная активность NK-клеток и повышенная экспрессия транскриптов KIR3DS1 в массе NK-клеток коррелирует с иммунитетом к инфекции даже после повторного инфицирования (Alter, G., Martin, M.P., Teigen, N., Carr, W.H., Suscovich, T.J., Schneidewind, A., Streeck, H., Waring, M., Meier, A., Brander, C, Lifson, J.D., Allen, T.M., Carrington, M. & Altfeld, M. Differential natural killer cell-mediated inhibition of HIV-I replication based on distinct KIR/HLA subtypes. The Journal of experimental medicine 204, 3027-3036 (2007); Long, B.R., Ndhlovu, L.C., Oksenberg, J.R., Lanier, L.L., Hecht, F.M., Nixon, D.F. & Barbour, J.D. Conferral of enhanced natural killer cell function by KIR3DS1 in early human immunodeficiency virus type 1 infection. J. Virol 82, 4785-4792 (2008)). Эти данные позволяют предположить, что конкретные популяции NK-клеток играют защитную роль в предупреждении и подавлении инфекции, однако точные фенотипы этих клеток пока не были определены.
Одним из механизмов, используемых NK-клетками для элиминации ВИЧ-инфицированных клеток, является прямой цитолиз после межклеточного контакта. Некоторые формы KIR, экспрессируемые на поверхности NK-клеток, посылают ингибирующие сигналы клетке, которая подавляет цитолитическую функцию при лигировании с HLA класса I, экспрессируемом на поверхности клетки-мишени (Moretta, A., Bottino, C, Mingari, M.C., Biassoni, R. & Moretta, L. What is a natural killer cell? Nat Immunol 3, 6-8 (2002)). В отсутствие таких взаимодействий NK-клетки активируют