Система и способ лечения методом ультразвуковой терапии
Иллюстрации
Показать все
Изобретение относится к медицинской технике, а именно к средствам ультразвуковой терапии. Система для подведения ультразвуковой терапии к ткани содержит ультразвуковой аппликатор, содержащий один или более преобразовательных элементов, работающих в режиме формирования изображения для формирования с перерывами изображения ткани, подлежащей лечению, множество линз с переменным фокусом, прикрепленных к одному или более преобразовательным элементам, причем управление фокусировкой каждой из множества линз осуществляется сигналом напряжения на линзе, контроллер перемещений ультразвукового аппликатора в одном из направления поворота и осевого направления и контроллер лечебной процедуры для приема сигналов изображений в качестве входных данных и управления сигналом напряжения, подаваемым на каждую из множества линз с переменным фокусом. Контроллер лечебной процедуры служит для направления ультразвукового терапевтического пучка. По меньшей мере три линзы с переменным фокусом из множества линз размещены бок о бок на каждом из преобразовательных элементов для формирования основного пучка на оптической оси по меньшей мере трех линз. Каждая из трех линз с переменным фокусом выполнена с возможностью раздельного управления контроллером лечебной процедуры для изменения апертуры основного пучка и формирования расходящихся пучков по сторонам от основного пучка. Способ изменения апертуры основного пучка содержит этапы, на которых размещают ультразвуковой аппликатор с одним или более ультразвуковыми преобразовательными элементами вблизи представляющей интерес ткани, возбуждают по меньшей мере один преобразовательный элемент сигналом возбуждения, контролируют эффект от этапа возбуждения с помощью изображений, управляют апертурой основного пучка и перемещают или поворачивают ультразвуковой аппликатор для охвата терапией по существу разных областей ткани для лечения разных областей ткани. Использование изобретения позволяет проводить точную настройку терапевтического пучка для проведения терапии в простатах различных размеров и форм с исключением поражения таких критических структур, как ректальная стенка и нервные узлы. 2 н. и 16 з.п. ф-лы, 7 ил.
Реферат
Настоящая заявка относится к области техники лечения, в частности к системам и способам лечения методом ультразвуковой терапии, и, конкретно, для лечения простаты.
Рак простаты занимает место в ряду основных причин заболеваемости и смертности в мире. По оценкам Американского общества по борьбе с раковыми заболеваниями (ACS) в 2007 г. будет выявлено 220000 новых случаев рака простаты, в связи с чем рак данного типа оказывается вторым по частоте диагностируемых раковых заболеваний мужчин США после немеланомного рака кожи. Кроме того, предполагается, что в США в 2007 г. от данного заболевания умрет 27000 мужчин. Рак простаты является характерным заболеванием не только для западного мира и входит в число 5 наиболее часто диагностируемых раковых заболеваний в мире. Доброкачественная гиперплазия простаты (BPH), или увеличение простаты, является другим заболеванием простаты и характеризуется мочеполовыми симптомами. Исследования показали, что у 50% всех мужчин после пятидесяти лет и у 90% мужчин после девяноста лет обнаруживаются некоторые патологические симптомы BPH.
Высокие показатели заболеваемости как раком простаты, так и BPH явились причиной усиленного изучения проблемы лечения упомянутых заболеваний. Общепринятые методы лечения рака простаты содержат радикальную простатэктомию, лучевую терапию внешним пучком, брахитерапию, криотерапию, гормональную терапию и химиотерапию. Все приведенные методы терапии вызывают соответствующие им побочные эффекты вследствие либо инвазивного характера, либо неспецифичности лечения, либо применения ионизирующего излучения, либо невозможности идентификации и назначения для облучения локализованного рака во время процедуры. Кроме того, побочные эффекты (проблемы с недержанием, импотенцией, кишечником), связанные с современными методами терапии, ограничивают их применение. Многие недостатки современных методов терапии рака простаты устраняются при использовании терапевтического ультразвука, например высокоинтенсивного сфокусированного ультразвука (HIFU), в частности, с управлением по изображениям. Метод HIFU в применении к простате является минимально инвазивным, обеспечивает неионизирующую абляционную терапию любого места внутри простаты и в связи с управлением по изображениям позволяет в реальном времени нацеливать терапию на конкретно идентифицированные локализованные участки раковых опухолей внутри и вокруг простаты. Кроме того, упомянутый метод можно применять в качестве терапии, дополнительной к облучению, и для локализации доставки новых лекарств к простате.
Современные подходы к ультразвуковой абляции простаты включают в себя трансректальные устройства, которые одобрены в Европе и ряде стран мира (Rewcastle 2006). Ограничения упомянутых устройств содержат продолжительное время процедуры (свыше 3 - 4 часов), невозможность лечения простат большого размера (простат, имеющих переднезадний размер больше чем 2,5 см или 4 см в зависимости от производителя) и вероятность развития импотенции до 60% (хотя и ниже чем вероятность 90% по опубликованным данным для альтернативных методов). Общий объем простаты, подвергаемой лечению упомянутыми устройствами, должен быть меньше чем 40 куб. см, и, во многих случаях выполняют уменьшение размера с использованием методов гормональной терапии или TURP (трансуретральной резекции простаты). Другими ограничениями являются искажение терапевтического ультразвука ректальной стенкой до достижения простаты и вероятность нагрева ректальной стенки в ближней зоне.
Для преодоления вышеупомянутых проблем предложены трансуретральные ультразвуковые аппликаторы, в которых одноэлементные преобразователи вводят в уретру для заполнения ультразвуком области впереди уретры и иногда поворачивают для охвата полного поперечного сечения. Трансуретральная конструкция предпочтительна потому, что обеспечивает прямой акустический доступ к предстательной железе без воздействий промежуточных тканей. На практике вдоль оси уретры располагают несколько преобразователей, чтобы охватить 3-мерный объем.
В настоящее время из-за пространственных ограничений в уретре трансуретральные преобразователи используют только один или малое число одноэлементных преобразователей. Приведенное ограничение лишает возможности настраивать направление или фокусировку пучка для назначения целью конкретных областей в простате, как обычно принято при электронной фокусировке с использованием нескольких элементов (обычно до 128 элементов в традиционной решетке ультразвуковых преобразователей для формирования изображений). Из-за отсутствия управления пучком трудно избежать повреждения чувствительных структур, например нервных пучков, при нацеливании на области опухолей в простате. Хотя для перемещения пучка к различным областям внутри простаты по поперечному сечению можно применить механический поворот, и для перемещения пучка вдоль оси простаты можно применить поступательное смещение, механическое движение не может перемещать пучок вдоль направления распространения ультразвука (осевого направления) от уретры к капсуле простаты.
Таким образом, одноэлементные терапевтические преобразователи, производимые в настоящее время, либо имеют плоскую поверхность, либо содержат механический объектив-линзу с криволинейными поверхностями (вогнутую или выпуклую) для придания линзе постоянной фокусировки. Упомянутую фокусировку преобразователя нельзя изменить после изготовления.
Технология Fluid Focus (фокусировки с помощью текучих сред) является решением, описанным в документах WO 03/069380 и WO 2005/122139 и предназначенным для обеспечения возможности фокусировать свет посредством изменения физических граничных поверхностей (т.е. мениска) полости, наполненной текучей средой с определенными показателями преломления. Технология, известная под названием электросмачивания, в соответствии с которой текучую среду внутри полости перемещают подачей напряжения на проводящие электроды, обеспечивает перемещение поверхности текучей среды. Упомянутое изменение топологии поверхности позволяет отражать свет таким образом, чтобы изменять путь распространения для обеспечения фокусировки.
Ультразвук распространяется в жидкой среде; фактически, человеческое тело часто называют жидкостью, не допускающей переноса иных высокочастотных ультразвуковых волн, кроме волн сжатия. В этом смысле волны подвержены искажению из-за различий скорости распространения ультразвука в объеме ткани, а также из-за резких изменений скорости звука на внутренних поверхностях раздела. Именно упомянутое свойство применяется в настоящем изобретении, которое предусматривает возможность использования управляемой жидкой линзы (например, линзы системы Fluid Focus (далее по тексту именуемой жидкостной фокусирующей линзой)) с двумя жидкостями, обладающими разными скоростями звука, чтобы посредством изменения формы поверхности раздела между жидкостями можно было управлять положением фокуса и направлением распространения ультразвуковых волн.
Сущность изобретения представлена в соответствии с параграфом 1.73 раздела 37 Свода федеральных правил (37 C.F.R. § 1.73), который требует, чтобы раздел «Сущность изобретения» кратко указывал характер и сущность изобретения. Сущность изобретения представляют в предположении, что она не должна служить для интерпретации или ограничения объема или смысла формулы изобретения.
В соответствии с одним аспектом примерных вариантов осуществления предлагается система для подведения ультразвуковой терапии к ткани. Система содержит ультразвуковой аппликатор, содержащий, по меньшей мере, один преобразовательный элемент. К преобразовательному элементу прикреплена, по меньшей мере, одна линза с переменным фокусом, при этом управление фокусировкой линзы с переменным фокусом осуществляется сигналом напряжения. Для получения изображений ткани, подлежащей лечению, предусмотрено средство визуализации. Предусмотрен также контроллер перемещений, выполненный с возможностью перемещения ультразвукового аппликатора в, по меньшей мере, одном из: направления поворота и осевого направления, вместе с контроллером лечебной процедуры, который принимает входные данные из средства визуализации и управляет напряжением, подаваемым на линзу с переменным фокусом. Контроллер лечебной процедуры управляет сигналами напряжения на линзе, по меньшей мере, частично определяемыми по входным данным из средства визуализации, и служит для направления ультразвукового терапевтического пучка, излучаемого упомянутым, по меньшей мере, одним преобразовательным элементом.
В настоящем изобретении применяют предпочтительно жидкостные фокусирующие линзы, что позволяет настраивать фокусировку преобразователя во время процедур сканирования для управления аксиальной, поперечной или вертикальной фокусировкой преобразователей с одним или несколькими элементами. Ультразвуковой аппликатор может иметь конфигурацию для лечения (например, простаты) с трансуретральным доступом и линза с переменным фокусом позволяет терапевтическому преобразователю направлять терапевтические пучки глубже внутрь простаты и подводить терапию вдоль большего числа направлений (разносить терапевтические пучки, направляемые под углом, поперечно и вертикально) вместо необходимости поворачивать преобразователь в новую зону, тем самым повышая точность подведения терапии и сокращая время терапии.
Изобретение допускает также точную настройку терапевтического пучка для подведения терапии простаты различных размеров и форм с исключением поражения таких критических структур, как ректальная стенка и нервные пучки. Один и тот же элемент можно использовать для создания как расходящихся пучков для медленного и консервативного лечения (например, по направлению к задней стороне), так и сходящихся пучков для ускоренного и/или более глубокого лечения (например, по направлению к передней стороне).
При одной конфигурации жидкостная фокусирующая линза может содержать множество элементов жидкостной фокусирующей линзы, расположенных на преобразовательном элементе. В предпочтительной конфигурации в ультразвуковом аппликаторе можно обеспечить множество преобразовательных элементов. Множество преобразовательных элементов предпочтительно расположено аксиально вдоль удлиненного ультразвукового аппликатора. В некоторых конфигурациях можно применять единственную линзу с переменным фокусом, охватывающую множество преобразовательных элементов, например соседних элементов. Некоторые конфигурации могут содержать комбинацию преобразовательных элементов и линз с переменным фокусом в единственном аппликаторе, например некоторые из преобразовательных элементов могут содержать линзу с переменным фокусом, выполненную из множества элементов жидкостной фокусирующей линзы, некоторые могут содержать единственную линзу с переменным фокусом, и некоторые могут содержать одну линзу с переменным фокусом, охватывающую, по меньшей мере, два преобразовательных элемента. Точную конфигурацию линз и элементов можно подбирать и изменять в соответствии с требуемым применением.
Средство визуализации может обеспечивать, по меньшей мере, какое-то одно из: изображений для планирования перед лечением и изображений для обратной связи во время лечения. Средство визуализации может быть любым подходящим средством визуализации. Например, средство визуализации может быть, по меньшей мере, каким-то одним из следующих средств: пульсирующий ультразвуковой пучок для визуализации, излучаемый упомянутым, по меньшей мере, одним преобразовательным элементом, система эндоректальной или вагинальной ультрасонографии, система ультразвуковой визуализации, содержащая внешний преобразователь, система магнитно-резонансной визуализации с возможностью или без выполнения MRI-термометрии (магнитно-резонансной термометрии), система визуализации методом PET (позитронно-эмиссионной томографии), система визуализации методом CT (компьютерной томографии), система визуализации с контрастным усилением, система тепловизионного контроля и/или система контроля эластичности тканей и любая из комбинаций вышеприведенных средств.
Контроллер лечебной процедуры может дополнительно управлять сигналом возбуждения, по меньшей мере, одного преобразовательного элемента, по меньшей мере, частично определяемым по входным данным из средства визуализации. Для предоставления оператору возможности визуализировать изображения из средства визуализации и видоизменять операции контроллера лечебной процедуры, может быть обеспечен пользовательский интерфейс.
В соответствии с другим аспектом примерных вариантов осуществления предлагается способ лечения ткани, который предусматривает размещение ультразвукового аппликатора с, по меньшей мере, одним ультразвуковым преобразовательным элементом вблизи представляющей интерес ткани. Способ дополнительно предусматривает возбуждение, по меньшей мере, одного из ультразвуковых преобразовательных элементов сигналом возбуждения и контроль эффекта лечения с помощью средства визуализации. Фокусировкой, по меньшей мере, одного из ультразвуковых преобразовательных элементов можно управлять регулированием напряжения, подаваемого на линзу с переменным фокусом, закрепленную на ультразвуковом преобразовательном элементе, на основании информации из средства визуализации. Способ дополнительно содержит этап перемещения или поворота ультразвукового аппликатора для проведения терапии в, по существу, разных областях в ткани.
В предпочтительной конфигурации линза с переменным фокусом является жидкостной фокусирующей линзой. Возможность настройки фокусировки пучка дает различные преимущества. Например, возможность направления пучка позволяет выводить пучок из плоскости лечения и устраняет недействующие участки между позициями элементов без необходимости механического смещения.
Способ может дополнительно содержать этап получения перед лечением предназначенных для планирования изображений ткани, подлежащей лечению, в дополнение к контрольным изображениям во время лечения. Средство визуализации может обеспечивать, по меньшей мере, какое-то одно из ультразвуковых изображений, магнитно-резонансных изображений, изображений, полученных методом магнитно-резонансной термометрии, изображений, полученных методом позитронно-эмиссионной томографии (PET-изображений), изображений, полученных методом компьютерной томографии (CT-изображений), изображений, полученных методом тепловизионного контроля, и изображений, полученных методом контроля эластичности тканей, и любые комбинации упомянутых изображений.
Для предоставления оператору возможности визуализировать изображения из средства визуализации и видоизменять операции контроллера лечебной процедуры, который управляет напряжением, подаваемым на линзу с переменным фокусом, может быть обеспечен пользовательский интерфейс. Управление перемещением и/или поворотом ультразвукового аппликатора осуществляется контроллером лечебной процедуры с возможностью изменения оператором.
Способ может также предусматривать управление сигналом возбуждения, по меньшей мере, одного ультразвукового преобразовательного элемента, по меньшей мере, частично на основании информации из средства визуализации, для управления, по меньшей мере, чем-то одним из: соответствующей амплитуды, частоты и фазы сигнала. Следовательно, возможно одновременное управление как фокусировкой пучка, так и интенсивностью и частотой пучка.
Вышеупомянутые и другие признаки и преимущества настоящего изобретения станут очевидны и понятны специалистам в данной области техники из нижеследующего подробного описания, чертежей и прилагаемой формулы изобретения.
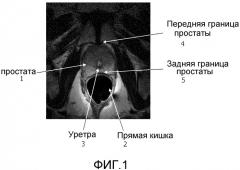
Фигура 1 - магнитно-резонансное (MR) изображение простаты в поперечном сечении.
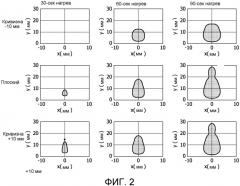
Фигура 2 - изображения, представляющие влияние кривизны элемента на схему распределения тепловой дозы для случая трех разных значений кривизны. Ось y является направлением распространения ультразвукового пучка.
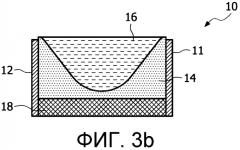
Фигуры 3a - 3d - изображения, представляющие поднабор линзовых структур, выполненных по технологии жидкостных фокусирующих линз.
Фигуры 4a - 4d - изображения, представляющие примерные сценарии возможного управления изменением направления с использованием технологии жидкостных фокусирующих линз.
Фигуры 5a и 5b - изображения, представляющие примеры применения 3 линз (L1, L2 и L3) для управления апертурой пучка.
Фигура 6 - схематичное представление системы ультразвуковой терапии с элементами, управляемыми жидкостными фокусирующими линзами, в соответствии с настоящим изобретением.
Фигура 7 - блок-схема последовательности операций в варианте осуществления способа подведения терапии/обратной связи в клинических условиях.
Примерные варианты осуществления настоящего изобретения описаны со ссылкой на ультразвуковую терапию человека. Специалисту со средним уровнем компетентности в данной области техники должно быть понятно, что примерные варианты осуществления настоящего изобретения можно применить для ультразвуковой терапии других типов и к другим участкам тела человека или животного. Применение способа и системы в соответствии с примерными вариантами осуществления настоящего изобретения можно адаптировать для использования с аппликаторами других типов.
На фигуре 1 чертежей показано поперечное сечение простаты (1) и прямой кишки (2), где видно, что расстояние от уретры (3) до края простаты (капсулы) не одинаково. В общем, расстояние от уретры (3) до передней границы (4) больше (например, 3 см), чем расстояние до задней границы (5), на которой возникают большинство раковых заболеваний. Когда расстояние от уретры до капсулы простаты является небольшим, врач может предпочесть применение расходящегося пучка, который может обеспечить замедленное и более консервативное лечение. С другой стороны, когда расстояние от уретры до капсулы простаты является большим, врач может предпочесть применение сфокусированных пучков, которые могут обеспечивать более глубокое проникновение терапевтического пучка и/или достижение заданных мест дальше от преобразователя.
На фигуре 2 для пояснения вышеописанного принципа показаны результаты моделирования контуров тепловой дозы (240 минут при 43°C) для элементов с разными значениями кривизны элементов (непрерывно излучающих на частоте 4 МГц). Верхний ряд представляет случай нагрева посредством элемента с размерами 4×10 мм (поперечный размер × вертикальный размер) и кривизной 10 мм, приводящей к расходящимся пучкам. Кривизна имеет место в направлении x (поперечном), и элемент является плоским в направлении z (перпендикулярно плоскости чертежа, т.е. в вертикальном направлении). Средний ряд представляет тепловую дозу от элемента аналогичного размера, но без кривизны (т.е. плоским). Нижний ряд представляет тепловую дозу от элемента аналогичного размера, но имеющего кривизну +10 мм, приводящую к сходящимся пучкам. Разные столбцы показывают влияние ультразвуковых воздействий разной продолжительности: 30, 60 или 90 секунд, каждое с последующей фазой охлаждения продолжительностью 30 секунд. Можно видеть, что расходящийся пучок полезен, когда предпочтительно консервативное и медленное лечение (например, для тщательного контроля тепловой дозы вблизи ректальной стенки или нервных узлов). С другой стороны, сходящий пучок может быть полезен, когда выполняется лечение в более глубоких местах и когда нет опасности повреждения критически важных структур (например, по направлению к передней стороне простаты), так как упомянутый пучок приводит к ускорению лечения.
Примерные варианты осуществления изобретения используют либо одно-, либо многоэлементный ультразвуковой преобразователь с одной или несколькими ультразвуковыми жидкостными фокусирующими линзами, расположенными над элементом(ами). Линза может состоять из двух жидкостей с согласующимися импедансами, но с разными скоростями звука. Подобное решение допускает максимум распространения в прямом направлении с возможностью управления направлением ультразвукового пучка. Жидкость в полости линзы будет обладать скоростью звука, выбранной из расчета максимального повышения гибкости фокусировки и рефракции ультразвукового сигнала. Жидкостная линза может содержать, по меньшей мере, два электрода, установленных так, чтобы обеспечивать управление топологией поверхности мениска, который, в свою очередь, будет допускать управление рефракцией ультразвукового пучка.
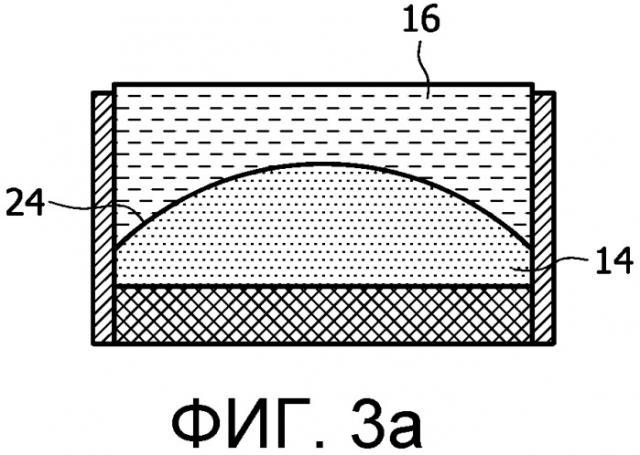
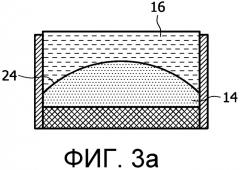
На фигурах 3a-3d представлен поднабор линзовых структур, использующих жидкостную фокусирующую линзу 10. Напряжение на электродах 11, 12 изменяет поверхность между 2 жидкостями (в данном случае маслом 14 и водой 16) для формирования разных линзовых конфигураций, которые будут изменять фокусировку в аксиальном направлении (направлении распространения) или направлять терапевтический пучок, излучаемый преобразователем 18. Жидкости расположены между двумя тонкими контактными пленочными слоями 20, 22, препятствующими утечке жидкостей. Собирающая линза (показанная на фигуре 3a) образуется, когда к мениску 24 между маслом 14 и водой 16 (или другими жидкостями, использованными в линзе) прилагаются усилия, формирующие выпуклую форму, в результате воздействия электродов 11, 12 на электропроводящую воду 16. Аналогично, рассеивающая линза образуется (как показано на фигуре 3b), когда масло испытывает воздействие, формирующее вогнутую форму. Как показано на фигурах 3c и 3d, линзы, управляющие изменением направления, могут формироваться, когда мениск 24 испытывает воздействие, создающее приблизительно треугольную конфигурацию.
Кривизну мениска 24 можно создавать вдоль одного измерения или вдоль двух измерений элемента в зависимости от числа электродных пар, используемых для наведения изменения напряжения, и таким образом можно формировать плоскую, полусферическую или цилиндрическую линзы. Изменения линзы могут происходить в реальном времени в течение процедуры лечения (вследствие изменений напряжения под управлением внешней системы управления) и тем самым создавать возможность управления фокусировкой в направлении распространения терапевтического пучка, а также изменением направления терапевтического пучка. В таком случае терапевтический пучок можно направлять не только в поперечном направлении, но также по вертикали.
На фигурах 4a-4d представлены примерные конфигурации, допускающие управление изменением направления с использованием технологии жидкостных фокусирующих линз для ультразвукового терапевтического пучка 26. Линза, управляющая изменением направления, как показано на фигуре 4a, может направлять пучок влево или вверх/вниз вдоль вертикального измерения. Линза, управляющая изменением направления, как показано на фигуре 4d, может направлять пучок вправо. При использовании собирающей линзы, показанной на фигуре 4b, пучок 26 можно аксиально фокусировать в точке A, а посредством изменения выпуклой формы мениска 24 точку фокусировки пучка 26 можно изменить на точку B, как показано на фигуре 4c. Изменения жидкой линзы можно выполнять в реальном времени одновременно с излучением ультразвукового терапевтического пучка 26, что изменяет фокусировку пучка, как требуется, чтобы достигнуть областей простаты, которые врач планирует лечить.
На фигурах 5a и 5b показано применение трех жидкостных фокусирующих линз L1, L2 и L3 для управления апертурой пучка 26. Линзы L1, L2 и L3 расположены в ряд на одном преобразователе 18. При раздельном управлении тремя наборами электродов 11, 12 можно создать систему, посредством которой либо используют полную апертуру, как показано на фигуре 5a, либо при формировании линзы L1 в виде линзы для поворота влево и линзы L3 в виде линзы для поворота вправо, как показано на фигуре 5b, можно сфокусировать большую часть энергии пучка линзой L2, чтобы использовать меньшую апертуру для осевого пучка 26. Линзами L1, L3 создаются менее энергетические пучки 28, 30, которые отклоняются от осевого пучка и содержат меньше энергии, чем основной пучок 26, и которые не мешают лечению благодаря низкой энергии.
Система для лечения заболеваний простаты, применяющая трансуретральную ультразвуковую терапию и/или систему визуализации, показана на фигуре 6. Управление направлением и фокусировка ультразвуковых пучков выполняются при помощи вышеописанной технологии жидкостных фокусирующих линз. Изобретение позволяет точно настраивать ультразвуковой терапевтический пучок для подведения терапии в простаты различных размеров и форм с исключением поражения таких критических структур, как ректальная стенка и нервные пучки. Один и тот же элемент можно использовать для создания как расходящихся пучков для медленного и консервативного лечения (например, по направлению к задней стороне), так и сходящихся пучков для ускоренного и/или более глубокого лечения (например, по направлению к передней стороне).
Как показано на фигуре 6, система может содержать ультразвуковой аппликатор 100, который содержит множество ультразвуковых преобразовательных элементов 102 и который можно перемещать с помощью электродвигателя 104. Например, в аппликаторе можно обеспечить восемь ультразвуковых преобразовательных элементов 102, хотя следует понимать, что число элементов можно изменять. Каждый преобразовательный элемент 102 может быть снабжен жидкостной фокусирующей линзой 10 (не показанной отдельно на фигуре 6), или, например, можно обеспечивать одну жидкостную фокусирующую линзу 10 для охвата, по меньшей мере, двух соседних преобразовательных элементов 102 или в других конфигурациях можно применить несколько жидкостных фокусирующих линз 10 с одним преобразовательным элементом 102. Аппликатор 100 можно размещать внутри или с примыканием к ткани T, подлежащей лечению, например простате. С аппликатором 100 могут быть соединены различные элементы управления, включая источник 106 питания для возбуждения преобразовательных элементов 102 и источник 108 напряжения для управления жидкостной фокусирующей линзой, закрепленной на каждом элементе 102. Система может также содержать электропривод и контроллер 110 перемещений, которые могут перемещать и/или поворачивать аппликатор посредством управления электродвигателем 104. Компоненты 104, 106 и 108 могут быть подсоединены к аппликатору 110 кабелями 112, 114 и 116 соответственно. При желании, можно также включить в состав системы источник 118 подачи воды охлаждения, чтобы воду можно было прокачивать вблизи преобразовательных элементов 102 по шлангу 120.
Можно обеспечить контроллер 122 лечебной процедуры, который управляет функционированием компонентов 104, 106, 108 и 110 и который принимает входные данные из подсистемы 124 визуализации для получения изображений для планирования и/или изображений обратной связи для контроля лечения (например, методами ультразвуковой или магнитно-резонансной (MR) визуализации, или с помощью любой другой подходящей системы визуализации, или методом тепловизионного контроля, или другими способами контроля информации в виде изображений, которые оценивают механические изменения в ткани в результате лечения). Контроллер 122 лечебной процедуры управляет сигналом возбуждения преобразовательных элементов и напряжением, подаваемым на жидкостную фокусирующую линзу, для подведения терапии к простате. Контроллер 122 лечебной процедуры может управлять перемещением аппликатора, чтобы направлять терапевтический пучок в намеченное в качестве мишени место. Контроллер 122 лечебной процедуры может быть подсоединен к пользовательскому интерфейсу 126 таким образом, чтобы данным контроллером мог управлять врач-оператор.
В первом варианте осуществления, по меньшей мере, один элемент 102, выполненный по технологии фокусировки с помощью текучих сред, может располагаться по окружности уретры и, тем самым, составлять один ряд элементов, подлежащих использованию для терапии. Вдоль оси аппликатора 100 может располагаться несколько рядов элементов, например можно применить восемь рядов элементов 102. Обычно уретра имеет диаметр около 6 мм, и поэтому число элементов в ряду может зависеть от размера элементов. Кроме того, следует отметить, что отношение высоты жидкостной фокусирующей линзы 10 к ее ширине влияет на степень фокусировки, которую можно обеспечить, и поэтому влияние размеров следует тщательно учитывать, чтобы обеспечить надлежащий компромисс между числом и размером преобразовательных элементов 102 с требуемыми прикрепленными жидкостными фокусирующими линзами 10 и степенью фокусировки. Рабочая частота передачи преобразователя составляет предпочтительно 4 МГц (в режиме постоянного излучения (CW) или с, по существу, высоким заполнением цикла), однако можно использовать любую частоту от приблизительно 0,5 до приблизительно 20 МГц. Терапевтические элементы могут быть встроены в баллон, который можно заполнять водой или текучей средой для акустической связи. Выбор, по меньшей мере, двух текучих сред (плотности, скорости звука, слоев между линзой и преобразователем и между линзой и внешней текучей средой) в линзовой системе можно производить из расчета, чтобы не происходило разрушения линзы энергией терапевтического пучка.
Кроме того, жидкостная фокусирующая линза 10 может располагаться поверх механически искривленного преобразовательного элемента. В таком случае жидкостная фокусирующая линза 10 будет предоставлять возможность локальных настроек фокусировки около постоянной фокусировки преобразовательного элемента и допускать управление направлением терапевтического пучка в вертикальном или поперечном направлении.
Примерный способ подведения терапии к простате описан со ссылкой на фигуру 7. На первом этапе 200 выполняются предварительная визуализация и планирование терапии. Упомянутый этап может содержать получение обычных ультразвуковых изображений (например, изображений в B-режиме сканирования), которые можно получать и представлять оператору, который выбирает объемы лечения (всю простату или ее участок). Упомянутую визуализацию можно производить с использованием эндоректальных преобразователей, внешних преобразователей и т.п. В альтернативном варианте можно применять систему магнитно-резонансной визуализации, позитронно-эмиссионный томограф (PET), компьютерный томограф (CT), метод контрастной визуализации и различные другие методы, предполагающие использование ультразвука и магнитного резонанса (MR). Ультразвуковую визуализацию можно выполнять с использованием эндоректальных преобразователей или внешних преобразователей. Предварительную визуализацию и планирование терапии можно выполнять за несколько дней до терапии, на усмотрение лечащего врача.
На этапе 202 после надлежащего расположения пациента и воздействия на него седативным средством при необходимости терапевтический датчик вводят в уретру на заданное первое место лечения простаты. Затем оператор наводит жидкостную фокусирующую линзу на глубокое место фокусировки посредством контроллера 122 лечебной процедуры с помощью пользовательского интерфейса 126, чтобы передать управляющие сигналы, задающие соответствующую жидкостную фокусирующую линзу для начала терапии простаты с переднего участка простаты, на этапе 204. Затем проводят терапию в упомянутом месте при одновременном контроле с помощью средства визуализации на этапе 206, чтобы обеспечивать надлежащий ход лечения. Средство визуализации обеспечивает обратную связь во время лечения и может быть отдельным ультразвуковым преобразователем, системой магнитно-резонансной визуализации, позитронно-эмиссионным томографом (PET), компьютерным томографом (CT), методом контрастной визуализации и различными другими методами, предполагающими использование ультразвука и магнитного резонанса (MR), в том числе ультразвуковую (US) или магнитно-резонансную (MR) термометрию. Упомянутую визуализацию можно выполнять с использованием эндоректальных преобразователей, внешних преобразователей и т.п., как при визуализации для предварительного планирования. В некоторых вариантах осуществления можно использовать температурную обратную связь вместо или в дополнение к ультразвуковой или другой визуализации, чтобы предоставлять оператору обратную связь (например, анатомическую, функциональную информацию или информацию о механической жесткости). В альтернативном варианте терапевтический преобразователь сам по себе может быть сконфигурирован для формирования с перерывами изображения простаты во время лечения.
На этапе 208 лечение анализируют, чтобы понять, завершено ли лечение. Если лечение завершено, то лечение можно прекратить с этого места (этап 210). Если лечение не завершено, то на этапе 212 поступает вопрос, завершено ли лечение для данного конкретного места расположения преобразователя, жидкостную фокусирующую линзу можно настроить на меньшую глубину и терапию можно подводить в данном новом направлении (этап 214). Жидкостную фокусирующую линзу можно настраивать при необходимости для направления пучка в вертикальном и поперечном направлениях. Размах управления направлением определяется апертурой преобразователя, выбранными текучими средами и высотой и конструкцией жидкостной фокусирующей линзы (т.е. преобразователь типичного диаметра 6 мм с линзой высотой 5 мм может предоставлять возможность управления направлением по углу около ±22 градусов от центральной оси с охватом в сумме около 45 градусов). После того как в исходной позиции преобразователя завершено всевозможное управление направлением, преобразователь можно повернуть (этап 216) и сместить в новую позицию для продолжения терапии и повторять фокусировку и изменение позиции до тех пор, пока не будет выполнено лечение всей простаты, с соответствующим внесением надлежащих видоизменений в жидкостную фокусирующую линзу.
Применение технологии жидкостных фокусирующих линз позволяет повысить управляемость лечения посредством настройки направления и фокусировки вдоль направления луча и обеспечивает широкие и узкие терапевтические пучки. Кроме того, время лечения можно сократить по сравнению с существующими одноэлементными конструкциями преобразователей, так как возможность управлять направлением методом фокусировки с помощью текучих сред допускает больший охват простаты до механического смещения/поворота в новую позицию.
Таким образом, изобретение допускает точную настройку ультразвукового терапевтического пучка для подведения терапии простаты различных размеров и форм с исключением поражения таких критических структур, как ректальная стенка и нервные пучки. Один и тот же элемент можно использовать для создания как расходящихся пучков для медленного и консервативного лечения (например, по направлению к задней стороне), так и сходящихся пучков для ускоренного и/или более глубокого лечения (например, по направлению к передней стороне).
В дополнительных вариантах осуществления можно применять несколько жидкостных фокусирующих линз на одном терапевтическом элементе, как поясняется со ссылкой на фигуры 5a и 5b, для создания возможности изменений апертуры, которые изменяют глубину резкости терапевтического пучка и разрешающую способность посредством изменения размера апертуры. Апертура меньшего размера может доставлять энергию по большему элементу разрешения, чем апертура большего размера, заданная физическим размером терапевтического элемента.
Возможна разработка комбинации из терапевтических преобразователей, содержащих один или несколько элементов, и преобразователей для ультразвуковой визуализации для терапии, контроля и оценки простаты, с жидкостными фокусирующими линзами в трансуретральном устройстве. В данном варианте осуществления терапевтические и визуализирующие элементы могут различаться или могут быть одними и теми же. В предпочтительном варианте визуализация будет выполняться до, после или с перерывами во время терапии.
Хотя лечение методом ультразвуковой терапии описано применительно к простате, предполагается также возможность других видов лечения ме