Внутриглазные системы доставки лекарственного средства с замедленным высвобождением и способы лечения глазных заболеваний
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для лечения повышенного внутриглазного давления. Используются биосовместимые, биоразлагаемые имплантаты и микросферы с замедленным высвобождением, включающие антигипертензивный агент и биоразлагаемый полимер, для внутрикамерного размещения или размещения внутри передней части стекловидного тела. Диаметр микросфер от 30 до 100 микрон, микросферы содержат от 10 до 30 масс.% антигипертензивного агента и от 70 до 90 масс.% биоразлагаемого полимера. Высвобождение антигипертензивного агента от 10 до 120 дней. Группа изобретений позволяет повысить эффективность лечения гипертензивного патологического состояния глаза, такого как глаукома. 4 н. и 8 з.п. ф-лы, 9 пр., 10 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА
Настоящая заявка испрашивает приоритет на основании не являющейся предварительной заявки на патент США №12/411250, поданной 25 марта 2009 года, полное описание которой включено в настоящий документ посредством данной конкретной ссылки.
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к внутриглазным системам и способам лечения глазных заболеваний. В частности, настоящее изобретение направлено на местное применение систем доставки лекарственных средств с замедленным высвобождением (т.е. микросфер и/или имплантатов, содержащих лекарственный препарат) в переднюю камеру глаза (т.е. внутрикамерное введение) и/или в переднюю камеру стекловидного тела глаза для лечения повышенного внутриглазного давления в водной камере глаза (т.е. гипертензивного состояния), которое может быть симптомом глаукомы или риска развития глаукомы.
Системы доставки лекарственного средства согласно нашему изобретению могут представлять собой имплантат, содержащий лекарственный препарат (т.е. единую монолитную систему доставки лекарственного средства с замедленным высвобождением) или имплантаты либо множество микросфер, содержащих лекарственный препарат (синонимично называемые «микрочастицы»). Систему доставки лекарственного средства можно применять терапевтически для лечения глазного заболевания или состояния, такого как повышенное внутриглазное давление и/или глаукома. Глаукома представляет собой заболевание глаза, характеризующееся повышенным внутриглазным давлением (ВГД) в водной камере глаза. При отсутствии лечения глаукома может привести к слепоте. Глаукома может быть первичной или вторичной. Первичная глаукома у взрослых (врожденная глаукома) может быть открытоугольной, или острой, или хронической закрытоугольной. Вторичная глаукома возникает в результате ранее существовавших глазных заболеваний, таких как увеит, внутриглазная опухоль или увеличенная катаракта. Для понижения ВГД и лечения глаукомы применялись различные гипертензивные агенты. Например, для лечения внутриглазной гипертензии и глаукомы применялись некоторые простагландины и их аналоги и производные, такие как производное латанопроста PGF2a (иногда называемое простагландиновым аналогом F2α), продаваемое под торговой маркой Ксалатан®. Внутриглазные имплантаты и микросферы, содержащие простагландин и простамид, описаны, например, в заявках на патент США №11/368845; 11/303462, 10/837260 и 12/259153. Особый интерес представляют примеры 1-5 на стр.36-47 заявки №12/259153. Также вызывает интерес заявка США №11/952938. Кроме того, также представляют интерес патенты США 5972326 и 5965152.
Общепринятый способ лечения глаукомы заключается в ежедневном применении глазных капель, содержащих антигипертензивный лекарственный препарат для снижения ВГД. Показатель соблюдения пациентами режима и схемы лечения регулярного, ежедневного применения глазных капель часто является низким. См., например, Nordstrom et al. AJO 2005; 140: 598. Кроме того, в результате неправильного применения глазной пипетки может возникнуть глазная инфекция. Поэтому существует потребность в продолжительном (т.е. с замедленным высвобождением) способе лечения внутриглазной гипертензии, который можно легко применять, например, во время посещения кабинета врача. Следовательно, было бы предпочтительно обеспечить внутриглазные системы доставки лекарственного средства с замедленным высвобождением (включающие имплантаты и/или микросферы) для внутриглазного терапевтического применения для лечения повышенного ВГД и/или глаукомы.
КРАТКОЕ ОПИСАНИЕ
Настоящее изобретение удовлетворяет эту потребность и обеспечивает внутриглазные системы доставки лекарственного средства с замедленным высвобождением, способы получения таких систем доставки лекарственного средства и способы лечения глазных заболеваний с применением предлагаемых систем. Внутриглазная система доставки лекарственного средства с замедленным высвобождением находится в форме имплантата или микросфер, которые преимущественно обеспечивают длительное высвобождение одного или более терапевтических антигипертензивных препаратов (например, простагландина или простамида, такого как латанопрост).
Определения
В настоящей заявке применяют следующие определения.
«Примерно» означает плюс или минут десять процентов от числа, параметра или характеристики, ограниченной таким образом.
«Микросфера» и «микрочастица» применяют как синонимы для обозначения устройства или детали малого диаметра или размера (см. ниже), которое структурировано, доведено до определенного размера или иным образом конфигурировано для внутрикамерного введения. Микросферы или микрочастицы включают частицы, микро- или наносферы, маленькие фрагменты, микрочастицы, наночастицы, тонкоизмельченные порошки и т.п., содержащие биосовместимую матрицу, инкапсулирующую или включающую терапевтический агент. Микросферы в общем случае биосовместимы с физиологической средой глаза и не вызывают значительных вредных побочных эффектов. Микросферы, изготовленные и применяемые, как описано в настоящей заявке, можно вводить внутрь камеры и безопасно применять, не вызывая нарушения остроты зрения глаза. Максимальный размер, например диаметр или длина, микросфер составляет менее чем 1 мм. Например, максимальный размер микрочастиц может составлять менее чем примерно 500 мкм. Максимальный размер микросфер также может составлять не больше чем примерно 200 мкм, и, предпочтительно, максимальный размер может составлять больше чем от 30 мкм до примерно 50 мкм или до примерно 75 микрон.
«Имплантат» представляет собой устройство доставки лекарственного средства, которое значительно больше, чем микросфера, при этом для лечения глазного заболевания (такого как глаукома) вводят множество (т.е. сотни или тысячи)) микросфер, и с этой же целью обычно вводят только от одного до самое большее шести имплантатов.
«Глазничная область», или «место глазницы», означает любой участок глазного яблока, в том числе передний и задний сегменты глаза, которые в общем случае включают, но не ограничиваются ими, любые функциональные (например, для обеспечения зрения) или структурные ткани, имеющиеся в глазном яблоке, или ткани или слои клеток, которые частично или полностью выстилают внутреннюю или внешнюю часть глазного яблока. Конкретные примеры участков глазного яблока в глазничной области включают переднюю (водную) камеру, заднюю камеру, полость стекловидного тела, сосудистую оболочку глаза, супрахориоидальное пространство, конъюнктиву, подконъюктивальное пространство, эписклеральное пространство, внутрироговичное пространство, эпикорнеальное пространство, склеру, плоскую часть ресничного тела, образующиеся после хирургической операции бессосудистые области, пятно и сетчатку.
«Глазное заболевание» означает заболевание, недомогание или состояние, которое поражает глаз или одну из частей или областей глаза или затрагивает их. В общих чертах, глаз включает глазное яблоко и ткани и жидкости, которые составляют глазное яблоко, периокулярные мышцы (такие как косые и прямые мышцы) и участок зрительного нерва, который проходит внутри глазного яблока или рядом с ним.
Заболевание передней части глаза представляет собой заболевание, недомогание или состояние, которое поражает или затрагивает переднюю (т.е. лицевую) часть глаза, глазничную область или участок, такой как периокулярная мышца, глазное веко или ткань глазного яблока, или жидкость, которая находится между передней и задней стенкой мембраны хрусталика или цилиарных мышц. Таким образом, заболевание передней части глаза главным образом поражает или затрагивает конъюнктиву, роговицу, переднюю камеру, радужную оболочку, заднюю камеру (позади сетчатки, но впереди задней стенки мембраны хрусталика), хрусталик или мембрану хрусталика и кровеносные сосуды и нерв, которые васкуляризируют или возбуждают переднюю глазничную область или участок.
Таким образом, заболевание передней части глаза может включать заболевание, недомогание или состояние, такое как, например, афакия; артифакия; астигматизм; тонический блефароспазм; катаракта; заболевания конъюнктивы; конъюнктивит; заболевания роговицы; язва роговицы; синдромы сухого глаза; заболевания век; заболевания слезных органов; непроходимость слезного канальца; близорукость; старческая дальнозоркость; заболевания зрачка; рефракционные заболевания и косоглазие. Глаукому также можно рассматривать как состояние передней части глаза, поскольку клиническая задача лечения глаукомы может состоять в снижении гипертензии водной жидкости в передней камере глаза (т.е. понижении внутриглазного давления).
Заболевание задней части глаза представляет собой заболевание, недомогание или состояние, которое главным образом поражает или затрагивает заднюю глазничную область или участок, такой как сосудистая оболочка глаза или склера (в положении позади плоскости, проходящей через заднюю стенку мембраны хрусталика), стекловидное тело, стекловидная камера, сетчатка, зрительный нерв (т.е. диск зрительного нерва) и кровеносные сосуды и нервы, которые васкуляризируют или возбуждают заднюю глазничную область или участок.
Таким образом, заболевание задней части глаза может включать заболевание, недомогание или состояние, такое как, например, острая макулярная нейроретинопатия; болезнь Бехчета; хориоидальная неоваскуляризация; диабетический увеит; гистоплазмоз; инфекции, такие как микозы и вирусные инфекции; дегенерация желтого пятна, такая как острая дегенерация желтого пятна, неэкссудативная возрастная дегенерация желтого пятна и экссудативная возрастная дегенерация желтого пятна; отек, такой как макулярный отек, кистозный макулярный отек и диабетический макулярный отек; многоочаговый хориоидит; травма глаза, которая поражает заднюю область или участок глазницы; глазные опухоли; нарушения сетчатки, такие как окклюзия центральной вены сетчатки, диабетическая ретинопатия (в том числе пролиферативная диабетическая ретинопатия), пролиферативная витреоретинопатия (PVR), окклюзионное поражение артерии сетчатки, отслоение сетчатки, увеальное заболевание сетчатки; симпатическая офтальмия; синдром Фогта-Коянаги-Харада (VKH); увеальная диффузия; состояние задней части глаза, вызванное или связанное с лазерным лечением глаза; состояние задней части глаза, вызванное или связанное с фототерапией, фотокоагуляция, радиационная ретинопатия, нарушения эпиретианальной мембраны, окклюзия ветки вены сетчатки, передняя ишемическая оптическая нейропатия, не связанная с ретинопатией диабетическая дисфункция сетчатки, пигментная дистрофия сетчатки и глаукома. Глаукома может рассматриваться как заболевание задней части глаза, поскольку терапевтическая цель состоит в предотвращении потери или снижения частоты потери зрения вследствие повреждения или потери клеток сетчатки или клеток зрительного нерва (т.е. нейрозащите).
«Биоразлагаемый полимер» означает полимер или полимеры, которые разлагаются in vivo, при этом эрозия полимера или полимеров со временем происходит параллельно с высвобождением терапевтического агента или после этого. Термины «биоразлагаемый» и «биоэродируемый» являются равнозначными и применяются в настоящей заявке взаимозаменяемо. Биоразлагаемый полимер может представлять собой гомополимер, сополимер или полимер, содержащий более двух различных полимерных звена. Полимер может представлять собой полимер типа геля или гидрогеля, полимер на основе полимолочной кислоты (ПМК) или на основе сополимеров молочной и гликолевой кислот (ПМГК), или их смеси, или производные.
«Терапевтически эффективное количество» означает уровень или количество препарата, необходимое для лечения глазного заболевания или уменьшения или предотвращения повреждения или поражения глаза, не вызывающее существенных негативных или вредных побочных эффектов в глазу или в области глаза. На основе вышеизложенного, терапевтически эффективное количество терапевтического средства, такого как латанопрост, представляет собой количество, эффективное для ослабления по меньшей мере одного симптома глазного заболевания.
Имплантаты и микросферы в рамках предлагаемого нами изобретения могут высвобождать антигипертензивный препарат на протяжении сравнительно длительного периода времени, например в течение по меньшей мере примерно одной недели или, например, в течение примерно от двух до примерно шести месяцев, после внутриглазного (т.е. внутрикамерного) введения антигипертензивного препарата, содержащего имплантат или микросферы. Такие длительные периоды высвобождения способствуют достижению успешных результатов лечения. Внутриглазную систему доставки лекарственного средства с замедленным высвобождением предпочтительно вводят либо внутрикамерно (то есть в водную камеру [также называемую передней камерой] глаза) или в передний участок задней камеры (также называемый стекловидной камерой) глаза.
Один вариант реализации предлагаемого нами изобретения представляет собой фармацевтическую композицию для внутриглазного применения для лечения глазного заболевания. Композиция может содержать множество микросфер, изготовленных из биоразлагаемого полимера, и антигипертензивное средство, такое как латанопрост, биматопрост и травопрост и их соли, эфиры и производные, заключенное в микросферы. Микросферы могут содержать от примерно 1% до примерно 99% по массе полимера, при этом полимер может представлять собой ПМГК и/или ПМК. Кроме того, среднее значение наибольшего размера микросфер может лежать в диапазоне от примерно 5 микрон до примерно 1 мм, например, средний диаметр микросфер может составлять примерно от 15 микрон до примерно 55 микрон, при этом терапевтическое средство может составлять от примерно 0.1% до примерно 90% по массе относительно массы микросфер, например от примерно 8 до 15 масс.% латанопроста.
Согласно другому варианту реализации предлагаемого нами изобретения композиция может включать высоковязкую гиалуроновую кислоту, при этом глазное заболевание, подвергаемое лечению, может представлять собой глаукому. Конкретный вариант реализации предлагаемого нами изобретения представляет собой фармацевтическую композицию для внутриглазного применения для лечения глаукомы, состоящую из множества микросфер, изготовленных из ПМГК и/или ПМК, латанопроста, заключенного в микросферы, и высоковязкой гиалуроновой кислоты. Другой вариант реализации предлагаемого нами изобретения представляет собой фармацевтическую композицию для внутриглазного применения для лечения глаукомы, при этом композиция включает имплантат замедленного высвобождения, изготовленный из полимера ПМГК, полимера ПМК и сорастворителя ПЭГ, и; латанопрост, заключенный в имплантате, причем имплантат содержит примерно 30 масс.% латанопроста, при этом имплантат может высвобождать латанопрост на протяжении времени, равного по меньшей мере 20, 30, 40, 50, 60, 70 или до 180 дней.
Другой вариант реализации предлагаемого нами изобретения представляет собой способ лечения глаукомы, включающий внутриглазное введение пациенту с глаукомой фармацевтической композиции, содержащей имплантат, описанный выше, или множество микросфер, изготовленные из ПМГК и/или ПМК; латанопрост или антигипертензивный агонист ЕР2, заключенный в микросферы или имплантат, и высоковязкую гиалуроновую кислоту (ГК), и, тем самым, предназначенной для лечения глаукомы. ГК предпочтительно применяют совместно со множеством композиций, содержащих микросферы, а не с одним введенным имплантатом. Микросферы могут высвобождать антигипертензивный препарат в течение по меньшей мере примерно одной недели после стадии введения. Стадию внутриглазного введения можно осуществить путем инъекции в субтеноновое пространство, например в переднее субтеноновое пространство, при этом предложенная фармацевтическая композиция лечит глаукому путем снижения исходного уровня внутриглазного давления на 20%, 30%, 40% или до 50% или более.
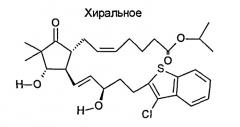
Предлагаемое нами изобретение включает способ лечения повышенного внутриглазного давления путем внутрикамерного введения пациенту с повышенным внутриглазным давлением множества биоразлагаемых микросфер замедленного высвобождения, средний диаметр которых составляет 30-60 микрон, при этом микросферы содержат от примерно 10 до примерно 30 масс.% антигипертензивного препарата и от примерно 70 до примерно 90 масс.% биоразлагаемого полимера, причем микросферы высвобождают терапевтически эффективные количества антигипертензивного препарата на протяжении времени от примерно 10 дней до примерно 120 дней. Биоразлагаемый полимер может содержать сополимер полимолочной и полигликолевой кислоты (ПМГК) и/или полимер полимолочной кислоты (ПМК). Антигипертензивный препарат может представлять собой латанопрост, биматопрост и травопрост и их соли, эфиры и пролекарства. С другой стороны, антигипертензивный препарат может представлять собой одно или более из соединений А-О (которые являются агонистами рецептора ЕР2) (показаны ниже), а также их соли, эфиры и пролекарства:
Вариант реализации предлагаемого нами изобретения включает высоковязкую гиалуроновую кислоту как часть системы доставки лекарственного средства. Конкретный вариант реализации предлагаемого нами изобретения представляет собой способ лечения повышенного внутриглазного давления путем внутрикамерного введения пациенту с повышенным внутриглазным давлением множества биоразлагаемых микросфер замедленного высвобождения, средний диаметр которых составляет 30-60 микрон, при этом микросферы содержат от примерно 10 до примерно 30 масс.% латанопроста и от примерно 70 до примерно 90 масс.% биоразлагаемого полимера, причем микросферы высвобождают терапевтически эффективные количества латанопроста на протяжении периода времени от примерно 10 дней до примерно 120 дней.
Дополнительный конкретный вариант реализации предлагаемого нами изобретения представляет собой способ лечения повышенного внутриглазного давления путем внутрикамерного введения пациенту с повышенным внутриглазным давлением вплотную к трабекулярной сети имплантата замедленного высвобождения выполненного в форме стержня, содержащего латанопрост и биоразлагаемый полимер, при этом имплантат содержит от примерно 10 до примерно 50 масс.% антигипертензивного препарата и от примерно 50 до примерно 90 масс.% биоразлагаемого полимера, причем имплантат высвобождает терапевтически эффективные количества латанопроста на протяжении периода времени от примерно 10 дней до примерно 120 дней.
Предлагаемое нами изобретение также включает фармацевтическую композицию для внутриглазного применения для лечения глазного заболевания, при этом композиция содержит множество биоразлагаемых микросфер замедленного высвобождения, средний диаметр которых составляет 30-60 микрон, при этом микросферы содержат от примерно 10 до примерно 30 масс.% антигипертензивного препарата и от примерно 70 до примерно 90 масс.% биоразлагаемого полимера, причем микросферы высвобождают терапевтически эффективные количества антигипертензивного препарата на протяжении периода времени от примерно 10 дней до примерно 120 дней. Микросферы могут содержать от примерно 1% до примерно 99% по массе полимера.
Наиболее предпочтительный вариант реализации предлагаемого нами изобретения представляет собой один монолитный (т.е. антигипертензивный лекарственный препарат гомогенно распределен [т.е. имплантаты резервуарного типа исключены из объема наиболее предпочтительного варианта реализации предлагаемого нами изобретения] по всей полимерной матрице имплантата) имплантат (содержащий терапевтическое количество антигипертензивного препарата) замедленного высвобождения выполненный в форме стержня, размещенный внутри камеры, длина которого составляет примерно от 2 мм до примерно 4 мм, а ширина составляет примерно от 0.5 мм до примерно 2 мм, имплантированный в положение, соответствующее 6-ти или 12-ти часам на циферблате, вплотную к трабекулярной сети с применением шприца-аппликатора (инжектора) (т.е. 22 калибра). Имплантат в форме диска не является предпочтительным, поскольку он не будет плотно примыкать и/или не будет оставаться в месте, прилегающем к трабекулярной сети. Размещение маленького имплантата в форме стержня (с приведенными выше размерами) вплотную к трабекулярной сети использует потоки, протекающие через водную камеру глаза, и дренирование жидкости в трабекулярную сеть для удержания имплантата в заданном месте вплотную к трабекулярной сети, тем самым, предотвращая смывание имплантата с места его размещения. При таком наиболее предпочтительном варианте реализации изобретения не происходит ухудшения зрения после устойчивого размещения имплантата и отсутствует раздражение радужной оболочки.
Дополнительные аспекты и преимущества настоящего изобретения изложены в приведенном ниже описании и формуле изобретения, в частности при рассмотрении в сочетании с прилагаемыми чертежами.
ЧЕРТЕЖИ
Фиг.1 представляет собой изображение поперечного сечения области угла, образованного передней камерой нормального человеческого глаза, на котором показано направление потока внутриглазной жидкости (горизонтальные стрелки) через большие поры в трабекуле в юкстаканаликулярную область (показано вертикальной стрелкой).
Фиг.2 представляет собой схематический чертеж, на котором стрелками показаны конвективные потоки внутриглазной жидкости в передней камере глаза и также указаны микросферы, размещенные внизу в передней камере глаза.
Фиг.3А представляет собой фотографию наружной стороны глаза кролика, вид спереди.
Фиг.3В представляет собой изображение глаза кролика, показанного на фиг.3А, полученное с применением флуоресцеиновых фильтров в заданном месте на формирователе изображения Heidelberg HRA, через два дня после имплантации флуоресцеинового имплантата (стрелка).
Фиг.3С представляет собой фотографию наружной стороны глаза кролика, повернутого вниз.
Фиг.3D представляет собой изображение глаза кролика, показанного на фиг.3С, полученное с помощью HRA через семь дней после имплантации флуоресцеинового имплантата, на котором показано распределение (стрелка) флуоресцеина, высвобождаемого из имплантата.
Фиг.4 представляет собой график, на котором показан совокупный % латанопроста, высвобождаемого (ось Y) in vitro (ФСБР с 0.1% Triton) со временем в днях (ось X) из микросфер состава А.
Фиг.5 представляет собой график, на котором показан совокупный % латанопроста, высвобождаемого (ось Y) in vitro (ФСБР with 0.1% Triton) со временем в днях (ось X) из микросфер состава В.
Фиг.6 представляет собой график, на оси Y которого отложено изменение в процентах ВГД относительно исходного уровня, а на оси Х - время в днях после внутриглазного введения устройства для доставки лекарственного средства. Результаты, показанные на Фиг.6, были получены после внутрикамерной инъекции в левый глаз собаке (бигль) микросфер замедленного высвобождения с составом А (сплошная линия на Фиг.6: «Микросферы»). Второй (правый) контрольный глаз (пунктирная линия на Фиг.6: «контроль») не демонстрировал понижение ВГД.
Фиг.7 представляет собой график изменения в процентах внутриглазного давления от исходного уровня (ось Y) у исследуемой собаки относительно времени в днях (ось X) на протяжении 84-дневного периода после внутрикамерного введения имплантата («Имплантат») в форме бруска с биматопростом, описанного в примере 5, который показывает, что падение ВГД на примерно 50%-60% сохранялось в течение 84-дневного периода наблюдения. Во второй (левый или «контрольный») глаз вводили имплантат с плацебо (без биматопроста).
ОПИСАНИЕ
Транссклеральная доставка включает введение в глаз лекарственного препарата путем его местного (т.е. глазные капли), а также внутрисклерального (т.е. подконъюктивального или субтенонового) размещения (например, путем инъекции, ввода или имплантации). Предлагаемое нами изобретение основано на наблюдении, что транссклеральная доставка является неэффективным способом введения антигипертензивного препарата (лекарственного средства или биопрепарата) в целевую ткань водной камеры или стекловидной камеры глаза для лечения повышенного внутриглазного давления. Мы полагаем, что это действительно так из-за очевидного существования трех типов барьеров, затрудняющих транссклеральную доставку лекарственного препарата - статических, динамических и метаболических барьеров. Ткани глаза, которые обладают физическим барьером в отношении диффузии лекарственного препарата (склера, сосудистая оболочка Бруха, пигментный эпителий сетчатки), представляют собой статические барьеры. Динамические барьеры связаны механизмами выведения лекарственных препаратов через кровеносные и лимфатические сосуды, в основном расположенные в конъюнктиве, через основной поток жидкости от передней к задней части глаза через сетчатку и выведения через хориокапилляр и склеру, и белки-переносчики пигментного эпителия сетчатки. Метаболические барьеры также существуют в глазу и уменьшают проникновение лекарственного препарата в глаз вследствие быстрого разложения введенных в склеру лекарственных препаратов. По-видимому, динамические барьеры являются наиболее важным барьером с точки зрения транссклеральной (т.е. субтеноновой) доставки терапевтических средств в переднюю часть глаза (переднюю камеру) для лечения внутриглазной гипертензии и глаукомы.
Предлагаемое нами изобретение основано на открытии, что прямое внутрикамерное введение или введение в переднюю область стекловидного тела внутриглазной системы доставки лекарственного средства с замедленным высвобождением, как изложено в настоящей заявке, (включающей имплантаты или микросферы, содержащие антигипертензивный препарат) можно эффективно применять для лечения глазного заболевания, такого как глаукома, характеризующегося повышенным внутриглазным давлением, минуя труднопреодолимые механизмы выведения лекарственного препарата через склеру.
Мы обнаружили существование подходящих альтернативных участков для доставки лекарственных препаратов в переднюю часть глаза (переднюю камеру) для понижения внутриглазного давления (ВГД) и преодоления активного выведения вызванного транссклеральным барьером. Внутрикамерные инъекции (т.е. прямая инъекция в переднюю камеру глаза) и инъекции в переднюю область стекловидного тела через плоскую часть ресничного тела позволяют эффективно преодолеть транссклеральные барьеры и увеличить эффективность глазных антигипертензивных соединений. Важно то что, как было обнаружено нами, системы внутрикамерной доставки лекарственного средства требовали разработки системы доставки лекарственного средства замедленного высвобождения с новыми физическими свойствами, необходимыми для терапевтической эффективности вследствие уникальной анатомии и физиологии передней камеры глаза. Например, в передней камере глаза скорости водного потока являются высокими, и это может фактически элиминировать микросферы замедленного высвобождения, содержащие лекарственные препараты, понижающие ВГД, и ускорить разложение других полимерных систем доставки. Внутриглазная жидкость выделяется в заднюю камеру с помощью цилиарного тела, в частности с помощью непигментированного эпителия цилиарного тела, за счет процесса, называемого ультрафильтрацией. Жидкость протекает через узкую щель между передней частью хрусталиков и задней частью радужной оболочки и выделяется через зрачок в переднюю камеру глаза. Внутриглазная жидкость дренирует в направлении 360 градусов в трабекулярную сеть, размеры диаметров пор которой на начальной стадии варьируют у людей от 10 до ниже 30 микрон (см. Фиг.1). Фиг.1 представляет собой изображение поперечного сечения области угла, образованного передней камерой глаза, на котором показано направление потока внутриглазной жидкости (горизонтальные стрелки) через поры большего размера (примерно от 10 до менее чем 30 микрон) в трабекуле и постепенно вплоть до юкстаканаликулярной области (показано вертикальной стрелкой), где размер пор снижается до примерно 6 микрон перед попаданием в канал Шлемма. Внутриглазная жидкость дренирует через канал Шлемма и выходит из глаза через 25-30 коллекторных каналов в водяные вены и, в конечном счете, в эписклеральную сосудистую сеть и вены глазницы (см. Фиг.2). Фиг.2 представляет собой схематический чертеж, на котором стрелки указывают конвективные потоки водной внутриглазной жидкости в передней камере глаза. Как показано, микросферы, высвобождающие глазное антигипертензивное лекарственное средство, размещаются внизу. Свободный лекарственный препарат, элюирующий из полимерных микросфер (или имплантата), поступает в конвективные потоки водной внутриглазной жидкости (стрелки). Затем лекарственный препарат успешно диспергируется по всей передней камере глаза и поступает в целевые ткани, такие как трабекулярная сеть и область цилиарного тела, через область корня радужной оболочки.
Другое преимущество внутрикамерной инъекции состоит в том, что передняя камера глаза представляет собой иммунологически привилегированную область тела и с меньшей вероятностью реагирует на инородный материал, такой как полимерные системы доставки лекарственного средства. Не так обстоит дело в случае субтенонового пространства, в котором при внесении инородных материалов часто имеют место воспалительные реакции. Помимо передней камеры глаза, содержащей иммунорегуляторные факторы, которые придают иммунную защиту, частицы с диаметрами больше чем 30 микрон, являются менее иммуногенными и проявляют меньшую склонность вызывать воспаление глаза. Оседлые макрофаги в глазу представляют собой первую линию обороны от инородных тел или возбудителей инфекции; однако частицы с размером больше чем 30 микрон трудно фагоцитировать. Поэтому частицы с размером больше чем 30 микрон проявляют меньшую склонность к активированию макрофагов и последующему воспалительному каскаду.
Мы обнаружили, что эффективность доставки лекарственного средства во внутриглазную жидкость с применением полимерной системы высвобождения гораздо выше при внутрикамерном размещении по сравнению с субтеноновым применением. Так, менее чем 1% лекарственного препарата, доставленного в субтеноновое пространство, будет поступать во внутриглазную жидкость, при этом 100% лекарственного препарата, высвобожденного из внутрикамерной системы, будет поступать во внутриглазную жидкость. Следовательно, ожидается, что для эффективных систем внутрикамерной доставки лекарственного средства потребуются меньшие дозы лекарственного препарата по сравнению с субтеноновой доставкой и, в результате, будет происходить меньшее системное воздействие указанного препарата. Кроме того, будет иметь место меньшее воздействие конъюнктивы на активный фармацевтический ингредиент и проявляться меньшая склонность в отношении развития конъюнктивальной гиперемии при доставке лекарственных препаратов, таких как простагландиновые аналоги. В заключение, лекарственный препарат будет поступать в конъюнктивальный/эписклеральный кровеносный сосуд непосредственно после внутрикамерных инъекций через водяные вены. Это может минимизировать конъюнктивальную гиперемию при применении простагландиновых аналогов по сравнению с субтеноновой инъекцией, когда множество сосудов подвергаются риску расширения при высокой концентрации лекарственного препарата, присутствующего диффузно в экстраваскулярном пространстве конъюнктивы. Прямые инъекции в глаз также устраняют необходимость применения консервантов, которые при применении в местных каплях могут раздражать поверхность глаза.
Антигипертензивные препараты, подходящие для применения в качестве активного агента в системах внутрикамерной и интравитреальной доставки лекарственного средства с замедленным высвобождением, описанные в настоящей заявке, включают:
простагландины, простамиды и гипотензивные липиды (например, биматопрост (лумиган)) {биматопрост увеличивает увеосклеральный отток внутриглазной жидкости, а также увеличивает трабекулярный отток} и соединения, описанные в патенте США №5352708. Простагландины представляют собой класс фармакологически активных гормоноподобных веществ, вырабатываемых в различных тканях млекопитающих, которые образуются из арахидоновой кислоты и опосредуют широкий ряд физиологических функций, в том числе кровяное давление, сокращение гладких мышц и воспаление. Примерами простагландинов являются простагландин E1 (альпростадил), простагландин E2 (динопростон), латанопрост и травопрост. Латанопрост и травопрост фактически представляют собой пролекарства простагландина (т.е. 1-изопропиловые эфиры простагландина), однако их называют простагландинами, поскольку они оказывают действие на рецептор простагландина F после гидролизации до 1-карбоновой кислоты. Простамид (также называемый простагландин-этаноламидом) представляет собой аналог простагландина, который фармакологически отличается от простагландина (т.е. поскольку простамиды оказывают действие на другой клеточный рецептор [рецептор простамида], нежели простагландины) и представляет собой нейтральный липид, образованный как продукт ферментного оксигенирования с помощью циклооксигеназы-2 («СОХ-2») эндоканнабиноида (такого как анандамид). Кроме того, простамиды не гидролизуются in-situ до 1-карбоновой кислоты. Примерами простамидов являются биматопрост (синтетически полученный этиламид 17-фенилпростагландина F2α) и простамид F2α.
аналоги простагландина (аналоги простагландина увеличивают увеосклеральный отток внутриглазной жидкости)(т.е. латанопрост [ксалатан], травопрост (траватан), унопростон;
агонисты рецептора ЕР2/ЕР4;
антагонисты бета-адренергического рецептора (такие как тимолол, бетаксолол, левобетаксолол, картеолол, левобунолол и пропранолол, которые уменьшают выработку внутриглазной жидкости с помощью цилиарного тела);
агонисты альфа-адренергического рецептора, такие как бримонидин (альфаган) и апраклонидин (иопидин) (которые действуют на основе двоякого механизма, уменьшая выработку водной жидкости и увеличивая увеосклеральный отток);
менее селективные симпатомиметические средства, такие как эпинефрин и дипивефрин (пропин) (действуют, увеличивая отток внутриглазной жидкости через трабекулярную сеть и, возможно, через путь увеосклерального оттока, возможно, под действием бета 2-агониста);
Миотические средства (парасимпатомиметические средства), такие как пилокарпин (действует путем сокращения цилиарной мышцы, сжимая трабекулярную сеть и делая возможным повышенный отток внутриглазной жидкости);
Ингибиторы_карбоангидразы, такие как дорзоламид (трузопт), бринзоламид (азопт), ацетазоламид (диамокс) (более низкое выделение внутриглазной жидкости за счет ингибировании карбоангидразы в цилиарном теле)
Ингибиторы Rho-киназы (уменьшение ВГД при разрушении актинцитоскелета трабекулярной сети;
блокаторы кальциевых каналов;
ваптаны (антагонисты рецептора вазопрессина);
анекортав ацетат и аналоги;
этакриновая кислота;
каннабиноиды;
бета-блокаторы