Способ проведения иммунохроматографического анализа для серодиагностики
Иллюстрации
Показать всеИзобретение относится к иммунологии и медицинской диагностике и представляет собой способ проведения иммунохроматографического анализа для серодиагностики. Предложенное изобретение предназначено для иммунохроматографического определения в жидких пробах антител к возбудителям инфекционных заболеваний или другим антигенам, например, таким как аллергены. Отличительной особенностью предлагаемого способа определения антител является то, что раствор для разбавления пробы содержит специфические антитела против иммобилизованной в аналитической зоне тест-полоски антигена (или антигенов). Используемая концентрация антител в разбавляющем растворе меньше нижнего предела определения антител данным методом при использовании разбавляющего раствора, не содержащего специфических антител, вследствие чего в отсутствие специфических антител в пробе окрашивания аналитической зоны тест-полоски не наблюдается. Если же проба содержит специфические антитела, то наличие в разбавляющем растворе дополнительного количества специфических антител приводит к усилению интенсивности окраски аналитической зоны тест-полоски. Применение изобретения позволяет регистрировать суммарную концентрацию специфических антител в пробе и в разбавляющем растворе, что приводит к снижению предела обнаружения анализа вследствие смещения рабочего диапазона определяемых тестом концентраций в область более низких значений. 3 ил., 1 пр.
Реферат
Изобретение относится к иммунологии и медицинской диагностике и представляет собой способ проведения иммунохроматографического анализа для серодиагностики. Наличие в сыворотке крови антител, специфичных к возбудителю определенного заболевания, или иному антигену, например, такому как аллерген, является эффективным критерием, позволяющим с высокой достоверностью диагностировать соответствующее инфекционное заболевание или аллергию (Резникова Л.С., Эпштейн-Литвак Р.В., Леви М.И. / Серологические методы исследования при диагностике инфекционных болезней - М., Медгиз, 1962; Медицинская микробиология, вирусология и иммунология: Учебник для студентов медицинских ВУЗов / Под ред. А.А Воробьева. - М.: ООО «Медицинское информационное агенство», 2006). В случае диагностики инфекционных заболеваний преимуществами данного подхода по сравнению с непосредственным выявлением и идентификацией возбудителя является определенность при выборе тестируемой пробы (сыворотка крови, тогда как возбудитель может на данной стадии инфекции преимущественно локализоваться в самых разных органах и тканях), а также возможность быстрой детекции достаточно высокого уровня антител, индуцированного контактом с антигеном, в то время как для выявления антигена могут потребоваться довольно продолжительные стадии доращивания до достижения им регистрируемой концентрации. Хотя в настоящее время активно используются как микробиологические, так и иммунологические способы диагностики инфекционных заболеваний, для проведения массового первичного скрининга оптимально иммунологическое определение наличия в сыворотке крови специфических антител (серодиагностика), которое может быть реализовано с высокой экспрессностью и производительностью. Особенный интерес вызывают серодиагностические подходы в тех случаях, когда в силу особенностей роста микроорганизмов получение результатов микробиологического тестирования может потребовать значительного времени. В случае диагностики аллергии антитела против определенного аллергена являются главным маркером данного функционального расстройства (IgE антитела в случае аллергии немедленного типа и IgG антитела в случае аллергии замедленного типа), поэтому методы лабораторной диагностики аллергии зачастую сводятся к определению антител, или выявлению реакции организма, связанной с наличием данных антител (как в случае провокационной пробы) (Паттерсон Р., Грэммер Л.К., Гринбергер П.А. Аллерические болезни: диагностика и лечение / Перевод с англ., под ред. акад. РАМН А.Г. Чучалина (гл. ред.), чл.-корр. РАМН И.С. Гущина (отв. ред.). - М.: ГЭОТАР-Медиа, 2000). Эти причины определяют значительный интерес к серодиагностическим методам.
Благодаря экспрессности, достаточно высокой чувствительности и специфичности серологические тесты незаменимы при массовых обследованиях. Кроме того, гуморальный иммунный ответ отражает активный инфекционный процесс, и поэтому результаты иммунохимического тестирования достоверно отражают именно случаи заболевания, дискриминируя их от бактерионосительства.
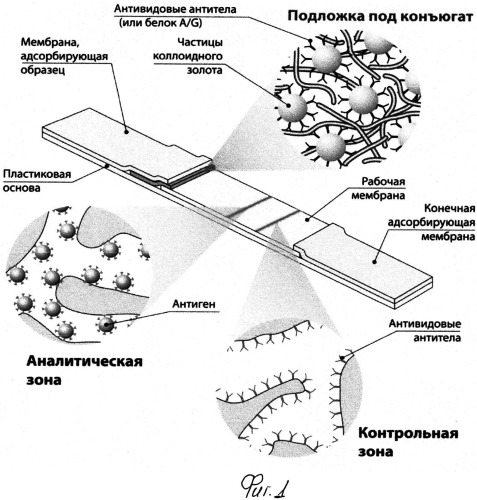
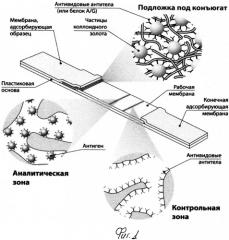
Иммунохимический анализ может быть реализован в различных форматах. Однако, поскольку для массовых обследований первоочередное значение имеют скорость и производительность тестирования, в данной ситуации несомненными преимуществами обладает иммунохроматографический анализ, для которого все необходимые реагенты предварительно нанесены на мембранные компоненты тест-полоски и ее контакт с тестируемой пробой непосредственно инициирует движение фронта жидкости по мембранам, протекание специфических реакций и формирование иммунных комплексов, которые благодаря включению в их состав окрашенного маркера могут детектироваться визуально или с помощью оптического детектора (Рис.1).
Применительно к серодиагностике (определению антител, специфичных к определенному антигену или группе антигенов) общая схема иммунохроматографии заключается в следующем.
Проба, потенциально содержащая специфические антитела, при контакте с тест-полоской под действием капиллярных сил перемещается вдоль тест-полоски. При этом она вначале взаимодействует с окрашенными частицами, на поверхности которых адсорбирован (конъюгирован) компонент, предназначенный для связывания с антителами. Часто в качестве такового компонента выбирают антивидовые антитела (иммуноглобулины, выделенные из сыворотки животного, иммунизированного препаратом иммуноглобулинов человека или другого организма, для которого проводится серодиагностика), белок A из Staphylococcus aureus, белок G из Streptococcus spp. или другие реагенты для связывания антител. В качестве метки наиболее часто используется коллоидное золото, а в качестве метода конъюгации - простая физическая адсорбция белка на поверхности с последующим отделением неадсорбированных молекул с помощью осаждения частиц коллоидного золота центрифугированием. Затем фронт жидкости преодолевает аналитическую (тестовую) зону, которая представляет собой участок мембраны с иммобилизованным антигеном (нативным или специально модифицированным для эффективной сорбции), в результате взаимодействия с которым формируются комплексы из молекул антигена/антигенов, специфических к ним антител и конъюгата с коллоидным золотом. Степень связывания маркера с иммобилизованным антигеном и, соответственно, интенсивность окрашивания мембраны определяются концентрацией специфических антител в пробе. Для проверки качества реагентов и сохранения функциональности тест-системы используется расположенная далее контрольная зона, в которой компонент, сорбированный на окрашенной частице, связывается с соответствующим иммобилизованным на мембране реагентом.
Ниже представлена информация о методике, реализуемой в тест-системе «TB-Check-1» фирмы «Vedalab» (Франция) - см. http://http://www.sanitamedikal.com/Assets/MD_220002_m3_TB_l408_c.pdf. Данная методика определения антител к возбудителю туберкулеза рассматривается в настоящей заявке в качестве прототипной.
Метод основан на комбинации антител к иммуноглобулинам человека, конъюгированных с хромогеном, и высокоочищенного БЦЖ-белка. При прохождении исследуемого образца через адсорбционную зону тестового устройства конъюгат, содержащий меченые антитела, связывается с IgG, образуя комплекс «антиген-антитело». Этот комплекс взаимодействует с высокоочищенным БЦЖ-белком в тестовой зоне устройства и, если концентрация специфического IgG к возбудителю туберкулеза превышает 350 Е/мл, образует окрашенную полосу. При низкой концентрации антител окрашенная полоса в тестовой зоне не образуется. Несвязавшийся конъюгат взаимодействует с реагентом в контрольной зоне тестового устройства, образуя окрашенную полосу, что указывает на правильное проведение теста. Процедура исследования: заполнить одноразовую пипетку сывороткой или плазмой и внести 1 каплю в окно для пробы тестового устройства. Добавить в окно для пробы 5-6 полных капель разбавляющего раствора (дилюента). Через 10-15 мин произвести учет результатов.
Одной из наиболее важных задач в иммунохроматографии является повышение чувствительности анализа. Применительно к серодиагностике это означает минимизацию ложноотрицательных результатов теста в случае, если антитела в пробе содержатся в диагностически значимых концентрациях, но ниже предела детекции метода. Заявителями предлагается подход для решения этой задачи, основанный на добавлении в пробу дополнительного количества специфических антител в концентрациях ниже, чем предел детекции метода при использовании разбавляющего раствора, не содержащего специфических антител. В этом случае суммарная концентрация антител в пробе и добавленных антител может превысить предел детекции и проба будет диагностирована как положительная. Таким образом, повышается чувствительность метода за счет смещения диапазона определяемых концентраций в область более низких значений.
Предложенный подход был реализован заявителями для серодиагностики туберкулеза с использованием антигена 38 кДа (Ag78, antigen 5, PhoS, Rv0934) M. tuberculosis. Ниже представлено описание способа получения тест-полосок и проведения иммунохроматографического анализа, а также полученные результаты.
Пример:
Для формирования тест-системы использовали набор мембран «mdi Easypack» фирмы «Advanced Microdevices» (Индия), включающий рабочую мембрану CNPC-SN12 L2-P25 (размер пор 15 мкм), подложку под конъюгат PT-R5, мембрану для нанесения образца GFB-R4, адсорбирующую мембрану AP 045 и ламинирующую защитную пленку МТ-1.
На мембраны были нанесены следующие реагенты:
1. Рекомбинантный антиген 38 кДа М. tuberculosis (Rv0934), фирма «Arista Biologicals Inc.» (США), кат. № AGMTB-0220.
2. Конъюгат коллоидного золота со средним диаметром частиц 30 нм и рекомбинантного антигена 38 кДа М. tuberculosis.
3. Моноклональные антитела НТМ81 против рекомбинантного антигена 38 кДа М. tuberculosis, Центр молекулярной диагностики и терапии, Москва (Россия).
Для формирования аналитической зоны использовали антиген 38 кДа, контрольной зоны - антитела против антигена 38 кДа. На 1 см полосы наносили 2 мкл раствора антигена (1,0 мг/мл в 50 мМ фосфатном буфере, pH 7,4) и 2 мкл раствора антител (0,5 мг/мл в том же буфере). Конъюгат коллоидного золота с антигеном 38 кДа наносили в разведении, соответствующем D520=2,0, в объеме 8 мкл на 1 см полосы. Для нанесения реагентов использовали диспенсер «IsoFlow» фирмы «Imagene Technology)) (США). Листы мембран с нанесенными иммунореагентами нарезали на индивидуальные тест-полоски шириной 4 мм.
Иммунохроматографический анализ проводили при комнатной температуре. Тест-полоску погружали в пробу на 1 мин в вертикальном положении, а затем извлекали и помещали на горизонтальную поверхность. Детекцию связывания коллоидного золота осуществляли через 10 мин визуально или получая цифровое изображение тест-полоски с помощью сканера и количественно оценивая интенсивность окраски аналитической зоны с помощью программы «Nonlinear Dynamics TotalLab TL120 v2009».
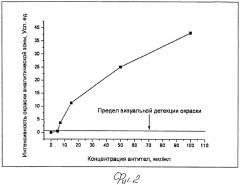
Путем тестирования растворов, содержащих фиксированные концентрации специфических антител (моноклональных антител НТМ81) построена калибровочная кривая и определен предел визуальной детекции метода (Рис.2). Затем были протестированы сыворотки крови от пациента, зараженного туберкулезом и от здорового донора (Рис.3, A), в этом случае положительных результатов тестирования не наблюдалось. После добавления в пробы дополнительного количества специфических антител в концентрации, соответствующей пределу визуальной детекции (5 мкг/мл), в сыворотке больного пациента наблюдается отчетливое окрашивание аналитической зоны (Рис.3, Б). Таким образом, предложенный подход позволил избежать ложноотрицательного результата теста.
Рис.1. Принцип иммунохроматографического анализа.
Рис.2. Калибровочная кривая определения специфических антител против антигена 38 кДа М. tuberculosis методом иммунохроматографии.
Рис.3. Тестирование сывороток крови больного туберкулезом и здорового донора без добавления дополнительного количества специфических антител (А) и после добавления специфических антител в концентрации 5 мкг/мл (Б).
Способ проведения иммунохроматографического анализа для серодиагностики, в котором на мембранной тест-полоске наносят антиген или антигены и частицы коллоидного золота, конъюгированные с реагентом для связывания антител, отличающийся тем, что раствор для разбавления пробы содержит специфические антитела против используемого антигена или антигенов.