Пестицидные композиции
Иллюстрации
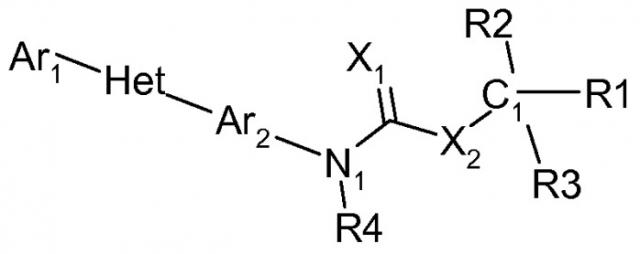
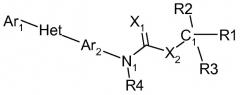
Показать всеОписываются новые гетероарил-N-арил-карбаматы общей формулы
где:
Ar1 - фенил, возможно замещенный C1-C6галогеналкилом или C1-C6галогеналкокси; Het - триазолил; Ar2 - фенил; X1 представляет собой О или S; X2 - О; R4 - Н или C1-C6алкил; n=0, 1 или 2; и R1, R2 и R3 независимо выбирают из Н, CN, C1-C6алкила, C1-С6галогеналкила, С3-С6циклоалкила, C2-C6алкенила, C2-C6алкинила, C(=O)O(C1-C6алкил)а, фенила и Het-1, где Het-1 - 5-членное ненасыщенное гетероциклическое кольцо, содержащее один гетероатом, выбранный из серы или кислорода, или 6-членное ненасыщенное гетероциклическое кольцо, содержащее один атом азота в качестве гетероатома, и Het-1 может быть замещен F, Cl, C1-C6алкилом, C1-C6галогеналкилом или C1-C6алкокси, и способ борьбы с насекомыми-вредителями Lepidoptera или Homoptera с использованием этих соединений в качестве инсектицидов и акарицидов. 3 н. и 2 з.п. ф-лы, 2 табл., 80 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данная заявка заявляет преимущество предварительной заявки Соединенных Штатов с порядковым номером 61/232142, поданной 7 августа 2009. Изобретение, раскрытое в этом документе, относится к области пестицидов и к их применению в осуществлении борьбы с насекомыми-вредителями.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Насекомые-вредители вызывают ежегодно миллионы человеческих смертей по всему миру. Кроме того, существует более десяти тысяч видов насекомых-вредителей, которые вызывают потери сельскохозяйственной продукции. Эти потери сельскохозяйственной продукции составляют каждый год миллиарды долларов США. Термиты нарушают целостность (наносят ущерб) различных конструкций, таких как дома. Потери от этих вызванных термитами потерь составляют каждый год миллиарды долларов США. В качестве решающего примечания, многие насекомые-вредители, обитающие в хранимых пищевых продуктах, едят и ухудшают хранимые пищевые продукты. Такие потери, связанные с потерями хранимых пищевых продуктов, составляют миллиарды долларов США ежегодно, но что более важно, лишают людей необходимых пищевых продуктов.
Существует острая потребность в новых пестицидах. Насекомые развивают устойчивость к пестицидам, применяемым в настоящее время. Сотни видов насекомых являются устойчивыми к одному или ко многим пестицидам. Развитие устойчивости к некоторым из более старых пестицидов, таким как ДДТ, карбаматы, и фосфорорганические соединения, общеизвестно. Но устойчивость развилась даже к некоторым из более новых пестицидов. Таким образом, существует потребность в новых пестицидах и, в особенности, в пестицидах, которые имеют новые механизмы действия.
ЗАМЕСТИТЕЛИ (НЕПОЛНЫЙ ПЕРЕЧЕНЬ)
Примеры, приведенные для заместителей (за исключением галогеновых заместителей), являются неполными и не должны быть истолкованы как ограничивающие изобретение, раскрываемое в этом документе.
«Алкенил» означает ациклический, ненасыщенный (имеется, по меньшей мере, одна углерод-углеродная двойная связь), разветвленный или неразветвленный, заместитель, состоящий из углерода и водорода, например, винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
«Алкенилоксигруппа» представляет собой алкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, аллилоксигруппу, бутенилоксигруппу, пентенилоксигруппу, гексенилоксигруппу, гептенилоксигруппу, октенилоксигруппу, ноненилоксигруппу и деценилоксигруппу.
«Алкоксигруппа» означает алкил, дополнительно содержащий углерод-кислородную одинарную связь, например, метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, 1-бутоксигруппу, 2-бутоксигруппу, изобутоксигруппу, трет-бутоксигруппу, пентоксигруппу, 2-метилбутоксигруппу, 1,1-диметилпропоксигруппу, гексоксигруппу, гептоксигруппу, октоксигруппу, ноноксигруппу и декоксигруппу.
«Алкил» представляет собой ациклический, насыщенный, разветвленный или неразветвленный, заместитель, содержащий углерод и водород, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
«Алкинил» означает ациклический, ненасыщенный (имеются, по меньшей мере, одна углерод-углеродная тройная связь, и любое количество двойных связей), разветвленный или неразветвленный, заместитель, содержащий углерод и водород, например, этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
«Алкинилоксигруппа» представляет собой алкинил, дополнительно содержащий углерод-кислородную одинарную связь, например, пентинилоксигруппу, гексинилоксигруппу, гептинилоксигруппу, октинилоксигруппу, нонинилоксигруппу и децинилоксигруппу.
«Арил» означает циклический, ароматический заместитель, содержащий водород и углерод, например, фенил, нафтил и бифенил.
«Циклоалкенил» представляет собой моноциклический или полициклический, ненасыщенный (имеется, по меньшей мере, одна углерод-углеродная двойная связь) заместитель, содержащий углерод и водород, например, циклобутенил, циклопентенил. Циклогексенил, циклогептенил, циклооктенил, циклодеценил, норборненил, бицикло[2.2.2]октенил, тетрагидронафтил, гексагидронафтил и октагидронафтил.
«Циклоалкенилоксигруппа» означает циклоалкенил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклобутенилоксигруппу, циклопентенилоксигруппу, циклогексенилоксигруппу, циклогептенилоксигруппу, циклооктенилоксигруппу, циклодеценилоксигруппу, норборненилоксигруппу, и бицикло[2.2.2]октенилоксигруппу.
«Циклоалкил» представляет собой моноциклический или полициклический, насыщенный заместитель, содержащий углерод и водород, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норборнил, бицикло[2.2.2]октил и декагидронафтил.
«Циклоалкоксигруппа» означает циклоалкил, дополнительно содержащий углерод-кислородную одинарную связь, например, циклопропилоксигруппу, циклобутилоксигруппу, циклопентилоксигруппу, циклогексилоксигруппу, циклогептилоксигруппу, циклооктилоксигруппу, циклодецилоксигруппу, норборнилоксигруппу и бицикло[2.2.2]октилоксигруппу.
«Галоген» представляет собой фтор, хлор, бром, и йод.
«Галогеналкил» означает алкил, дополнительно содержащий, от одного до максимально возможного количества, идентичных или различных, галогенов, например, фторметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил, и 1,1,2,2-тетрафторэтил.
«Гетероциклил» представляет собой циклический заместитель, который может быть полностью насыщенным, частично ненасыщенным, или полностью ненасыщенным, где циклическая структура содержит, по меньшей мере, один углерод и, по меньшей мере, один гетероатом, где упомянутый гетероатом представляет собой азот, серу, или кислород, например, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензоксазолил, бензотиенил, бензотиазолил, циннолинил, фуранил, индазолил, индолил, имидазолил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, фталазинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, хиноксалинил, 1,2,3,4-тетразолил, тиазолинил, тиазолил, тиенил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил и 1,2,4-триазолил.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения этого изобретения имеют следующую формулу:
где:
(а) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, и замещенный тиенил, имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы,
где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы;
(b) Het представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или более гетероатомов, независимо выбранных из азота, серы, или кислорода, и, где Ar1 и Ar2 не находятся в орто-положении по отношению друг к другу (но могут находиться в мета- или в пара-положении, например, в случае 5-членного кольца они находятся в 1,3-положении, и в случае 6-членного кольца они находятся либо в 1,3-положении, либо в 1,4-положении), и, где упомянутое гетероциклическое кольцо может также быть замещено одним или более заместителями, независимо выбранными из H, F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы,
где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы;
(с) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, или замещенный тиенил,
где упомянутый замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, и замещенный тиенил, имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, замещенного фенила и замещенной феноксигруппы (где такой замещенный фенил и замещенная феноксигруппа имеют один или более заместителей, независимо выбранных из H, F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила и феноксигруппы;
(d) Х1 представляет собой О или S;
(е) Х2 представляет собой О или S;
(f) R4 представляет собой Н, С1-С6 алкил, С1-С6 галогеналкил, С3-С6 циклоалкил, С3-С6 галогенциклоалкил, C3-C6 циклоалкоксигруппу, C3-C6 галогенциклоалкоксигруппу, C1-C6 алкоксигруппу, C1-C6 галогеналкоксигруппу, C2-C6 алкенил, C2-C6 алкинил, S(=O)n(C1-C6 алкил), S(=O)n(C1-C6 галогеналкил), OSO2(C1-C6 алкил), OSO2(C1-C6 галогеналкил), С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил), C(=O)O(C1-C6 алкил), C(=O)(C1-C6 галогеналкил), C(=O)О(C1-C6 галогеналкил), C(=O)(C3-C6 циклоалкил), C(=O)О(C3-C6 циклоалкил), C(=O)(C2-C6 алкенил), C(=O)О(C2-C6 алкенил), (С1-С6 алкил)O(C1-C6 алкил), (С1-С6 алкил)S(C1-C6 алкил), С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил), фенил, феноксигруппу,
где каждый(ая) алкил, галогеналкил, циклоалкил, галогенциклоалкил, циклоалкоксигруппа, галогенциклоалкоксигруппа, алкоксигруппа, галогеналкоксигруппа, алкенил, алкинил, фенил, и феноксигруппа необязательно замещены одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, и феноксигруппы;
(g) n=0, 1 или 2;
(h) Rx и Ry независимо выбирают из Н, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, и феноксигруппы; и
(i) R1, R2 и R3 независимо выбирают из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C2-C6 алкенила, C2-C6 алкинила, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, (С1-С6 алкил)O(C1-C6 алкил)О(С1-С6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, С(=О)фенила, фенила, С1-С6 алкилфенила, С(=О)феноксигруппы, феноксигруппы, С1-С6 алкилфеноксигруппы, С(=О)Het-1, Het-1, или C1-C6 алкилHet-1,
где Het-1 представляет собой 5- или 6-членное, насыщенное или ненасыщенное, гетероциклическое кольцо, содержащее один или более гетероатомов, независимо выбранных из азота, серы или кислорода, и
где каждый(ая) алкил, галогеналкил, циклоалкил, галогенциклоалкил, циклоалкоксигруппа, галогенциклоалкоксигруппа, алкоксигруппа, галогеналкоксигруппа, алкенил, алкинил, фенил, феноксигруппа, и Het-1, необязательно замещены одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, (C1-C6 алкенил)NRxRy, (C1-C6 алкинил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы, и Het-1,
где R1 и R2 вместе необязательно могут образовывать 3-12-членную насыщенную или ненасыщенную циклическую группу, которая может содержать один или более гетероатомов, выбранных из азота, серы, и кислорода (при условии, что в такой циклической группе имеется предпочтительно не С1-О-связь), где упомянутая циклическая группа может иметь один или более заместителей, независимо выбранных из F, Cl, Br, I, CN, NO2, оксогруппы, C1-C6 алкила, C1-C6 галогеналкила, C3-C6 циклоалкила, C3-C6 галогенциклоалкила, C3-C6 циклоалкоксигруппы, C3-C6 галогенциклоалкоксигруппы, C1-C6 алкоксигруппы, C1-C6 галогеналкоксигруппы, C2-C6 алкенила, C2-C6 алкинила, S(=O)n(C1-C6 алкил)а, S(=O)n(C1-C6 галогеналкил)а, OSO2(C1-C6 алкил)а, OSO2(C1-C6 галогеналкил)а, С(=О)Н, С(=О)NRxRy, (C1-C6 алкил)NRxRy, C(=O)(C1-C6 алкил)а, C(=O)O(C1-C6 алкил)а, C(=O)(C1-C6 галогеналкил)а, C(=O)О(C1-C6 галогеналкил)а, C(=O)(C3-C6 циклоалкил)а, C(=O)О(C3-C6 циклоалкил)а, C(=O)(C2-C6 алкенил)а, C(=O)О(C2-C6 алкенил)а, (С1-С6 алкил)O(C1-C6 алкил)а, (С1-С6 алкил)S(C1-C6 алкил)а, С(=О)(С1-С6 алкил)С(=O)О(C1-C6 алкил)а, фенила, феноксигруппы и Het-1.
В другом варианте осуществления Ar1 представляет собой замещенный фенил, где упомянутый замещенный фенил, имеет один или более заместителей, независимо выбранных из С1-С6 галогеналкила и С1-С6 галогеналкоксигруппы.
В еще одном варианте осуществления Het означает триазолил.
В другом варианте осуществления Ar2 представляет собой фенил.
В еще одном варианте осуществления R4 означает Н или С1-С6 алкил.
В другом варианте осуществления R1, R2 и R3 независимо выбирают из Н, CN, С1-С6 алкила, С1-С6 галогеналкила, С3-С6 циклоалкила, С2-С6 алкенила, С2-С6 алкинила, C(=O)O(C1-C6 алкил)а, фенила и Het-1.
В еще одном варианте осуществления R1, R2 и R3 независимо выбирают из С1-С6 алкила, С1-С6 галогеналкила, С3-С6 циклоалкила, С2-С6 алкенила, С2-С6 алкинила, C(=O)O(C1-C6 алкил)а, фенила, и Het-1, каждый из которых замещен одним или более заместителями, независимо выбранными из F, Cl, Br, I, CN, NO2, C1-C6 алкила, C1-C6 галогеналкила, C1-C6 алкоксигруппы, S(=O)n(C1-C6 алкил)а, (C1-C6 алкил)NRxRy, (C1-C6 алкенил)NRxRy, (C1-C6 алкинил)NRxRy, С(=О)О(C1-C6 алкил)а и фенила.
В другом варианте осуществления, в том случае, когда R1, R2, и R3 представляют собой Het-1, их независимо выбирают из пиримидинила, пиридила, хинолинила, тиазолила, тиенила, фуранила, изоксазолила, каждый из которых может быть необязательно замещен.
В другом варианте осуществления Het и Het-1 в том случае, когда они имеют азот кольца, включают группу (N+-O-).
Хотя и были представлены эти варианты осуществления, другие варианты осуществления и комбинации этих представленных вариантов осуществления и других вариантов осуществления являются возможными.
ПОЛУЧЕНИЕ ПРОМЕЖУТОЧНЫХ ТРИАРИЛЬНЫХ СОЕДИНЕНИЙ
Соединения этого изобретения получают присоединением Х2(С1)R1R2R3 к промежуточному триарильному соединению, Ar1-Het-Ar2, посредством карбаматной или тиокарбаматной связи N1(C=X1) (определено выше). Широкий спектр триарильных предшественников может быть использован для получения соединений этого изобретения, при условии, что они содержат подходящую функциональную группу на Ar2. Подходящие функциональные группы включают аминогруппу, или группу карбоновой кислоты. Эти промежуточные триарил-соединения могут быть получены способами, ранее описанными в химической литературе. Несколько из этих способов описаны ниже.
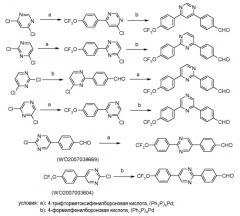
Промежуточные соединения, где 'Het' представляет собой дизамещенный пиридин, пиримидин, пиразин или пиридазин, могут быть сделаны с использованием реакции сочетания галоген- или алкилтио-замещенного пиридина, пиримидина или пиразина с арилбороновой кислотой или боратным сложным эфиром, в условиях арилирования по Сузуки. Смотри, например, следующее.
В случае пиридинов: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 и Puglisi et al. Eur. J. Org. Chem. 2003, 1552.
В случае пиразинов: Schultheiss and Bosch Heterocycles 2003, 60, 1891.
В случае пиримидинов: Qing et al. J. Fluorine Chem. 2003, 120, 21 и Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415.
Для 2,4-диарил-пиримидинов: Schomaker and Delia J. Org. Chem. 2001, 66, 7125.
Таким образом, последовательные катализированные палладием реакции арилирования, с использованием 4-формилфенил-бороновой кислоты и 4-трифторметоксифенил-бороновой кислоты, могут давать по существу любую схему замещения, что показано на схеме ниже:
Подобно тому, диарил- пиридины и пиразины и другие дигалогенированные гетероциклические ароматические соединения могут быть получены из дигалогенированных пиридинов и пиразинов и других дигалогенированных гетероциклических ароматических соединений с использованием аналогичного протокола:
Галоген- или алкилтио-пиримидиновые и пиридиновые предшественники являются либо коммерчески доступными, либо могут быть синтезированы с использованием путей, описанных в литературе (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235).
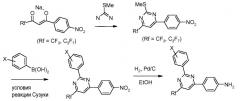
Соединения, где 'Het' представляет собой 1,3-диарил-6-перфторалкил-пиримидин, могут быть получены в соответствии со следующей схемой. 2-Метилтио-замещенный пиримидин был арилирован в модифицированных условиях реакции Сузуки (Liebeskind and Srogl Org. Lett. 2002, 4, 979), что дает 2-фенил-пиримидины, которые затем были восстановлены до соответствующих анилинов с использованием, например, палладиевого катализатора на углеродном носителе (Pd/C) в EtOH в атмосфере водорода.
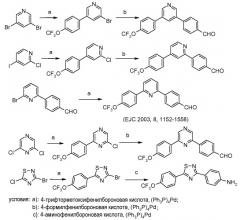
Промежуточные соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазол, могут быть получены в соответствии с одной из следующих схем.
Путь А: 1,3-Диарил 1,2,4-триазолы были получены из соответствующих -NH 3-арил-1,2,4-триазолов, следуя опубликованному пути для N-арилирования имидазолов (Lin et al. J. Org. Chem. 1979, 44, 4160). Реакция сочетания 1,2,4-триазолов с арилгалогенидами была проведена в термических или, предпочтительно, микроволновых условиях (Antilla et al. J. Org. Chem. 2004, 69, 5578).
Путь В: Бромирование гидразонов с последующей обработкой бромгидразона тетразолом приводит к образованию 1,3-диарил 1,2,4-триазола (Butler and Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587).
Путь С: Соединения 1,2,4-триазола, в которых 5-положение дополнительно замещено алкильной или замещенной алкильной группой, могут быть получены в соответствии со следующей схемой (Paulvannan and Hale Tetrahedron 2000, 56, 8071):
Соединения, где 'Het' представляет собой имидазол, могут быть получены в соответствии с одной из следующих схем:
Путь А: (Стадия 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадия 2: Liu et al. J. Org. Chem. 2005, 70, 10135):
Путь В: В случае галоген-арильных групп, которые также содержат активирующую группу, такую как нитро-группа или циано-группа, замена арил-галогенида имидазолом, с использованием основания, такого как карбонат калия в полярном апротонном растворителе, таком как N,N-диметилформамид (DMF) или диметилсульфоксид (DMSO), может быть выполнена следующим образом (Bouchet et al. Tetrahedron 1979, 35, 1331):
Путь С: Следуя методике, впервые описанной Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенацил-анилин обрабатывают тиоцианатом калия в кислой среде (HCl), и получающийся в результате 2-меркапто-имидазол затем превращают в десульфурированный диарил-имидазол посредством обработки азотной кислотой в уксусной кислоте.
Путь D: N-Арилирование 4-бромимидазола в условиях микроволнового излучения (Путь А, Стадия 2) предоставило промежуточный 1-арил-4-бромимидазол, который был превращен в промежуточные триарил-соединения посредством обработки арил-бороновыми кислотами в катализируемых палладием условиях.
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,3-триазол, могут быть получены в соответствии со следующей схемой (Feldman et al. Org Lett. 2004, 6, 3897):
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазол, могут быть получены в соответствии со следующей схемой (Yeung et al. Tetrahedron Lett. 2005, 46, 3429):
Соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазолин-5-он, могут быть получены в соответствии со следующей схемой (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 и Lyga Synth. Commun. 1986, 16, 163). (DPPA означает дифенил-фосфорилазид):
Соединения, где 'Het' представляет собой 1,3-диарил-пиразолин, могут быть получены в соответствии со следующей схемой. Моногидразон терефталальдегида обрабатывают N-хлорсукцинимидом (NCS) в изопропиловом спирте (i-PrOH), и получающееся в результате хлоргидразоновое промежуточное соединение обрабатывают непосредственно основанием и замещенным олефином с получением пиразолина:
Соединения, где 'Het' представляет собой 3,5-дизамещенный изоксазол, могут быть получены в соответствии со следующей схемой:
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразол, могут быть получены в соответствии со следующей схемой. Реакция сочетания пиразола с галогенированными ароматическими соединениями была выполнена с использованием условий микроволнового излучения, описанных Liu et al., Путь А, Стадия 2, приведенная выше. (DMA представляет собой диметилацеталь.)
Соединения, где 'Het' представляет собой 2,4-дизамещенный тиазол, получают реакцией конденсации тиоамида с α-галоген-ацетофеноном в протонном растворителе, таком как этанол (например, Potts and Marshall J. Org. Chem. 1976, 41, 129).
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,4-триазолин-5-он, получают в соответствии со следующей схемой (Henbach DE 2724819 A1, 1978 с небольшим изменением в двух стадиях):
Соединения, где 'Het' представляет собой 2,4-дизамещенный оксазолин, получают, начиная с α-бромацетофенона, в соответствии со следующей схемой (Periasamy et al. Synthesis 2003, 1965 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
Соединения, где 'Het' представляет собой 2,5-дизамещенный оксазолин, получают в соответствии со следующей схемой (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
Соединения, где 'Het' представляет собой 1,4-дизамещенный пиперазин, получают в соответствии со следующей схемой (Evans et al. Tetrahedron Lett. 1998, 39, 2937):
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразолин, получают добавлением арил-гидразина к β-диметиламино-пропиофенону так, как показано в следующей схеме, которая описана в публикации Linton et al. Tetrahedron Lett. 2007, 48, 1993, и в публикации Wheatley et al. J. Am. Chem. Soc. 1954, 76, 4490. В дополнение к пиразолину, небольшая доля бис-присоединения дает в результате соответствующий диметиламинометил-пиразолин. Эти вещества могут быть разделены хроматографическими методами.
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазин, получают в соответствии со следующей схемой (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 и Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315):
Соединения, где 'Het' представляет собой 2-кетопиперазин или 2,5-дикетопиперазин, получают так, как в следующей схеме. Сложный эфир нитрофенил-глицина может быть подвергнут ацилированию с использованием хлорацетил-хлорида, и промежуточный N-хлорацетилированный сложный эфир глицина, при обработке анилином, подвергается замещению и циклизации при температуре от 120 до 180°С с образованием дикетопиперазина. Альтернативно, насыщенные или ненасыщенные монокето-пиперазины могут быть образованы из промежуточного ацеталь-соединения, показанного ниже, посредством гидролиза и циклизации.
ПОЛУЧЕНИЕ СОЕДИНЕНИЙ С (ТИО)КАРБАМАТНОЙ СВЯЗЬЮ
Соединения с карбаматной или тио-карбаматной связью могут быть получены из соответствующих арил-аминов путем превращения либо в изоцианат, либо в изотиоцианат, либо в пара-нитрофенил-карбамат, с последующей обработкой соответственным спиртом (ROH) и органическим или неорганическим основанием в подходящем растворителе, таком как тетрагидрофуран (THF), при температурах от 0 до 100°С. Альтернативно, карбамат может быть получен из хлорформиата, образованного из спирта (ROH) посредством обработки трифосгеном в присутствии основания, такого как пиридин, с последующей реакцией с соответствующим амином.
Промежуточное изоцианатное соединение может быть получено из карбоновой кислоты путем обработки с использованием источника азида, такого как дифенилфосфорил-азид (DPPA). Затем может быть получен ацилазид с тем, чтобы подвергнуть его перегруппировке Курциуса посредством нагревания до 110°С в толуоле, и получающийся в результате изоцианат может быть обработан соответствующими спиртом и основанием, что описано выше, с тем, чтобы получить карбамат. Карбоновые кислоты-предшественники могут быть получены посредством окисления альдегида, с использованием условий, описанных в Примере 18, посредством основного гидролиза нитрила (например, гидролиза 4-(1-(4-трифторметоксифенил)-1,2,4-триазол-3-ил)-бензонитрила, который описан в Примере 10), или посредством кислотного гидролиза нитрила с использованием любого из множества условий, описанных в литературе.
Карбаматы также могут быть получены с использованием нитрофенил-карбонатов так, как показано ниже и продемонстрировано в публикации McClure and Sieber Heteroat. Chem. 2000, 11, 192. Реакция третичного карбинола с металлическим калием, с последующим добавлением пара-нитрофенил-хлорформиата, обеспечивает желаемый пара-нитрофенилкарбонат. Последующая реакция карбоната с амином в присутствии карбоната натрия в диметилформамиде предоставляет карбамат.
Алкинилкарбаматы могут быть дополнительно функционализированы путем депротонирования посредством основания, такого как н-бутил-литий, в полярном апротонном растворителе, таком как тетрагидрофуран (THF), с последующим проведением реакции с этилхлорформиатом с обеспечением замещенного алкина.
Алкен-содержащие карбаматы могут быть дополнительно функционализированы посредством гидроборирования-окисления с использованием комплекса боран-диметилсульфид, с последующей обработкой тетрагидратом пербората натрия.
ПРИМЕРЫ
Примеры привед