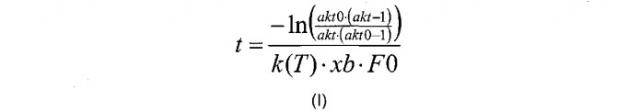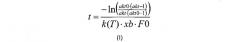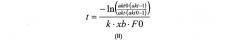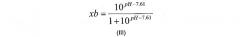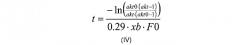Способ контроля реакции модификации полипептида
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ контроля аутоактивации фактора VII или его аналога и способ предотвращения расщепления активированного фактора VII или его аналога. Способы включают измерение начальной концентрации фактора VII/VIIa или его аналога. Измеряют начальную долю активированного фактора VII или его аналога. Рассчитывают время реакции активации фактора VII или его аналога путем корреляции значений, измеренных на вышеуказанных стадиях, со значением необходимой доли активированного фактора VII или его аналога. Выполняют реакцию активации фактора VII при pH от 6,0 до 8,0. Завершают реакцию путем снижения pH до значения ниже приблизительно 6,0. Предложенное изобретение позволяет определить оптимальное время реакции для достижения желательных уровней модифицированного фактора VII или его аналога, получить более чистый протеазный продукт, а также снизить расходы на производственную базу. 2 н. и 13 з.п. ф-лы, 5 ил., 1 табл., 2 пр.
Реферат
Область изобретения
Данное изобретение относится к способу контроля реакции модификации полипептида, а именно, но не исключительно, к способу контроля активации человеческого фактора VII (FVII) при продуцировании человеческого фактора VII(a) (FVII(a)). Также изобретение относится к полипептидам, получаемым в ходе реакции модификации полипептида, и к фармацевтическим композициям, включающим указанные полипептиды.
Предшествующий уровень техники
Свертывание крови представляет собой процесс, состоящий из сложного взаимодействия различных компонентов крови (или факторов), что в итоге приводит к фибриновому сгустку. Как правило, компоненты крови, которые участвуют в том, что называют коагуляционным «каскадом», являются ферментативно неактивными белками (проферментами или зимогенами), которые превращаются в протеолитические ферменты под действием активатора (который сам по себе является активированным коагулирующим фактором). Факторы свертывания крови, которые подверглись подобному превращению, как правило, называются «активными факторами» и обозначаются добавлением буквы «а» к имени фактора свертывания крови (например, фактор VII(a)).
FVII (известный также как одноцепочечный FVII, неактивированный FVII или зимоген) представляет собой одиночную полипептидную цепь, которая в ходе протеолитического расщепления пептидной связи между Arg152 и IIe153 превращается в активированную форму: FVII(a). Эта реакция может катализироваться аутопротеолизом FVII(а) или под действием других ферментов, таких как FXa или яд гадюки Рассела. Аутоактивация обладает тем преимуществом, что не требует добавления фермента и удаления его физически в конце процесса.
Очень важно тщательно контролировать активацию FVII, поскольку содержание продуктов деградации с тяжелой цепью (АА290 и АА315) резко возрастает после того, как доля активации достигает более чем 99% (т.е. как только количество предпочтительного субстрата Arg152 уменьшается). Поэтому важно не слишком активировать продукт. В то же время желательной является высокая доля активации, например свыше 94%, и остается довольно узкий интервал (например, 94-99%), в котором можно получить как низкое содержание продуктов деградации, так и высокую активность.
Одновременно с очисткой фермента будет происходить активация определенного количества фермента. Кроме того, уровни активации во время процесса очистки будут неизбежно меняться вследствие изменений в составе исходного вещества - главным образом титра FVII(a) и, следовательно, загрузки колонки. Непредвиденное время задержки в ходе очистки также будет приводить к изменениям в уровнях активации. При очистке молекулы FVII(a) будут подвержены перемене условий, это касается концентрации, pH, температуры и времени удерживания, что приведет к частичной активации. Согласно наблюдениям после очистки доля активации изменялась в широких пределах (например, от 16% до 74%) в зависимости от методики очистки и условий. Это изменение в доли активации после очистки создает значительную проблему в отношении проведения стандартизованного процесса активации вслед за очисткой.
Долю активации FVII можно рассчитать известными методами, однако в настоящее время не существует методик измерений в реальном времени, и продолжительность известных процедур обычно составляет около 30 минут. Таким образом, если доля активации приближается к 99% при удалении образца в ходе измерения, то это значение будет превышено к тому моменту, как будут получены результаты. Это приведет к высоким уровням нежелательных продуктов деградации с тяжелой цепью.
US 4,286,056 (Baxter Travenol Lab) описывает способ получения активированного концентрата протромбинового комплекса, согласно которому контролируют уровень активации, определяя состояние активации исходного вещества, и затем изменяют по меньшей мере одно из условий активации в соответствии с анализами протекания активации исходного вещества для достижения заранее установленного уровня активации. WO 2007/013993 (Maxygen Holdings Ltd) описывает способ активации FVII до FVII(a) в растворе, согласно которому добавляют аминосоединение, Ca2+, доводят конечный pH раствора до приблизительно 7,2-8,6, инкубируют полученную в результате активационную смесь между приблизительно 2°C и приблизительно 25°C в течение времени, достаточного для превращения по меньшей мере 90% scFVII в FVII(a). US 4,456,591 (Baxter Travenol Lab) описывает способ введения пациенту с нарушением фактора свертывания крови, такого как дефицит или ингибирование, эффективного гемостатического количества композиции, в которой единственный эффективный активированный кровоостанавливающий агент является фактором VII(a).
Таким образом, существует значительная потребность в создании улучшенного способа определения оптимального времени реакции для достижения желательных уровней модифицированного фермента.
Также согласно настоящему изобретению получен более чистый протеазный продукт. Менее вероятно, что более чистый продукт приведет к образованию антипротеазы (антитела) у пациента.
Кроме того, жесткий контроль над скоростью активации протеазы в итоге приведет к снижению расходов на производственную базу, поскольку меньше серийных партий будет отбраковываться, когда большее число партий будет соответствовать установленным требованиям с точки зрения чистоты и равномерности качества.
Сущность изобретения
Согласно первому аспекту изобретения разработан способ контроля реакции модификации полипептида, включающий стадии, на которых рассчитывают по меньшей мере один параметр процесса и используют указанный параметр в математической модели для расчета значения дополнительного параметра процесса.
Согласно второму аспекту изобретения разработан способ осуществления реакции модификации полипептида, включающий стадии, на которых:
(а) измеряют начальную концентрацию полипептида;
(б) измеряют начальную долю модифицированного полипептида;
(в) рассчитывают время реакции модификации полипептида путем корреляции значений, рассчитанных на каждой из стадий (а) и (б), со значением необходимой доли модифицированного полипептида; и
(г) выполняют реакцию модификации полипептида в течение времени, рассчитанного на стадии (в).
Согласно третьему аспекту изобретения создан полипептид, получаемый по способу, как определено выше.
Графические материалы
Фигура 1 иллюстрирует общую идею изобретения. При различном вводе способ гарантирует, что выход по существу является предсказуемым и постоянным.
Фигура 2 иллюстрирует важность точного регулирования степени, с которой активируют протеазу. Когда степень активации (%) увеличивается от 99,5% до 100%, то процент продукта расщепления (протеазы) увеличивается экспоненциально.
Фигура 3 показывает, что чем больше фермента (то есть протеазы) находится в партии, тем быстрее будет происходить активация протеазы. Молярную долю (xb), выраженную в процентах, можно найти, используя диаграмму Гендерсона-Гассельбаха. Активная фракция фермента может быть вычислена для любого pH. Существует нелинейная корреляция.
Фигура 4 показывает концентрационную зависимость полученного FVII(a). При высокой концентрации FVII(a) скорость активации FVII больше, чем при низкой концентрации FVII(a).
Фигура 5 показывает, как концентрация полученного FVII(a) зависит от pH. При более высоком pH (6,8) скорость активации FVII выше; при более низком pH (6,2) скорость активации FVII ниже, и при pH 6,5 скорость активации FVII имеет промежуточное значение.
Подробное описание изобретения
Согласно первому аспекту изобретения разработан способ контроля реакции модификации полипептида, включающий стадии, на которых рассчитывают по меньшей мере один параметр процесса и используют указанный параметр в математической модели для расчета значения дополнительного параметра процесса.
Следовательно, изобретение обеспечивает преимущество объединения физической или математической модели с методом процессной аналитической технологии (ПАТ) для оценки существенного параметра процесса. Метод ПАТ обладает тем преимуществом, что используется «на линии», «в линии» и/или «у линии» для точного контроля реакции модификации. Таким образом, применение подобной методики позволяет пользователю с непосредственно требуемым значением, при котором реакцию можно осуществить наилучшим образом, достигнуть оптимальных результатов. В одном воплощении по меньшей мере один параметр процесса может быть выбран из степени модификации, измерений концентрации реагента, измерений pH, измерений температуры. В одном воплощении дополнительным параметром процесса может быть время реакции.
В одном воплощении по способу контролируют степень пегилирования полипептида. Таким образом, согласно дополнительному аспекту изобретения разработан способ контроля степени пегилирования полипетида, включающий стадии, на которых используют степень необходимого пегилирования, концентрацию фермента, концентрацию ПЭГ, концентрацию полипептида и температуру в математической модели и рассчитывают время реакции.
В одном воплощении по способу контролируют степень пегилирования полипептида фактора IX (FIX). В одном воплощении степень пегилирования рассчитывают в соответствии со следующими параметрами процесса: время реакции, концентрация фермента, концентрация ПЭГ, концентрация FIX и температура (которая обычно составляет 22°). Следует понимать, что квалифицированный специалист способен рассчитать оптимальное время реакции для достижения необходимой степени пегилирования FIX путем введения значений параметров процесса в математическую модель (которая может быть получена методами Эйлера, Рунге-Кутта, Ньютона-Рафсона или DASPK). Такие математические методы можно успешно использовать для точного контроля реакций модификации полипептида.
Согласно второму аспекту изобретения разработан способ осуществления реакции модификации полипептида, включающий стадии, на которых:
(а) измеряют начальную концентрацию полипептида;
(б) измеряют начальную долю модифицированного полипептида;
(в) рассчитывают время реакции модификации полипептида путем корреляции значений, рассчитанных на каждой из стадий (а) и (б), со значением необходимой доли модифицированного полипептида; и
(г) выполняют реакцию модификации полипептида в течение времени, рассчитанного на стадии (в).
В одном воплощении реакция модификации включает ферментативное расщепление или модификацию при добавлении к полипептиду химического реагента (например, пегилирование).
В одном воплощении, где модификация включает ферментативное расщепление, неожиданно было обнаружено, что начальную концентрацию и долю расщепления можно соотнести с требуемой долью расщепления для расчета точного времени реакции. Результаты этой корреляции чрезвычайно точны (часто с точностью приблизительно 0,5% доли расщепления) и воспроизводимы. Также этот способ обладает значительным преимуществом, так как только два измерения необходимо рассчитать до реакции (а именно, начальную концентрацию и долю расщепления). Кроме того, реакция может продолжаться в течение расчетного времени без необходимости наблюдения за состоянием реакции (или даже измерения конечной доли расщепления, когда это необходимо с целью контроля качества).
Как используется здесь, термин «белок», «полипептид» и «пептид» означает соединение, состоящее по меньшей мере из пяти составляющих аминокислот, соединенных пептидными связями. Составляющие аминокислоты могут быть из группы аминокислот, кодируемых генетическим кодом, и они могут представлять собой как природные аминокислоты, которые не кодируются генетическим кодом, так и синтетические аминокислоты. Природными аминокислотами, которые не кодируются генетическим кодом, являются, например, гидроксипролин, y-карбоксиглутамат, орнитин, фосфосерин, D-аланин и D-глутамин. Синтетические аминокислоты включают аминокислоты, полученные в ходе химического синтеза, то есть D-изомеры аминокислот, кодируемых генетическим кодом, такие как D-аланин и D-лейцин, Aib (α-аминоизомасляная кислота), Abu (α-аминомасляная кислота), Tie (трет-бутилглицин), β-аланин, β-аминометилбензойная кислота и антраниловая кислота.
В одном воплощении полипептид представляет собой фермент, такой как фактор свертывания крови или связанный с гемостазом белок (например, серин-протеаза). Примеры таких полипептидов включают: I (фибриноген), II (протромбин), тканевый фактор, V (проакцелерин), VI, VII, VIII, IX (фактор Кристмаса), X (фактор Стюарта-Прауэра), XI (предшественник плазменного тромбопластина), XII (фактор Хагемана), XIII (фибринстабилизирующий фактор), фактор фон Виллебранда, прекалликреин, высокомолекулярный кининоген (ВМК), фибронектин, антитромбин III, кофактор гепарина II, белок Cf, белок S, белок Z, ингибитор белок Z-подобной протеазы (ZPI от protein Z-related protease inhibitor), плазминоген, альфа-2-антиплазмин, тканевой активатор плазминогена (ТАП), урокиназу, ингибитор активатора плазминогена-1 (ИАП-1), ингибитор активатора плазминогена-2 (ИАП-2) и раковый прокоагулянт.
В дополнительном воплощении полипептид представляет собой аутоактивированный полипептид. В дополнительном воплощении фермент представляет собой фактор свертывании крови (например, серин-протеазный фактор свертывания крови). Примеры подходящих серин-протеазных факторов свертывания крови включают те, что классифицированы как EC 3.4.21, например: II, VII, IX, X, XI, XII, прекалликреин, белок C и плазминоген (активированными формами этих неактивных зимоген являются Flla, FVIIa, FIXa, FXa, FXIa, FXIIa, калликреин, активированный белок C (аРС) и плазмин, соответственно).
В одном воплощении, где реакция модификации включает ферментативное расщепление, фактор свертывания крови представляет собой фактор VII, или его аналог или производное.
В одном воплощении, где реакция модификации включает пегилирование, фактор свертывания крови представляет собой фактор IX, или его аналог или производное.
Согласно одному аспекту изобретения разработан способ активации серин-протеазного фактора свертывания крови, включающий стадии, на которых:
(а) измеряют начальную концентрацию серин-протеазного фактора свертывания крови;
(б) измеряют начальную долю активированного серин-протеазного фактора свертывания крови;
(в) рассчитывают время реакции активации серин-протеазного фактора свертывания крови путем корреляции значений, измеренных на каждой из стадий (а) и (б), со значением необходимой доли активированного серин-протеазного фактора свертывания крови; и
(г) выполняют реакцию активации серин-протеазного фактора свертывания крови в течение времени, рассчитанного на стадии (в);
(д) завершают реакцию по истечении времени реакции, рассчитанного на стадии (в).
Согласно дополнительному аспекту изобретения разработан способ активации фактора VII до фактора VII(a), или его аналога или производного, включающий стадии, на которых:
(а) измеряют начальную концентрацию фактора VII;
(б) измеряют начальную долю активированного фактора VII;
(в) рассчитывают время реакции активации фактора VII путем корреляции значений, рассчитанных на каждой из стадий (а) и (б), со значением необходимой доли активированного фактора VII; и
(г) выполняют реакцию активации фактора VII в течение времени, рассчитанного на стадии (в).
На дополнительной необязательной стадии (д) реакцию завершают по истечении времени реакции, рассчитанного на стадии (в).
Согласно еще одному дополнительному аспекту изобретения разработан способ предотвращения расщепления активированного серин-протеазного продукта, включающий стадии, на которых:
(а) измеряют начальную концентрацию серин-протеазного фактора свертывания крови;
(б) измеряют начальную долю активированного серин-протеазного фактора свертывания крови;
(в) рассчитывают время реакции активации серин-протеазного фактора свертывания крови путем корреляции значений, измеренных на каждой из стадий (а) и (б), со значением необходимой доли активированного серин-протеазного фактора свертывания крови; и
(г) выполняют реакцию активации серин-протеазного фактора свертывания крови в течение времени, рассчитанного на стадии (в);
(д) завершают реакцию по истечении времени реакции, рассчитанного на стадии (в).
В одном воплощении изобретения корреляцию, описанную на стадии (в) рассчитывают в соответствии с формулой (I):
где «akt» относится к необходимой доли расщепляемого полипептида, «akt0» относится к начальной доли расщепляемого полипептида, измеренной на стадии (б), «F0» относится к начальной концентрации полипептида (в г/л), измеренной на стадии (а), к(Т) относится к константе реакции для данной реакции (в л/г/мин), как функция от температуры, T, и xb относится к мольной доли. В одном воплощении k(T) представляет собой полином или сплайн, который описывает изменение к в зависимости от температуры. Для rFVIIa используется следующий полином 3-го порядка: k(T)=k*(0,00001 T∧3-0,00147Т∧2+0,02566 T+0.86729), где T является температурой (5-60°). Подобным образом pKa можно выразить в виде функции от температуры.
В одном воплощении температура находится между 5°C и 25°C, предпочтительно 10°C-20°C. В дополнительном воплощении реакцию активации проводят при комнатной температуре (например, около 21,5°C).
В воплощении, где модификация включает расщепление фактора VII, реакцию активации обычно проводят при постоянной температуре.
Применение изобретения к активации фактора VII выгодно приводит к получению полностью активированных молекул фактора VII, содержащих минимальное количество продуктов расщепления.
Используемый здесь в отношении полипептида термин «аналог» означает модифицированный пептид, где один или более аминокислотных остатков пептида заменены другими аминокислотными остатками, и/или где один или более аминокислотных остатков удалены из пептида, и/или где один или более аминокислотных остатков добавлены в пептид. Такое добавление или удаление аминокислотных остатков может происходить на N-концевом пептиде и/или C-концевом пептиде. Следует понимать, что все аминокислоты, для которых оптический изомер не указан, являются L-изомерами.
Примеры аналогов фактора VII можно найти в WO 02/22776, аналоги которого включены сюда путем ссылки на них. В одном воплощении аналог фактора VII представляет собой сверхактивный аналог, то есть который обладает по меньшей мере в два раза большей амидолитической активностью, чем фактор VII дикого типа. В предпочтительном воплощении аналогом фактора VII является V158D/E296V/M298Q-FVII(a) (пример 6 в WO 02/22776).
Измерение начальной концентрации полипептида на стадии (а) обычно может быть выполнено с помощью УФ-спектроскопии. В одном воплощении концентрация будет установлена между приблизительно 1,5 г/л и 2,2 г/л (например, около 1,9 г/л).
Измерение начальной доли расщепляемого полипептида на стадии (б) обычно может быть выполнено с помощью восстанавливающего SDS-PAGE (электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия), восстанавливающей и невосстанавливающей ВЭЖХ или чип-электрофореза (например, Agilent Bioanalyzer). В одном воплощении стадию (б) выполняют с помощью чип-электрофореза (например, Agilent Bioanalyzer). В одном воплощении, где полипептид включает фактор VII, начальная доля активированного фактора VII(a) обычно находится между 10 и 90% в зависимости от условий очистки.
Следует понимать, что ссылки на «необходимая доля модифицированного полипептида» относятся к любой доле модификации, необходимой для пользователя. В воплощении, где модификация включает расщепление фактора VII, необходимая доля расщепления будет находиться между 94 и 99%, так между 95 и 97% (например, около 95%). Обычно эти диапазоны выбирают, чтобы получить высокую долю активации продуктов (например, фактор VII(a)), и свести к минимуму количество продуктов расщепления с тяжелой цепью (АА290 и АА315).
В воплощении, где модификация включает расщепление фактора VII, реакция расщепления дополнительно включает добавление аминосоединения (например, гистидина, Трис, лизина, аргинина, фосфорилхолина или бетаина). В дополнительном воплощении аминосоединение является гистидином. В одном воплощении аминосоединение добавляют до конечной концентрации около 1-500 мМ, такой как приблизительно 10-100 мМ (например, 10 мМ).
В воплощении, где модификация включает расщепление фактора VII, реакция расщепления дополнительно включает добавление ионов кальция (например, хлорида кальция). В одном воплощении ионы кальция добавляют до конечной концентрации около 1-50 мМ, такой как между 10 и 25 мМ (например, 12 мМ).
В воплощении, где модификация включает расщепление фактора VII, реакция расщепления дополнительно включает добавление хлорида натрия. В одном воплощении хлорид натрия добавляют до конечной концентрации около 1-100 мМ, такой как между 20 и 80 мМ (например, 60 мМ).
В одном воплощении изобретения необходимая доля расщепления серин-протеазы находится между 90 и 99%, например между 94 и 99%, например между 95 и 97%, например между 96 и 98%, например между 97 и 99%.
В воплощении, где модификация включает расщепление фактора VII, реакцию активации обычно выполняют при рН между 6,0 и 8,0. Аутокаталитическая реакция фактора VII зависит от рН. Повышение рН инициирует амидолитическую активность фактора VII, и, таким образом, скорость реакции соответственно увеличивается. Поэтому желательно выбрать значение рН между 6,0 и 8,0 и гарантировать, что реакция продолжается при этом pH, соответствующем буферизации. Если рН изменяется в ходе реакции активации, то скорость активации будет отличаться от того значения, что рассчитано на стадии (в) и, следовательно, влиять на качество продукта реакции.
Таким образом, в одном воплощении способ по изобретению дополнительно включает стадию, на которой выбирают рН между 6,0 и 8,0 до инициирования реакции активации и поддерживают выбранное значение рН в ходе реакции активации. В дополнительном воплощении рН выбран между 6,25 и 6,75 (например, 6,5±0,05).
Принимая во внимание существенную точность описанной здесь методики, желательно следить за тем, чтобы реакция активация завершалась сразу по истечении времени реакции, рассчитанного на стадии (в). Если реакция активации будет продолжаться после времени, рассчитанного на стадии (в), то это приведет к увеличению возможного присутствия нежелательных продуктов расщепления с тяжелой цепью. Ряд альтернативных способов завершения реакции известны квалифицированному специалисту в данной области, например добавление диоксида кремния к реакционной смеси. Однако в одном воплощении реакция активации завершается понижением рН до значения ниже приблизительно 6,0, такого как между 5,5 и 6,0 (например, 5,8). В одном воплощении pH уменьшают, добавляя сильную кислоту (например, 1 М соляную кислоту).
В дополнительном воплощении изобретения корреляция, описанная на стадии (в), используемая для расчета времени реакции (далее обозначаемого как «t»), может быть рассчитана в соответствии с формулой (II):
где «akt» относится к необходимой доли расщепляемого полипептида, «akt0» относится к начальной доли расщепляемого полипептида, измеренной на стадии (б), «F0» относится к начальной концентрации полипептида (в г/л), измеренной на стадии (а), к относится к константе реакции для данной реакции (в л/г/мин), и xb относится к мольной доли.
Мольная доля (xb) может быть рассчитана с использованием соотношения Гендерсона-Гассельбаха, которое устанавливает взаимосвязь между активной фракцией фермента при любом значении рН. Обычно это соотношение представляет собой нелинейную корреляцию (например, сигмоидальную).
В воплощении, где модификация включает расщепление фактора VII, xb можно рассчитать, исходя из степени протонирования гистидина. Сериновые протеазы (включая фактор VII(a)) характеризуются каталитической триадой, состоящей из трех остатков: серина 139, гистидина 57 и аспартата 81. Известно, что остаток гистидина должен быть депротонирован, чтобы прореагировать, и сериновая протеаза активна только в диапазоне рН выше pKa гистидина (который составляет 7,61).
Следовательно, в воплощении, где модификация включает расщепление фактора VII, xb можно рассчитать по следующему уравнению формулы (III):
где рН относится к выбранному рН реакции.
Значение к можно рассчитать в соответствии с реакционной кинетикой данной реакции, предназначенной для измерения. Таким образом, к представляет собой физическую константу, которая определяет концентрационную зависимость. Обычно такая константа может быть рассчитана в соответствии с суммой наименьших квадратов, которая должна быть очевидна квалифицированному специалисту в данной области. Например, в воплощении, где полипептид включает фактор VII, значение к рассчитано как 0,29 л/г/мин. Следовательно, в воплощении, где модификация включает расщепление фактора VII, корреляция, описанная на стадии (в) для вычисления времени реакции («t»), может быть рассчитана в соответствии с формулой (IV):
Где akt, akt0, xb и F0 являются такими, как определено здесь выше.
В дополнительном воплощении изобретения, корреляция, описанная на стадии (в), рассчитывается по формуле (V), в которой xb формулы (II) представляет собой 1:
где «akt» относится к необходимой доли расщепляемого полипептида, «art0» относится к начальной доли расщепляемого полипептида, измеренной на стадии (б), «F0» относится к начальной концентрации полипептида (в г/л), измеренной на стадии (а), и к относится к константе реакции для данной реакции (в л/г/мин).
Согласно третьему аспекту изобретения создан полипептид, получаемый согласно способу, как определено выше.
В разных воплощениях указанный серин-протеазный фактор свертывания крови представляет собой фактор II или фактор VII, или фактор IX, или фактор X, или фактор XI, или фактор XII; или аналог или производное любого из указанных факторов свертывания крови.
В одном воплощении полипептид представляет собой аналог или производное фактора VII(a) или фактора IX.
Аналоги или производные фактора VII(a) или фактора IX и фармацевтические композиции, включающие аналоги или производные фактора VII(a) или фактора IX по настоящему изобретению, можно применять для лечения заболеваний, облегчаемых путем введения человеческого фактора свертывания крови VII(a) или IX, таких как нарушение свертываемости крови, например гемофилия, болезнь крови, гемартроз, гематома, кожно-слизистое кровотечение, наследственная болезнь крови, семейное нарушение свертываемости крови, семейная болезнь крови, или при факторной заместительной терапии. В одном воплощении заболевание, облегчаемое введением человеческого фактора свертывания крови VII(a) или IX, представляет собой гемофилию, такую как гемофилия В или болезнь Кристмаса.
Таким образом, согласно дополнительному аспекту изобретения разработан способ лечения гемофилии, согласно которому вводят пациенту терапевтически эффективное количество аналога или производного фактора VII(a) или IX, как определено выше.
Также разработан аналог или производное фактора VII(a) или фактора IX, как определено выше, для использования при лечении гемофилии.
Также обеспечено применение аналога или производного фактора VII(a) или фактора IX, как определено выше, при изготовлении лекарства для лечения гемофилии.
Также разработана фармацевтическая композиция, включающая аналог или производное фактора VII(a) или IX, как определено выше, для использования при лечении гемофилии.
Как используется здесь, термин «лечение» и «подвергаемый лечению» означает ведение и забота о пациенте с целью противодействия состоянию, такому как заболевание или расстройство. Подразумевается, что термин включает полный спектр методов лечения данного состояния, от которого страдает пациент, а именно введение активного соединения для облегчения симптомов или осложнений, для замедления развития заболевания, расстройства или состояния, для облегчения или ослабления симптомов или осложнений и/или для излечения или устранения заболевания, расстройства или состояния, а также для предотвращения состояния, где предотвращение следует понимать как ведение и заботу о пациенте с целью противодействия заболеванию, состоянию или расстройству, и что оно включает введение активных пептидов, чтобы предотвратить появление симптомов или осложнений. Пациент, который подвергается лечению, предпочтительно представляет собой млекопитающее, а именно человек, но также может включать животных, таких как собаки, кошки, коровы, овцы и свиньи. Следует понимать, что терапевтические и профилактические (предупредительные) режимы являются отдельными аспектами настоящего изобретения.
Как используется здесь, «терапевтически эффективное количество» пептида означает количество, достаточное для излечения, облегчения или частичной задержки клинических проявлений данного заболевания и его осложнений. Количество, достаточное для достижения этого, определено как «терапевтически эффективное количество». Эффективные количества для каждой цели будут зависеть от вида и тяжести заболевания или повреждения, а также веса и общего состояния объекта. Следует понимать, что определение соответствующей дозировки может быть достигнуто с использованием рутинного экспериментирования, путем построения матрицы значений и проверки разных точек в матрице, все это находится в пределах общепринятых навыков подготовленного терапевта или ветеринара.
Согласно дополнительному аспекту изобретения разработан фармацевтический препарат, включающий полипептид, как определено выше.
Препарат дополнительно может включать буферную систему, консервант(ы), тонический агент(ы), хелатообразующий агент(ы), стабилизаторы и поверхностно-активные вещества. В одном воплощении изобретения фармацевтический препарат представляет собой водный препарат, то есть препарат, содержащий воду. Подобный препарат обычно является раствором или суспензией. В одном воплощении изобретения фармацевтический препарат представляет собой водный раствор.
Термин «водный препарат» определен, как препарат, содержащий по меньшей мере 50 мас./мас. % воды. Подобный образом термин «водный раствор» определен, как раствор, содержащий по меньшей мере 50 мас./мас. % воды, и термин «водная суспензия» определен, как суспензия, содержащая по меньшей мере 50 мас./мас. % воды.
В одном воплощении фармацевтический препарат представляет собой высушенный сублимацией препарат, в который врач или пациент добавляет растворители и/или разбавители до применения.
В одном воплощении фармацевтический препарат представляет собой высушенный препарат (например, высушенный сублимацией или высушенный распылением), готовый для применения без предварительного растворения.
В одном воплощении изобретение относится к фармацевтическому препарату, включающему водный раствор пептида по настоящему изобретению, и буфер, где указанный пептид находится в концентрации 0,1-100 мг/мл, и где указанный препарат имеет рН от приблизительно 2,0 до приблизительно 10,0.
В одном воплощении изобретения рН препарата выбран из списка, состоящего из 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9 и 10,0.
В одном воплощении изобретения буфер выбран из группы, состоящей из ацетата натрия, карбоната натрия, цитрата, глицил-глицина, гистидина, глицина, лизина, аргинина, дигидрофосфата натрия, гидрофосфата натрия, фосфата натрия и трис(гидроксиметил)-аминометана, бицина, трицина, яблочной кислоты, сукцината, малеиновой кислоты, фумаровой кислоты, винной кислоты, аспарагиновой кислоты или их смесей. Каждый из этих конкретных буферов составляет альтернативное воплощение изобретения.
В одном воплощении изобретения препарат дополнительно включает фармацевтически приемлемый консервант.В одном воплощении изобретения консервант выбран из группы, состоящей из фенола, o-крезола, м-крезола, п-крезола, метил-п-гидроксибензоата, пропил-п-гидроксибензоата, 2-феноксиэтанола, бутил-п-гидроксибензоата, 2-фенилэтанола, бензилового спирта, хлорбутанола и тиомерсала, бронопола, бензойной кислоты, имидомочевины, хлоргексидина, дегидроацетата натрия, хлоркрезола, этил-п-гидроксибензоата, бензетоний хлорида, хлорфенезина (3п-хлорфеноксипропан-1,2-диола) или их смесей.
В одном воплощении изобретения консервант присутствует в концентрации от 0,1 мг/мл до 20 мг/мл. В одном воплощении изобретения консервант присутствует в концентрации от 0,1 мг/мл до 5 мг/мл. В одном воплощении изобретения консервант присутствует в концентрации от 5 мг/мл до 10 мг/мл. В одном воплощении изобретения консервант присутствует в концентрации от 10 мг/мл до 20 мг/мл. Каждый из этих конкретных консервантов составляет альтернативное воплощение изобретения. Квалифицированному специалисту хорошо известно использование консерванта в фармацевтических композициях. Для удобства сделана ссылка на Remington: The Science and Practice of Pharmacy, 20-e издание, 2000.
В одном воплощении изобретения препарат дополнительно включает изотонический агент. В одном воплощении изобретения изотонический агент выбран из группы, состоящей из соли (например, хлорида натрия), сахара или сахарного спирта, аминокислоты (например, L-глицина, L-гистидина, аргинина, лизина, изолейцина, аспарагиновой кислоты, триптофана, треонина), альдита (например, глицерола (глицерина), 1,2-пропандиола (пропиленгликоля), 1,3-пропандиола,1,3-бутандиола), полиэтиленгликоля (например, ПЭГ400) или их смесей. Можно использовать любой сахар, такой как моно-, ди- или полисахариды, или водорастворимые глюканы, включая, например, фруктозу, глюкозу, маннозу, сорбозу, ксилозу, мальтозу, лактозу, сахарозу, трегалозу, декстран, пуллулан, декстрин, циклодекстрин, растворимый крахмал, гидроксиэтил-крахмал и карбоксиметилцеллюлозу-Na. В одном воплощении добавочным сахаром является сахароза. Сахарный спирт определен как С4-С8 углеводород, имеющий по меньшей мере одну -ОН группу, и включает, например, маннит, сорбит, инозит, галактит, дульцит, ксилит и арабит. В одном воплощении добавочный сахарный спирт является маннитом. Указанные выше сахара и сахарные спирты можно использовать по отдельности или в сочетании. Не существует фиксированного предела используемого количества, поскольку сахар или сахарный спирт растворим в жидком препарате и не воздействует отрицательно на стабилизирующие эффекты, достигнутые при использовании способов по изобретению. В одном воплощении концентрация сахара или сахарного спирта находится между приблизительно 1 мг/мл и приблизительно 150 мг/мл. В одном воплощении изобретения изотонический агент находится в концентрации от 1 мг/мл до 50 мг/мл. В одном воплощении изобретения изотонический агент находится в концентрации от 1 мг/мл до 7 мг/мл. В одном воплощении изобретения изотонический агент находится в концентрации от 8 мг/мл до 24 мг/мл. В одном воплощении изобретения изотонический агент находится в концентрации от 25 мг/мл до 50 мг/мл. Каждый из этих конкретных изотонических агентов составляет альтернативное воплощение изобретения. Применение изотонического агента в фармацевтических композициях хорошо известно квалифицированному специалисту. Для удобства сделана ссылка на Remington: The Science and Practice of Pharmacy, 20oe издание, 2000.
В одном воплощении изобретения препарат, кроме того, включает хелатообразующий агент. В одном воплощении изобретения хелатообразующий агент выбран из солей этилендиаминтетрауксусной кислоты (ЭДТА), лимонной кислоты и аспарагиновой кислоты и их смесей. В одном воплощении изобретения хелатообразующий агент находится в концентрации от 0,1 мг/мл до 5 мг/мл. В одном воплощении изобретения хелатообразующий агент находится в концентрации от 0,1 мг/мл до 2 мг/мл. В одном воплощении изобретения хелатообразующий агент находится в концентрации от 2 мг/мл до 5 мг/мл. Каждый из этих конкретных хелатообразующих агентов составляет альтернативное воплощение изобрете