Устройство для интегрального анализа нуклеиновых кислот в реальном времени и способ определения целевой нуклеиновой кислоты с его использованием
Иллюстрации
Показать всеГруппа изобретений относится к области молекулярно-диагностических исследований. Устройство для комплексного качественного или количественного анализа нуклеиновых кислот в реальном времени используют в способе определения целевой нуклеиновой кислоты. Устройство состоит из множества приспособлений для автоматизированной очистки и распределения, амплификатора нуклеиновых кислот в реальном времени, контроллера и блока отображения. Использование изобретений позволяет быстро и точно проводить исследования различных мишеней из различных образцов, посредством проведения амплификации при одинаковых условиях для всех мишеней. 2 н. и 14 з.п. ф-лы, 11 ил., 2 табл., 3 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к устройству для интегрального анализа нуклеиновых кислот в реальном времени и к способу определения целевой нуклеиновой кислоты с его использованием и, более конкретно, к устройству для интегрального анализа нуклеиновых кислот в реальном времени для одновременного осуществления качественного анализа или количественного анализа генов в многочисленных биологических образцах различных типов и к способу определения целевой нуклеиновой кислоты с его использованием.
ПРЕДПОСЫЛКИ
В отношении диагностического исследования in vitro (диагностическое исследование iv), конкретное целевое вещество определяют или количественно анализируют, используя образец, полученный из организма человека, такой как кровь, моча, слюна или т.п., в качестве образца, с целью определить, протекает ли заболевание или инфекция, или нет. Молекулярное диагностическое исследование или исследование нуклеиновой кислоты (NAT) является самым быстро растущим сегментом рынка диагностических исследований in vitro, но его осуществляют только в крупных больницах и организациях, специализированных на клинических исследованиях, вследствие сложности процесса.
Качественные и количественные исследования на вирусы или бактерии, вызывающие инфекционные заболевания, в настоящее время составляют основную часть молекулярных диагностических исследований, и подтверждающее исследование или т.п. осуществляют для того, чтобы независимо подтвердить результаты диагностического исследования на инфекционные заболевания или подтвердить наличие мутантов. Быстро растет число диагностических исследований для ранней идентификации опухолей и увеличения эффективности способов терапии. Молекулярные диагностические исследования различно применяют в области персонализированной медицины для определения аномальных генов, определения способов терапии, выбора лекарственного средства и оценки эффективности лекарственного средства, в отношении заболеваний, вызываемых личной генетической предрасположенностью.
Используемая в настоящее время автоматизированная система для молекулярного диагностического исследования разработана таким образом, что весь ход выделения, амплификации, идентификации и т.п. нуклеиновой кислоты является автоматизированным. Например, в отношении системы прямого отбора образца из пробирки TIGRIS DTS компании Gen-Probe, которая является первой автоматизированной системой, одобренной Управлением по контролю над продуктами и лекарствами США, захват мишеней, амплификация, идентификация и вывод результатов исследования являются автоматизированными. Система может исследовать инфекцию Neisseria gonorrhea, которая является возбудителем гонореи, в качестве одного из типичных венерических заболеваний, и Chlamydia trachomatis, которая является возбудителем передаваемого половым путем заболевания. В качестве других примеров, разработаны система COBAS (Ampliprep, анализатор Taqman) компании Roche Molecular Systems, система m2000 (m2000sp, m2000rt) компании Abbott, система GeneXpert компании Cepheid, анализатор Liat («Лаборатория в пробирке») компании IQuum Inc., в автоматизированной системе, основанной на полимеразной цепной реакции (ПЦР), и представлены на рынке.
Однако в соответствии с существующей автоматизированной системой, поскольку получение образцов, количественный анализ в реальном времени и отчет в отношении образца одного типа осуществляют за одну стадию, невозможно осуществлять получение образцов, количественный анализ и качественный анализ в реальном времени и создавать отчет в отношении образцов многих различных видов одновременно и за один раз.
В частности, число пациентов с гепатитом В велико, тогда как число пациентов с туберкулезом не много. В этом случае исследования нужно отложить на несколько дней до тех пор, пока не будет получено предварительно определенное количество образцов. В случае, когда осуществляют диагностическое исследование образцов нескольких типов, для каждого типа нужно осуществлять отличающееся исследование, что требует повторных экспериментов и, таким образом, многие исследования нельзя осуществить за день. Необходимо много времени для сбора образцов для определения гепатита B и выделения, очистки и амплификации нуклеиновой кислоты для того, чтобы определить вирус гепатита В.
По существу, много времени необходимо для того, чтобы получить большое количество образцов одного типа, и расточительно использовать современный 96-луночный реактор для амплификации нуклеиновых кислот для того, чтобы анализировать только несколько образцов гепатита В. В конце концов, в этом случае устройство работает без пользы или нужно дополнительно собирать образцы. По этой причине мелкие и средние больницы не могут осуществлять различные клинические исследования относительно малого числа клинических образцов вследствие экономических и временных ограничений и, таким образом, привлекает внешние исследовательские организации для проведения исследований, что ведет к увеличению времени, затрат и усилий.
ОПИСАНИЕ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Авторы настоящего изобретения, изучая автоматизированную систему, способную выделять, анализировать и создавать отчеты о мишенях нескольких типов одновременно, разработали устройство для интегрального анализа нуклеиновых кислот в реальном времени для сбора образцов нескольких типов, выделения нуклеиновых кислот из образцов нескольких типов в тот же день и одновременного определения нуклеиновых кислот в одном амплификаторе нуклеиновых кислот для того, чтобы предоставить маленьким и средним больницам, которые имеют относительное небольшое число образцов, возможность осуществлять различные диагностические исследования эффективно, и способ анализа целевых нуклеиновых кислот с его использованием, и затем выполнили настоящее изобретение.
Цель настоящего изобретения состоит в том, чтобы предоставить устройство для интегрального анализа нуклеиновых кислот в реальном времени, которое способно одновременно осуществлять качественный анализ или количественный анализ генов, соответствующих биологическим образцам множества различных типов.
Другая цель настоящего изобретения состоит в том, чтобы предоставить способ определения целевой нуклеиновой кислоты с использованием устройства для интегрального анализа нуклеиновых кислот в реальном времени.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Настоящее изобретение относится к устройству для интегрального анализа нуклеиновых кислот в реальном времени, которое способно одновременно осуществлять качественный анализ или количественный анализ генов из многочисленных биологических образцов различных типов.
Настоящее изобретение также относится к способу определения целевой нуклеиновой кислоты из биологических образцов, содержащих нуклеиновые кислоты, с использованием устройства для интегрального анализа нуклеиновых кислот в реальном времени.
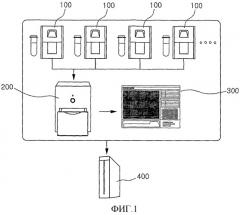
В основном аспекте представлено устройство для интегрального анализа нуклеиновых кислот в реальном времени для одновременного осуществления качественного анализа или количественного анализа целевых нуклеиновых кислот, соответствующих биологическим образцам различных типов, где устройство для интегрального анализа нуклеиновых кислот в реальном времени содержит: множество приспособлений для автоматизированной очистки и распределения 100, которые отделяют и очищают целевые нуклеиновые кислоты от биологических образцов различных типов, содержащих целевые нуклеиновые кислоты; амплификатор нуклеиновых кислот в реальном времени 200, содержащий многолуночный блок термоциклирования 210 и измеряющий количества целевых нуклеиновых кислот различных типов в реальном времени, которые получены посредством множества приспособлений для автоматизированной очистки и распределения 100; контроллер, который назначает множество лунок на блоке термоциклирования 210 амплификатора нуклеиновых кислот в реальном времени 200 посредством стандартизованной колонки, в соответствии с типами целевых нуклеиновых кислот, соответственно целевым нуклеиновым кислотам различных типов, соответственно разделенным и очищенным посредством приспособлений для автоматизированной очистки и распределения 100, сохраняет информацию о биологических образцах из приспособлений для автоматизированной очистки и распределения 100 в соответствии с соответствующими лунками, назначенными посредством стандартизованной колонки, осуществляет одновременную амплификацию при тех же условиях для блока термоциклирования и осуществляет комплексное управление так, что результаты амплификации, посредством которых соответствующие целевые нуклеиновые кислоты качественно или количественно анализируют, соответствуют соответствующим биологическим образцам, которые подвергли разделению и очистке посредством приспособлений для автоматизированной очистки и распределения 100; и блок отображения 300 в реальном времени, который выводит результаты качественного или количественного анализа с контроллера.
При назначении множества лунок на блоке термоциклирования 210 амплификатора нуклеиновых кислот в реальном времени 200 посредством стандартизованной колонки, в соответствии с типами целевых нуклеиновых кислот, и сохранении информации о биологических образцах в соответствии с приспособлениями для автоматизированной очистки и распределения 100 соответственно соответствующим лункам, назначенным посредством стандартизованной колонки, можно дополнительно хранить информацию об образце положительного стандарта, образце отрицательного стандарта или образце количественного стандарта.
Амплификатор нуклеиновых кислот в реальном времени 200 может иметь диагностические наборы, загруженные на многолуночный блок термоциклирования 210, диагностические наборы содержат нуклеиновые кислоты различных типов, полученные от множества приспособлений для автоматизированной очистки и распределения 100.
Многолуночный блок термоциклирования 210 может представлять собой 96-луночный блок термоциклирования, состоящий из 12 колонок × 8 рядов лунок.
Измеряемые элементы можно выборочно установить на многолуночный блок термоциклирования 210 посредством стандартизованной колонки.
Контроллер, когда внутренний положительный контроль (ВПК) отделяют вместе с биологическими образцами различных типов в каждом приспособлении для автоматизированной очистки и распределения 100, может определить по продукту амплификации посредством амплификатора нуклеиновых кислот в реальном времени 200, успешно ли отделили нуклеиновую кислоту посредством приспособления для автоматизированной очистки и распределения 100, и тем самым может определить, нужно ли повторять отделение нуклеиновой кислоты.
Контроллер может качественно определить присутствие или отсутствие целевых нуклеиновых кислот, посредством сравнения значений Ct соответствующих биологических образцов, которые получены посредством одновременной амплификации при тех же условиях амплификатора нуклеиновых кислот в реальном времени 200, с критическим значением Ct.
Контроллер может количественно определять целевую нуклеиновую кислоту в образце посредством сравнения соответствующих значений Ct, полученных посредством одновременной амплификации образца количественного стандарта с известной концентрацией и соответствующих биологических образцов при тех же условиях амплификатора нуклеиновых кислот в реальном времени 200, с количественным графиком значений Ct образца количественного стандарта для вычисления числа целевых нуклеиновых кислот.
Приспособление для автоматизированной очистки и распределения 100 может содержать картридж, содержащий различные биологические образцы, содержащие нуклеиновые кислоты и буферы, используемые для выделения нуклеиновых кислот из них, охлаждающий блок, высокотемпературный блок, емкость для жидких отходов, картридж пипетки и блок пипетки, блок пипетки можно перемещать на подложке, на которой предоставлены блоки и картриджи, что делает возможным присоединение и разъединение пипеток, и содержит блок приложения магнитного поля для приложения магнитного поля к пипеткам или его выключения, а информацию о соответствующих образцах стандартов и биологических образцах и информацию о целевых нуклеиновых кислотах в соответствии с приспособлениями для автоматизированной очистки и распределения 100 можно хранить в контроллере.
Амплификатор нуклеиновых кислот в реальном времени 200 может содержать многолуночный блок термоциклирования, температуру которого меняют в соответствии с предварительно определяемыми значениями температуры, источник света облучения для облучения светом реакционных пробирок, загруженных в блок термоциклирования, и датчик определения флуоресцентного света для того, чтобы принимать свет, создаваемый в реакционных пробирках, и измеряемые элементы задают и хранят посредством стандартизованной колонки назначенных лунок.
Устройство для интегрального анализа нуклеиновых кислот в реальном времени может дополнительно содержать блок хранения базы данных 400, хранящий результаты анализов.
В другом основном аспекте способ определения целевой нуклеиновой кислоты с использованием устройства для интегрального анализа нуклеиновых кислот в реальном времени содержит: 1) отделение и очистку нуклеиновых кислот, содержащихся в соответствующих образцах, от различных биологических образцов, содержащих образцы стандартов и нуклеиновые кислоты, посредством множества приспособлений для автоматизированного разделения и очистки 100, и затем внесение раствора, таким образом отделенного и очищенного, в реакционную пробирку с реакционной смесью для амплификации нуклеиновых кислот; 2) назначение множества лунок на многолуночном блоке термоциклирования 210 посредством стандартизованной колонки в соответствии с типами целевых нуклеиновых кислот так, что многолуночный блок термоциклирования 210, на который загружают реакционные пробирки с реакционной смесью для амплификации нуклеиновых кислот, и соответствующие целевые нуклеиновые кислоты, разделенные и очищенные посредством приспособлений для автоматизированной очистки и распределения 100, соответствуют друг другу, и хранение информации об образцах стандартов и биологических образцах, разделенных посредством приспособлений для автоматизированной очистки и распределения 100, соответственно с соответствующими лунками, назначенными посредством стандартизованной колонки; 3) загрузку реакционных пробирок, подготовленных на стадии 1), в соответствующие лунки в соответствии с хранимой информацией о биологических образцах в соответствующих лунках многолуночного блока термоциклирования 210 амплификатора нуклеиновых кислот в реальном времени; и 4) одновременно амплификацию соответствующих целевых нуклеиновых кислот, загруженных на блок термоциклирования 210 амплификатора нуклеиновых кислот в реальном времени, при тех же условиях и осуществление качественного анализа или количественного анализа соответствующих целевых нуклеиновых кислот для множества биологических образцов, и тем самым получение результатов амплификации.
На стадии 1) внутренний положительный контроль (ВПК) можно добавить в биологический образец с последующим отделением нуклеиновой кислоты в приспособлении для автоматизированной очистки и распределения 100 и можно определить эффективность определения целевой нуклеиновой кислоты посредством определения успешности отделения целевой нуклеиновой кислоты в приспособлении для автоматизированной очистки и распределения 100 по результатам амплификации, а также эффективность амплификации.
Реакционную пробирку с реакционной смесью для амплификации нуклеиновых кислот можно подготовить посредством внесения раствора отделенной и очищенной нуклеиновой кислоты в реакционную пробирку, которая содержит компоненты, необходимые для амплификации нуклеиновой кислоты, в сухом виде и смешивания раствора с компонентами.
Внутренний положительный контроль может представлять собой частицу вируса табачной мозаики, когда целевой нуклеиновой кислотой является РНК.
Внутренний положительный контроль может представлять собой плазмидную ДНК или продукт ПЦР, когда целевой нуклеиновой кислотой является ДНК.
ПОЛЕЗНЫЕ ЭФФЕКТЫ
Как изложено выше, устройство для интегрального анализа нуклеиновых кислот в реальном времени может автоматически осуществлять отделение и очистку нуклеиновых кислот от биологических образцов различных типов, используя по меньшей мере два приспособления для автоматизированной очистки и распределения, и может одновременно анализировать различные образцы за один раз в амплификаторе нуклеиновых кислот в реальном времени, и может снижать временные и финансовые затраты на исследование, используя контроллер, который управляет приспособлениями для автоматизированной очистки и распределения и амплификатором нуклеиновых кислот в реальном времени.
Кроме того, в соответствии со способом определения целевой нуклеиновой кислоты с использованием устройства для интегрального анализа нуклеиновых кислот в реальном времени, можно подтвердить, отделены ли нуклеиновые кислоты для соответствующих биологических образцов или нет, и имели ли место проблемы во время процедуры амплификации нуклеиновой кислоты в амплификаторе нуклеиновых кислот в реальном времени, посредством добавления внутренних положительных контролей по настоящему изобретению вместе с биологическими образцами в приспособление для автоматизированной очистки и распределения во время отделения и очистки нуклеиновой кислоты.
Кроме того, множество лунок многолуночного блока термоциклирования можно назначить в соответствии с типами целевых нуклеиновых кислот соответственно целевым нуклеиновым кислотам различных типов, отделенным и очищенным в соответствующих приспособлениях для автоматизированной очистки и распределения, и, таким образом, можно параллельно осуществлять исследования различных мишеней, необходимые для различных образцов, за одну стадию. Следовательно, настоящее изобретение можно эффективно использовать в больницах или т.п., где необходимо быстро диагностировать заболевания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные выше и другие цели, признаки и преимущества настоящего изобретения видны из следующего описания предпочтительных вариантов осуществления, данного в сочетании с сопроводительными чертежами, на которых:
На фиг. 1 представлено схематическое изображение устройства для интегрального анализа нуклеиновых кислот в реальном времени по настоящему изобретению.
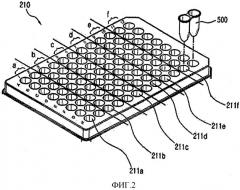
На фиг. 2 представлен вид многолуночного блока термоциклирования 210, предоставленного в амплификаторе нуклеиновых кислот в реальном времени 200 по настоящему изобретению.
На фиг. 3 представлен вид блока отображения 300 по настоящему изобретению.
На фиг. 4 представлена полная схема устройства для интегрального анализа нуклеиновых кислот в реальном времени по настоящему изобретению.
На фиг. 5 представлена загружающая образцы в лунки часть картриджа в приспособлении для автоматизированной очистки и распределения по настоящему изобретению.
На фиг. 6 представлен график полимеразных цепных реакций в реальном времени (ПЦР) со стандартными матрицами вируса табачной мозаики (TMV) в отношении частиц вируса табачной мозаики (ВПК) по настоящему изобретению.
На фиг. 7 представлена калибровочная кривая (наклон: -0,283, R2: 1) для графика ПЦР в реальном времени стандартных матриц вируса табачной мозаики (TMV) на основе частиц вируса табачной мозаики (ВПК) по настоящему изобретению.
На фиг. 8 представлен график ПЦР в реальном времени ДНК стандартной матрицы HBV в амплификаторе нуклеиновых кислот в реальном времени с использованием наборов для количественной ПЦР HBV по настоящему изобретению.
На фиг. 9 представлена калибровочная кривая (наклон: -0,2882, R2: 0,9997) для графика ПЦР в реальном времени ДНК стандартной матрицы HBV в амплификаторе нуклеиновых кислот в реальном времени с использованием наборов для количественной ПЦР HBV по настоящему изобретению.
На фиг. 10 представлен график ПЦР в реальном времени стандартной матрицы РНК HCV в амплификаторе нуклеиновых кислот в реальном времени с использованием наборов для количественной ОТ-ПЦР HCV по настоящему изобретению.
На фиг. 11 представлена калибровочная кривая (наклон: -0,2970, R2: 0,9998) для графика ПЦР в реальном времени стандартной матрицы РНК HCV в амплификаторе нуклеиновых кислот в реальном времени с использованием наборов для количественной ОТ-ПЦР HCV по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ОСНОВНЫХ ЭЛЕМЕНТОВ
100: приспособление для автоматизированной очистки и распределения
200: амплификатор нуклеиновых кислот в реальном времени
300: блок отображения
400: блок хранения базы данных
ЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ
В настоящем документе подробно описано устройство для интегрального анализа нуклеиновых кислот в реальном времени со ссылкой на сопроводительные чертежи. Следующие чертежи предоставлены в качестве примера с тем, чтобы в достаточном объеме передать идею настоящего изобретения специалистам в той области, к которой относится настоящее изобретение, и могут быть выполнены не в масштабе.
Если не указано иначе, следует понимать, что все термины, используемые в описании, включая технические и научные термины, имеют такое же значение, в котором их понимают профессионалы в данной области, и, кроме того, в приведенных ниже описании и сопроводительных чертежах хорошо известные функции или конструкции не описаны подробно, поскольку это может излишне затруднить понимание настоящего изобретения.
ПРИМЕР 1
Пример 1 направлен на устройство для интегрального анализа нуклеиновых кислот в реальном времени по настоящему изобретению. На фиг. 1 схематически изображено устройство для интегрального анализа нуклеиновых кислот в реальном времени по настоящему изобретению, и далее в настоящем документе настоящее изобретение описано более подробно.
Устройство для интегрального анализа нуклеиновых кислот в реальном времени содержит множество приспособлений для автоматизированной очистки и распределения 100 для отделения и очистки различных нуклеиновых кислот от биологических образцов различных типов, содержащих нуклеиновые кислоты. Биологический образец обозначает биологический материал, который выделен из природной окружающей среды и содержит нуклеиновую кислоту. Биологический образец по настоящему изобретению может представлять собой раствор нуклеиновой кислоты, микроорганизм, ткань, биологическую жидкость или клетки, которые очищены или отделены. Примеры биологической жидкости могут включать кровь, плазму, мокроту, мочу, церебральную спинномозговую жидкость, жидкость лаважа желудка, лейкофорез, различные образцы, полученные из организма человека и т.п., но не ограничен этим. Образец по настоящему изобретению может представлять собой образец, полученный из любого растения, животного, организма человека, бактерии или вируса, содержащий нуклеиновые кислоты. Примеры нуклеиновой кислоты в настоящем изобретении, как правило, могут включать ДНК, РНК, ПНК, гибрид ДНК и РНК или содержащее их вещество, но не ограничены этим. Устройство по настоящему изобретению можно использовать при разделении и определении вещества, такого как белок.
Как показано на фиг. 1, можно установить несколько приспособлений для автоматизированной очистки и распределения 100 по настоящему изобретению, предпочтительно, от 2 до 6, для того, чтобы отделять нуклеиновые кислоты от образцов одного типа, многих типов или нескольких типов. Приспособление для автоматизированной очистки и распределения 100 по настоящему изобретению отличается тем, что магнитную частицу обратимо связывают с нуклеиновой кислотой для отделения нуклеиновой кислоты для того, чтобы отделить нуклеиновые кислоты от большого числа растворов биологических образцов.
Приспособление для автоматизированной очистки и распределения 100 автоматически очищает и распределяет нуклеиновые кислоты и содержит картридж, содержащий различные биологические образцы, содержащие нуклеиновые кислоты и буферы, которые используют для выделения нуклеиновых кислот из них, охлаждающий блок, высокотемпературный блок, емкость для жидких отходов, картридж пипетки и блок пипетки. Блок пипетки можно двигать по подложке, на которой предоставлены упомянутые выше блоки и картриджи, что делает возможным присоединение и разъединение пипеток, и содержит блок приложения магнитного поля для приложения магнитного поля к пипеткам или его выключения. Блок пипетки может позволять присоединение и разъединение от 8 до 16 пипеток.
Магнитные частицы, используемые при отделении нуклеиновых кислот от большого числа растворов биологических образцов, связывают нуклеиновые кислоты в буфере. Если магнитное поле применяют к пипетке, когда нуклеиновые кислоты, связанные с магнитными частицами, всосаны в пипетку, то магнитные частицы, связанные с нуклеиновыми кислотами, образуют скопления в пипетке и прилипают к внутренней части пипетки, а другие вещества выбрасывают из пипетки.
В качестве магнитных частиц по настоящему изобретению предпочтительно используют мелкие магнитные частицы, обладающие большой площадью поверхности.
В настоящем изобретении можно использовать постоянный магнит или электромагнит в качестве блока приложения магнитного поля для приложения магнитного поля к пипетке, а магнитное поле можно применять к пипетке обратимо. Раствор можно выбрасывать посредством поршня, соединенного с пипеткой во время работы пипетки, а перемещать пипетку можно посредством блока перемещения пипетки.
В качестве приспособления для автоматизированной очистки и распределения 100 по настоящему изобретению можно использовать общеизвестное устройство автоматизированной очистки и распределения, и можно использовать, например, устройство, описанное в корейском патенте с регистрационным № 148239, US5702590, US5647994, EP 0691541, US 5336760, US5897783, US6187270, и корейской патентной заявке № 10-2008-0032904. Также предпочтительно можно использовать полностью автоматизированную систему очистки ДНК/РНК/белков ExiPrep™ 16 компании Bioneer Company в качестве приспособления для автоматизированной очистки и распределения 100 по настоящему изобретению.
Нуклеиновую кислоту, отделенную и очищенную приспособлением для автоматизированной очистки и распределения 100, распределяют в диагностический набор, состоящий из стандартизованной реакционной пробирки, ранее загруженной в него. Диагностический набор, состоящий из 8-луночной полоски пробирок, в которых нуклеиновую кислоту распределяют в приспособлении для автоматизированной очистки и распределения 100, вынимают и запечатывают прозрачной пленкой и затем загружают в колонку, назначенную в амплификаторе нуклеиновых кислот в реальном времени. Запускают амплификатор нуклеиновых кислот в реальном времени и, таким образом, автоматически получают результаты.
Блок распознавания штрих-кодов (не показан) можно добавить ко множеству приспособлений для автоматизированной очистки и распределения 100 для отделения и очистки нуклеиновых кислот от биологических образцов, содержащих нуклеиновые кислоты. Информацию о биологическом образце, которую узнают посредством блока распознавания штрих-кодов, можно хранить в виде базы данных в контроллере, который представляет собой программное обеспечение управления системой в устройстве для интегрального анализа нуклеиновых кислот в реальном времени, и эту информацию также можно автоматически применить в амплификаторе нуклеиновых кислот в реальном времени 200. Штрих-код предоставляет информацию, необходимую для того, чтобы различать образцы между собой, такую как пол, возраст, тип биологического образца и т.п.
Настоящее изобретение относится к амплификатору нуклеиновых кислот в реальном времени 200 для амплификации целевых нуклеиновых кислот различных типов, полученных из множества приспособлений для автоматизированной очистки и распределения 100 в реальном времени.
Амплификатор нуклеиновых кислот в реальном времени 200 по настоящему изобретению содержит многолуночный блок термоциклирования 210, в который загружают диагностические наборы, соответствующие отделенным и очищенным нуклеиновым кислотам из приспособлений для автоматизированной очистки и распределения 100, и температуру которого меняют в соответствии с предварительно определяемыми значениями температуры, источник света для облучения светом реакционных пробирок, загруженных в блок термоциклирования, и датчик определения флуоресцентного света для получения света, образованного обнаружимыми метками внутри реакционных пробирок. Датчик определения флуоресцентного света допускает результаты качественных и количественных анализов в реальном времени в отношении целевых нуклеиновых кислот.
В качестве амплификатора нуклеиновых кислот в реальном времени 200 по настоящему изобретению, который представляет собой устройство, которое допускает ПЦР в реальном времени, можно использовать известное устройство для полимеразной цепной реакции (ПЦР) нуклеиновой кислоты в реальном времени, и предпочтительно устройство, описанное в корейском патенте № 794703, устройство, описанное в PCT/KR2008/064558, или можно выбрать и использовать блок количественного термоциклирования в реальном времени Exicycler™ 96, продукт компании Bioneer Company.
Амплификатор нуклеиновых кислот в реальном времени 200 содержит многолуночный блок термоциклирования 210. Многолуночный блок термоциклирования 210 состоит из 96 лунок 12 колонок × 8 рядов. Соответствующие лунки разделяют посредством стандартизованной колонки и тем самым назначают посредством стандартизованной колонки. Таким образом, количество амплификации соответствующих нуклеиновых кислот и информацию о мишени в соответствии с целевыми нуклеиновыми кислотами различных типов можно отображать посредством стандартизованной колонки через блок отображения 300 в реальном времени. В настоящем примере элементы определения целевых нуклеиновых кислот задают посредством стандартизованной колонки лунок, но без ограничения этим, но их можно задавать посредством стандартизованного ряда или стандартизованной лунки.
В настоящем изобретении устройство для интегрального анализа нуклеиновых кислот в реальном времени может дополнительно содержать блок хранения базы данных 400, хранящий результаты анализов.
Амплификатор нуклеиновых кислот в реальном времени 200 по настоящему изобретению хранит информацию о типах целевых нуклеиновых кислот, отделенных и очищенных посредством приспособлений для автоматизированной очистки и распределения 100, и о биологических образцах. Также амплификатор нуклеиновых кислот в реальном времени 200 назначает множество лунок на многолуночном блоке термоциклирования 210 посредством стандартизованной колонки в соответствии с типами соответствующих целевых нуклеиновых кислот, отделенными соответствующими приспособлениями для автоматизированной очистки и распределения 100. Одну или несколько колонок предпочтительно назначают на многолуночном блоке термоциклирования. Нуклеиновые кислоты, отделенные от биологического образца и образцов стандартов, помещают в соответствующие лунки в каждую из назначенных областей, которые задают так, чтобы иметь одинаковую определяемую мишень, и связанную информацию хранят для каждой лунки.
В настоящем изобретении «лунка 211a» обозначает каждую лунку многолуночного блока термоциклирования 210, на которую можно загрузить реакционную пробирку диагностического набора. Соответствующие определяемые мишени задают посредством стандартизованной колонки на многолуночном блоке термоциклирования амплификатора нуклеиновых кислот в соответствии с типами диагностических наборов.
Настоящее изобретение относится к управляющему программному обеспечению устройства для интегрального анализа нуклеиновых кислот в реальном времени, которое управляет приспособлениями для автоматизированной очистки и распределения 100, управляет амплификатором нуклеиновых кислот в реальном времени 200, передает информацию из устройства автоматизированной очистки и разделения в амплификатор нуклеиновых кислот в реальном времени, и хранит и управляет информацией амплификатора нуклеиновых кислот в реальном времени.
Диагностический набор, используемый в настоящем изобретении, содержит обнаружимую метку и состоит из реакционных пробирок 500, которые в одинаковых количествах содержат праймеры для амплификации конкретных целевых нуклеиновых кислот и буфер.
В настоящем изобретении, «реакционная пробирка 500» содержит контейнер для размещения образца в нем. Можно подготавливать от 1 до 96, предпочтительно 8, 12, 16 или 96 реакционных пробирок. Реакционная пробирка может представлять собой углубление или пробирку, сформированную в пластмассе или схожем веществе, и может представлять собой пробирку, образующую регулярную структуру, например, 96-луночный реакционный планшет или 384-луночный реакционный планшет с прямоугольной решеткой или 8-луночную полоску.
Реакционная пробирка 500 для диагностического набора содержит праймер для амплификации целевой нуклеиновой кислоты, обнаружимую метку и буфер, и в нее добавляют отделенную нуклеиновую кислоту. Их общий объем предпочтительно составляет от 10 до 50 мкл, но без ограничения этим. Различные праймеры и зонды в нескольких диагностических наборах амплифицируют при одинаковой температуре отжига (T1). Каждая стандартизованная реакционная пробирка диагностического набора содержит праймер и зонд, предназначенные для амплификации различных целевых нуклеиновых кислот.
В настоящем изобретении диагностический набор получают посредством высушивания композиции, в которой смешивают конкретный праймер для амплификации конкретной части нуклеиновой кислоты, зонд, содержащий прикрепленную к нему флуоресцентную группу, ДНК полимеразу, и dNTP. В него можно добавить стабилизатор. Высушивание можно осуществлять посредством лиофилизации, термической сушки, вакуумной сушки при пониженном давлении или т.п. Следовательно, поскольку композиция диагностического набора присутствует в высушенном виде, в нее добавляют предварительно определенное количество раствора отделенной и очищенной нуклеиновой кислоты, не регулируя количество композиции, и тем самым непосредственно получают реакционную смесь для амплификации нуклеиновой кислоты.
В праймерах для определения целевых нуклеиновых кислот, которые используют в соответствующих диагностических наборах в настоящем изобретении, используют последовательности оснований, разработанные так, чтобы иметь одинаковую температуру плавления (Tm, °C) для диагностического исследования соответствующих целевых нуклеиновых кислот. Температуру плавления (Tm, °C) разрабатывают на основе части последовательности оснований целевой нуклеиновой кислоты, и важным является установить одинаковые температурные условия реакции для того, чтобы одновременно и избирательно амплифицировать различные целевые нуклеиновые кислоты на основе температуры отжига. По настоящему изобретению, несколько целевых нуклеиновых кислот можно одновременно определять в образцах от одного человека или в образцах от нескольких людей. Например, исследования для диагностики СПИД, гепатита B, гепатита C и венерических заболеваний можно осуществлять на одном амплификаторе нуклеиновых кислот в реальном времени при одинаковых условиях амплификации за один раз.
На фиг. 2 представлен многолуночный блок термоциклирования 210, который имеет множество лунок, в которые загружают множество реакционных пробирок 500 для диагностических наборов, соответственно. В настоящем изобретении, реакционную пробирку 500 можно выполнить в виде полоски из 8 пробирок, полоски из 16 пробирок или 96-луночного планшета.
Как показано на фиг. 2, реакционные пробирки, в которые вносят нуклеиновые кислот