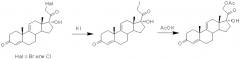
Способ получения 11бета, 17альфа, 21-тригидрокси-16альфа-метил-9альфа-фторпрегна-1,4-диен-3,20-диона (дексаметазона) из фитостерина
Иллюстрации
Показать всеИзобретение относится к способу получения дексаметазона из фитостеринов (β-ситостерина, кампестерина, стигмастерина, брассикастерина) способом, включающим последовательность микробиологических и химических реакций, а именно: микробиологическое окислительное элиминирование боковой цепи фитостерина с образованием 9α-гидроксиандрост-4-ен-3,17-диона культурой Mycobacterium sp. ВКМ Ac-1817Д; обработку 9α-гидроксиандрост-4-ен-3,17-диона минеральной кислотой в среде апротонного органического растворителя с образованием 9(11)-двойной связи; 17-гидроцианирование андроста-4,9(11)-диен-3,17-диона; защиту 3-кетогруппы 17α-гидрокси-17β-цианандроста-4,9(11)-диен-3-она образованием циклического кеталя, защиту 17α-гидроксигруппы образованием 1-алкоксиэтилового эфира, алкилирование 17-CN-группы с последующим удалением защитных группировок, С21-ацетоксилирование полученного 17α-гидрокси-20-кетопрегнана с применением метода прямого С21-иодирования; этерификацию 17α-гидроксигруппы 21-ацетокси-17α-гидроксипрегна-4,9(11)-диен-3,20-диона и элиминирование17α-ацетоксигруппы; микробиологическое 1,2-дегидрирование 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона культурой Nocardioides simplex ВКМ Ас-2033Д с образованием 21-ацетоксипрегна-1,4,9(11),16-тетраен-3,20-диона; реакцию каталитического 1,4-присоединения реактива Гриньяра по Δ16-20-кетосистеме с образованием магнийгалоидпроизводного 21-ацетокси-20-гидрокси-16α-метилпрегна-1,4,9(11),17(20)-тетраен-3-она; введение 17α-гидропероксигруппы аутоокислением последнего; восстановление 17α-гидропероксигруппы в 17α-гидроксильную; 9,11-бромгидроксилирование 21-ацетокси-17α-гидрокси-16α-метилпрегна-1,4,9(11)-триен-3,20-диона и последующее 9β(11)-эпоксидирование с одновременным гидролизом ацетоксигруппы при С21; раскрытие 9β(11)-эпокисного кольца 17α,21-дигидрокси-16α-метил-9β(11)-эпоксипрегна-1,4-диен-3,20-диона действием фтористоводородной кислоты. Способ позволяет получить дексаметазон с выходом 23%. 23 з.п. ф-лы, 3 табл., 16 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области биотехнологии, конкретно касается получения стероидного соединения 11β,17α,21-тригидрокси-16α-метил-9α-фторпрегна-1,4-диен-3,20-диона (дексаметазона) из фитостерина и может быть использовано для производства субстанции дексаметазона и его производных.
УРОВЕНЬ ТЕХНИКИ
11β,17α,21-Тригидрокси-16α-метил-9α-фторпрегна-1,4-диен-3,20-дион (дексаметазон, 9α-фтор-16α-метилпреднизолон, CAS 50-02-2) является глюкокортикостероидным препаратом, обладающим сильным противовоспалительным и антиаллергическим действием [М.Д. Машковский. Лекарственные средства. В двух томах. Изд.13-е. Харьков: Торсинг, 1997 г., Т.2. с.35]. Кроме того, дексаметазон может быть использован в качестве исходного субстрата в синтезе его производных, например динатриевой соли 21-фосфата дексаметазона (динатрийфосфат дексаметазона, CAS 2392-39-4), применяемой для внутривенного и внутримышечного введения, а также в офтальмологии для лечения аллергических конъюнктивитов, кератитов, уменьшения воспалительных проявлений после глазных операций и травм.
К настоящему времени в литературных источниках нет опубликованных данных о схеме синтеза дексаметазона из фитостерина как таковой. Однако имеются сообщения о синтезе его различных интермедиатов. Поиск и изучение различных подходов в синтезе дексаметазона ведется ведущими фармацевтическими компаниями мира на протяжении последних 50 лет и обусловлен вариабельностью источников стероидного сырья и поиском возможных интермедиатов синтеза, общих для дексаметазона и ряда других стероидных препаратов.
Наиболее перспективным источником стероидного сырья являются стерины. Стерины являются структурными предшественниками в производстве стероидных гормональных препаратов (гестагенов, андрогенов, эстрогенов, кортикоидов и др.). Фитостерин - стерин растительного происхождения - может быть получен из отходов переработки древесины или соевых бобов. Слово «фитостерин» обозначает стерины растительного происхождения (β-ситостерин, кампестерин, стигмастерин и др.) или их смеси. В последние годы в мире разработаны эффективные методы окислительной деградации боковой цепи стеринов с образованием андрост-4-ен-3,17-диона (АД), которая может сопровождаться одновременной или последовательной его функционализацией с образованием 1,2-дегидро- или 9α-гидрокси-производных АД.
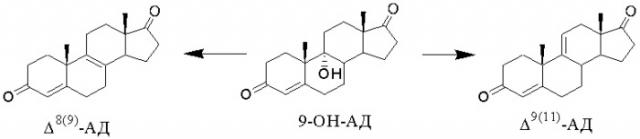
9α-Гидроксиандрост-4-ен-3,17-дион (9-ОН-АД) является идеальным интермедиатом в синтезе кортикостероидов из стеринов (например, таких, как гидрокортизон, преднизолон, дексаметазон, триамцинолон, 6α-метилпреднизолон и др.). Это особенно важно, так как позволяет исключить из технологического процесса стадию микробиологического 11-гидроксилирования.
Синтез дексаметазона из фитостерина через 9-ОН-АД представляет собой многостадийную последовательность превращений, включающую следующие этапы функционализации:
- дегидратация 9α-гидроксигруппы с образованием ∆9(11)-связи;
- введение 17α-гидрокси-17β-прегнановой цепи;
- введение гидроксильной группы в 21-положение 17α-гидрокси-С20-кетопрегнана с образованием кортикостероидной (диоксиацетоновой) цепи;
- дегидратация 17α-гидроксигруппы с образованием ∆16-3,20-дикетопрегнана;
- введение 1,2-двойной связи (химическим или микробиологическим способом);
- введение 16α-метил-17α-гидрокси- фрагмента по ∆16 связи;
- введение 9α-фтор-11β-гидрокси- фрагмента по ∆9(11)-связи.
Как следует из литературных данных, эти этапы могут быть проведены в любом порядке. Выбор очередности этапов и методов синтеза является сложной задачей, решение которой определяет успех в создании экономически эффективной технологии производства.
Методы окислительной деградации боковой цепи фитостерина с образованием Δ4-3,17-дикетоандростанов, в том числе с образованием 9-ОН-АД, известны. 9-ОН-АД получают из фитостерина микробиологической трансформацией методами и культурами микроорганизмов, описанными в литературных источниках [Прикл. биохим. микробиол., 2011, 47(3), 297-301; Biochim. Biophs. Acta, 1978, 539, 308; US4035236, 1977; US4175006, 1979; US4397946, 1983; DD298278, 1992; DD298279, 1992; RU2077590, 1997; Appl. Microbiol. Biotechnol., 2005, 67(5), 671-678; J. Chem. Technol. Biotechnol., 2005, 80, 55-60 и др.].
Дегидратация 9α-гидроксигруппы с образованием ∆9(11)-связи
В синтезе кортикостероидной цепи на основе 17-кетогруппы 9-ОН-АД дегидратацию 9α-гидроксигруппы обычно проводят на первом этапе, так как образующийся андроста-4,9(11)-диен-3,17-дион (Δ9(11)-АД) более стабилен в дальнейшем синтезе (например, в синтезе ацетата гидрокортизона из стерина [Tetrahedron Lett., 1990, 31(26), 3669-3672]). Это позволяет избежать на следующих стадиях синтеза возможных нежелательных реакций с участием третичной гидроксильной группы при С9. Кроме того, наличие 9,11-двойной связи - необходимое условие для дальнейшего введения галоида в положение 9α в синтезе 9-галоидированных кортикостероидов, в том числе и дексаметазона. Также целесообразно проводить дегидратацию в отсутствие гидроксильных групп в других положениях. Таким образом, Δ9(11)-АД является ключевым соединением в синтезе кортикостероидов из природных стеринов (холестерина или фитостерина).
Способы получения Δ9(11)-АД дегидратацией 9-ОН-АД известны. Особенностью дегидратации 9-ОН-АД является возможность образования нежелательного изомера андроста-4,8(9)-диен-3,17-диона (Δ8(9)-АД).
При этом изомерные ∆9(11)- и ∆8(9)- олефины имеют одинаковое значение Rf на ТСХ и не могут быть разделены кристаллизацией. Определение примеси ∆8(9)-изомера может быть проведено, например, спектроскопически (1Н ЯМР, 13С ЯМР) [EP0253415, 1988; EP0294911, 1988] или хроматографически (ВЭЖХ [EP0253415, 1988; EP0294911, 1988] , ГЖХ [US4102907, 1978]).
В качестве дегидратирующего агента используют минеральные и органические кислоты, ангидриды и хлорангидриды минеральных и органических кислот, а также другие реагенты.
Реакция дегидратации 9-ОН-АД с образованием ∆9(11)-АД может быть проведена или в среде дегидратирующего агента без использования растворителя, или в среде органического растворителя.
Сочетанием существенных признаков по заявляемому изобретению в части проведения дегидратации 9α-гидроксигруппы с образованием ∆9(11)-связи является проведение реакции дегидратации 9-ОН-АД с образованием ∆9(11)-АД в среде инертного апротонного органического растворителя, конкретно, в среде ароматического углеводорода (например, бензола, толуола) или хлорсодержащего углеводорода (например, дихлорметана, дихлорэтана, хлороформа), с применением в качестве дегидратирующего агента минеральной кислоты, в том числе содержащей воду, конкретно, ортофосфорной, серной или хлорной кислоты.
Известны способы проведения дегидратации 9-ОН-АД с образованием ∆9(11)-АД в среде органического растворителя. Известно, что в качестве среды могут быть использованы хлорсодержащие углеводороды, ароматические углеводороды, циклические эфиры, органические основания. Однако при этом в качестве дегидратирующего агента использованы N,N1-тионил-диимидазол, образующийся из тионилхлорида и имидазола (в среде тетрагидрофурана) [Journal für Praktische Chemie, 1988, 330(2), 309-312]; или п-толуолсульфокислота (п-ТСК, в среде бензола) [Chem.and Ind., 1961, 1530]; или адсорбат ароматической сульфокислоты на силикагеле (в среде ароматического углеводорода) [EP0253415, 1988]; или кислоты Льюиса - хлорид железа, трифторид бора или их комплексы, пентахлорид сурьмы, тетрахлорид титана - и смеси этих соединений с силикагелем (в среде инертного органического растворителя) [EP0294911, 1988]; или хлорсульфоновая кислота (в среде хлористого метилена) [US4127596, 1978, примеры 1-8].
Одним из существенных признаков по настоящему изобретению является использование в качестве дегидратирующего агента минеральной кислоты, в том числе содержащей воду, более конкретно, ортофосфорной, серной или хлорной кислоты.
Известен способ получения ∆9(11)-стероидов ряда андростана, в том числе и ∆9(11)-АД, реакцией 9α-гидроксистероида (в частности, 9-ОН-АД) с неароматической кислородсодержащей кислотой с pKa ≤1,0 [US4127596, 1978]. При этом кислота выбрана из группы: хлорсульфоновая, серная, фосфорная, метансульфоновая, перхлорная и трифторуксусная. Реакцию проводят в среде кислородсодержащей кислоты.
Также известен способ получения ∆9(11)-АД из 9-ОН-АД дегидратацией с полифосфорной кислотой [HUT36138, 1985].
Общим недостатком методов дегидратации в среде дегидратирующего агента, особенно в присутствии воды, является использование большого избытка дегидратирующего агента, большая продолжительность реакции, а также в большинстве случаев необходимость применения колоночной хроматографии для очистки продукта и, как следствие, или низкий выход, или неудовлетворительное качество.
Таким образом, анализ методов дегидратации 9-ОН-АД, известных из доступных литературных источников, показывает, что при проведении реакции в среде органического растворителя, в частности в среде ароматического углеводорода или хлорсодержащего углеводорода, использование минеральных кислот, в том числе содержащих воду, неизвестно. Описано проведение реакции органическими кислотами или их производными, ангидридами или хлорангидридами минеральных кислот, при этом наличие безводной среды является условием проведения реакции, обеспечивающим положительный результат. Как следует из уровня техники, использование минеральных кислот, в том числе содержащих воду, для получения ∆9(11)-АД возможно и известно в процессах дегидратации 9-ОН-АД без применения органического растворителя, однако эти методы имеют существенные недостатки и полученные результаты нельзя считать удовлетворительными.
Таким образом, в доступных литературных источниках отсутствует информация о проведении реакции дегидратации 9-ОН-АД с образованием ∆9(11)-АД с использованием в качестве дегидратирующего агента минеральных кислот, в том числе содержащих воду, в среде апротонного органического растворителя.
Кроме того, в доступных литературных источниках отсутствует информация об интенсификации процесса дегидратации удалением избыточной воды в течение реакции дегидратации, например, методом азеотропной отгонки.
Кроме того, в доступных литературных источниках отсутствует информация о возможности получения ∆9(11)-АД из фитостерина через образование 9-ОН-АД без выделения последнего из экстракта культуральной жидкости, полученной в результате микробиологической трансформации.
Введение 17α-гидрокси-17β-прегнановой цепи
Гидроцианирование
Одним из хорошо известных методов синтеза 17α-гидрокси-17β-ацетилстероидов является циангидринный метод, который заключается во взаимодействии 17-кетостероидов с цианистым водородом и последующем алкилировании полученного 17α-гидрокси-17β-нитрила. Химические синтезы прегнанов из 17-кетоандростанов с применением циангидринного синтеза известны и описаны в литературе [Pharmaceutical Chemistry Journal, 1987, 21, (4), 225-300]. Донором цианид-аниона могут служить как соли цианистоводородной кислоты [DD281394, 1990], так и ацетонциангидрин [J. Am. Chem. Soc., 1953, 75 (3), 650-653; RU2156255, 2000], а также их смеси [US4500461, 1985; US3043833, 1962; US4548748, 1985] и другие циансодержащие органические соединения, например, диэтилалюминия цианид [US3496169, 1970]. Реакцию с циансодержащими соединениями проводят в щелочной среде, в качестве щелочного агента, кроме гидроксидов щелочных металлов, может быть использован триэтиламин [GB1109626, 1968].
Циангидринный вариант построения боковой цепи кортикостероидов из АД, 9α-ОН-АД и других 17-кетостероидов имеет ряд преимуществ: избирательность реакции гидроцианирования по 17-кетогруппе [Organic Reactions, 1977, 25, р.255]. Однако гидроцианирование 17-кетостероидов протекает с образованием равновесной смеси эпимерных 17β- и 17α-карбонитрилов. В зависимости от условий проведения процесса гидроцианирования в смеси может преобладать тот или иной изомер.
Следует отметить, что наибольшее развитие и применение этот метод получил в синтезе 17-циангидринов АД. Известен способ введения прегнановой боковой цепи в АД с применением ацетонциангидрина в качестве цианирующего агента [DD147669, 1979, пример 2].
Использование одного ацетонциангидрина как агента для гидроцианирования ∆9(11)-АД, хотя и заявлено в патентах [RU2156255, 2000; US4500461, 1985], однако не подтверждено примерами. Циангидринный способ построения прегнановой цепи на основе АД описан японскими авторами [Bull. Chem. Soc. Jpn., 1985, 58 (3), 978-980]. Однако гидроцианирование ∆9(11)-АД с ацетонциангидрином в описанных авторами условиях протекает с образованием исключительно нежелательного 17α-циан-17β-гидрокси-эпимера, в то время как реакция в присутствии 9-гидроксигруппы в этих же условиях дает исключительно желаемый 17β-циан-17α-гидрокси-эпимер [Bull. Chem. Soc. Jpn., 1985, 58 (3), 978-980]. 17β-Циан-17α-гидрокси-∆9(11)-эпимер может быть получен последующей изомеризацией первично образованного 17α-циан-17β-гидрокси-изомера действием, например, цианида натрия или триэтиламмоний гидроцианида в среде низшего спирта [JPS5762298, 1982; JPS5762299, 1982].
Таким образом, можно сделать вывод, что технический результат, полученный на примере АД в патентах [RU2156255, 2000 и RU2156256, 2000], не может быть очевидным при использовании ∆9(11)-АД в качестве исходного соединения в синтезе 17β-циан-17α-гидрокси-производного.
Авторам патента [DD281394, 1990] удалось получить 17β-циан-17α-гидрокси-эпимер с выходом 93%, исходя из ∆9(11)-АД, в среде водного спирта, содержащей ацетон, используя цианид натрия в качестве цианирующего агента и метод эпимеризации, сущность которого состояла в постепенном осаждении 17β-циан-эпимера изменением концентрации воды. Аналогичный метод получения циангидрина ∆9(11)-АД с применением цианида калия описан в патенте [US4548748, 1985], смеси ацетонциангидрина и цианида калия - в патенте [US4500461, 1985, пример 2].
Таким образом, о применении одного ацетонциангидрина для стереоселективного гидроцианирования ∆9(11)-АД информация нами не найдена.
Защита 3-кетогруппы
Для предотвращения возможного алкилирования 3-кетогруппы проводят ее защиту. Защита 3-кетогруппы может быть осуществлена образованием енолэфира (метилового или этилового) [J. Am. Chem. Soc., 1953, 75(3), 650-653; J. Org. Chem., 1961, 26(10), 3925-3928; US3516991, 1970; US4500461, 1985, EP263569, 1988; US4921638, 1990], циклического кеталя [US3516991, 1970; US4500461, 1985; http://www.springerlink.com/content/106464/?p=077e6ed5e8a848f38bd231d4c7dbdf27&pi=0, 1984, 20(3),302-304; JPS5762296, 1982; JPS5762298, 1982; JPS5762299, 1982; JPS5762300, 1982; Tetrahedron Letters, 1990, 31(26), 3669-3672] или енамина [US3629298, 1971]. Этиленкетальная защита нашла наибольшее применение и чаще других упоминается в литературных источниках. Так, в работах [US4500461, 1985; JPS5762296, 1982; , 1987, 21(4), 225- 300; EP263569, 1988] использована защита 3-кетогруппы образованием пятичленного 1,3-диоксолановаго цикла реакцией с этиленгликолем. Однако в синтезе 3.3-этилендиокси-17α-гидрокси-17β-цианоанодроста-5,9(11)-диена описано введение этиленкетальной защиты до стадии гидроцианирования [JPS5762296, 1982], а не после стадии гидроцианирования, как предлагается в заявляемом способе.
Способ гидроцианирования 17-кетона после защиты 3-кетогруппы ∆9(11)-АД образованием 3-метилового эфира в синтезе гидрокортизона из 9-ОН-АД описан в работе [Tetrahedron Lett., 1990, 31(26), 3669-3672].
Таким образом, описание примера защиты карбонила при атоме С3 образованием, например, этиленкеталя после получения 17α-гидрокси-17β-циан-производного из ∆9(11)-АД (циангидрина ∆9(11)-АД) в литературных источниках нами не найдено.
О применении 2,2-диметил-1,3-пропандиола (неопентилгликоля) для защиты 3-кетогруппы молекулы АД с образованием 1,3-диоксанового цикла впервые сообщено в патентах [RU2156255, 2000; RU2156256, 2000]. Однако, несмотря на то, что в общей формуле изобретения заявлена применимость этой защиты при алкилировании циангидрина ∆9(11)-АД, примеры получения и использования 1,3-диоксанового кеталя циангидрина ∆9(11)-АД отсутствуют.
Как в случае введения диоксановой, так и при образовании диоксолановой защиты применяют триалкилортоформиаты (триэтил- и триметилортофрмиат) [RU2156256, 2000] или диэтилацеталь диметилформамида. Это позволяет сдвинуть равновесие в реакции кетализации за счет химического связывания воды, образующейся в процессе реакции. В качестве катализатора используют п-ТСК или сульфосалициловую кислоту. Для кетализации 17α-гидрокси-17β-цианандрост-4-ен-3-она может быть применен классический способ кипячения с этиленгликолем в бензоле в присутствии каталитического количества п-ТСК с азеотропной отгонкой образующейся воды [Chemistry of Natural Compounds, 1984, 20(3), 302-304]. Однако он менее эффективен, чем описанный выше.
Защита 17α-гидроксигруппы
Известно, что в условиях алкилирования циангидринная группа может элиминироваться с регенерацией карбонильной группы с последующим образованием продуктов ее алкилирования. Содержание последних может достигать значительных количеств, что приводит к потере выхода и загрязнению целевого соединения. Для предотвращения этих нежелательных процессов прибегают к защите 17α-гидрокси-группы образованием эфира. В качестве этерифицирующего агента используют алкилвиниловые эфиры (этилвиниловый [US4500461. 1985; US4548748, 1985] или бутилвиниловый [JP57062296, 1982]). Также известны способы защиты образованием 17-тетрагидропиранилового эфира [J. Am. Chem. Soc., 1959, 81 (21), 5725-5727; EP263569, 1988] реакцией с 2,3-дигидропираном в условиях кислого катализа (п-ТСК или оксихлорид фосфора) или триметилсилилового эфира реакцией с триметилхлорсиланом [Tetrahedron Lett. 1971, 2005-2008]. Однако в процессе образования 17-тетрагидропиранилового эфира наблюдается частичная изомеризация 17β-циан-соединения с увеличением содержания примеси нежелательного 17α-циан-17β-тетрагидропиранилокси-изомера. Триметилсилильная же защитная группировка также нежелательна, так как является громоздкой и проявляет экранирующий эффект на последующей стадии алкилирования нитрильной группы. Это приводит к необходимости применения жестких условий алкилирования (длительное кипячение в ТГФ или применение высококипящих растворителей, например, анизола) и сопровождается побочной реакцией по 1,3-диоксолановому кольцу с образованием продукта его расщепления по С-О-связи 3ξ-метил-3ξ-(оксиэтокси)-прегнана с высоким выходом (в анизоле, например, с количественным) [Chemistry of Natural Compounds, 1984, 20(3), 302-304; J. Chem. Soc., Perkin Trans.I, 1993, (7), 783-793]. Поэтому наиболее приемлемой, по нашему мнению, является защита 17-гидроксигруппы 17β-карбонитрила образованием 17α-(1-алкокси)этилового эфира.
Введение 20-кето-прегнановой боковой цепи алкилированием карбонитрильной группы
Дальнейшее превращение 17β-циан-17α-гидрокси-соединения в 20-кетопрегнаны осуществляют взаимодействием соответствующих циангидринов с защищенными 3-кето- и 17α-гидрокси- группами с метиллитием [EP263569, 1988; Pharmaceutical Chemistry Journal, 1987, 21(4), 297-300; Bull. Chem. Soc. Jpn., 1985, 58(3), 978-980] или метилмагнийбромидом [Chemistry of Natural Compounds, 1984, 20(3), 302-304].
Наиболее близким по сущности к заявляемому способу в части построения прегнановой боковой цепи на основе 17-кетоандростанов с применением циангидринного метода, циклической защиты 3-кетогруппы и защиты 17α-гидроксильной группы образованием 17α-(1-алкокси)этилового эфира является способ, описанный в патенте [RU2156255, 2000].
Однако метод в формуле патента [RU2156255, 2000] заявлен в общем виде. Примерами подтверждено получение 17α-гидроксипрогестерона из АД. Применение в качестве исходного соединения ∆9(11)-АД не подтверждено примерами. ∆9(11)-АД не является гомологом АД. Как известно специалисту, работающему в данной области техники, и как упоминалось выше, 9,11-двойная связь является функциональной реакционн-оспособной группой, то есть дополнительным реакционным центром, поэтому технический результат, полученный на примере АД, не может быть очевидным при использовании ∆9(11)-АД в качестве исходного соединения.
Последовательность синтеза 17α-гидроксипрегна-4,9(11)-диен-3,20-диона (∆9(11)-ГПГ) из ∆9(11)-АД по настоящему изобретению в доступных источниках литературы не описана.
Введение гидроксильной группы в 21-положение 17α-гидрокси-С20-кетопрегнана с образованием кортикостероидной (диоксиацетоновой) цепи
Известно, что в синтезе кортикостероидов из 17α-гидроксипрегнанов предварительной стадией, как правило, является галоидирование 21-положения с образованием 21-галоид-17α-гидроксипрегнанового интермедиата, который далее подвергают реакции замещения на ацетоксигруппу действием ацетата щелочного металла.
Известен способ получения 21-ацетата вещества «S» из 17α-гидроксипрогестерона с предварительно защищенной 3-кетогруппой образованием N-морфолинил-производного, который заключается в том, что 20-кетопрегнан подвергают α-галоидированию по положению С21 путем введения атома брома в присутствии HCl, а затем полученную смесь 21-бром- и 21-хлор-производных обрабатывают ацетатом калия в присутствии небольшого количества иодистого натрия в среде ацетона [Хим. фарм.ж. 1990, 24(11), 55-57].
Синтез 21-ацетокси-17α-гидроксипрегна-4,9(11)-диен-3,20-диона (21-ацетокси-∆9(11)-ГПГ) также может быть осуществлен из 21-бромпроизводного ∆9(11)-ГПГ [US4041055, 1977] или 21-хлорпроизводного [US4342702,1982; US4357279, 1982] реакцией последовательного замещения атома брома или хлора сначала на атом иода реакцией с иодидом калия, а затем - на ацетоксигруппу взаимодействием 21-иод-∆9(11)-ГПГ с ацетатом калия в среде ацетона [US4041055, 1977] или смеси ацетона и дихлорметана [US4342702,1982].
Однако при переходе от ∆9(11)-ГПГ к 21-бром- или 21-хлор-производному необходима защита ∆4-3-кетосистемы, для чего используют образование метилового или этилового 3,5-диенолэфиров, пирролидинового или морфолинового енаминов, или кетальной защиты. В противном случае наблюдается образование побочного продукта α-галоидирования (например, бромирования) по атому С2 и при большем избытке брома - продукта галоидирования и в положение С6.
Последующая реакция замещения атома иода на ацетоксигруппу может быть проведена с применением как ацетата калия, так и ацетата натрия. Кроме того, может быть использован ацетат триэтиламина в среде ацетона [CN101125877, 2008] с общим выходом на стадиях иодирования и ацетоксилирования до 88% [Bull. Chem. Soc. Jpn., 1985, 58, 1081-1082].
Способ 21-ацетоксилирования прегнанов с применением метода прямого иодирования без защиты ∆4-3-кетогруппировки также хорошо известен. Впервые этот метод был предложен Хоггом и соавторами в 1955 г. [J. Am. Chem. Soc., 1955, 77(16), 4436-4438] для получения 21-ацетата кортексолона и ацетата гидрокортизона из 17-гидроксипрогестерона, согласно которому С21-метильная группа стероидной молекулы реагирует с иодом в присутствии основания и образованное 21-моно-иодпроизводное в результате обработки ацилатом щелочного металла превращается в соответствующий 21-ацилоксистероид.
Наибольшее применение метод прямого иодирования получил в производстве ацетата кортексолона из 17α-гидроксипрогестерона [J. Am. Chem. Soc., 1958, 80(1), 250; http://www.springerlink.com/content/106490/?p=97444ae762a94bcfab26466d7f1502ed&pi=0, 1990, 24(11), 839-842; http://www.springerlink.com/content/0091-150x/" \o "Link to the Journal of this Article 1969, http://www.springerlink.com/content/0091-150x/3/12/" \o "Link to the Issue of this Article), 709-712; SU151331, 1966; RU2156256, 2000]. В патенте [GB882388, 1961] описано проведение этого процесса на 6-метилзамещенном 17α-гидроксипрогестерона, в патенте [US5565588, 1996] - на 9,17α-дигидроксипрогестероне.
Наиболее близким по сущности к заявляемому способу в части последовательности построения диоксиацетоновой боковой цепи на основе 17-кетоандростанов, а именно с применением циангидринного метода, циклической защиты 3-кетогруппы, защиты 17α-гидроксильной группы образованием 17α-(1-алкокси)этилового эфира, алкилирования нитрильной группы и 21-ацетоксилирования с применением метода прямого иодирования, является способ, описанный в патенте [RU2156256, 2000].
В патенте [RU2156256, 2000] заявлено применение метода прямого иодирования в синтезе кортикостероидов с образованием 21-моно-иодпроизводного и последующего ацетоксилирования в условиях Л.Г. Гаценко и В.Н. Петрова [Хим. фарм. ж., 1972, 10, 27]. Однако метод в формуле патента [RU2156256, 2000] заявлен в общем виде. Примерами подтверждено получение 21-ацетокси-17α-гидроксипрогестерона из АД. Примеры получения 21-иод-∆9(11)-ГПГ и далее 21-ацетокси-∆9(11)-ГПГ отсутствуют.
В литературных источниках отсутствует информация о получении 21-иод-∆9(11)-ГПГ методом прямого иодирования ∆9(11)-ГПГ.
Последовательность синтеза 21-ацетокси-∆9(11)-ГПГ из ∆9(11)-АД через образование 21-иод-∆9(11)-ГПГ по настоящему изобретению в доступных источниках литературы не описана.
Дегидратация 17α-гидроксигруппы с образованием ∆16-3,20-дикетопрегнана
Для перехода от 17α-гидрокси-20-кетопрегнана к соединению с ∆16-связью, необходимой для введения 17α-гидрокси-16α-метильного фрагмента, проводят дегидратацию 17α-гидроксигруппы.
Дегидратация 17α-гидроксигруппы в соответствующий 16,17-дегидропродукт может быть проведена, например, смесью оксихлорида фосфора и пиридина.
Известен способ введения ∆16-связи в молекулу 21-ацетокси-∆9(11)-ГПГ [US3493563, 1970]. Способ состоит в обработке 17-гидроксисоединения тионилхлоридом в пиридине и предусматривает предварительную защиту 3-кетогруппы кетализацией, а 20-кетогруппы - образованием метоксииминопроизводного.
Однако постадийные выходы интермедиатов невысокие.
В 1970 г. Salse, Hazen и Schoenewaldt сообщили, что нагревание 17α-ацилокси-производных 20-оксостероидов при температуре 100-105ºС в содержащем ацетат калия диметилформамиде в течение 7 ч приводит к элиминированию ацилокси-функции с образованием 16-дегидро-20-оксостероидов [J. Org. Chem., 1970, 35, p 1681; US 3631076, 1971]. Важным условием протекания этой реакции является наличие сложноэфирной группы при атоме С21, что было установлено в результате исследования влияния природы заместителя при С21 на элиминирование 17α-ацилоксигруппы у 17α-ацилокси-20-оксостероидов, проведенного Solo и Suto в 1980 г. [J. Org. Chem., 1980, 45, 2012].
При этом выход продукта при наличии 21-ацетоксигруппы не превышал 62%. В присутствии 21-гидроксигруппы происходила ацильная миграция ацетоксигруппы из положения С17 в положение С21, а в случае 21-хлорзамещенного реакция элиминирования не шла вовсе.
Этерификацию пространственно затрудненной третичной 17α-гидроксигруппы проводят ацилированием преимущественно 21-ацетатов 20-оксопрегнанов смесью карбоновой кислоты и ангидрида карбоновой кислоты в присутствии кислотных катализаторов при температуре 18-35ºС. В качестве катализаторов могут быть использованы п-ТСК, 55-70% хлорная кислота, серная кислота и др. [SU668288, 1994; GB1375770, 1974]. Основной побочной реакцией 17-ацилирования ∆4-3-кетосоединений является енолацилирование по атому С3, которое протекает в тех же условиях кислотного катализа. С3-Ацилат может быть затем гидролизован с регенерацией ∆4-3-кетоструктуры. Однако в случае кортикоидов - соединений с диоксиацетоновой боковой цепью при С17 - при гидролизе 3-ацилата возникает новая проблема: гидролиз 21-ацетоксигруппы, ацильная миграция сложноэфирной группы из 17 положения к атому С21, и ее дальнейший гидролиз с образованием 17α,21-дигидроксисоединения.
Кроме того, реакция 17-ацетилирования может быть проведена в условиях основного катализа [US3678082, 1972] диметиламинопиридином в системе Ас2О/триэтиламин. Однако в патенте примеры использования этого метода для 17-ацетилирования кортикоидов отсутствуют.
Этерификация стерически затрудненных гидроксильных групп без затрагивания ∆4-3-кетогруппы возможна при проведении реакции в среде Ас2О в присутствии СаО при температуре кипения [JP53009755, 1978]. Кроме СаО, авторы использовали Al2O3, ZnO, а также ацетаты магния, кальция, марганца, цинка или бария. Однако получение 17α,21-диацетоксипрегна-4,9(11)-диен-3,20-диона этим способом в формуле и описании отсутствует.
В патенте [DE2055221, 1972] описано проведение ацилирования 17α-гидроксипрегнанов с высоким выходом с использованием ангидрида или ацилхлорида в смеси с безводным SnCl4 в среде нитрометана. Могут быть также использованы галоидиды или ангидриды карбоновых кислот в присутствии фосфатного катализатора (например, H3PO4 или ее моно- или диалкиловых эфиров), например Ac2O/H3PO4. Однако описание получения 17α,21-диацетоксипрегна-4,9(11)-диен-3,20-диона в этом патенте отсутствует.
Известен способ ацетилирования 17α-гидроксигруппы молекулы 21-ацетокси-∆9(11)-ГПГ [US4154748, 1979, пример 1], согласно которому образование 17α,21-ацетоксипрегна-4,9(11)-диен-3,20-диона проводят действием уксусного ангидрида в условиях катализа производными фосфорной кислоты. Отмечено, что при катализе 85% фосфорной кислотой (Ас2О/АсОН) продукт получен с выходом 97,5% и содержанием примесей исходного соединения и 3-енолацетата в следовых количествах.
Наиболее близким по сущности метода ацетилирования, использованного в настоящем изобретении, является способ [GB1097164, 1967]. Ацилирование 17α-гидроксигруппы в присутствии 21-ацетоксигруппы проводят методом смешанных ангидридов, который заключается в обработке исходного стероида смесью трифторуксусного ангидрида и кислоты, получение сложного эфира которой является целью реакции, при температуре 80ºС в течение 1 ч [GB1097164, 1967]. Однако получение 17α,21-диацетоксипрегна-4,9(11)-диен-3,20-диона этим способом в формуле и описании отсутствует. Более того, применение метода смешанных ангидридов для ацетилирования 17α-гидроксигруппы у 21-ацетокси-17α-гидроксипрегна-4,9(11)-диен-3,20-диона в доступных литературных источниках не найдено.
Известен способ [US3631076, 1971], согласно которому 17,21-диацетат может быть конвертирован в ∆16-производное реакцией с ацетатом калия при температуре 100°С в течение 7 ч в среде диметилформамида. Однако пример получения 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона в этом патенте не описан и выходы продуктов не указаны.
Более эффективный метод элиминирования 17α-ацетоксигруппы описан в патенте [SU 819119, 1981], который заключается в обработке исходного стероида ацетатом калия в среде диметилсульфоксида, и процесс проводят при температуре 80-85°С. Однако получение 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона этим способом в формуле и описании отсутствует.
Введение 1,2-двойной связи микробиологическим способом
Микробиологические способы проведения процесса 1,2-дегидрирования стероидов, включая стероиды прегнанового ряда, известны.
В качестве биокатализаторов процесса 1,2-дегидрирования используют культуры с 3-кетостероид-∆1-дегидрогеназой (3-КСД) (ЕС 1.3.99.4) родов: Arthrobacter, Alternaria, Alcaligenes, Calonectria, Ophiobolus, Corynebacterium, Bacillus, Nocardia, Streptomyces, Bacterium, Mycobacterium, Fusarium, Cylindrocarpon, Pseudomonas, Protaminobacter, Septomyxa, Didymella, Rhodococcus и др. [Charney W., Herzog H. Microbial transformation of Steroids. Academic Press. Inc. New York. 1967, p. 236-261; J. Basic. Microbiol. 1990, 30(6), 415-423; J. Biochem., 1999, 126, 662-667]. Наиболее часто для проведения процесса 1,2-дегидрирования стероидных соединений ряда прегнана и андростана используются штаммы вида Arthrobacter simplex.
Особенностью процесса 1,2-дегидрирования ацетилированных производных 21-гидрокси-∆4-3-кетостероидов микроорганизмами является сопровождение реакции 1,2-дегидрирования дезацетилированием (гидролизом сложноэфирной группы) [Steroids, 2003, 68(5), 415-421]. Это является существенным недостатком известных методов, так как появляется необходимость проведения реакции ацетилирования гидроксильной группы при С21.
Наиболее близким по сущности к предложенному способу в части введения 1,2-двойной связи является метод, описанный в патенте [US4524134, 1985, пример 4]. Авторы используют растущую культуру Arthrobacter simplex для 1,2-дегидрирования 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона с нагрузкой стероида 8 г/л в среде фосфатного буфера (рН 7,5) в присутствии менадиона, а стероидный субстрат вносят в среду для трансформации в растворе диметилформамида, концентрация которого в среде составляет 2 об.%. Однако 1,2-дегидропродукт получен лишь с выходом 18,1%, при этом содержание основного вещества составляет всего 59,1%. В продукте также содержится 40,9% нетрансформированного субстрата и значительное количество других нежелательных стероидных соединений. Авторы отмечают, что указанные недостатки связаны с использованием растущей культуры и их можно избежать, если использовать высушенные клетки в тех же условиях трансформации. Способ получения 1,2-дегидро-Δ4-3-кетостероидов, включающий обработку соответствующего 1-насыщенного Δ4-3-кетостероида высушенными клетками Arthrobacter simplex, содержащими от 1 до 10% влаги, причем клетки высушены в отсутствие какого-либо органического растворителя, описан в этом же примере [US 4524134, 1985, пример 4]. При этом 1,2-дегидро-Δ4-3-кетостероид или 21-моноэфир выбраны из группы, включающей и 21-ацетоксипрегна-1,4,9(11),16-тетраен-3,20-дион (п.2 формулы). Согласно этому способу процесс 1,2-дегидрирования 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона проводят в фосфатном буфере (рН 7,5) высушенными клетками (10 г/л) с нагрузкой стероида 8 г/л в присутствии менадиона, а стероидный субстрат вносят в среду для трансформации в растворе диметилформамида, концентрация которого в среде составляет 2 об.%. Продолжительность инкубирования 24 ч при температуре 31°С. Однако, как отмечено в примере 3, в результате биоконверсии 21-ацетилированных стероидов получают смеси, состоящие из 21-ацетокси-Δ1,4-соединений и их 21-гидрокси-аналогов. Так, выход смеси продуктов - 21-ацетоксипрегна-1,4,9(11),16-тетраен-3,20-диона (21-ацетата тетраена) и 21-гидроксипрегна-1,4,9(11),16-тетраен-3,20-диона (тетраена) - с использованием высушенных клеток составил 79,6%, содержание основного вещества, имеющего Δ1,4-структуру, 97,8%, содержание остаточного субстрата 2,1%.
Таким образом, основным недостатком указанного способа является необходимость проведения предварительного высушивания клеток до содержания влаги от 1 до 10% в отсутствие органического растворителя. Как описано в примере 2 патента [US 4524134, 1985] клетки культуры после инкубации подвергают центрифугированию, а затем высушиванию в вакууме при температуре 55°С в течение 24 ч. После чего высушенный клеточный материал помещают в герметичный контейнер и хранят при 50°С до использования в биоконверсии. Процесс высушивания клеток сложен и энергоемок. Кроме этого, несмотря на высокий выход продукта трансформации при использовании высушенных клеток (1,25 г клеток на 1 г стероидного субстрата), он содержит смесь 21-ацетата тетраена и его 21-дезацилированного аналога. Таким образом, анализ материалов, представленных в патенте, свидетельствует о том, что процесс 1,2-дегидрирования 21-ацетилированных производных ∆4-3-кето-стероидов ряда прегнана, как с применением высушенных клеток, так и растущей культурой, неселективен. 1,2-Дегидрирование сопровождается дезацетилированием. В проанализированном информационном материале отсутствуют данные о количественном выходе 1,2-дегидрированного ацетилированного целевого продукта. Не указана степень гидролиза и соотношение дегидрированного 21-ацетилированного и дегидрированного 21-дезацетилированного продуктов, что является существенными недостатками данного способа.
Наиболее близким к заявляемому способу в части введения 1,2-двойной связи по техническому результату является способ получения 1,2-дегидро-3-кетостероида, который заключается в том, что 1,2-насыщенный 3-кетостероид подвергают взаимодействию с A. simplex или Bacterium cyclooxydans в присутствии экзогенного носителя электронов и несмешивающегося с водой растворителя, включая ароматические углеводороды [GB2131811, 1984]. Согласно этому способу (пример 1) процесс трансформации 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона с нагрузкой 8 г/л проводят клетками A. simplex в присутствии 1% вес. менадиона в среде фосфатного буферного раствора (рН 7.5), содержащей 10 об.% толуола, в течение 25 ч при температуре 28±1°С. Толуольная фаза содержит 94,3% 21-ацетата тетраена, 4,2% тетраена и 1,5% исходного 21-ацетоксипрегна-4,9(11),16-триен-3,20-диона. Однако в описании отсутствует информация о результате выделения продукта и, соответственно, о его выходе и качестве.
Также известен способ превращения 1,2-насыщенных 3-кетостероидов в 1,2-дегидро-3-кетостероиды, который заключается в том, что 1,2-насыщенные 3-кетостероиды подвергают взаимодействию со средством, имеющим стероид-1,2-дегидрогеназную активность A. simplex или B. cyclooxydans, в присутствии экзогенного носителя электронов и одного или более дополнительного поглотителя токсичного кислорода, выбранного из группы, содержащей каталазу, супероксиддисмутазу или платину [US4749649, 1988]. При этом 1,2-насыщенный 3-кетостероид является 1,2-насыщенным 3-кетопрегнаном (п.9 формулы), выбранным из группы, включающей и 21-ацетоксипрегна-4,9(11),16-триен-