Применение поликарбоксильного производного фуллерена в качестве микробицидного противовирусного средства
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к применению поликарбоксильного производного фуллерена С60 в качестве микробицидного противовирусного средства для ингибирования вирусов простого герпеса (ВПГ) и цитомегаловируса (ЦМВ). Производное поликарбоксильного фуллерена С60 имеет структурную формулу
Изобретение обеспечивает средство для экстренной профилактики, предотвращающей передачу ВПГ и ЦМВ при половом контакте. 7 ил., 2 табл., 5 пр.
Реферат
Изобретение относится к медицине, а именно к этиотропной химиотерапии вирусных инфекций, и касается применения соединения на основе фуллерена С60 в качестве микробицидного средства для ингибирования герпес-вирусных инфекций (ГВИ), вызываемых вирусом простого герпеса (ВПГ) и цитомегаловирусом (ЦМВ), и может быть использовано для экстренной профилактики ВПГ- и ЦМВ-инфекций, передающихся половым путем.
Широкое распространение инфекций, вызываемых вирусом простого герпеса (ВПГ) и цитомегаловирусом (ЦМВ), передаваемых половым путем, заставляет уделять этой области инфекционной патологии человека особое внимание. Однако специфические противовирусные препараты, используемые для лечения герпес-вирусных инфекций (ГВИ), имеют ряд существенных недостатков. Одним из них является высокая токсичность [Faulds D., Heel R.C., Ganciclovir. A review of its antiviral activity, pharmacokinetic properties and therapeutic efficacy in cytomegalovirus infections. Drugs. 1990, V.39, P.597-638]. Кроме того, применение известных противовирусных препаратов характеризуется развитием лекарственной устойчивости [Erice A. Resistance of human cytomegalovirus to antiviral drugs., Clin Microbiol Rev., 1999, V.12, P.286-297; Bhorade S.M., Lurain N.S., Jordan A., Leischner J., Villanueva J., Durazo R., Creech S., Vigneswaran W.T., Garrity E.R. Emergence of ganciclovir-resistant cytomegalovirus in lung transplant recipients, J Heart Lung Transplant. 2002, V. 21, P.1274-1282].
В связи с этим разрабатывается новый подход - создание микробицидов. Микробициды с противовирусным действием являются совершенно новой категорией препаратов, которые инактивируют или уничтожают микроорганизмы непосредственно перед или при половом контакте и таким образом предотвращают распространение инфекций, передающихся половым путем, при местном применении: ректально или вагинально (экстренная профилактика). Лекарственные препараты в виде геля, крема или вагинальной (ректальной) свечи для защиты от вируса иммунодефицита человека (ВИЧ) и других инфекций, передаваемых половым путем, могут стать реальной альтернативой презервативам, и усилия ученых разных стран сосредоточены на различных аспектах этой проблемы. Существенным недостатком многих предложенных соединений являются отсутствие надежно установленной химической структуры, токсичность для клеток человека и невысокая противовирусная активность. Это указывает на необходимость поиска новых соединений, обладающих микробицидными антигерпетическими свойствами. В настоящее время перспективным считают использование водорастворимых производных фуллеренов вследствие их высокой биодоступности, которые могут найти применение в медицине.
Наиболее близкими к изобретению являются противовирусные водорастворимые аминокислотные или дипептидные производные фуллерена С60 [Миллер Г.Г., Кущ А.А., Романова B.C. Средство для ингибирования ВИЧ и ЦМВ-инфекций и способах ингибирования, патент RU 2002101294/14, 2003]. В качестве таких производных фуллерена используется С60-6-аминокапроновая кислота или ее натриевая соль (С60-АКК) либо С60-4-аминомасляная кислота или ее натриевая соль (С60-АМК). Указанные соединения наряду с фуллереновым ядром С60, обеспечивающим гидрофильно-гидрофобный баланс молекулы, содержат водорастворимые радикалы - амино- и карбоксильные группы, благодаря которым соединение приобретает способность растворяться в водных растворах. Эти соединения in vitro одновременно подавляют развитие ВИЧ и ЦМВ-инфекций в клеточных культурах. Однако наличие только одного полярного радикала у гидрофобной составляющей С60 недостаточно для преодоления сильного гидрофобного взаимодействия между молекулами, что приводит к снижению эффективности ингибирующих свойств соединений. Кроме того, указанные соединения не были испытаны в качестве микробицидных анти-ВПГ и анти-ЦМВ агентов, применяемых для экстренной профилактики.
Задача, на решение которой направлено изобретение, заключается в создании микробицидного средства на основе полизамещенного (поликарбоксильного) производного фуллерена С60 и его использовании для экстренной профилактики, предотвращающей передачу ВПГ- и ЦМВ-инфекций при половом контакте.
Кроме того, задача решается терапевтической композицией противовирусного действия, в которой содержание поликарбоксильного производного фуллерена С60 1-К составляет от 0,0001 до 99,9999 весовых процентов.
Указанный результат достигается путем использования в качестве микробицидного противовирусного средства производного фуллерена 1-К, в котором для солюбилизации фуллеренового каркаса присоединены остатки феноксимасляной кислоты. Указанное соединение было получено в соответствии с методикой, представленной в примере 1. Это соединение проявляет выраженную противовирусную активность in vitro как при ВПГ-, так и ЦМВ-инфекциях в клеточных культурах. При этом предотвращение ГВИ осуществляется по микробицидному способу, обеспечивающему экстренную профилактику.
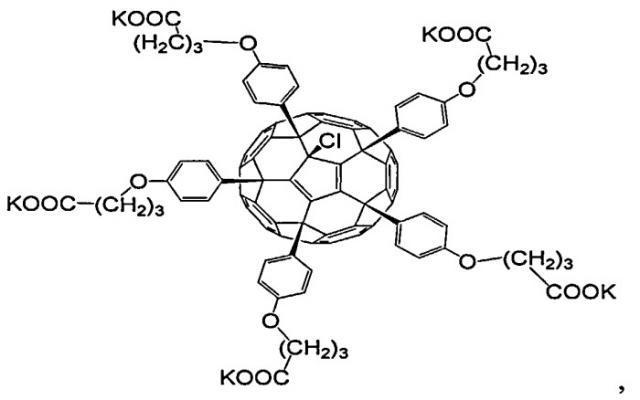
Молекулярная формула соединения 1-К приведена на фиг.1.
Соединение 1-К не обладает цитотоксичностью до 1000 мкг/мл и проявляет выраженную противовирусную активность in vitro как при ВПГ-, так и ЦМВ-инфекциях в клеточных культурах. Эффективные ингибирующие дозы (ИД50) 1-К составляют 18 мкг/мл для ВПГ и 10 мкг/мл для ЦМВ. Химиотерапевтический индекс (ХТИ) превышает 100 как для ВПГ-, так и ЦМВ-инфекций. При этом предотвращение ГВИ осуществляется по микробицидному способу, обеспечивающему экстренную профилактику.
Предлагаемое изобретение относится к применению производного фуллерена С60 1-К, обладающего высокой биодоступностью и относящегося к группе нетоксичных субстанций.
Сущность предложенного изобретения заключается в том, что у полизамещенного производного фуллерена С60 1-К обнаружена способность оказывать ингибирующее воздействие как на ВПГ, так и на ЦМВ при микробицидном способе применения для экстренной профилактики.
Оценку токсичности и изучение антивирусной активности соединения осуществляли в чувствительных клеточных культурах in vitro поэтапно. На первом этапе определяли цитотоксические свойства соединения 1-К. В качестве сравнения использовали данные о цитотоксичности референс-препаратов: ацикловира, обладающего анти-ВПГ активностью, и ганцикловира, обладающего анти-ЦМВ активностью.
На втором этапе проводили тестирование противовирусных свойств соединения 1-К в отношении ВПГ- и ЦМВ-инфекций в клеточных культурах in vitro. В качестве вируса семейства Herpesviridae используются: вирус простого герпеса 1 типа (ВПГ-1), референс штамм F, и цитомегаловирус человека (ЦМВ), референс штамм AD169. Выбор вируса простого герпеса 1 типа основывается на результатах, свидетельствующих о том, что начиная с 90-х годов причиной генитального герпеса в 70-90% случаях является ВПГ-1 [Nilsen A., Myrmel H. Changing trends in genital herpes simplex virus infection in Bergen, Norway. Acta Obstet. Gynecol. Scand. 2000; 79(8), 693-696]. Противовирусную активность соединения 1-К изучали в микробицидной схеме применения, которая заключается в том, что тестируемое вещество вносится в культуру клеток за 1 час до заражения [Bernstein D.I., Stanberry L.R., Sacks S., Ayisi N.K., Gong Y.H., Ireland J., Mumper R.J., Holan G., Matthews В., McCarthy Т., Bourne N. Evaluations of unformulated and formulated dendrimer-based microbicide candidates in mouse and guinea pig models of genital herpes. Antimicrob Agents Chemother. 2003; 47(12), 3784-3788]. Для изучения брали клетки почки зеленой мартышки (Vero), которые чувствительны к ВПГ-1, и диплоидные фибробласты человека (ФЛЭЧ), которые чувствительны к ЦМВ. Клеточные культуры получали из коллекции культур тканей ФГБУ «НИИ вирусологии им. Д.И. Ивановского» Минздравсоцразвития России.
Краткое описание фигур
Для более ясного понимания заявленного изобретения, которое отражено в формуле изобретения, а также для демонстрации его особенностей и преимуществ далее приводится подробное описание со ссылками на чертежи.
На фиг.1 представлена молекулярная формула соединения 1-К.
На фиг.2 представлен график зависимости жизнеспособности клеток Vero от концентрации соединения 1-К в течение 24 часов воздействия. На графике показано определение острой цитотоксической дозы (ОЦД50) - концентрации 1-К, при которой наблюдается гибель 50% клеток через 24 часа воздействия. ОЦД50 составила 2300 мкг/мл.
На фиг.3 представлен график зависимости жизнеспособности клеток Vero от концентрации соединения 1-К в течение 72 часов воздействия. На графике показано определение хронической цитотоксической дозы (ХЦД50) - концентрации 1-К, при которой наблюдается гибель 50% клеток через 72 часа воздействия. ХЦД50 составила 2000 мкг/мл.
В таблице 1 приведены обобщенные данные, которые характеризуют цитотоксическое действие 1-К в отношении клеток Vero. Для сравнения приведены данные о цитотоксичности референс-препарата ацикловир, применяемого в клинической практике для лечения ВПГ-инфекции. Как видно из представленных данных, цитотоксичность соединения 1-К существенно ниже, чем токсичность известного противовирусного препарата ацикловир.
На фиг.4 представлен график зависимости жизнеспособности клеток ФЛЭЧ от концентрации соединения 1-К в течение 24 часов воздействия. На графике показано определение острой цитотоксической дозы (ОЦД50) - концентрации 1-К, при которой наблюдается гибель 50% клеток через 24 часа воздействия. ОЦД50 составила 1354 мкг/мл.
На фиг.5 представлен график зависимости жизнеспособности клеток ФЛЭЧ от концентрации соединения 1-К в течение 72 часов воздействия. На графике показано определение хронической цитотоксической дозы (ХЦД50) - концентрации 1-К, при которой наблюдается гибель 50% клеток через 72 часа воздействия. ХЦД50 составила 1269 мкг/мл.
В таблице 2 приведены обобщенные данные, которые характеризуют цитотоксическое действие 1-К в отношении клеток ФЛЭЧ. Для сравнения приведены данные о цитотоксичности референс-препарата ганцикловир, применяемого в клинической практике для лечения ЦМВ-инфекции. Как видно из представленных данных, ОЦД50 и ХЦД50 для соединения 1-К ниже, чем эти показатели для известного противовирусного препарата ганцикловир.
На фиг.6 представлен график зависимости подавления бляшкообразующей способности ВПГ от концентрации 1-К. На графике показано определение 50% ингибирующей дозы (ИД50) - концентрации 1-К, вызывающей ингибирование бляшкообразования на 50%. ИД50 1-К для ВПГ составила 18 мкг/мл.
На фиг.7 представлен график зависимости подавления бляшкообразующей способности ЦМВ от концентрации 1-К. На графике показано определение 50% ингибирующей дозы (ИД50) - концентрации 1-К, вызывающей ингибирование бляшкообразования на 50%. ИД50 1-К для ЦМВ составила 10 мкг/мл.
Сущность изобретения характеризуется следующими примерами.
Пример 1. Получение производного фуллерена 1-К
Хлорфуллерен C60Cl6 (0.933 г) растворяли при перемешивании в сухом 1,2-дихлорбензоле (250 мл) в атмосфере аргона. Раствор откачивали при легком нагревании (30-40°С) для удаления растворенных газов и следов воды. К раствору прибавляли перегнанный в вакууме эфир феноксимасляной кислоты (10 мл), после чего еще раз вакуумировали до прекращения выделения пузырьков газа. К полученному раствору прибавляли безводный тетрахлорид олова (0.3 г), после чего систему быстро нагревали до температуры начала реакции (50-70°С). Выдерживали при указанной температуре 30 мин, после чего охлаждали до комнатной температуры.
Реакционную смесь выливали в делительную воронку, содержащую 1 л разбавленной соляной кислоты, и встряхивали для удаления солей олова из органической фазы. Органическую фазу промывали дистиллированной водой 3-4 раза, после чего отделяли и сушили прокаленным сульфатом натрия или сульфатом магния.
Выделение целевого продукта 1а проводилось методом колоночной хроматографии. Для этого дихлорбензольный раствор, содержащий продукты реакции, разбавляли вдвое петролейным эфиром и наносили на широкую хроматографическую колонку (диаметр 30 мм, высота слоя силикагеля 30 см). Удаляли дихлорбензол пропусканием чистого толуола, а затем медленно отделяли продукты элиминирования C60Ar2-4 элюированием 0,4-0,5% раствором метанола в толуоле. Целевые продукты вымывали 0,6-0,7% метанолом в толуоле, отбирая отдельные фракции объемом 50-100 мл и контролируя их чистоту методом ВЭЖХ (обращенная фаза С 18, растворитель - смесь метанола с 30% толуола). Фракции продукта с чистотой более 95% собирали вместе и упаривали на роторном испарителе, а нечистые фракции упаривали до небольшого объема и повторно хроматографировали в тех же условиях. После упаривания растворов остаток промывали метиловым или этиловым спиртом и высушивали на воздухе. Получали 0.876 г продукта 1а (выход 47%).
Для проведения кислотного гидролиза соединение 1а (0.876 г) растворяли в толуоле (200 мл/г) в атмосфере аргона или на воздухе, после чего к раствору прибавляли равный объем уксусной кислоты и концентрированную 37% соляную кислоту (40 мл). Двухфазную смесь нагревали при интенсивном перемешивании до 90-95°С в течение двух-трех дней, приливая 5-10 мл соляной кислоты каждые 3 часа.
По окончании гидролиза органическую фазу, содержащую поликарбоксильное производное 1b, отделяли и упаривали на роторном испарителе. Для удаления следов толуола сухой остаток несколько раз упаривали с ледяной уксусной кислотой. Ярко-красный порошок продукта 1b промывали диэтиловым эфиром и извлекали механически. Выход 1b составил 96-99%. Калийную соль 1-К получали с количественным выходом растворением 1b в водном растворе карбоната калия (2.5 эквивалента К2СО3 на один эквивалент 1b).
Спектральные характеристики:
1а. 1Н ЯМР (600 МГц, CDCl3, δ, м. д.): 2,06 (м, 2Н); 2,17 (м, 8Н); 2,49 (т, 2Н); 2,59 (т, 8Н); 3,68 (с, 3Н); 3,73 (с, 6Н); 3,74 (с, 6Н); 3,93 (т, 2Н); 4,06 (м, 8Н); 6,66 (д, 2Н); 6,84 (д, 4Н); 6,89 (д, 4Н); 7,16 (д, 2Н); 7,56 (д, 4Н); 7,84 (д, 4Н). 13С ЯМР (150 МГц, CDCl3, δ, м. д.): 24,58 (СН2); 24,64 (СН2); 24,67 (СН2); 30,45 (СН2); 30,58 (СН2); 51,66 (ОСН3); 51,72 (ОСН3); 57,52 (sp3 каркас); 60,14 (sp3 каркас); 62,86 (sp3 каркас); 66,48 (ОСН2); 66,72 (ОСН2); 66,83 (ОСН2); 113,66 (Ar); 114,56 (Ar); 114,67 (Ar); 114,80 (Ar); 127,74; 129,10; 129,25; 129,40; 129,76; 130,56; 131,03; 131,26; 136,45; 142,85; 143,42; 143,54; 143,75; 143,86; 144,09; 144,14; 144,24; 144,43; 144,49; 145,30; 145,42; 146,88; 147,25; 147,27; 147,40; 147,84; 148,14; 148,30; 148,45; 148,63; 148,68; 148,69; 148,76; 150,55; 151,34; 153,64; 156,86; 157,87; 158,38; 158,44; 173,65 (СООСН3); 173,67 (СООСН3); 173,71 (СООСН3)
1b/1-К 1Н ЯМР (600 МГц, CS2-ацетон-D6, δ, м. д.): 2,00 (м, 2Н), 2,09 (м, 8Н), 2,45 (т, 2Н), 2,53 (м, 8Н), 3,96 (т, 2Н), 4,08 (м, 8Н), 6,70 (д, 2Н), 6,92 (д, 4Н), 6,96 (д, 4Н), 7,20 (д, 2Н), 7,61 (д, 4Н), 7,88 (д, 4Н). 13С ЯМР (150 МГц, CS2-ацетон-D6, δ, м. д.): 24,61 (CH2); 24,64 (CH2); 24,69 (CH2); 29,85 (CH2); 29,88 (CH2); 57,55 (sp3 каркас); 60,27 (sp3 каркас); 62,96 (sp3 каркас); 66,76 (CH2); 66,85 (CH2); 66,93 (CH2); 77,04 (С-Cl); 113,79 (Ar); 114,68 (Ar); 114,87 (Ar); 114,92 (Ar); 115,01 (Ar); 128,82; 129,20; 129,30; 129,66; 129,81; 130,35; 131,33; 136,03; 142,88; 143,59; 143,77; 143,83; 143,89; 144,17; 144,21; 144,28; 144,42; 144,52; 145,43; 145,57; 147,10; 147,23; 147,26; 147,39; 147,81; 148,09; 148,26; 148,42; 148,56; 148,64; 148,66; 148,73; 150,81; 151,53; 153,81; 157,03; 158,25; 158,79; 158,81; 173,55 (COOX); 173,68 (COOX); 173,85 (COOX).
Пример 2. Определение цитотоксического действия поликарбоксильного производного фуллерена 1-К на клетки Vero.
Цитотоксичность определяли по трем параметрам: острая цитотоксическая доза, хроническая цитотоксическая доза и максимально переносимая доза. Клетки инкубировали при температуре 37°С в атмосфере 4,7% CO2 в присутствии 1-К в возрастающих концентрациях. Проводили определение острой цитотоксичности через 24 часа после внесения соединения. Хроническую цитотоксичность определяли через 72 часа, максимально переносимую дозу - через 7 суток после внесения соединения. Жизнеспособность клеток определяли по исключению витального красителя трипанового синего. Для этого клетки окрашивали 0,4% раствором трипанового синего и просчитывали в камере Горяева. Живые клетки оставались неокрашенными, в то время как погибшие в результате токсического действия субстанции окрашивались в ярко-синий цвет.
Острая цитотоксическая доза (ОЦД50) 1-К соответствует концентрации соединения, при которой наблюдалась гибель 50% клеток через сутки после внесения вещества. Хроническая цитотоксическая доза (ХЦД50) - концентрации соединения, при которой отмечалась гибель 50% клеток через трое суток после внесения вещества. Максимально переносимая доза (МПД) - это концентрация соединения, при которой не выявлено цитопатогенного действия в течение 7 суток после внесения вещества. На основании полученных данных построили графики зависимости количества жизнеспособных клеток от концентраций соединения. Результаты экспериментальной оценки цитотоксического действия соединения 1-К представлены на фиг.2 и 3.
В таблице 1 приведены данные по цитотоксическому действию соединения 1-К на жизнеспособность клеток Vero. Значения ОЦД50, ХЦД50 и МПД составили 2300 мкг/мл, 2000 мкг/мл и 1000 мкг/мл соответственно. В качестве сравнения приведены данные о цитотоксичности референс-препарата ацикловир, обладающего анти-ВПГ активностью. Как видно из представленных данных, цитотоксичность соединения 1-К ниже, чем токсичность известного противовирусного препарата ацикловир, применяемого в клинической практике для лечения ВПГ-инфекции.
Пример 3. Определение цитотоксического действия поликарбоксильного производного фуллерена 1-К на клетки ФЛЭЧ.
Цитотоксичность определяли по трем параметрам: острая цитотоксическая доза, хроническая цитотоксическая доза и максимально переносимая доза. Клетки инкубировали при температуре 37°С в атмосфере 4,7% CO2 в присутствии 1-К в возрастающих концентрациях. Проводили определение острой цитотоксичности через 24 часа после внесения соединения. Хроническую цитотоксичность определяли через 72 часа, максимально переносимую дозу - через 7 суток после внесения соединения. Жизнеспособность клеток определяли по исключению витального красителя трипанового синего. Для этого клетки окрашивали 0,4% раствором трипанового синего и просчитывали в камере Горяева. Живые клетки оставались неокрашенными, в то время как погибшие в результате токсического действия субстанции окрашивались в ярко-синий цвет.
Острая цитотоксическая доза (ОЦД50) 1-К соответствует концентрации соединения, при которой наблюдалась гибель 50% клеток через сутки после внесения вещества. Хроническая цитотоксическая доза (ХЦД50) - концентрация соединения, при которой отмечалась гибель 50% клеток через трое суток после внесения вещества. Максимально переносимая доза (МПД) - это концентрация соединения, при которой не выявлено цитопатогенного действия в течение 7 суток после внесения вещества. На основании полученных данных построили графики зависимости количества жизнеспособных клеток от концентраций соединения. Результаты экспериментальной оценки цитотоксического действия соединения 1-К представлены на фиг.4 и 5.
В таблице 2 приведены данные по цитотоксическому действию соединения 1-К на жизнеспособность клеток ФЛЭЧ. Значения ОЦД50, ХЦД50 и МПД составили 1354 мкг/мл, 1269 мкг/мл и 10 мкг/мл соответственно. В качестве сравнения приведены данные о цитотоксичности референс-препарата ганцикловир, обладающего анти-ЦМВ активностью. Как видно из представленных данных, значения ОЦД50 и ХЦД50 соединения 1-К ниже, чем эти показатели для известного противовирусного препарата ганцикловир, применяемого в клинической практике для лечения ЦМВ-инфекции.
Результаты тестирования показали, что ОЦД50 и ХЦД50 для поликарбоксильного производного С60 1-К превышают 1000 мкг/мл. Таким образом, приведенные данные свидетельствуют о низкой цитотоксичности соединения 1-К.
Определение противовирусных свойств 1-К в микробицидной схеме применения в клеточных системах in vitro.
Для установления противовирусного действия 1-К определяли концентрацию вещества, вызывающую подавление вирусной активности на 50%. Выявление вирусной активности проводили методом иммуноцитохимического окрашивания с использованием моноклональных антител, взаимодействующих с вирусными белками, с последующим подсчетом антигенсодержащих клеток (бляшек).
Пример 4. Определение противовирусных свойств производного фуллерена 1-К в отношении ВПГ-1 в микробицидной схеме применения.
На клеточный монослой Vero наносили соединение 1-К в различных концентрациях и инкубировали в течение 1 часа при 37°С. Затем клетки заражали ВПГ-1, референс-штамм F, с множественностью инфицирования 10-3 БОЕ/кл. Контролем служили инфицированные клетки, не обработанные соединением 1-К. Через 3 суток после заражения подсчитывали количество вирусспецифических бляшек в контрольных и опытных образцах. Антивирусную активность соединения оценивали по подавлению способности ВПГ-1 к бляшкообразованию и выражали в процентной доле от контроля. На фиг.6 представлена зависимость подавления бляшкообразующей способности ВПГ-1 от концентраций 1-К. Концентрацию соединения, вызывающую ингибирование бляшкообразования на 50% по отношению к контролю, принимали за ингибирующую дозу (ИД50). ИД50 1-К для ВПГ-1 составила 18 мкг/мл.
Пример 5. Измерение противовирусных свойств производного фуллерена 1-К в отношении ЦМВ в микробицидной схеме применения.
На клеточный монослой фибробластов наносили соединение 1-К в различных концентрациях и инкубировали в течение 1 часа при 37°С. Затем клетки заражали ЦМВ, референс-штамм AD 169, с множественностью инфицирования 10-4 БОЕ/кл. Контролем служили инфицированные клетки, не обработанные соединением 1-К. Через 5 суток после заражения подсчитывали количество вирусспецифических бляшек в контрольных и опытных образцах. Антивирусную активность соединения оценивали по подавлению способности ЦМВ к бляшкообразованию и выражали в процентной доле от контроля. На фиг.7 представлена зависимость подавления бляшкообразующей способности ЦМВ от концентраций 1-К.
Концентрацию соединения, вызывающую ингибирование бляшкообразования на 50% по отношению к контролю, принимали за ингибирующую дозу (ИД50). ИД50 1-К для ЦМВ составила 10 мкг/мл.
Химиотерапевтическая оценка соединения 1-К
Для оценки перспективности применения соединения 1-К как возможного химиотерапевтического средства был рассчитан химиотерапевтический индекс (ХТИ), который характеризует специфическую противовирусную активность препаратов.
ХТИ=ХЦД50/ИД50,
где ХЦД50 - концентрация соединения, вызывающая снижение жизнеспособности клеток на 50% через 72 часа после внесения вещества.
ИД50 - концентрация соединения, подавляющая бляшкообразующую способность вируса на 50%.
Установлено, что ХТИ соединения 1-К составляет 111 для ВПГ- инфекции и 127 - для ЦМВ-инфекции. Превышение значения ХТИ, равного 100, свидетельствует о высокой противовирусной активности патентуемого соединения 1-К.
Таким образом, соединение 1-К, для которого заявляется применение в качестве микробицидного противовирусного средства, обладает низкой цитотоксичностью в клеточных культурах in vitro. Хроническая цитотоксическая доза этого соединения составляет 2000 мкг/мл и 1269 мкг/мл в отношении клеток Vero и ФЛЭЧ соответственно. Соединение 1-К проявляет выраженную анти-ВПГ и анти-ЦМВ активность при использовании в микробицидной схеме применения in vitro. Ингибирующая доза (ИД50) составляет для ВПГ-1 18 мкг/мл и для ЦМВ - 10 мкг/мл. 1-К характеризуется высоким химиотерапевтическим индексом (ХТИ) более 100 как для ВПГ, так и для ЦМВ. Важным преимуществом данного соединения является его способность одновременно ингибировать ВПГ- и ЦМВ-инфекции в отличие от большинства препаратов, обладающих монотерапевтическим действием.
Представленные данные подтверждают перспективность использования соединения 1-К в качестве химиотерапевтического средства или биологически активной субстанции в составе лекарственных форм противовирусного назначения для предотвращения заражения при сексуальном контакте для экстренной профилактики ВПГ- и ЦМВ-инфекций.
Применение поликарбоксильного производного фуллерена С60, имеющего структурную формулу в качестве микробицидного противовирусного средства для ингибирования вирусов простого герпеса и цитомегаловируса.