Способ и устройство для определения анализируемого вещества
Иллюстрации
Показать всеИзобретение относится к аналитической химии, в частности к аспектам, относящимся к способам неферментативного определения присутствия или количества углеводов в образце, и описывает способ, устройство и набор для анализа образца для определения присутствия или количества анализируемого вещества, в частности углеводорода, более конкретно сахара, в образце при использовании ткани. Способ включает нанесение образца на синтетическую ткань; химическую модификацию указанного углевода, присутствующего в образце, окисляющим средством с достаточным окисляющим потенциалом, чтобы расщепить углевод между двумя гидроксильными группами; инактивацию указанного окисляющего средства, которое препятствовал бы определению химически модифицированного углевода; определение присутствия или количества указанного химически модифицированного углевода при помощи медьсодержащего соединения для получения видимого изменения цвета. Изобретение может использоваться для определения присутствия углевода на поверхности для индикации загрязнения поверхности, в частности загрязнения веществом, способствующим микробному росту. 6 н. и 14 з.п. ф-лы, 2 ил., 7 табл.,4 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу, устройству и набору для анализа образца при использовании ткани для определения присутствия или количества в образце анализируемого вещества, в частности углевода, более конкретно, сахара.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Санитарному состоянию внешней среды уделяется растущее внимание в лабораториях, приемных медицинских учреждений, дома, в местах общего пользования и на предприятиях промышленного производства. Тенденция состоит в развитии способов, при помощи которых пользователь, использующий или очищающий пространство, может легко убедиться в его гигиеническом состоянии. Такие способы должны быть чрезвычайно простыми, удобными для пользования, быстрыми и недорогими.
Убедиться в гигиеническом состоянии можно по определению присутствия микроорганизмов, например концентрации бактерий или веществ, стимулирующих бактериальный рост, на поверхностях. Анализ микроорганизмов с поверхностей при использовании принятых в настоящее время способов медленный и требует профессиональной экспертизы. Анализ веществ, например сахаров и белков, облегчающих рост микроорганизмов, например бактерий и грибов, определяет чистоту поверхностей с практически сравнимой достоверностью.
Существуют быстрые и чувствительные тесты, пригодные для определения присутствия белка, которые основываются на бромкрезола зеленого с белками. Такие тесты были описаны, например, в заявке на патент WO 2006/122733, в которой подробно обсуждаются существующие форматы тестов на основе использования различных мембран. В заявке также подробно обсуждаются различные способы применения реагентов на мембране в виде дупликации рулон-на-рулон или других способов печати.
Наиболее известные способы анализа углеводов, таких как сахара, основаны на способах, в которых сахара определяют по изменению окраски. Большинство способов, основанных на изменении окраски, были разработаны для спектрофотометрического анализа сахаров. К настоящему времени не существует недорогих, быстрых и простых тестов, пригодных для определения присутствия сахаров на поверхностях. Проблема сахаров состоит в их стабильной структуре, что означает, что их анализ требует присутствия специфических и по-видимому нестабильных ферментов, инкубацию при сильно повышенных температурах, продолжительного времени реакции и/или химических реагентов, вредных для здоровья или небезопасных для использования.
Существует несколько способов, пригодных для анализа сахаров, которые основаны на изменении цветов. Способы, основанные на восстановлении меди, включают реактивы Фелинга, арсеномолибдатный и BCA (бицинхининовой кислоты) анализ. Другие способы, применимые для определения сахара, включают способы с использованием цианида железа и DNS (динитросалициловой кислоты), способы, основанные на образовании ацеталей, антронный способ, способы индикации, включающие феназиновую группу, реактивы Шиффа и тетразолиевый голубой, а также бороновые сенсоры, основанные на циркулярном дихроизме, фотоабсорбции и флуоресценции. Другие способы, пригодные для определения сахаров, включают ферментативные способы, такие как глюкозоксидазный/пероксидазный и гексокиназный, и люминесцентные способы, включающие биолюминесценцию и хемилюминесценцию.
Такие пригодные способы не представляют собой применимые для использования в формате теста, где сахара определяют, используя способ на ткани. Все способы, основанные на восстановлении меди, требуют нагревания для достаточно быстрого воздействия на реакцию.
В патенте США 6586195 для индикации сахаров используют зеленый янус В. В патенте показано, что восстанавливающие сахара способны к восстановлению зеленого януса B в достаточно высоких концентрациях, порядка 10 г/л, в основных условиях, при этом зеленый янус B изменяет цвет с синего на серый. Изменение цвета не представляет собой оптимальное, поскольку указанная реакция - изменение с синего на серый - делает чрезвычайно сложным определение результата теста с концентрацией, близкой к пределу определения.
Способы, основанные на образовании ацеталя, и антронный способ используют сильные кислоты в высоких концентрациях, что делает указанные способы непригодными в разработке быстрого теста на основе ткани.
Индикационные способы включают простые композиции реагентов, что уменьшает требуемый объем реагентов для отпечатывания на ткани. При достаточно высоких концентрациях сахаров, изменения в окраске индикаторов также можно наблюдать даже при комнатной температуре. Недостаток состоит в том, что можно определять только сахара с высокой восстанавливающей способностью, например фруктозу. Также недостаточно коммерчески доступных индикаторов.
Ферментативные способы и способы на основе люминесценции представляют собой чувствительные и быстрые. Недостатки, связанные с некоторыми ферментами, включают их стоимость и их нестабильные характеристики. Более того, специфическое действие ферментов, например, они действуют исключительно в отношении определенных сахаров, мешает их использованию в быстрых тестах, которые должны быть способны определять общую концентрацию всех или практически всех углеводов. Способы на основе люминесценции пригодны только в сочетании с модифицирующими сахара ферментами и, таким образом, разделяют те же проблемы, что и ферментативные способы.
Хорошо известные способы, знакомые специалистам в данной области, и реагенты, которые они применяют, не пригодны для быстрых диагностических способов. Например, способ цианида железа не применим для быстрого анализа сахаров, поскольку в кислых условиях выделяется цианид в виде цианистого водорода, высоко токсичного вещества. Некоторые способы могут не работать при комнатной температуре (например, способ DNS или зеленый янус В), или они обладают плохой стабильностью (например, способы, требующие ферментов, реактивы Шиффа и образующие ацеталь реагенты). Несколько способов также требуют сильно кислотные или щелочные условия.
Таким образом, существует необходимость для быстрого и чувствительного теста для определения углеводов на поверхностях. В особенности существует необходимость в тесте, который можно осуществлять без повышения температуры.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает способ определения присутствия или количества определяемого при анализе вещества в образце, указанный способ, включающий:
нанесение образца на ткань;
химическую модификацию указанного определяемого вещества, если оно присутствует в образце;
определение присутствия или количества указанного химически модифицированного анализируемого вещества.
В одном из вариантов осуществления средства для химической модификации анализируемого вещества, например реактив(ы), присутствуют в ткани до того, как образец наносится на ткань. Предпочтительно, реактивы отпечатаны или другим образом нанесены, абсорбированы или прикреплены к ткани.
В одном из вариантов осуществления настоящего изобретения способ дополнительно включает инактивацию агента, который препятствует определению химически модифицированного анализируемого вещества. Предпочтительно, химическую модификацию и инактивацию препятствующего агента проводят до определения химически модифицированного анализируемого вещества. Согласно данному варианту осуществления любой образец или препятствующий продукт, например агент, реактив, композиция или субстанция, присутствующие в образце, реактив для анализа, нанесенный на ткань или образованный в ходе анализа, могут подвергаться инактивации, например, нейтрализацией или предотвращением его движения осаждением. В одном варианте осуществления средства инактивации препятствующего агента присутствуют на ткани до нанесения образца на ткань. Указанные средства предпочтительно отпечатаны, другим образом нанесены, абсорбированы или прикреплены к ткани. В одном из вариантов осуществления средства для химической модификации анализируемого вещества и средства для инактивации препятствующего агента присутствуют на ткани до нанесения образца на ткань.
Настоящее изобретение также обеспечивает устройство для теста, пригодное для проведения способа, указанное устройство включает ткань, несущую средства для химической модификации анализируемого вещества, средства для определения химически модифицированного анализируемого агента и необязательно средства для инактивации препятствующего агента. Согласно одному из вариантов осуществления указанные средства нанесены или отпечатаны периодически, например, в виде областей, зон или участков, предпочтительно так, чтобы при использовании устройства образец мог проходить через области в определенном порядке.
Настоящее изобретение дополнительно обеспечивает набор для определения присутствия или количества анализируемого вещества в образце, включающий:
материал ткани; и
средства для модификации анализируемого вещества при использовании химически модифицирующих агентов; и
средства для инактивации препятствующих агентов; и
средства для определения химически модифицированного анализируемого вещества.
Дополнительно, настоящее изобретение относится к способу дупликации рулон-на-рулон, где реагенты и указанные средства последовательно отпечатывают на определенных участках ткани.
В одном из вариантов осуществления анализируемое вещество представляет собой углеводород. В одном из вариантов осуществления анализируемое вещество представляет собой сахар. Предпочтительно, сахар включает фруктозу, декстрин, лактозу, мальтозу и/или сахарозу.
Настоящее изобретение обеспечивает способ определения сахара в образце, включающий неферментативный способ, проводимый при комнатной температуре путем нанесения указанного образца на ткань.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. Структурный принцип способа абсорбирующей влагу ткани.
Фигура 2. Конкретный пример ткани, пригодной для теста на сахар, показывающий реагенты в различных участках ткани.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу, устройству и набору для анализа образца таким образом, что анализируемое вещество в образце может быть химически изменено или модифицировано и, необязательно, препятствующие реакционные агенты, или агенты, и/или продукты, полученные в ходе анализа, могут быть инактивированы в ходе анализа.
Способ широко применим для измерения анализируемого вещества, которое представляет собой стабильное или иным образом сложное для измерения в той форме, в которой оно находится в образце. Способ по настоящему изобретению в особенности пригоден для определения присутствия углеводов, в особенности сахаров, в образце.
Изобретение относится к способу определения сахаров в образце при использовании способа абсорбирующей влагу ткани. Способ можно проводить без увеличения температуры реакции. Настоящее изобретение также относится к устройству, содержащему ткань, для использования в настоящем способе. При производстве устройства химические вещества, используемые при анализе, могут переноситься на ткань при использовании традиционных способов печати. Пригодный способ производства описан в деталях в WO 2006/122733, включенном здесь в качестве ссылки. Ламинирование ткани между пластиковыми мембранами позволяет жидкости быстрее двигаться вдоль ткани. Однако процедура производства отличается от процедуры, описанной в WO 2006/122733 тем, что представляет собой более сложную и трудную, из-за различных областей, на которые наносят изменяющий(е) агент(ы), инактивирующий(ие) агент(ы) и типичные реагенты анализа. Способ и устройство по настоящему изобретению применимы для быстрого теста. Основные требования для быстрого теста представляют собой простоту, чувствительность, специфичность, безопасность, легкость использования, пригодность для удаления отходов и пригодность для промышленного производства печатными способами.
Несмотря на то, что тест по настоящему изобретению можно использовать для любого пригодного анализируемого вещества, для удобства последующее описание будет обсуждать в деталях вариант осуществления, в котором анализируемое вещество представляет собой углевод. Тест по настоящему изобретению можно использовать для определения углеводородов, в особенности сахаров, таких как фруктоза (фруктовый сахар), декстрин, лактоза (молочный сахар), мальтоза (солодовый сахар) и сахароза (гранулированный сахар), предпочтительно при использовании видимого изменения цвета. При использовании традиционных способов фруктоза представляет собой наиболее просто определяемый сахар, тогда как наиболее сложно определяемыми являются сахароза и крахмал. Сахароза и крахмал представляют собой наиболее сложно определяемые, поскольку они имеют значительно более низкую восстанавливающую способность, по сравнению с упомянутыми выше сахарами. Настоящее изобретение способно определять присутствие 150 мкг сахаров, включая присутствие нейтральных сахаров, таких как сахароза.
Для оценки санитарного состояния тесты главным образом представляют собой количественные, показывая присутствие сахара в образце в заданном пределе чувствительности. Настоящее изобретение способно определять присутствие углеводов, в частности сахаров, с чувствительностью, так что предел определения составляет 1 г/л. Это соответствует способности определять 500 мкг сахаров в образце 500 мкл, отобранном с поверхности 10×10 см2. Предел определения сахаров (при использовании тех же единиц) предпочтительно составляет 0,5 г/л (250 мкг), более предпочтительно, 0,2 г/л (100 мкг), 0,1 г/л (50 мкг), 0,05 г/л (25 мкг), 0,02 г/л (10 мкг) или 0,01 г/л (5 мкг).
Настоящее изобретение предоставляет простое и недорогое устройство для определения санитарного состояния в, например, больницах, кабинетах врача, лабораториях, пищевой промышленности, молочных заводах, пекарнях, пивоваренных заводах и в производстве напитков.
«Углевод» представляет собой химическое соединение, которое содержит углерод, кислород и водород. Предпочтительно, он представляет собой сахар.
«Сахар» представляет собой водорастворимый моносахарид, олигосахарид или полисахарид.
Серийная реакция на ткани может быть использована для осуществления способа по изобретению. Кратко, образец вводят в реакцию на ткани для реакции с желаемыми химическими веществами в конкретным образом определенном порядке.
Образец обычно вводят в ткань, протирая тканью исследуемые поверхности. Также предусмотрены другие варианты осуществления изобретения. Например, ткань можно помещать на исследуемую поверхность или образец жидкости можно отбирать из исследуемой области и вводить в ткань при использовании, например, пипетки сходных устройств для переноса. Поверхность и/или ткань можно обрабатывать перед введением в контакт. Например, одну из них (предпочтительно, поверхность) можно увлажнять водным раствором для облегчения обеспечения жидкого образца. Водный раствор можно наносить в виде, например, спрея или раствора. Это представляет собой в особенности желательное, если исследуемая поверхность сухая или обычно сама по себе не несет воды или раствора, включающего вещества, благоприятные для проведения анализа, например буферы.
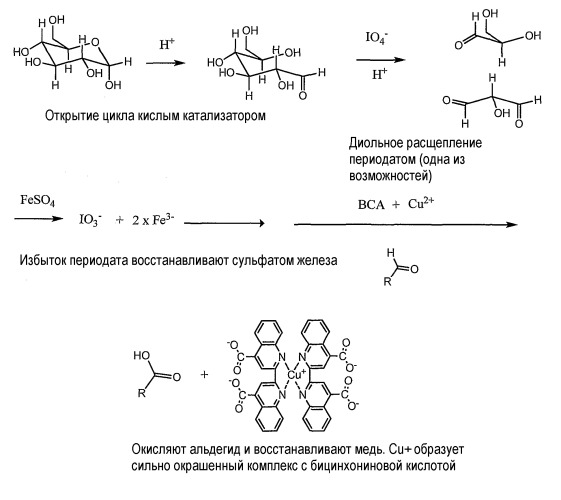
Буфер не должен содержать соединения, которые взаимодействуют с химическими веществами, используемыми для модификации анализируемого вещества или для определения анализируемого вещества. Например, если анализируемое вещество представляет собой углевод, химическая модификация обычно представляет собой окисление, и стадия определения обычно включает использование металлических комплексов, цвет которых представляет собой видимую индикацию положительного результата. В данном варианте осуществления препятствующие агенты, которые предпочтительно должны отсутствовать в водном растворе, включают, но не ограничиваются перечисленным, иодаты и фосфаты, которые образуют комплексы с медью, и борную кислоту и бораты, которые образуют комплексы с углеводами, препятствуя окислению. Буферные растворы могут содержать первичные, вторичные и третичные спирты, хотя ди-, три- и полиспирты не представляют собой предпочтительные. Водный раствор может также содержать иод и стабилизаторы, такие как KI, для определения крахмала и других полисахаридов, продвижение которых в тестовом устройстве может быть более ограниченным из-за хроматографического разделения.
Пригодные водные растворы представляют собой буферы, которые приготовлены согласно ASC или качества для анализа. Водный раствор должен также иметь низкое содержание примесей металлических ионов. Предпочтительно, он содержит не более чем 0,002% или не более чем 0,001% Fe. Предпочтительно, он содержит не более чем 10 ч/млн или не более чем 5 ч/млн Pb. Более предпочтительно, содержание примесей металлических катионов в водном растворе должно быть настолько низким, насколько это возможно.
После того как образец жидкости вводится в ткань, обычно первая стадия представляет собой химическую модификацию углевода. Если углевод представляет собой сахар, его обычно изменяют или модифицируют таким образом, который позволяет определение при комнатной температуре. В одном из вариантов осуществления сахара делают более реакционно-активными за счет открытия простой эфирной связи в кольцевой структуре сахара и между мономерами с последующим способом окисления, где число альдегидных групп увеличивается. Средства для химической модификации углевода могут представлять собой реакционный агент, например периодную кислоту или соль периодной кислоты, такую как периодат натрия, или другой тип химического вещества, такой как соль церия (IV). Такие средства химической модификации предпочтительно представляют собой окисляющий агент с достаточным окислительным потенциалом для расщепления углеводной цепи между двумя гидроксильными группами и предпочтительно представляет собой бесцветный.
Другие реакции, рассмотренные для модификации углеводорода в более легко определяемую форму и которые могут быть использованы на основе способа и устройства определения по настоящему изобретению, включают, но не ограничиваются перечисленным:
- мультиротацию, где -ОН группу подвергают мультиротации из α- в β-форму при использовании слабой кислоты.
- катализируемое кислотой образование кислородного мостика (простой эфир) между сахар-ОН и спиртом.
- образование карбоновой кислоты, например, глюконовой кислоты, в присутствии слабого окислителя, например Cu2+.
- образование дикарбоновой кислоты, например глюкуроновой кислоты, при повышенных температурах с сильной кислотой.
- восстановление при использовании NaBH4 до сахарных спиртов (разрыв эфирного цикла и образование гидроксильной конечной группы).
- образование ацетатов, при наличии Na-ацетата и уксусного ангидрида.
- образование альдегидов в присутствии, например, оксида серебра и метилиодида.
Считается, что способ химической модификации анализируемого вещества перед определением химически модифицированного анализируемого вещества представляет собой процедуру, не известную ранее для ткани. В способе по настоящему изобретению образец и средства модификации или изменения должны встретиться, предпочтительно, препятствующие агенты должны быть инактивированы и только заданные композиции или вещества должны далее продвигаться по материалу ткани.
«Интерферирующий агент» представляет собой вещество, которое, если присутствует при определении химически модифицированного анализируемого вещества, будет препятствовать определению химически модифицированного вещества. Препятствующий агент может присутствовать в образце изначально, может представлять собой избыточный реагент из химической модификации анализируемого вещества или может существовать в результате реакции химической модификации анализируемого вещества, т.е. может представлять собой побочный продукт реакции.
Если анализируемое вещество представляет собой углевод, примеры препятствующих агентов включают иодаты и фосфаты, которые образуют комплексы с медью, а также борную кислоту и бораты, которые склонны образовывать комплексы с углеводородами, препятствуя окислению углеводов. Также восстанавливающие агенты, такие как катионы металлов, способны восстанавливать медь, таким образом, приводя к окрашенной реакции без присутствия сахара.
Интерферирующие агенты могут быть инактивированы или в том же участке ткани, где имеет место химическая модификация, или в последующем участке ткани, через который проходит образец, включающий химически модифицированное анализируемое вещество. Предпочтительно, инактивацию проводят в последующем участке. Инактивация проходит до определения химически модифицированного анализируемого вещества.
Затем определяют химически модифицированное анализируемое вещество. Если анализируемое вещество представляет собой углеводород, определение предпочтительно проводят при использовании BCA анализа. В способе BCA Cu2+ в кипящей щелочи. Винную кислоту используют в качестве комплексообразователя для Cu2+, препятствующего образованию осадка гидроксида меди. В ходе указанного способа Cu2+ восстанавливают до Cu+, который реагирует с бицинхониновой кислотой и образует окрашенный комплекс, образование которого связывают с присутствием сахара.
Несмотря на то, что BCA способ использует инкубацию, даже небольшие количества восстановленной меди определяются в виде BCA комплекса и используемые реакционные агенты можно оставлять отвердевать в стабильные соединения на ткани.
Ткань предпочтительно представляет собой синтетическую ткань, поскольку ткань на основе, например, природной целлюлозы и вискозы имеет склонность приводить к ложно положительным результатам при использовании для определения углеводов. Синтетические ткани, которые могут использоваться, включают, но не ограничиваются перечисленным, не содержащие целлюлозы и вискозы ткани, полиэфирные ткани, полиэтановые, полиамидные ткани, полипропиленовые ткани, поливинилхлоридные ткани и их комбинации. В одном варианте осуществления ткань представляет собой полиэфирную ткань.
Термин «ткань» используют в настоящем описании и определяют как включающий любой материал, способный абсорбировать образец жидкости и транспортировать или переносить указанный образец посредством капиллярного действия. Обычно используют термин «матрица», который представляет собой материал с соответствующими свойствами.
Термин «модифицировать» используют и определяют в значении также изменять.
Термин «участок» используют и определяют в значении «зона», «фаза», «область», «сегмент», например, в мультистадийном тесте.
Термин «вытирание» используют и определяют для обозначения также «протирания». В ходе вытирания ткань абсорбирует жидкость с поверхности.
Термин «продукт» используют и определяют для обозначения любого агента, реакционного агента, композиции или вещества.
В одном из вариантов осуществления настоящего изобретения ВСА способ используют для функционирования на ткани. При получении пригодного устройства химическое вещество в жидкой форме отпечатывают на ткани, где оно высыхает. В твердой форме химическое вещество ни передвигается по ткани, ни разбавляется от испарения и его стабильность улучшается по сравнению со стабильностью в жидкой форме. Быстрый диагностический тест по настоящему изобретению позволяет определять сахара на поверхностях на основе реакции, вызывающей изменение цвета, в котором устранены проблемы, связанные с упомянутыми выше тестами. Тестовое устройство по настоящему изобретению представляет собой одноразовое и может быть изготовлено при использовании способа печати рулон-на-рулон, который сохраняет низкую стоимость. Проведение теста является простым и не требует специальной квалификации. Более того, включаемые химические вещества представляют собой безопасные для ежедневного использования.
Существуют несколько способов для определения и индикации сахаров; указанные тесты обсуждались во введении выше. Способы, обнаруженные в литературе, включают BCA и различные индикаторы. Указанные способы удовлетворяют одно из предпочтительных требований успешного теста, т.е. они вызывают изменение цвета при комнатной температуре. Недостаток состоит в том, что они требуют высоких концентраций сахара, несмотря на то, что небольшие количества могут быть определены термическим катализом. Однако свойства, обсуждаемые в литературе, недостаточны для способов, чтобы непосредственно использовать на ткани. Настоящее изобретение устраняет указанные проблемы и необходимость в нагревании, хотя тесты представляют собой достаточно чувствительные для определения даже низких концентраций сахара. Настоящее изобретение дает возможность создания на ткани условий способа в пробирке, что приводит к тому, что образец, перенесенный с увлажненной поверхности, претерпевал изменения цвета, если образец содержит сахар.
Согласно изобретению реакционные агенты, использованные в исследованных способах, переносили на ткань путем печати, что дополнительно к экономичному производству тестового устройства также обеспечивает гомогенную концентрацию реакционного агента по всей области печати. Наиболее обычные способы печати рулон-на-рулон включают рельефную печать, глубокую печать, офсетную печать и шелкографию, а также струйную печать в некоторых применениях.
Глубокая печать представляет собой предпочтительную в качестве способа печати по настоящему изобретению. Однако специалистам в данной области будет понятно, что также могут применяться другие способы печати, использованные с небольшими модификациями. Глубокая печать представляет собой предпочтительную из-за простой механики переноса чернил, что позволяет использовать чернила с в значительной степени различными реологическими свойствами, и хорошего химического переноса и свойств химической устойчивости способа. В примерах печать осуществляли при использовании настольной тестовой печатной машины.
Все способы тестировали по отношению к следующим сахарам: фруктозе, декстрину, лактозе, мальтозе и сахарозе, из которых сахароза была более нейтральной по сравнению с восстанавливающим сахаром.
Пример 1
Одновременно испытывали биологические и искусственные ткани. На ранней стадии было отмечено, что биологические ткани, содержащие целлюлозу и вискозу и, таким образом, сахароподобные группы, оказались непригодными для использования, поскольку сахароподобные функциональные группы вызывали изменение цвета даже в тесте нулевого образца. Ввиду этого, синтетические целлюлозо- и вискозоподобные ткани также испытывали и не наблюдали изменения цвета. Из испытанных тканей было обнаружено, что полиэфирные ткани представляют собой предпочтительные по сравнению с полипропановыми из-за их в меньшей степени гидрофобной природы.
Протоколы Waffenschmidt или Smith использовали в ходе экспериментов для определения сахаров следующим образом (Smith et al., Measurement of Protein Using Bicinchoninic Acid, 1985, 150, 76-85; Waffenschmidt ef al., Anal. Biochem. 1987, 165, 337-340).
Протокол для определения восстанавливающих сахаров при помощи ВСА способа:
Композиции растворов
Раствор А
- BCA 971 мг
- Na2CO3×H2O 31,75 г
- NaHCO3 12,1 г
- H2O до 500 мл
Раствор В
- CuSO2×5H2O 624 мг
- L-серин 631 мг
- H2O до 500 мл
Растворы смешивали 1:1 ежедневно.
Образец сахара смешивали с 1 мл смеси растворов А и В. Указанную содержащую сахар смесь выдерживали в течение 15 минут в нагревающем до 100ºС блоке. После охлаждения до комнатной температуры, примерно 20 минут, измеряли абсорбцию при 560 нм.
Предел определения для восстанавливающих моносахаридов составляет примерно 5 нмоль. Для глюкозы 5 нмоль составляет примерно 0,9 мг.
Композиции растворов, использованных в ходе протокола Smith et al. для определения белка способом ВСА, показаны в Таблице 3.1.
| Таблица 3.1Композиции растворов в ВСА смеси | |||
| Раствор А | Раствор В | ||
| Химическое вещество | Количество | Химическое вещество | Количество |
| Натриевая соль в ВСА | 1 г | CuSO2×5H2O | 4 г |
| Na2CO3×H2O | 2 г | H2O | До 100 мл |
| Динатрий тартрат | 0,16 г | - | - |
| NaOH | 0,4 г | - | - |
| NaHCO3 | 0,95 г | - | - |
| H2O | До 100 мл | - | - |
| pH установлен, 10М NaOH до 11,25 | - |
Растворы А и В смешивали в пропорции 50:1 ежедневно.
Образец раствора и смесь растворов А и В смешивали в пропорции 1:20, соответственно. Смесь инкубировали, если имелся ограниченный предел времени для определения или сохранялось только небольшое количество белка.
Поглощающую способность измеряли при использовании спектрофотометра. Сходные показания оптической плотности достигали при использовании различного времени инкубации. Эти результаты представлены в таблице 3.2.
| Таблица 3.2Достижение поглощающей способности 0,2 при различном содержании белка и параметрах инкубации | |||
| Поглощающая способность | Количество протеина | Температура инкубации | Время инкубации в минутах |
| ~0,2 | 20 мкг | Комнатная температура | ~5 |
| ~0,2 | 20 мкг | 37°С | ~2,5 |
| ~0,2 | 5 мкг | 60°С | ~3 |
Несмотря на то, что протокол Smiths предназначен для анализа белков, он может быть использован для определения восстанавливающих сахаров. Это показано в Таблице 3.3, где представлено препятствующее действие восстанавливающего сахара (глюкозы).
| Таблица 3.3Препятствующее действие восстанавливающего сахара в протоколе Smiths | ||
| 100 мкл образца, состоящего из 50 мкг BSA* и | Тест BCA** (BSA* обнаружен) при использовании контрольной поправки воды | Тест BCA** (BSA* обнаружен) при использовании препятствующей поправки |
| 900 мкг глюкозы | 245 мкг | 57,1 мкг |
| 450 мкг глюкозы | 144 мкг | 47,7 мкг |
| 90 мкг глюкозы | 70 мкг | 49,1 мкг |
| *Бычий сывороточный альбумин (белок)**Протокол описан выше с инкубацией при 37°С в течение 30 минут |
При использовании «контрольной поправки воды» все реакционные агенты присутствуют в контроле + таком же количестве воды, что и в образце, для поддержания одинакового объема образца и контроля. Абсорбцию контроля регистрировали и абсорбированное количество вычитали из абсорбции образца для коррекции абсорбции, вызванной загрязнением, реакционными агентами, лабораторным оборудованием и т.д.
«Препятствующая поправка» сходна с «контрольной поправкой воды», но контроль также включает такое же количество препятствующего(их) агента(ов), что и в образце. Таким образом, абсорбция, вызванная препятствующим агентом, загрязнением, реакционными агентами, лабораторным оборудованием и т.д., может быть вычтена из образца.
Композиции BCA реагентов, использованных в экспериментах согласно Smiths протокол, представлены в Таблице 3.1. В способах в пробирке реакционные агенты смешивали в соотношении 50А:1В, после чего образец инкубировали.
Химические вещества, использованные в ВСА способе, переносили на чистую, промытую другим буфером ткань при использовании настольной тестовой печатной машины. Испытывали диапазон различных тканей, значений рН и комбинаций ВСА химических веществ, создавая основу для дальнейших разработок. Наблюдения при испытаниях и их объяснения представлены в Таблице 3.4
| Таблица 3.4Наблюдения при испытаниях и их объяснения | |
| Наблюдения | Объяснения |
| Интенсивность нулевой реакции увеличивалась при более высоких значениях рН. | В тесте использовали биологическую ткань, таким образом достигалась более интенсивная реакция при достижении оптимальных условий ВСА способа. Оптимальная величина рН для сахара при использовании способа ВСА составляет 10,2. |
| Биологическая ткань вызывает нулевую реакцию, и нулевые реакции не наблюдаются с синтетическими тканями. | Нулевая реакция, наблюдаемая с биологическими тканями, была вызвана реакцией меди с восстанавливающим веществом, присутствующем в биологической ткани в форме вискозы и целлюлозы. Отсутствие нулевой реакции с синтетическими тканями подтверждает гипотезу. |
| При высоких рН использовали фосфатные буферы, нулевая реакция имела цвет, хотя цвет постепенно исчезал. | При использовании фосфатных буферов, наблюдалась цветная реакция, но цвет постепенно исчезал. Это происходило из-за реакции меди с фосфатами. |
| Самый низкий предел определения достигали при буфере ацетата натрия с величиной рН 4,7. | Ацетатный буфер с величиной рН 4,7 был наиболее чувствительным, поскольку тест проводили при использовании буфера и субстрата, которые не препятствовали способу ВСА. |
Способ ВСА дополнительно развивали с целью создания оптимальных условий пробирочного теста на ткани. Поскольку было показано, что биологическая ткань непригодна из-за положительного результата при отрицательной контрольной реакции, в качестве субстрата была выбрана полиэфирная ткань, поскольку она не содержит восстанавливающих групп, которые вызывают ложную контрольную реакцию.
Для исследования влияния буфера и рН ткань промывали 0,1 М карбонатным буфером, рН 10,2 и результаты сравнивали с ацетатным буфером, рН 4,7. Растворы реакционного агента ВСА отпечатывали на ткани, промытой карбонатным буфером в соотношении А=½ В, т.е. раствор В разбавляли до половинной силы водой перед печатью. Сначала отпечатывали раствор А, после высыхания отпечатка добавляли раствор ½ В. В Таблице 3.1 представлены растворы композиций перед разбавлением.
В предыдущих тестах предел определения для фруктозы на ткани, промытой буфером ацетата натрия, рН 4,7, составлял 5 г/л. Другие определяемые сахара не вызывали изменения цвета. Карбонатный буфер с рН 10,2 понижал предел определения фруктозы до 1 г/л, при этом другие сахара все еще не вызывали изменения цвета.
Поскольку способ анализа в пробирке включал инкубацию образца, влияние тепла на тканевый способ проверяли при помещении ткани, смоченной сахарами, в печь при 80°С на 30 минут. Термический эффект также был очевиден при использовании ткани, предел определения для фруктозы составил 0,05 г/л, но реакцию изменения цвета не наблюдали с сахарами.
Поскольку медный комплексообразующий агент представляет собой элемент способа, различные комплексообразующие агенты испытывали в попытке улучшения производительности теста. В предыдущих тестах использовали натриевую винную кислоту в качестве комплексообразующего агента Cu2+, но на этот раз его замещали на L-серин, поскольку было показано Waffenschmidt, что L-серин представляет собой более эффективный комплексообразующий агент для серебра по сравнению с натриевой винной кислотой.
Последующий тест был основан на композиции реакционных агентов по Waffenschmidt (Waffenschmidt et al., выше). Ткань обрабатывали тем же карбонатным буфером и химические вещества отпечатывали на ткани таким же образом, как и в предыдущих тестах. При печати использовали два различных соотношения, А+В и А+ ½ В. В таблице 3,5 показаны композиции растворов А и В.
| Таблица 3.5Композиция ВСА растворов по Waffenschmidt | |||
| Раствор А | Раствор В | ||
| Химическое вещество | Количество | Химическое вещество | Количество |
| BCA | 0,194 г | CuSO4×5H2O | 0,194 г |
| NaCO3×H2O | 6,35 г | L-серин | 0,126 г |
| NaHCO3 | 2,42 г | H2O | До 100 мл |
| H2O | До 100 мл | - | - |
При испытании сахаров на ткани нулевая реакция с водой была интенсивной, и ткань самопроизвольно окрашивалась в лиловый цвет в течение двух недель. Полагается, что L-серин образовывал комплекс с Cu2+ и пос