Способ выявления днк mycoplasma hominis из образцов крови
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способу выделения ДНК Mycoplasma hominis (М. hominis) для дальнейшего применения в диагностическом алгоритме. Изобретение представляет способ выделения ДНК Mycoplasma hominis из крови путем ее разделения центрифугированием на супернатант и осадок, последующее обогащение исследуемого материала, выделение ДНК методом аффинной сорбции с добавлением сорбента и лизирующего буфера, инкубацию, трехкратную отмывку сорбентного осадка центрифугированием и удаление надосадочной жидкости, высушиванием сорбентного осадка, добавление раствора для элюции ДНК и детекцию ПЦР-методом. Способ отличается тем, что в качестве исследуемого материала используют осадок цельной крови, а его обогащение производят в процессе выделения ДНК путем удвоения числа пробирок на один образец со 100 мкл осадка цельной крови и 20 мкл сорбента в каждой, в которые перед третьей отмывкой добавляют по 375 мкл отмывочного раствора, а их содержимое соединяют в одну пробирку и к сорбентному осадку добавляют раствор для элюции ДНК в количестве 40 мкл. Изобретение обеспечивает повышение точности диагностики M. Hominis. 1 табл.
Реферат
Изобретение относится к области медицины, а именно к способам выявления молекулярных маркеров Mycoplasma hominis (М. hominis) для дальнейшего применения в диагностическом алгоритме.
М. hominis относят к условно-патогенным микроорганизмам, распространенность которых в различных популяционных группах варьирует от 10 до 50% (по данным ряда авторов, до 80%). М. hominis может в норме колонизировать органы урогенитальной системы и нередко выявляются у клинически здоровых лиц (5-20%). Однако при определенных условиях эти микроорганизмы могут вызывать развитие воспалительных процессов мочеполового тракта [1].
Инфицирование происходит преимущественно половым путем. Также имеет место внутриутробное инфицирование плода и заражение новорожденных при прохождении через инфицированные родовые пути матери. М. hominis могут являться причиной негонококкового уретрита и простатита, воспалительных заболеваний органов малого таза (сальпингиты, оофориты, эндометриты, аднекситы), патологии беременности и плода, бесплодия у женщин и мужчин, а также перинатальной инфекции новорожденных. Социальная значимость урогенитальной микоплазменной инфекции состоит в ее осложнениях: нарушении репродуктивной функции в виде бесплодия, угрозы прерывания беременности, частого недонашивания, патологии плаценты, внутриутробного инфицирования плода [2].
Обследование на урогенитальные микоплазмы проводится по клиническим показаниям. Основными методами идентификации микоплазм являются:
1. Молекулярно-биологические методы, основанные на амплификации специфических фрагментов ДНК/РНК из урогенитального тракта труднокультивируемых возбудителей М. hominis, с использованием тест-систем, разрешенных к медицинскому применению в Российской Федерации.
2. Культуральное (бактериологическое) исследование для идентификации М. hominis. Микоплазмы очень требовательны к питательным средам и с трудом выделяются культуральным методом от больных, особенно при хронических инфекциях.
Метод полимеразной цепной реакции (ПЦР) позволяет выявить генетический материал возбудителя инфекции, обладает высокой чувствительностью и специфичностью. Результат анализа не зависит от состояния иммунной системы и стадии заболевания, а определяется лишь фактом наличия возбудителя, либо его генетического материала в исследуемом образце. Исследование позволяет выявлять микоплазмы различных видов. Тест используется для подтверждения диагноза при генерализованных формах микоплазменной инфекции [3].
В основе выделения ДНК методом аффинной сорбции лежит избирательная сорбция на поверхности силикогеля в присутствие хаотропной соли лизирующего буфера. Ингибиторы и другие компоненты исследуемого материала, которые могут привести к ухудшению реакции, остаются в растворе. С помощью центрифугирования силикагель с адсорбированной ДНК осаждается, а надосадочная жидкость с ингибиторами ПЦР удаляется. Серия последующих отмывок обеспечивает получение высокоочищенной ДНК, благодаря чему, данная методика является универсальной и подходит для широкого спектра биологических образцов, в том числе образцов с высоким содержанием белков, таких как биоптаты или цельная кровь, а также для обнаружения различных инфекций с максимальной чувствительностью. При диагностическом исследовании проб сыворотки крови пациентов возможны ложноотрицательные результаты, т.к. проведенные исследования показали, что в сыворотке крови микоплазмы выявляются значительно реже, чем в урогенитальном тракте [4].
Для получения сыворотки пробирки с кровью отстаивают в течение 30 минут до полного образования сгустка. Затем центрифугируют при 3000 об/мин в течение 10 минут при комнатной температуре [5]. Предварительная подготовка образцов крови для получения сыворотки (супернатанта) способствует осаждению вместе с форменными элементами крови в неиспользуемый в диагностике осадок и жизненных форм искомых микроорганизмов, что приводит к снижению ценности сыворотки как объекта исследования с целью диагностики М. hominis.
Следовательно, диагностика микоплазменной инфекции не может быть основана на выявлении ДНК в сыворотке крови с помощью ПЦР. В то же время этот метод может оказаться полезным для изучения путей и способов распространения микоплазм в организме, генерализации инфекции и механизмов патогенеза [2]. Так, в сыворотке крови больных с хронической урогенитальной микоплазменной инфекцией, при синдроме хронической усталости и ряде других хронических патологических состояниях удавалось обнаружить ДНК микоплазм и уреаплазм методом ПЦР при отрицательных результатах культурального метода [6].
Выявление ДНК М. hominis из крови высокоинформативно для установления причин хронических, малосимптомных воспалительных заболеваний верхнего и нижнего отделов урогенитального тракта, поражения суставов, что является показателем генерализации инфекции. Однако низкое содержание инфекционного агента в образцах крови требует определенных подходов для повышения информативности метода.
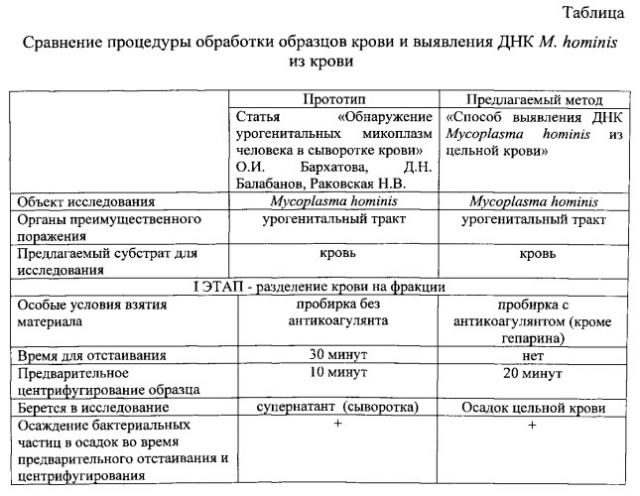
Наиболее близким решением является обнаружение урогенитальных микоплазм (М. hominis) человека в сыворотке крови (супернатанте) методом ПЦР [7]. Аликвоту сыворотки крови 1 мл центрифугировали (предварительное обогащение). К осадку добавляли 100 мкл транспортной среды и выделяли ДНК методом аффинной сорбции (по инструкции [8]).
Амплификацию ДНК проводили в амплификаторе Терцик, а ее детекцию - с помощью электрофоретического анализа в агарозном геле.
Данным способом в сыворотке крови М. hominis была обнаружена в 8% случаев.
Задачей изобретения является усовершенствование метода обнаружения ДНК М. hominis из крови.
Технический результат, который будет достигнут от использования изобретения, заключается в повышении точности диагностики М. hominis.
Технический результат достигается тем, что в способе выделения ДНК М. hominis из образцов крови путем ее разделения центрифугированием на супернатант и осадок, последующее обогащение исследуемого материала, выделение ДНК методом аффинной сорбции с добавлением сорбента и лизирующего буфера, инкубацию, трехкратную отмывку сорбентного осадка центрифугированием и удалением надосадочной жидкости, высушивание сорбентного осадка, добавление раствора для элюции ДНК и детекцию ПЦР-методом, в качестве исследуемого материала используют осадок цельной крови, а его обогащение производят в процессе выделения ДНК путем удвоения числа пробирок на один образец со 100 мкл осадка цельной крови и 20 мкл сорбента, в которые перед третьей отмывкой добавляют по 375 мкл отмывочного раствора, а их содержимое соединяют в одну пробирку и к сорбентному осадку добавляют 40 мкл раствора для элюции ДНК.
Сущность изобретения состоит в определенных подходах, способствующих повышению точности диагностики (детекции) ДНК М. hominis в крови:
1. Выбор в качестве объекта исследования - осадка цельной крови, содержащего наибольшее количество бактериальных частиц.
2. Учитывая биологическую особенность - содержание инфекционного агента в крови в количествах на грани детекции, включен дополнительный этап обогащения образца (исследуемого материала) в процессе выделения ДНК, который позволяет анализировать удвоенное количество осадка цельной крови без снижения эффективности сорбции ДНК на силикогеле и без повышения содержания нежелательных примесей, ингибирующих ПЦР, при этом:
- лизирование образца в присутствии силикогеля в двух отдельных пробирках создает пространственно оптимальные условия прохождения процесса лизиса и способствует эффективной сорбции ДНК и отмывке от ингибиторов;
- 20 мкл раствора сорбента является необходимым и достаточным количеством (подобрано экспериментальным путем) для полной сорбции ДНК, полученной из 100 мкл лизированной цельной крови
- использование отмывочного раствора в количестве 375 мкл подобрано для половинной наполненности пробирки эппендорф (макс. объем 1500 мкл) при соединении раствора сорбента из двух пробирок в одну и не снижает качество третьей отмывки сорбента;
- добавление сорбента в каждую пробирку по 20 мкл (общее количество объема - 40 мкл) и выход сорбированной ДНК в 40 мкл раствора для элюции повышает концентрацию ДНК и вероятность попадания целевой ДНК в реакцию амплификации со специфичными праймерами.
Из анализа научно-технической и патентной литературы использование в качестве исследуемого образца осадка цельной крови и его обогащение перед выделением ДНК М. hominis методом ПЦР заявляемой совокупностью приемов обеспечивает увеличение вероятности попадания ДНК искомого агента в образец, что увеличивает шансы наработки специфической ДНК во время амплификации - т.е. шансы положительного результата при наличии инфекционного агента, т.е. значительного повышения точности диагностики, нами не выявлено, что позволяет сделать вывод о соответствии заявляемого решения критериям «новизна» и «изобретательский уровень».
Изобретение осуществляется следующим образом.
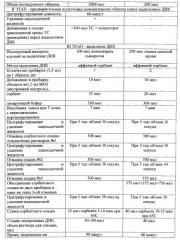
Цельную венозную кровь, взятую в пробирку с антикоагулянтом, центрифугируют при 3000 об/мин в течение 20 минут при комнатной температуре. Затем отбирают всю плазму (супернатант), а осадок берут на исследование методом ПЦР.
Во все пробирки вносят по 20 мкл сорбента и по 100 мкл осадка цельной крови, вортексируют и инкубируют при комнатной температуре 7 минут, постоянно перемешивая. Затем осаждают сорбент центрифугированием при 5 тыс об/мин в течение 30 секунд. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник без фильтра для каждой пары пробирок.
Затем проводят отмывку №1. Для чего добавляют 300 мкл раствора для отмывки №1, перемешивают на вортексе до полного ресуспендирования сорбента. Осаждают сорбент центрифугированием при 5 тыс об/мин в течение 30 секунд. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник без фильтра для каждой пары пробирок. Отмывку №2 проводят с добавлением в пробы по 500 мкл раствора для отмывки №2, перемешивают на вортексе до полного ресуспендирования сорбента. Осаждают сорбент центрифугированием при 5 тыс об/мин в течение 30 секунд. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник без фильтра для каждой пары пробирок. Отмывку №3 проводят с добавлением в пробы по 375 мкл раствора для отмывки №2, перемешивают на вортексе до полного ресуспендирования сорбента. Затем суспензию сорбента из одной пробирки переносят дозатором на 1000 мкл с одноразовым наконечником и фильтром во вторую пробирку образца, тем самым соединяют в одну пробу, содержащую 700 мкл суспензии. Вортексируют. Осаждают сорбент центрифугированием при 5 тыс. об/мин в течение 30 секунд. Удаляют надосадочную жидкость, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы. Пробирку с открытой крышкой, содержащей сорбентный осадок, помещают в термостат при T 65°C на 10-15 минут для его подсушивания.
Затем проводят стадию элюирования ДНК: добавляют 40 мкл раствора для элюции ДНК, перемешивают на вортексе и помещают в термостат при 65°C на 5 минут, периодически встряхивая на вортексе. Центрифугируют пробирку при 12 тыс. об/мин в течение 1 минуты на микроцентрифуге. Сливают надосадочную жидкость в чистую пробирку. ДНК готова к постановке ПЦР. Для выделения ДНК М. hominis из цельной крови в качестве лизирующего, отмывочных растворов, раствора для элюции ДНК могут быть использованы любые наборы на основе силикагеля, предназначенные для выделения ДНК из цельной крови.
Сравнение эффективности выявления ДНК М. hominis заявляемым способом и способом по прототипу представлено в таблице.
Как видно из таблицы, заявляемый способ является более информативным: обеспечивает в среднем в 35 раз больший выход специфической ДНК по сравнению с прототипом, в связи с чем увеличивает шансы положительного результата при наличии инфекционного агента, а следовательно, повышает выделение ДНК M. hominis из осадка цельной крови в 1,2 раза по сравнению с выделением из урогенитального тракта. Таким образом, заявляемый способ может быть использован для выявления ДНК M. hominis в осадке цельной крови с помощью ПЦР с целью диагностики урогенитальных микоплазм.
Литература
1. Ведение больных инфекциями, передающихся половым путем и урогенитальными инфекциями. Клинические рекомендации. Российское общество дерматовенерологов и косметологов. М. 2012. Деловой экспресс. С. 74-78.
2. Тапильская Н.И. Применение Вильпрафена у пациенток с бесплодием и привычным невынашиванием беременности на этапе прегравидарной подготовки / Трудный пациент. - 2010. №1-2. С.13-18.
3. Зигангирова Н.А. Персистенция патогенных микоплазм и ее молекулярно-генетические механизмы / Автореферат дисс. … докт. биол. наук, 2001. 46 с.
4. Балабанов Д.Н. Антигенемия при урогенитальных микоплазменных инфекциях / Автореф. дисс. … канд. мед. наук, Москва, 2009. - 31 с.
5. Методические рекомендации. Забор, транспортировка, хранение клинического материала для ПЦР-диагностики. ЦНИЭ МЗ РФ, Москва, 2003. С.4.
6. Раковская И.В. с соавт. Длительность сохранения жизнеспособных клеток, ДНК и антигенов Mycoplasma hominis и уреаплазм в сыворотке крови человека при 37°C "Клин. лаб. диагностика", 2008, №11, С.40-42.
7. Бархатова О.И. с соавт. "Обнаружение урогенитальных микоплазм человека в сыворотке крови" "Клин. лаб. диагностика", 2008, №3, С.49-51.
8. Инструкция по применению комплекса реагентов для выделения ДНК из клинического материала «ДНК-сорб-В», утверждена Приказом Росздравнадзора от 13.07.09 г. №5535-Пр/09. С.3-4.
Способ выделения ДНК Mycoplasma hominis из крови путем ее разделения центрифугированием на супернатант и осадок, последующее обогащение исследуемого материала, выделение ДНК методом аффинной сорбции с добавлением сорбента и лизирующего буфера, инкубацию, трехкратную отмывку сорбентного осадка центрифугированием и удалением надосадочной жидкости, высушивание сорбентного осадка, добавление раствора для элюции ДНК и детекцию ПЦР-методом, отличающийся тем, что в качестве исследуемого материала используют осадок цельной крови, а его обогащение производят в процессе выделения ДНК путем удвоения числа пробирок на один образец со 100 мкл осадка цельной крови и 20 мкл сорбента в каждой, в которые перед третьей отмывкой добавляют по 375 мкл отмывочного раствора, а их содержимое соединяют в одну пробирку и к сорбентному осадку добавляют раствор для элюции ДНК в количестве 40 мкл.