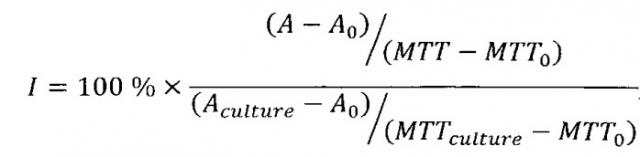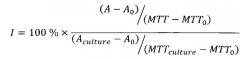Ингибиторы калиевых каналов как лекарственные средства при лимфомах и лейкозах
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, молекулярной генетики и биотехнологии и может быть использовано в медицине, а также в сельском хозяйстве и в промышленной биотехнологии для разработки принципиально нового подхода в противолейкозной терапии с помощью низкомолекулярных соединений, направленных против специфических молекулярных мишеней, к которым относятся молекулы субъединиц потенциалзависимых калиевых каналов семейства Kv. Предложено применение ингибиторов калиевых каналов, выбранных из гидрохлорида дилтиазема, анандамида (арахидонилэтаноламида), гидрохлорида верапамила, линолевой кислоты в качестве средства для усиления апоптоза опухолевых В-клеток хронического лимфолейкоза. Техническим результатом изобретения является создание ингибиторов калиевых каналов, используемых как средство для индукции апоптоза опухолевых В-клеток хронического лимфолейкоза. Технический результат достигается тем, что с помощью низкомолекулярных соединений смоделирован ингибирующий эффект белка KCNRG, который препятствует нормальной сборке белков калиевых каналов, связываясь с областью, отвечающей за их тетрамеризацию, и тем самым подавляя активности каналов. 2 ил., 3 табл.
Реферат
Изобретение относится к области молекулярной биологии, молекулярной генетики и биотехнологии и может быть использовано в медицине, а также в сельском хозяйстве и в промышленной биотехнологии для разработки принципиально нового подхода в противолейкозной терапии с помощью низкомолекулярных соединений, направленных против специфических молекулярных мишеней, к которым относятся молекулы субъединиц потенциалзависимых калиевых каналов семейства Kv.
Известно использование циклоалкильных соединений в качестве ингибиторов функции калиевых каналов. Патент Российской Федерации №2343143, основные коды МПК: С07С 233/59, С07С 233/60, С07С 279/28, С07С 307/08, С07С 311/16, C07D 261/08, C07D 213/82, C07D 271/06, C07D 409/12, C07D 413/12, А61К 031/155, А61К 031/165, А61К 031/415, А61К 031/4427, А61К 031/4245.
Известно описание АТР-чувствительного калиевого канала человеческого или иного происхождения, его производных, а также перечень диагностических или терапевтических средств против заболеваний, связанных с изменением активности данного канала. Патент Российской Федерации №2190663, коды МПК: C12N 15/12, С07К 14/705, С07Н 21/04.
Таким образом, использование калиевых каналов в качестве терапевтических мишеней достаточно интенсивно исследуется в нашей стране. Однако в российском патентном пространстве в качестве мишеней описаны только сами калиевые каналы, а не их белковые ингибиторы, принадлежащие к семейству KCNRG. Примеров использования калиевых каналов в качестве биомаркеров заболеваний человека в российском патентном пространстве не обнаружено.
Техническим и медицинским результатом изобретения является создание ингибиторов калиевых каналов, использующихся в качестве средства для индукции апоптоза опухолевых клеток В-клеточного хронического лимфолейкоза.
Технический результат достигается тем, что с помощью низкомолекулярных соединений был смоделирован ингибирующий эффект белка KCNRG, который препятствует нормальной сборке белков калиевых каналов, связываясь с областью, отвечающей за их тетрамеризациию, и тем самым подавляя активности каналов, с целью дальнейшего их использования в качестве потенциальных лекарственных средств для больных В-клеточным хроническим лимфолейкозом, и на модели В-клеточной линии Raji определены диапазоны эффективных действующих концентраций этих соединений.
Хронический лимфолейкоз является практически неизлечимым, однако, медленно прогрессирующим заболеванием. В отличие от острого миелоидного лейкоза и хронического миелобластного лейкоза, радикальных методов терапии хронического лимфолейкоза на сегодняшний день не существует. Из-за системного характера заболевания радиотерапия при ХЛЛ не применяется. Стандартом терапии являются химиотерапевтические режимы с включением нуклеотидных аналогов, алкилирующих препаратов и моноклональных антител.
Сущность изобретения поясняется на фиг.2 и таблице 3.
Белковый продукт гена KCNRG содержит единственный домен Т1, являющийся N-концевым цитоплазматический доменом, ответственным за тетрамеризацию субъединиц калиевых каналов, открывающихся в зависимости от разности потенциалов на мембране клетки. Потенциалзависимые калиевые каналы (Kv) представляют собой чрезвычайно разнообразную группу. Однако при множественном выравнивании аминокислотных последовательностей каналов, Т1-домен показал высокую гомологию и консервативность, что продемонстрировано на фиг.1, где отображено множественное выравнивание последовательностей Т1-домена, выбранных для анализа потенциалзависимых калиевых каналов, полученное с помощью программного обеспечения ClustalX 1.83.
В таблице 1 приведен полный список ингибиторов/блокаторов и активатора калиевых каналов, включенных в настоящее исследование, а также оптимальные теоретические концентрации для ингибирования калиевых каналов для каждого ингибитора.
В качестве рабочих концентраций, помимо теоретических концентраций, на начальном этапе были выбраны также в 10 раз более и в 10 раз менее концентрированные растворы. Предварительные эксперименты по определению эффективных действующих концентраций были проведены на В-клеточной линии Raji. Культуры клеток, выделенных от больных В-ХЛЛ, обрабатывали выбранными концентрациями указанных соединений. В случае ингибирующего действия на калиевые каналы выбранных веществ, был сделан вывод о том, что эти вещества обладают KCNRG-подобным опухоль-супрессорным действием.
Мононуклеары периферической крови больных В-ХЛЛ выделяли с помощью стандартной методики Ficoll-Hipaque. После троекратной промывки стерильным PBS, клетки помещали в культуральный флакон со средой RPMI-1640, содержащей 2 мМ L-глутамина, 15 мкг/мл гентамицина и 10% бычью эмбриональную сыворотку, в концентрации 1-2 млн клеток/мл. Культура помещалась в СО2-инкубатор при 37°C с атмосферой, насыщенной водяными парами и не менее чем 5% CO2. С учетом специфики проводимых экспериментов (определение цитостатического действия низкомолекулярных соединений в отношении клеток В-ХЛЛ по высокочувствительному измерению активности каспаз 3 и 7), культуру считали «живой» в том случае, если количество живых клеток превышало 70% от исходного (оценивалось по окраске трипановым синим).
Все дальнейшие эксперименты проводили в 24-луночных планшетах. В лунку вносили 2 мл первичной культуры, различные концентрации растворов ингибиторов в конечном объеме 8 мкл, после чего планшет помещали в CO2-инкубатор и инкубировали при 37°C, сильном увлажнении и не менее чем при 7% концентрации CO2. Цитотоксичность ингибиторов оценивалась в случае, когда в положительном контроле (клетки без ингибиторов) оставалось более 70% живых клеток.
Первоначальную оценку цитотоксичности и выбор оптимального диапазона концентраций проводили при помощи визуального подсчета клеток после окраски трипановым синим на клеточной линии Raji, а затем подтвердили на первичных культурах клеток В-ХЛЛ, полученных от больных. Эти эксперименты позволили выделить группу из 10 соединений, действие которых на первичные культуры является наиболее заметным и стабильным. Для этих веществ был определен рабочий диапазон концентраций (см. табл.2).
Чувствительность лимфоцитов периферической крови к воздействиям ингибиторов определяли с помощью теста с МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) и наборов для определения каспазной активности. Показания считывали через 3 и 24 часа после начала инкубации с цитотоксическими веществами.
Клетки после инкубации с цитотоксическими веществами помещали в 96-луночные планшеты. В качестве контроля использовали интактные клетки. Для учета фоновой оптической плотности в лунки вносили ростовую среду без клеток. В каждую лунку вносили 20 мкл раствора МТТ в стандартном фосфатно-солевом буфере в концентрации 5 мкг/мл. Инкубировали в течение 4 часов (в CO2-инкубаторе при 37°C с атмосферой, насыщенной водяными парами и не менее чем 7% CO2), после чего образовавшиеся кристаллы формазана растворяли равным объемом кислого изопропанола, интенсивно перемешивая. Оптическую плотность регистрировали при длине волны 540 нм на оптическом анализаторе Униплан-Пикон (Россия).
Для оценки воздействия выбранных химических ингибиторов на первичные культуры клеток использовался относительный индекс апоптоза I, рассчитываемый по следующей формуле:
,
где А - показание активности каспаз 3 и 7 в образце, А0 - фоновое показание активности каспаз 3 и 7 (без клеток), Aculture - показание активности каспаз 3 и 7 в отрицательном контроле (без добавления блокаторов), МТТ - показание теста МТТ в образце, МТТ0 - фоновое показание теста МТТ (без клеток), MTTculture - показание теста МТТ в отрицательном контроле (без добавления блокаторов).
Если относительный показатель I>100 (например, 200), это означает, что воздействие вещества в данной концентрации приводит к увеличению апоптоза (в примере в два раза). Если индекс I=100, это значит, что вещество не действует на культуру, и интенсивность ее апоптоза не изменяется. Если I<100, это означает, что вещество приводит к уменьшению интенсивности ее апоптоза.
В исследовании участвовало 8 больных В-ХЛЛ и 4 здоровых доноров в качестве контроля. На фиг.2 представлены характеристики выборок индекса апоптоза I в зависимости от исследуемых ингибиторов при трех различных концентрациях.
Целью настоящего исследования был поиск таких ингибиторов, которые бы действовали на культуру клеток от здоровых доноров в меньшей степени (или не действовали вообще), чем на выборку больных. Для выявления подобной закономерности нами был проведен статистический анализ с использованием непараметрического U критерия Манна - Уитни - Уилкоксона для оценки различий между двумя выборками по уровню относительного индекса апоптоза I. Значения критерия Манна - Уитни приведены в таблице 3.
Нулевой гипотезой при анализе было предположение, что выборки больных и здоровых отвечали на воздействия одинаково. Альтернативной гипотезой служило предположение, что данные выборки отличаются друг от друга. Жирным в таблицах выделены ингибиторы, воздействие которых на культуры подтверждает альтернативную гипотезу с вероятностью р<0,05. Такие ингибиторы можно назвать перспективными, то есть приводящими к апоптозу преимущественно культуры клеток больных. Данные ингибиторы могут быть рекомендованы в качестве основы для разработки новых фармацевтических препаратов для лечения В-клеточного хронического лимфолейкоза. Выделенные курсивом потенциально перспективные ингибиторы удовлетворяют критерию Манна - Уитни не в полной мере (с вероятностью р<0,1), однако их показатели могут быть, вероятно, улучшены при увеличении выборок больных и здоровых.
Приведенный выше анализ был проделан на данных, полученных после культивирования культур клеток в присутствии блокаторов калиевых каналов в течение суток.
| Таблица 1 | ||
| № п/п | Название | Теоретически рассчитанные концентрации |
| 1 | хлорид тетраэтиламмония | 560 mM |
| 2 | 4-аминопиридин | 290 µМ |
| 3 | ацетат флекаинида | 217 µМ |
| 4 | нифедипин | 96 µМ |
| 5 | гидрохлорид дилтиазема | 187 µМ |
| 6 | дигидрат гидрохлорида налтрексона | 2 nM |
| 7 | анандамид (арахидонилэтаноламид) | 2.7 µМ |
| 8 | хинин | 14 µМ |
| 9 | гидрохлорид верапамила | 6 µМ |
| 10 | рилузол | 70 µМ |
| 11 | хинидин | 1 mM |
| 12 | гидрохлорид никардипина | 0.8 µМ |
| 13 | гидрохлорид бипувакаина | 4.1 µМ |
| 14 | гидрохлорид амиодарона | 35 µМ |
| 15 | кетоконазол | 500 nM |
| 16 | пимозид | 300 nM |
| 17 | галотан (2-бром-2-хлор-1,1,1 -трифторэтан) | 200 М |
| 18 | 3-изобутил-1-метилксантин | 100 µМ |
| 19 | арахидоновая кислота | 2 µМ |
| 20 | никотин | 40 µМ |
| 21 | линолевая кислота | 280 М |
| 22 | капсаицин | 45 µМ |
| 23 | хлорид бария | 5 mM |
| 24 | фосфат флудабарина | Нет данных |
| 25 | орлистат | Нет данных |
| Таблица 2 | ||
| № п/п | Название | Экспериментально определенный диапазон рабочих концентраций |
| 4 | нифедипин | 30-960 µМ |
| 5 | гидрохлорид дилтиазема | 6-600 µМ |
| 7 | анандамид (арахидонилэтаноламид) | 0,27-27 µМ |
| 9 | гидрохлорид верапамила | 6-600 µМ |
| 10 | рилузол | 70-700 µМ |
| 14 | гидрохлорид амиодарона | 3,5-35 µМ |
| 17 | галотан (2-бром-2-хлор-1,1,1-трифторэтан) | 2-20 М |
| 21 | линолевая кислота | 50-140 М |
| 22 | капсаицин | 20-200 µМ |
| 25 | орлистат | 0,5-5 mg/1 |
| Таблица 3 | |||
| (3.1) Значения критерия Манна-Уитни при концентрации 10х | |||
| Ингибитор | U | z | p-level |
| nifedipine | 15,00 | 0,17 | 0,87 |
| diltiazem hydrochloride | 5,00 | 1,87 | 0,06 |
| anandamide | 1,00 | 2,55 | 0,01 |
| verapamil hydrochloride | 12,00 | 0,68 | 0,50 |
| riluzole | 14,00 | 0,34 | 0,73 |
| amiodarone hydrochloride | 12,00 | 0,68 | 0,50 |
| linoleic acid | 9,00 | 1,39 | 0,16 |
| capsaicin | 8,00 | 1,36 | 0,17 |
| fludarabine phosphate | 4,00 | 1,89 | 0,06 |
| orlistat | 3,00 | 2,08 | 0,04 |
| (3.2) 3начения критерия Манна-Уитни при концентрации 1х | |||
| Ингибитор | U | Z | p-level |
| nifedipine | 9,00 | 1,19 | 0,23 |
| diltiazem hydrochloride | 1,00 | 2,55 | 0,01 |
| anandamide | 16,00 | 0,00 | 1,00 |
| verapamil hydrochloride | 2,00 | 2,38 | 0,02 |
| riluzole | 6,00 | 1,70 | 0,09 |
| amiodarone hydrochloride | 12,00 | 0,68 | 0,50 |
| linoleic acid | 10,00 | 0,76 | 0,45 |
| capsaicin | 14,00 | 0,00 | 1,00 |
| fludarabine phosphate | 12,00 | -0,38 | 0,71 |
| orlistat | 4,00 | 1,89 | 0,06 |
| (3.3) Значения критерия Манна-Уитни при концентрации 0,1х | |||
| Ингибитор | и | Z | p-level |
| nifedipine | 5,00 | 1,87 | 0,06 |
| diltiazem hydrochloride | 4,00 | 2,04 | 0,04 |
| anandamide | 9,00 | 1,19 | 0,23 |
| verapamil hydrochloride | 4,00 | 2,04 | 0,04 |
| riluzole | 13,00 | 0,51 | 0,61 |
| amiodarone hydrochloride | 6,00 | 1,70 | 0,09 |
| linoleic acid | 4,00 | 2,04 | 0,04 |
| capsaicin | 14,00 | 0,00 | 1,00 |
| fludarabine phosphate | 12,00 | 0,38 | 0,71 |
| orlistat | 4,00 | 1,89 | 0,06 |
Применение ингибиторов калиевых каналов, выбранных из гидрохлорида дилтиазема, анандамида (арахидонилэтаноламида), гидрохлорида верапамила, линолевой кислоты, в качестве средства для усиления апоптоза опухолевых В-клеток хронического лимфолейкоза.