Биоактивный резорбируемый пористых 3d-матрикс для регенеративной медицины и способ его получения
Иллюстрации
Показать всеИзобретение относится к медицине. Биоактивный пористый 3D-матрикс для тканевой инженерии включает резорбируемый частично-кристаллический полимер с пористостью 60-80% и размером пор от 2 до 100 мкм. В часть пор инкорпорирован биополимерный гель с размером частиц 30-100 мкм. Соотношение полимер/гель составляет от 99:1 до 50:50 мас.%. Для получения матрикса растирают смесь геля и порошка полимера со средним размером частиц 100 мкм и наполняют приготовленной смесью предварительно обработанные пресс-формы, которые затем помещают в камеру высокого давления, где повышают сначала температуру до 25-40°C, а затем давление CO2 до 4,0-25,0 МПа. Систему выдерживают в указанных условиях 1 час, после чего в течение 30-120 минут сбрасывают давление в камере до атмосферного значения, понижают температуру до комнатной и извлекают образцы. Технический результат заключается в обеспечении универсальности применения матрикса в различных органах и системах, в отсутствии токсичности, в повышении способности к стимуляции регенерации тканей, в увеличении длительности проявления эффекта биостимуляции. 2 н. и 4 з.п. ф-лы, 5 пр., 1 табл., 4 ил.
Реферат
Изобретения относятся к области медицины, в частности к заместительной и регенеративной медицине, и могут быть использованы в тканевой инженерии и при замещении дефектов костных и мягких тканей в качестве биоактивного резорбируемого пористого 3D-матрикса (БРПМ).
Фундаментальной проблемой современной клинической трансплантологии является повсеместная нехватка донорских органов, которая, согласно прогнозам на ближайшие годы, будет только увеличиваться.
В последние годы при поиске альтернативных способов компенсации или замены поврежденных жизненно важных органов и тканей основной акцент в решении этих проблем делается на использование технологий регенеративной клеточной медицины [Atala A., Lanza R., Thompson J., Nerem R., Principles of regenerative medicine. Academic Press is an imprint of Elsevier, First edition, 2008, 1473 p.].
Технологии регенеративной клеточной медицины можно разделить на три группы:
- клеточная терапия - использование стволовых клеток или сигнальных биомолекул для стимуляции процессов регенерации тканей;
- биостимуляция регенерации тканей пациента с помощью биоактивных биополимерных материалов;
- тканевая инженерия - тканеинженерные конструкции (ТИК) органов и тканей.
В свою очередь, ТИК включают в себя следующие компоненты:
- аутологичные или аллогенные клетки, способные формировать функционирующий внеклеточный матрикс;
- подходящий биодеградируемый носитель (матрикс, каркас) для трансплантации клеток;
- биоактивные молекулы (цитокины, факторы роста), которые оказывают стимулирующее действие на клетки поврежденной ткани [Plase E.S., Evans D.N., Stevens M.M., Complexity in biomaterials for tissue engineering, Nature Materials, 2009, 8, pp.457-470; Севастьянов В.И., Перова H.B., Немец E.A., Сургученко В.А., Пономарева А.С., Примеры экспериментально-клинического применения биосовместимых материалов в регенеративной медицине. В книге: Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., Часть II, глава 3, с.237-252].
Трехмерные биорезорбируемые пористые матриксы являются сегодня базовыми элементами в заместительной и регенеративной медицине, обеспечивающими организацию и поддержание роста, пролиферацию и дифференцировку мультипотентных стромальных клеток в процессе формирования определенных типов живых тканей [Хенч Л., Джонс Д. Биоматериалы, искусственные органы и инжиниринг тканей. Серия «Мир биологии и медицины», Москва, Техносфера, 2007, 305 с.]. Они способствуют локализации клеток в области имплантации, одновременно являясь их носителем и действуя как аналог естественного внеклеточного матрикса (ВКМ) [Шумаков В.И., Севастьянов В.И. Биополимерные матриксы для искусственных органов и тканей. Здравоохранение и медицинская техника. 2003, №4, с.30-33].
Одной из основных проблем разработки и создания ТИК с необходимыми физико-химическими и биологическими свойствами является выбор материалов и технологий формирования трехмерных биорезорбируемых пористых матриксов требуемой архитектоники [Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., 544 стр.]. К материалам, предназначенным для имплантации в живой организм, предъявляются жесткие и разнообразные требования. В первую очередь - это биологическая совместимость. Материал не должен провоцировать недопустимого клеточного ответа, проявлять иммуногенность и токсичность. Механические свойства материала должны соответствовать характеристикам заменяемой ткани. Материал должен обеспечивать механическую прочность и устойчивость структуры в процессе имплантации, а затем и при ремоделировании ткани. Как и все материалы, контактирующие с человеческим телом, материалы матриксов должны быть легко стерилизуемы для предотвращения занесения и распространения инфекции.
Матриксы для ТИК изготавливают из материалов синтетического и природного происхождения (металлы и их сплавы, синтетические полимеры, керамика, биостекла, композитные материалы, хитозан, коллаген, желатин, эластин, фибронектин, альгинат и др.) с соответствующими медико-техническими характеристиками [Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., 544 стр.]. Матриксы также могут быть получены из биологических тканей определенных типов посредством удаления из них иммуногенных компонентов с сохранением исходной трехмерной структуры [Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., 544 стр.].
Использование биорезорбируемых полимеров для формирования матриксов особенно привлекательно. В современной литературе используется несколько терминов, характеризующих степень и механизм деградации полимерных материалов. Согласно определению М. Верта [Vert М, Li M.S,. Spenlehauer G, Guerin P., Bioresorbability and biocompatibility of aliphatic polyesters, J. Mater. Science: Mater. Med., 1992, 3, 432-436], к биодеградируемым относятся твердые полимерные материалы, которые распадаются при взаимодействии с биологическими системами на низкомолекулярные фрагменты в результате макромолекулярной деградации, рассеиваясь в живых тканях и, как правило, оставаясь в них в виде побочных продуктов. К биорезорбируемым относятся полимеры, которые растворяются в организме и затем полностью им поглощаются в результате биохимических реакций или процессов метаболизма. Таким образом, биорезорбция приводит со временем к исчезновению инородного тела (имплантата) без каких-либо побочных эффектов.
Имплантируемый матрикс из биорезорбируемого материала действует как временный каркас, способствующий формированию зрелой ткани. При этом скорость резорбции материала матрикса должна коррелировать определенным образом со скоростью регенерации ткани в каждом конкретном случае. Этот процесс, в идеале, должен приводить к формированию новых тканей требуемых типов, полностью интегрированных с тканями организма, существовавшими ранее.
Суммируя сказанное, матриксы для ТИК должны обладать следующими принципиально важными свойствами:
- многофункциональностью (выполнять одновременно функции каркаса, подложки и питательной среды для клеточных культур);
- механической прочностью и эластичностью, достаточной для хирургических манипуляций;
- биосовместимостью на белковом и клеточном уровне;
- способностью стимулировать пролиферацию и дифференциацию клеток;
- пористой структурой, обеспечивающей процессы неоваскуляризации;
- возможностью стерилизации стандартными способами без изменения их физико-химических и биохимических характеристик.
Широкое распространение получили биорезорбируемые матриксы на основе биополимерных материалов и синтетических резорбируемых полимеров.
Среди природных материалов следует обратить внимание на коллаген, являющийся основным компонентом внеклеточного матрикса, его денатурированную форму - желатин, альгинат (природный полисахарид), имеющий сходство с гликокомпонентами внеклеточного матрикса, раствор которого способен образовывать гидрогели в присутствии двухвалентных ионов, а также хитозан и гиалуроновую кислоту. [Сургученко В.А., Матриксы для тканевой инженерии и гибридных органов. В книге: Биосовместимые материалы. Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., Часть II, глава 1, с.199-228; Хенч Л., Джонс Д., Биоматериалы, искусственные органы и инжиниринг тканей. Серия «Мир биологии и медицины», Москва, Техносфера, 2007, 305 с.].
Коллаген обладает исключительно слабыми антигенными свойствами, также обладает чрезвычайно слабыми анафилактогенными и токсическими свойствами. Однако, наряду с перечисленными преимуществами, серьезным недостатком коллагеновых матриксов является нерегулируемое время биодеградации и ограниченный срок функционирования коллагеновых изделий (до 1 месяца) в условиях живого организма, что недостаточно для полного восстановления и приводит к формированию рубцовой ткани.
Для уменьшения скорости биодеградации были разработаны способы формирования гетерогенной надмолекулярной структуры гидрогелей, содержащих основные компоненты внеклеточного матрикса сельскохозяйственных животных [Патент РФ №2249462, Патент РФ №2433828].
Основным недостатком биополимерных гидрогелевых материалов является невозможность создания из них каркасов заданной конфигурации с необходимыми физико-механическими свойствами.
Среди синтетических биодеградируемых материалов широко используют полимеры и сополимеры молочной и гликолевой кислот, поликапролактон, полипропиленфумарат, моноангидриды, полиортоэфиры и др. [Сургученко В.А., Матриксы для тканевой инженерии и гибридных органов. В книге: Биосовместимые материалы. Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., Часть II, глава 1, с.199-228., Vert M, Li M.S,. Spenlehauer G, Guerin P., Bioresorbability and biocompatibility of aliphatic polyesters, J. Mater. Science: Mater. Med., 1992,. 3,. 432-436].
Анализируя результаты большого количества различных экспериментальных работ, посвященных изучению процессов взаимодействия описанных выше полимерных соединений с живой тканью, можно получить представление о средних сроках их биорезорбции в организме [Hutmacher D., Markus M.S., Hurzeler В., Schliephake H., A review of material properties of biodegradable and bioresorbable polymers and devices for GTR and GBR applications. Intern. J Oral&Maxillofacial Implants, 1996, v.11, pp.667-678]:
| 1. поли(L-лактид) | 18-36 месяцев |
| 2. поли(D,L-лактид) | 4-6 месяцев |
| 3. полигликолид | 3-4 месяца |
| 4. поли(D,L-лактид-гликолид) (50:50) | 2-4 месяца |
| 5. поли(D,L-лактид-гликолид) (85:15) | 2-3 месяца |
| 6. поли(D,L-лактид-ε-капролактон) (90:10) | 2-3 месяца |
Основным недостатком синтетических алифатических полимеров является их высокая гидрофобность, что отрицательно влияет на их взаимодействие с клеточными культурами. Кроме того, слабо выраженные биоактивные свойства полилактидов и их сополимеров относительно пролиферации клеток и регенерации тканей существенно ограничивают их применения в заместительной и регенеративной медицине.
Аналогами изобретений заявляемой группы можно считать различные коллагенсодержащие вещества, биокомпозиции и способы их получения, которые могут использоваться для хирургических и биопластических целей: например, способ получения средства, стимулирующего репаративные процессы (патент РФ №2065745, 1996 г.); ранозаживляющее покрытие (патент РФ №2085217, 1997 г.), материал для пластики тканей (патент РФ №2137441, 1999 г.), армированный трансплантат для склеропластических операций (патент РФ №2140242, 1999 г.), антиадгезионный агент (патент РФ №2155592, 2000 г.), биосовместимый полимерный материал и способ его получения (патент РФ №2162343, 2001 г.), коллагенсодержащий материал для кератинопластики (патент США №6197330, 2001 г.), пористый композиционный хитозан-желатиновый матрикс для заполнения костных дефектов (патент РФ №2421229, 2010 г.).
В перечисленных разработках содержится в основном описание использования гомогенного коллагена и его денатурированной формы желатина в комбинации с резорбируемыми или биостабильными полимерами.
В качестве наиболее близкого аналога (прототипа), как в части БРПМ, так и в части способа его получения можно рассмотреть патент РФ №2464987, где речь идет о способе получения резорбируемой полилактидной матрицы для культивирования и имплантации клеток, предназначенных для заживления ран.
Известный способ-прототип предполагает получение резорбируемой гидрофильной пористой полилактидной матрицы, равномерно покрытой микрофибриллярным коллагеном 1-го типа. Предварительно получают гидрофобную пористую полилактидную матрицу толщиной от 13 мкм до 15 мкм и диаметром пор от 2 мкм до 3 мкм. Затем проводят нанесение на гидрофобную пористую полилактидную матрицу 0,01%-ного раствора коллагена 1-го типа в 0,1%-ной уксусной кислоте, инкубируют в течение 30 минут при комнатной температуре, далее поверхность матрицы промывают фосфатно-солевым буфером pH 7,4 для удаления несвязавшегося с субстратом белка. Данную процедуру проводят двукратно. Гидрофильную поверхность пористой полилактидной матрицы, равномерно покрытую микрофибриллярными структурами коллагена диаметром от 10 нм до 20 нм, используют для культивирования кератиноцитов человека.
Основными недостатками этого способа получения пористого композиционного матрикса являются:
- использование токсичного органического растворителя (хлорид метилена) при создании полилактидной матрицы;
- ограниченные возможности для применения в качестве ТИК, так как получаемые резорбируемые матрицы из полилактида и коллагена I типа (толщина не более 15 мкм, диаметр пор 2-3 мкм) не предназначены для использования в качестве 3D-матриксов в тканеинженерных конструкциях, за исключением ТИК кожи;
- слабо выраженные регенераторные свойства из-за использования только одного компонента ВКМ - коллагена I типа.
Существуют различные технологии изготовления высокопористых (60-90 объемных %) биосовместимых матриксов (носителей, каркасов) для тканевой инженерии: метод ультрадиспергирования гидрогелей с последующей сшивкой; нетканое связывание полимерных нитей; метод выщелачивания; порообразование с использованием газов; методы с фазовым разделением; электроспиннинг; метод биопринтирования; формирование пористых матриксов с помощью технологий сверхкритических флюидов (СКФ) [Василец В.Н. Методы изготовления матриксов. В книге: Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., Часть II, глава 2, с.229-236].
Однако при анализе научно-технической литературы нам не удалось найти сведения о БРПМ, представляющем собой композиционный материал из синтетического частично-кристаллического полимера медицинского назначения и инкорпорированного в часть его пор биополимерного гетерогенного геля, который можно было бы использовать в качестве универсальной ТИК для заместительной и регенеративной медицины различных органов и систем. Соответственно в уровне техники отсутствуют сведения о способе получения такого БРПМ.
Нами поставлена задача создать твердотельный БРПМ с высокими биостимулирующими свойствами, который может быть использован в качестве универсальной ТИК в регенеративной и заместительной медицине различных органов и систем.
Технический результат, достигаемый при использовании предлагаемой группы изобретений, заключается:
- в обеспечении универсальности применения созданного БРПМ в ТИК различных органов и систем за счет 1) сочетания положительных свойств резорбируемых полимеров - получение материала с требуемыми физико-механическими и биохимическими свойствами, и биополимерных гелей - гидрофильность, выраженная биостимуляция тканей, 2) возможности получения БРПМ любого размера и формы, 3) использования в качестве исходного сырья широкого ряда синтетических полимеров; 4) формирования на поверхности пор матрикса гидрофильно-гидрофобной структуры, имитирующей гидрофильно-гидрофобную поверхность клеточных мембран;
- в отсутствии токсичности полученного БРПМ за счет исключения действия токсичных органических растворителей и удаления растворимых в сверхкритическом CO2 (ск-CO2) токсичных соединений;
- в повышении способности к стимуляции регенерации тканей организма за счет использования в составе матрикса биоактивной гелевой компоненты;
- в увеличении длительности проявления эффекта биостимуляции за счет меньшей скорости резорбции одной из компонент БРПМ -гетерогенного геля.
Предлагаемый способ сопровождается удалением растворимых в ск-CO2 токсичных соединений (непрореагировавшие мономеры и низкомолекулярные олигомеры, инициаторы полимеризации, пластификаторы и т.д.), что способствует повышению биосовместимости формирующегося матрикса.
Важно отметить, что формирование матриксов в нашем способе проводится при температурах, близких к комнатной, что и позволяет использовать в качестве гелевой компоненты термолабильный биологически активный биополимерный гетерогенный гель, и не требует применения дополнительных органических растворителей. Кроме того, ск-CO2 легко и практически без остатка удаляется из полимера после завершения процесса простым сбросом давления ниже критического значения.
Сущность предлагаемой группы изобретений заключается в следующем.
БРПМ для тканевой инженерии представляет собой композиционный материал из резорбируемого синтетического частично-кристаллического полимера медицинского назначения в виде 3D-матрикса и биополимерного гетерогенного геля. Пористость БРПМ составляет от 60 до 90%, а размер пор колеблется в диапазоне от 2 до 100 мкм. При этом биополимерный гетерогенный гель с размером частиц 30-100 мкм, модулем вязкости 15-70 Па и модулем упругости 45-1200 Па инкорпорирован в часть пор. Соотношение полимер/гель составляет от 99:1 до 50:50 масс.%, значение контактного угла смачивания поверхности матрикса по воде - от 60 градусов до 20 градусов, соответственно. В частном случае биополимерный гетерогенный гель включает функциональную добавку, выбранную из группы: гидроксиапатиты, факторы роста, цитокины, антиоксиданты или их смеси. Способ получения патентуемого биоактивного резорбируемого пористого 3D-матрикса для тканевой инженерии включает следующие операции. Механически растирают смесь порошка резорбируемого синтетического частично-кристаллического полимера медицинского назначения со средним размером частиц 100 мкм и биополимерный гетерогенный гель в соотношении полимер/гель от 99:1 до 50:50 мас.%. Наполняют приготовленной смесью пресс-формы. Предварительно пресс-формы обезжиривают и очищают в ск-CO2 при температуре 60°C, давлении 20 МПа в течение 1 часа. Наполненные пресс-формы помещают в камеру высокого давления, где повышают сначала температуру до 25-40°C, а затем - давление CO2 до 4,0-25,0 МПа. Систему выдерживают в этих условиях 1 час. После чего в течение 30-120 минут сбрасывают давление в реакционной камере до атмосферного значения, а затем понижают температуру до комнатной и извлекают образцы.
В частном случае образцы стерилизуют γ-облучением в дозе 15 кГр.
В частном случае порошок полимера представляет собой сополимер полилактогликолида марки PDLG7507 с размером частиц от 50 до 200 мкм.
В частном случае биополимерный гетерогенный гель содержит фукциональную добавку, выбранную из группы, включающей гидроксиапатиты, факторы роста, цитокины, антиоксиданты или их смеси.
Существо изобретений поясняется на следующих фигурах:
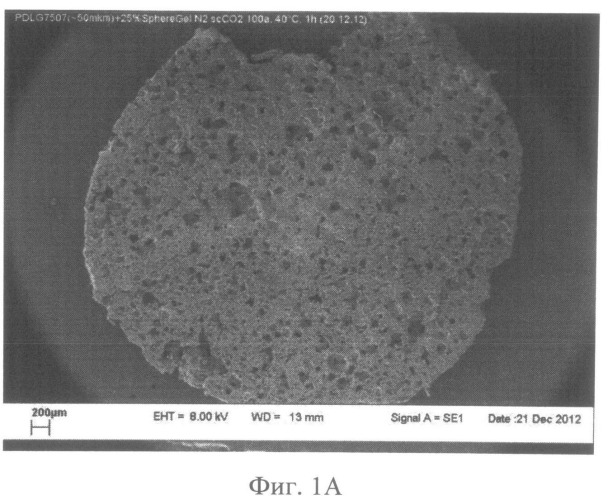
фиг.1А - общий вид микроструктуры резорбируемого пористого матрикса из PDLG7507. Сканирующий электронный микроскоп JSM-6360 LA (Jeol, Япония), маркер - 200 мкм.
фиг.1Б - детальная микроструктура резорбируемого пористого 3-D матрикса из PDLG7507, демонстрирующая распределение пор по размеру. Сканирующий электронный микроскоп JSM-6360 LA (Jeol, Япония), маркер - 100 мкм;
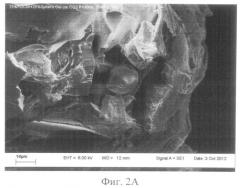
фиг.2А - общий вид микроструктуры биоактивного резорбируемого пористого 3-D матрикса из PDLG7507 и гетерогенного биополимерного геля (Сферогель). Сканирующий электронный микроскоп JSM-6360 LA (Jeol, Япония), маркер - 100 мкм;
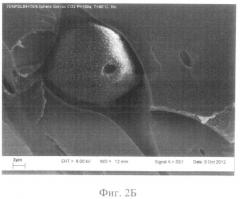
фиг.2Б - детальная микроструктура биоактивного резорбируемого пористого 3-D матрикса из PDLG7507 и гетерогенного биополимерного геля (Сферогель), иллюстрирующая наличие свободных пор и пор, заполненных биополимерным гелем. Сканирующий электронный микроскоп JSM-6360 LA (Jeol, Япония), маркер - 2 мкм;
фиг.3 - результаты исследования метаболической активности фибробластов мыши линии NIH 3T3, адгезированных на поверхности резорбируемого пористого 3-D матрикса из PDLG7507 и биоактивного резорбируемого пористого 3-D матрикса из PDLG7507 и гетерогенного биополимерного геля (Сферогель).
фиг.4 - результаты реакции тканей, прилегающих к имплантату (место имплантации) на 14 сутки после подкожной имплантации резорбируемого пористого 3-D матрикса из PDLG7507 и биоактивного резорбируемого пористого 3-D матрикса из PDLG7507 и гетерогенного биополимерного геля (Сферогель). А - контроль (PDLG7507), Б - образцы БРПМ, где 1 - фрагменты пористого матрикса; 2 - пролиферирующие фибробластоподобные клетки мыши. Окрашивание гематоксилином и эозином. Оптический микроскоп. Увеличение 400.
Заявляемый способ получения предлагаемого нами БРПМ осуществляют следующим образом.
В качестве исходных резорбируемых полимерных материалов могут использоваться любые резорбируемые синтетические частично-кристаллические полимеры, предназначенные для биомедицинских исследований и клинических применений. К ним, в частности, относятся:
- алифатические полиэфиры, включая полимолочные и полигликолиевые кислоты, а также их сополимеры, сополимеры полимолочной и полигликолиевых кислот с полиэтиленгликолем (ПЭГ), поликопролактоны (такие как, поли-ε-капролактон и поли-γ-капролактон), поли-p-диоксанон, полидиоксепанон, полипропилен фумарат и др.;
- полифосфазены, включая полидихлорфосфазены, полиорганофосфазены и др.;
- алифатические полиангидриды;
- полиакрилаты, включая полиэтилметакрилат и их сополимеры;
- поливинилы, включая поливинилацетат, поливиниловый спирт и их сополимеры, поливинилпиролидон и др.;
- полиаминокислоты.
Вышеперечисленные полимеры могут быть использованы для создания трехмерных пористых матриксов с помощью технологий сверхкритических флюидов.
В качестве порошка полимера может быть выбран, например, сополимер полилактогликолида марки PDLG7507 с размером частиц от 50 до 200 мкм.
Биоактивной гидрофильной составляющей матрикса может быть, например, инъекционная композиция гетерогенного имплантируемого геля Сферо®ГЕЛЬ (производства ЗАО «БИОМИР сервис», Москва), обладающая ярко выраженными биостимулирующими свойствами и разрешенная к клиническому применению (№ ФСР 2012/13033 от 01.02.2012 г.).
В порошок синтетического резорбируемого частично-кристаллического полимера добавляют биополимерный гетерогенный гидрогель с последующим механическим растиранием смеси. Механическое растирание может быть выполнено, например, в агатовой или форфоровой ступке.
Предварительно обезжиренные и очищенные в ск-CO2 при 60°C и 20 МПа в течение одного часа пресс-формы заполняют приготовленной смесью.
Наполненные пресс-формы помещают в камеру высокого давления, где повышают сначала температуру до 25-40°C, а затем - давление CO2 до 4,0-25,0 МПа. Систему выдерживают в этих условиях 1 час, после чего в течение 30-120 минут сбрасывают давление в реакционной камере до атмосферного значения, а затем понижают температуру до комнатной и извлекают образцы.
В качестве камеры высокого давления могут быть использованы, например, установки по СКФ синтезу [Попов В.К., Имплантаты в заместительной и регенеративной медицине костных тканей. В книге: Биосовместимые материалы (учебное пособие). Под ред. В.И. Севастьянова и М.П. Кирпичникова. Изд-во «МИА», М., 2011 г., Часть II, глава 4, с.253-294].
Образцы стерилизуют γ-облучением в дозе 15 кГр.
Для радиационной стерилизации применяют:
- радиационно-технологические установки (РТУ) с ускорителями электронов промышленного назначения с максимальной энергией до 10 МэВ;
- радиационно-технологические установки с радионуклидными источниками ионизирующего излучения закрытого типа 60Co.
Радиационную стерилизацию проводят в соответствии с ГОСТ Р 50325-92 «Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации» и МИ 2548-99 «ГСИ. Установки радиационно-технологические с радионуклидными источниками для стерилизации изделий медицинского назначения. Методика аттестации» или МИ 2549-99 «ГСИ. Установки радиационно-технологические с ускорителями электронов для стерилизации изделий медицинского назначения. Методика аттестации». Факт облучения изделий подтверждают цветовыми индикаторами поглощенной дозы, которые должны соответствовать требованиям ГОСТ Р ИСО 11140-1-2000 «Стерилизация медицинской продукции. Химические индикаторы. Часть 1. Общие требования, контроль процесса стерилизации должен проводиться по ГОСТ Р ИСО 13485-2004, ГОСТ Р 50325-92, ГОСТ Р ИСО 11137-1-2008, ГОСТ Р ИСО 11137-3-2008.
Биополимерный гетерогенный гель может содержать функциональную добавку, выбранную из группы водорастворимых биологически активных веществ, включающей факторы роста, цитокины, антиоксиданты или их смеси, например, наноразмерный порошок гидроксапатита, фактор некроза опухоли, инсулино-подобные факторы роста (ИФР-1 и ИФР-2), факторы роста фибробластов, дигидрокверцетин, которые перед механическим смешиванием полимерной и гидрогелевой компонент растворяют или диспергируют в определенных соотношениях в гидрогелевой фазе.
Для изготовления образцов определенной конфигурации использовали тефлоновые пресс-формы заданного размера. Например, для изготовления трехмерных образцов в форме дисков могут быть использованы пресс-формы, состоящие из набора сплошных фторопластовых дисков толщиной 2 мм, а также дисков толщиной 6 мм с отверстиями диаметром 5 мм, расположенными концентрически относительно центра, которые нанизывают попеременно на шпильку, изготовленную из нержавеющей стали с резьбой на торцах. Для одновременного получения нескольких образцов пресс-формы собирали в обойму, состоящую из 8 пресс-форм.
Обойму из нескольких пресс-форм помещают в камеру высокого давления установки для СКФ обработки полимерных материалов.
Камеру закрывают, уплотняют и проверяют на герметичность, напуская в нее диоксид углерода и постепенно повышая его давление до 5,5 МПа (исходное давление в баллоне с CO2) при комнатной температуре (~20°C). Затем включают нагреватель и повышают температуру системы до 25-40°C. По достижении заданной температуры повышают давление CO2 до 4,0-25,0 МПа и выдерживают систему в этих условиях 1 час. После этого, в течение 30-120 минут сбрасывают давление в реакционной камере до атмосферного значения, а затем понижают температуру до комнатной и извлекают образцы.
Для доказательств возможности реализации заявленных назначений и достижения указанного технического результата приводим следующие данные.
ПРИМЕР 1.
В частном конкретном случае осуществления предлагаемого изобретения получают БРПМ для тканевой инженерии следующим образом. В агатовой ступке агатовым пестиком растирали смесь: порошок сополимера полилактогликолида марки PDLG7507 (лактид/гликолид = 75:25, Mw~20 кДа и Mw~100 кДа, соответственно) со средним размером частиц 100 мкм и композицию гетерогенного имплантируемого геля Сферогель со средним размером частиц 150 мкм, модулем вязкости 15-70 Па и модулем упругости 45-1200 Па в соотношении полимер:гель, равным 75:25 масс.%. При этом размер частиц Сферогеля предварительно уменьшали до 30-100 мкм. Приготовленной смесью наполняли предварительно обезжиренные и очищенные в сверхкритическом CO2 (60°C, 20 МПа, 1 ч) пресс-формы (внутренний диаметр 5 мм и высота 2 мм) с последующим помещением обоймы из нескольких пресс-форм в камеру высокого давления установки по СКФ синтезу. Для этого камеру закрывали, уплотняли и проверяли на герметичность, напуская в нее диоксид углерода и постепенно повышая его давление до 5,5 МПа (исходное давление в баллоне с CO2) при комнатной температуре (~20°C). Часть газа стравливали для окончательной продувки и очистки кюветы от атмосферы воздуха. Затем включали нагреватель и повышали температуру системы до заранее выбранного значения температуры - 40°C. По достижении заданной температуры, повышали давление CO2 до значения 25,0 МПа и выдерживали систему в этих условиях 1 час. После этого, в течение 30 минут постепенно сбрасывали давление до атмосферного значения и оставляли остывать смесь в камере до комнатной температуры, затем извлекали образцы в виде пористых дисков правильной цилиндрической формы диаметром 5 мм и высотой 2 мм.
Аналогично получали резорбируемый пористый 3D-матрикс только из порошка сополимера полилактогликолид марки PDLG7507, который служил в качестве контроля. Все исследуемые образцы БРПМ и контроля стерилизовали γ-облучением в дозе 15 кГр.
Микрофотографии структуры поверхности образцов резорбируемого пористого матрикса из полилактогликолида (контроль) и БРПМ представлены на Фиг.1А, Б и 2А, Б, соответственно.
Все образцы имеют равномерную пористость от 60% до 90%, с размером пор в диапазоне от 2 мкм до 100 мкм. Пористость полученных образцов определяли по формуле Ω=1-m/m0, где m - масса пористого образца, а m0 - масса монолитного (исходного) полимера равного объема плотностью ρ=1,21 г/см3.
Значения контактного угла смачивания по воде, измеренные на установке для измерения краевых углов САМ 101 (KSV Instruments, Германия) для БРПМ и контроля, были равны (36±14)° и (68±9)°, соответственно.
ПРИМЕР 2.
Испытания в условиях in vitro цитотоксичности заявляемого БРПМ.
На культуре фибробластов мыши линии NIH 3T3 исследовали цитотоксичность трех образцов (шифр №№1, 2, 3) пористых полимерных дисков в виде дисков диаметров 5 мм и высотой 2 мм, изготовленных по способу, изложенному в Примере 1. В качестве контроля были образцы той же формы, изготовленные из полилактогликолида марки PDLG7507 тем же способом. Отрицательным контролем служила культуральная среда DMEM, не содержащая сыворотку, положительным - стандартный раствор цинка в азотной кислоте (Zn 1-2 wt. % HNO3, разведение 1:200 раствором 0,9% NaCl для инъекций).
Испытания на цитотоксичность проведены в соответствии с:
- ГОСТ Р ИСО 10993.1-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования»
- ГОСТ Р ИСО 10993.5-99 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 5. Исследование на цитотоксичность: методы in vitro».
Результаты исследования показали (Таблица), что все образцы предлагаемого нами БРПМ (n=3) в условиях данного эксперимента не оказывают цитотоксического действия на культуру фибробластов мыши линии NIH 3T3.
| Таблица | ||
| Степень ответной реакции фибробластов мыши линии NIH 3T3 на исследуемый образец | ||
| Образец | Реакция | Выводы |
| БРПМ (n=3) | Отсутствует | Не цитотоксично |
| Отрицательный контроль | Отсутствует | Не цитотоксично |
| Положительный контроль | Резкая | Цитотоксично |
ПРИМЕР 3.
Испытания в условиях in vitro матриксных свойств БРПМ.
На культуре фибробластов мыши линии NIH 3T3 исследовали матриксные свойства БРПМ дисков в виде дисков диаметров 5 мм и высотой 2 мм, изготовленных по способу, изложенному в Примере 1. В качестве контроля были образцы той же формы, изготовленные из полилактогликолида марки PDLG7507 тем же способом. Под матриксными свойствами исследуемых образцов подразумевается способность поддерживать прикрепление и пролиферацию фибробластов мыши линии NIH 3T3, т.е. биостимулирующие свойства образцов.
В асептических условиях фибробласты мыши линии NIH 3T3 высевали на поверхность образцов в концентрации 1×105/образец, инкубировали в течение 2 ч при температуре 37°C в стандартных условиях: влажной атмосфере, содержащей (5±1) % CO2, давая клеткам проникнуть внутрь пор и прикрепиться, после чего помещали образцы в микропробирки, содержащие полную ростовую среду (ПРС).
Образцы с клетками инкубировали при температуре 37°C, во влажной атмосфере, содержащей 5±1% CO2. Через 24 ч, 48 ч, 72 ч и 96 ч оценивали метаболическую активность клеток с помощью витального реагента prestoBlue® (Invitrogen™, USA).
Результаты исследования метаболической активности фибробластов мыши линии NIH 3T3 представлены на Фиг.3, на котором приведены данные, характеризующие метаболическую активность фибробластов мыши линии NIH 3T3 после посева на образцы контроля и БРПМ (∗ - достоверные различия, p<0,05).
Из сравнения двух кривых (Фиг.3) видно, что через 24 ч метаболическая активность фибробластов мыши, характеризующая количество адгезировавших клеток в первые часы инкубации, достоверно больше для БРПМ. На последующих сроках культивирования клеток на образцах метаболическая активность фибробластов мыши, пропорциональная их пролиферативной активности, достоверно (p<0,5) выше для образцов БРПМ по сравнению с контролем, что доказывает биоактивные свойства предлагаемого композиционного матрикса (увеличение количества адгезированных клеток и повышение скорости их пролиферации), обусловленные наличием в его составе биоактивного биополимерного геля.
ПРИМЕР 4.
Испытания в условиях in vivo БРПМ.
Исследовали образцы, изготовленные по способу, изложенному в Примере 1.
Раздражающего эффекта при однократной инсталляции в конъюктивальный мешок глаза кролика нет. По оценочной шкале реакция соответствовала нулевой степени.
Исследование реакций общей анафилаксии и активной кожной анафилаксии на морских свинках показало отсутствие аллергических реакций анафилактического типа.
Сенсибилизирующего действия на белых крысах не выявлено, реакция дегрануляции тучных клеток отрицательная.
Имплантация выполнена на крысах (внутримышечно). Срок наблюдения 3 месяца. Морфологическими исследованиями патологических изменений окружающих тканей не выявлено.
Стерильность: Испытанные образцы стерильны.
Пирогенность: Экстракты, приготовленные на 0,9% растворе натрия хлорида для инъекций, пирогенных реакций при внутривенном введении кроликам не показали. Суммарное повышение температуры не превысило 1,4°C, образцы не пирогенны.
ПРИМЕР 5.
Испытания в условиях in vivo биоактивных свойств БРПМ.
Исследовали образцы, изготовленные по способу, изложенному в Примере 1.
Для исследования в условиях in vivo биоактивных свойств БРПМ полученные образцы БРПМ имплантировали подкожно 10-ти мышам-самцам линии DBA. Контрольной группе (3 мыши-самца линии DBA) имплантировали образцы пористых дисков, изготовленные из полилактогликолида марки PDLG7507 (контроль). Через 14 и 28 суток после имплантации животных выводили из эксперимента, а место имплантации вместе с имплантатом фиксировали в 10% формалине и направляли на гистологию.
Образцы обезвоживали в этаноле с восходящими концентрациями, обезжиривали в смеси абсолютного спирта с хлороформом или ксилолом и заливали в парафин с добавлением пчелиного воска. Срезы толщиной 4-5 мкм получали с помощью микротома Leica, модель RM 3255, Германия. Полученные срезы переносили на предметное стекло. Гистологические препараты окрашивали гематоксилином и эозином, альциановым синим, по Малори и на коллаген II типа.
На Фиг.4 приведены результаты реакции тканей, прилегающих к имплантату (место имплантации) на 14 сутки после подкожной имплантации пористых образцов. А - контроль (PDLG7507), Б - образцы БРПМ, где 1 - фрагменты пористого матрикса; 2 - пролиферирующие фибробластоподобные клетки мыши. Окрашивание гематоксилином и эозином. Увеличение 400.
Из сравнения двух гистологических срезов места имплантации видно, что в контроле и в БРПМ на 14-е сутки присутствуют пролиферирующие фибробластоподобные клетки вокруг фрагментов пористого матрикса. Однако количество пролиферирующих фибробластоподобных клеток для БРПМ существенно больше по сравнению с контролем, что свидетельствует о биостимулирующих свойствах БРПМ.
Таким образом, нами получен биоактивный твердотельный матрикс с высокими биостимулирующими свойствами, который может быть использован в регенераторной и заместительной медицине различных органов с систем. На основании экспериментов, проведенных в условиях in vitro и in vivo, можно утверждать, что исследуемые образцы БРПМ являются биосовместимыми и биоактивными.
Приоритетной областью применения предлагаемого БРПМ является использование его как для замещения дефектов мягких и костных тканей, так и в тканевой инженерии и регенеративной медицине для активации регенерации собственных тканей пациента, создания тканеинженерных конструкций мягких и костных тканей с участием аутологичных или аллогенных клеточных культур. Кроме того, данный продукт может служить депо биологически активных веществ при создании пролонгированных лекарственных форм.
Преимущества предлагаемого способа получения БРПМ таковы:
1. в качестве исходных полимерных материалов можно использовать любые резорбируемые частично-кристаллические полимеры медицинского назначения;
2. возможность получать 3D-матриксы различных размеров и форм, которые определяются только размерами пресс-форм и реакционных камер, что позв