Катализатор и способ получения обогащенной по водороду газовой смеси из диметоксиметана
Иллюстрации
Показать всеИзобретение относится к катализаторам, используемым в реакции паровой конверсии диметоксиметана, а именно к катализатору для получения обогащенной по водороду газовой смеси взаимодействием диметоксиметана и паров воды. Предлагаемый катализатор является бифункциональным и содержит на поверхности центры гидратации диметоксиметана и паровой конверсии метанола/формальдегида. При этом в качестве активного компонента паровой конверсии метанола используются медьсодержащие системы на основе оксида меди, нанесенные на оксид алюминия - активный компонент гидратации диметоксиметана. Предлагаемый катализатор обладает высокой каталитической активностью, селективностью и стабильностью в отношении паровой конверсии диметоксиметана. Изобретение также относится к способу получения обогащенной по водороду газовой смеси взаимодействием диметоксиметана и паров воды с использованием данного катализатора. 2 н. и 6 з.п. ф-лы, 4 табл., 12 пр.
Реферат
Изобретение относится к реакции паровой конверсии диметоксиметана (ДММ) с целью получения обогащенной по водороду газовой смеси, которая может использоваться для питания топливных элементов различного назначения, в том числе и для топливных элементов, установленных на передвижных средствах.
Задачей, на решение которой направлено настоящее изобретение, является разработка новой каталитической системы, обладающей высокой каталитической активностью, селективностью и стабильностью в отношении паровой конверсии ДММ, а также разработка процесса получения из ДММ газовой смеси, обогащенной по водороду, с использованием этой каталитической системы.
Задача решается разработкой бифункционального катализатора паровой конверсии ДММ, содержащего кислотные центры для гидратации ДММ в метанол и формальдегид, а также медьсодержащего центра для паровой конверсии метанола и формальдегида. Предлагаемые катализаторы представляет собой нанесенный оксид меди на оксиды алюминия, при этом кислотные центры оксида алюминия катализируют реакцию гидратации ДММ в метанол и формальдегид, а медьсодержащий центр отвечает за паровую конверсию образовавшего метанола и формальдегида в водородсодержащий газ. Использование их в паровой конверсии ДММ позволяет получать водородсодержащий газ с низким содержанием оксида углерода при соотношении водяной пар/ДММ, равным стехиометрическому (H2O/ДММ=4), что имеет важное технологическое значение.
Изобретение относится к каталитическому способу осуществления реакции паровой конверсии ДММ с целью получения обогащенной по водороду газовой смеси, которая может использоваться в водородной энергетике. Например, в качестве топлива для питания топливных элементов различного назначения, в том числе и для топливных элементов, установленных на передвижных средствах. В настоящее время топливные элементы рассматриваются как альтернативный и экологически чистый источник электрической энергии.
Основным топливом для питания топливных элементов является водород или обогащенная по водороду газовая смесь, которая может быть получена посредством паровой конверсии природного газа, бензина (ископаемые топлива), спиртов и эфиров.
Несмотря на развитую инфраструктуру и относительно низкую цену ископаемых топлив, их использование имеет такие недостатки, как высокая температура конверсии (выше 600°C для природного газа и выше 800°C для бензина), а также большое количество оксида углерода в получаемом водородсодержащем газе. В отличие от ископаемых топлив, синтетические топлива, такие как метанол, диметиловый эфир (ДМЭ) и ДММ, могут легко и селективно конвертироваться в водородсодержащий газ при относительно низкой температуре (200-350°C). Важно отметить, что ДММ является коррозионно-инертным и нетоксичным соединением по сравнению с метанолом. В отличие от ДМЭ, при нормальных условиях ДММ представляет собой жидкость, следовательно, легко хранится и транспортируется. Указанные факты позволяют рассматривать ДММ как перспективное сырье для получения водорода для питания топливных элементов.
Наиболее эффективным способом получения водорода из ДММ является его паровая каталитическая конверсия. Таким образом, процесс паровой конверсии ДММ с целью получения водорода для питания топливного элемента является серьезной альтернативой процессу паровой конверсии метанола и ДМЭ.
Известно, что реакция паровой конверсии ДММ может протекать последовательно по схеме через гидратацию ДММ в метанол и формальдегид (1) и паровую конверсию образовавшего метанола (2) и формальдегида (3) в водородсодержащий газ:
C H 3 O C H 2 O C H 3 + H 2 O = 2 C H 3 O H + C H 2 O ( 1 )
C H 3 O H + H 2 O = C O 2 + 3 H 2 ( 2 )
C H 2 O + H 2 O = C O 2 + 2 H 2 ( 3 )
Суммарная реакция:
C H 3 O C H 2 O C H 3 + 4 H 2 O = 8 H 2 + 3 C O 2 ( 4 )
Следовательно, паровая конверсия ДММ, так же как и паровая конверсия ДМЭ, может быть осуществлена на катализаторах, содержащих кислотные и медьсодержащие центры.
Из анализа литературы известно, что реакция паровой конверсии ДММ осуществляется на механической смеси катализаторов гидратации ДММ и паровой конверсии метанола/формальдегида. Известны следующие системы, представляющие собой механическую смесь катализатора гидратации ДММ и медьсодержащего катализатора паровой конверсии. В работе Y. Fu, J. Shen, Production of hydrogen by catalytic reforming of dimethoxymethane over bifunctional catalysts. Journal of Catalysis, vol.248 (2007) p.101-110 использовали механическую смесь различных кислотных катализаторов (оксиды алюминия, цеолиты, углеродные нановолокна) и медьсодержащие катализаторы конверсии метанола (CuZnAlOx). В работе Q. Sun, A. Auroux, J. Shen, Journal of Catalysis 244 (2006) 1-9 использовали механическую смесь оксида ниобия Nb2O5 и медьсодержащего катализатора (CuZnAlOx). Недостатком использования катализатора, представляющего механическую смесь, является его расслоение катализаторов гидратации ДММ и паровой конверсии метанола под воздействием вибрации и, как следствие, падение активности катализатора. Последнее обстоятельство существенно снижает возможность использования механически смешанных катализаторов в топливных процессорах. От вышеупомянутых недостатков лишены бифункциональные катализаторы, которые содержат на поверхности оба, кислотные центры для гидратации ДММ и медьсодержащие центры для паровой конверсии метанола.
Задачей, на решение которой направлено настоящее изобретение, является разработка новой бифункциональной каталитической системы, обладающей высокой каталитической активностью, селективностью и стабильностью в отношении паровой конверсии ДММ, а также разработка процесса получения из ДММ газовой смеси, обогащенной по водороду, с использованием этой каталитической системы.
Задача решается разработкой катализатора для получения обогащенной по водороду газовой смеси взаимодействием ДММ и паров воды, представляющего собой бифункциональный катализатор, содержащий кислотные центры для гидратации ДММ и медьсодержащие центры для паровой конверсии метанола/формальдегида. Предлагаемые бифункциональные катализаторы представляют собой нанесенный оксид меди на оксид алюминия, при этом кислотные центры оксида алюминия катализируют реакцию гидратации ДММ в метанол и формальдегид, а медьсодержащий центр отвечает за паровую конверсию образовавшего метанола и формальдегида в водородсодержащий газ.
Предлагаемый катализатор для получения обогащенной по водороду газовой смеси взаимодействием диметоксиметана ДММ и паров воды представляет собой бифункциональный катализатор, содержащий на поверхности центры гидратации диметоксиметана ДММ и паровой конверсии метанола/формальдегида, и характеризуется тем, что в качестве активного компонента паровой конверсии метанола используются медьсодержащие системы на основе оксида меди, нанесенные на оксид алюминия - активный компонент гидратации диметоксиметана ДММ.
В состав катализатора паровой конверсии диметоксиметана входит оксид меди в количестве до 20 мас.%, остальное - оксид алюминия Al2O3.
В состав катализатора паровой конверсии диметоксиметана входят медно-цериевые оксиды в количестве до 30 мас.%, остальное - оксид алюминия Al2O3. Медно-цериевые оксиды, активные в паровой конверсии метанола, применяют с весовым соотношением Cu:Ce=1:1-4:1.
В состав катализатора паровой конверсии диметоксиметана входят медно-цинковые оксиды в количестве до 30 мас.%, остальное - оксид алюминия Al2O3. Медно-цинковые оксиды, активные в паровой конверсии метанола, применяют с весовым соотношением Cu:Zn=1:1-4:1.
Задача также решается разработкой способа получения обогащенной по водороду газовой смеси взаимодействием ДММ и водяного пара в присутствии бифункционального катализатора, представляющего собой нанесенный оксид меди на оксид алюминия. Реакцию осуществляют при 200-400°C, атмосферном давлении и мольном соотношении вода/диметоксиметан H2O/ДММ 2-10.
Отличительным признаком предлагаемой каталитической системы является то, что активные компоненты гидратации ДММ и паровой конверсии находятся на поверхности одного носителя и, таким образом, обеспечивают бифункциональность катализатора.
Бифункциональные катализаторы CuO-CeO2/γAl2O3 готовят пропиткой гранул γ-Al2O3 (SБЭТ=200 м2/г, объем пор 0.7 см3/г, суммарная концентрация льюисовских и бренстедовских поверхностных кислотных центров 600 мкмоль/г) раствором азотнокислых солей меди и церия, взятых в заданном соотношении. Полученные образцы сушат на воздухе и затем в течение 2 ч прокаливают при температуре 450°C.
Были получены образцы катализаторов CuO-CeO2/γ-Al2O3 с содержанием оксида меди до 20 мас.% и массовым отношением Cu:Ce=1:1-4:1.
Отличительным признаком предлагаемого способа получения обогащенной по водороду газовой смеси путем взаимодействия диметоксиметана и водяного пара является использование вышеописанного бифункционального катализатора.
Сущность изобретение иллюстрируется следующими примерами.
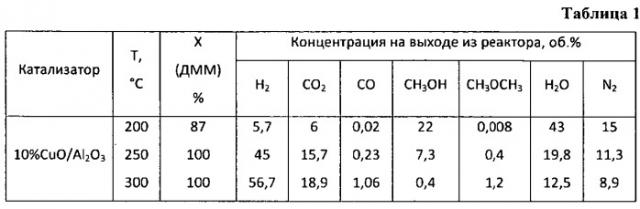
Пример 1. Паровую конверсию диметоксиметана осуществляют в установке проточного типа в кварцевом реакторе с внутренним диаметром 4 мм на навеске катализатора 0,5 мл при соотношении H2O:ДММ=5:1, времени контакта 10000 ч-1, температуре 200°C и давлении 1 атм. Состав оксидного катализатора составляет, мас.%: оксид меди - 10, остальное - оксид алюминия. Полученные результаты приведены в таблице 1.
Пример 2. Аналогично примеру 1, но реакцию проводят при температуре 250°C, результаты приведены в таблице 1.
Пример 3. Аналогично примеру 1, но реакцию проводят при температуре 300°C, результаты приведены в таблице 1.
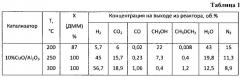
Пример 4. Аналогично примеру 1, но состав оксидного катализатора составляет, мас.%: оксид меди - 10, оксид церия - 5, остальное - оксид алюминия. Полученные результаты приведены в таблице 2.
Пример 5. Аналогично примеру 4, но реакцию проводят при температуре 250°C, результаты приведены в таблице 2.
Пример 6. Аналогично примеру 4, но реакцию проводят при температуре 300°C, результаты приведены в таблице 2.
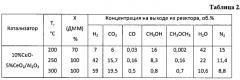
Пример 7. Аналогично примеру 1, но состав оксидного катализатора составляет, мас.%: оксид меди - 10, оксид цинка - 5, остальное - оксид алюминия. Полученные результаты приведены в таблице 3.
Пример 8. Аналогично примеру 7, но реакцию проводят при температуре 250°C, результаты приведены в таблице 3.
Пример 9. Аналогично примеру 7, но реакцию проводят при температуре 300°C, результаты приведены в таблице 3.
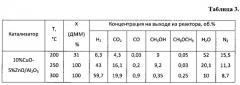
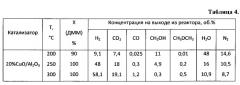
Пример 10. Аналогично примеру 1, но содержание оксида меди составляет 20%, результаты приведены в таблице 4.
Пример 11. Аналогично примеру 10, но реакцию проводят при температуре 250°C, результаты приведены в таблице 4.
Пример 12. Аналогично примеру 10, но реакцию проводят при температуре 300°C, результаты приведены в таблице 4.
1. Катализатор для получения обогащенной по водороду газовой смеси взаимодействием диметоксиметана ДММ и паров воды, представляющий собой бифункциональный катализатор, содержащий на поверхности центры гидратации диметоксиметана ДММ и паровой конверсии метанола/формальдегида, отличающийся тем, что в качестве активного компонента паровой конверсии метанола используются медьсодержащие системы на основе оксида меди, нанесенные на оксид алюминия - активный компонент гидратации диметоксиметана ДММ.
2. Катализатор по п.1, отличающийся тем, что в состав катализатора паровой конверсии диметоксиметана входит оксид меди в количестве до 20 мас.%, остальное - оксид алюминия Al2O3.
3. Катализатор по п.1, отличающийся тем, что в состав катализатора паровой конверсии диметоксиметана входят медно-цериевые оксиды в количестве до 30 мас.%, остальное - оксид алюминия Al2O3.
4. Катализатор по п.1, отличающийся тем, что в состав катализатора паровой конверсии диметоксиметана входят медно-цинковые оксиды в количестве до 30 мас.%, остальное - оксид алюминия Al2O3.
5. Катализатор по п.3, отличающийся тем, что медно-цериевые оксиды, активные в паровой конверсии метанола, применяют с весовым соотношением Cu:Ce=1:1-4:1.
6. Катализатор по п.4, отличающийся тем, что медно-цинковые оксиды, активные в паровой конверсии метанола, применяют с весовым соотношением Cu:Zn=1:1-4:1.
7. Способ получения обогащенной по водороду газовой смеси взаимодействием диметоксиметана ДММ и паров воды в присутствии бифункционального катализатора, содержащего на поверхности центры гидратации диметоксиметана ДММ и паровой конверсии метанола/формальдегида, отличающийся тем, что используют катализатор по любому из пп.1-6.
8. Способ по п.7, отличающийся тем, что реакцию осуществляют при температуре 200-400°C, атмосферном давлении и мольном отношении H2O/ДММ=2-10.