Дифференцирование плюрипотентных стволовых клеток, представляющих собой линию клеток человека
Иллюстрации
Показать всеИзобретение относится к области медицины, биотехнологии и клеточных технологий. Способ дифференцирования плюрипотентных стволовых клеток, представляющих собой линию клеток человека, в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, включает обработку плюрипотентных стволовых клеток средой, отличающейся тем, что она не содержит активин А и содержит GDF-8, в течение периода времени, достаточного для того, чтобы плюрипотентные стволовые клетки дифференцировались в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы. Изобретение может быть использовано в медицине для целей трансплантации. 13 з.п. ф-лы, 19 табл., 27 ил., 24 пр.
Реферат
В настоящем изобретении заявляется о приоритете заявки с порядковым номером 61/076900, поданной 30 июня 2008 года, заявки с порядковым номером 61/076908, поданной 30 июня 2008 года, и заявки с порядковым номером 61/076915, поданной 30 июня 2008 года.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам дифференцирования плюрипотентных стволовых клеток. В частности, настоящее изобретение относится к способам и препаратам для дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, включая культивирование плюрипотентных стволовых клеток в среде, содержащей достаточное количество GDF-8 для стимуляции дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Последние достижения в области заместительной клеточной терапии для лечения сахарного диабета 1 типа и нехватка островков Лангерганса для трансплантации заставили обратить внимание на разработку источников инсулин-продуцирующих клеток, или β-клеток, подходящих для трансплантации. Одним из подходов является формирование функциональных β-клеток из плюрипотентных стволовых клеток, таких как, например, эмбриональные стволовые клетки.
При эмбриональном развитии позвоночных плюрипотентные клетки дают начало группе клеток, формирующих три зародышевых листка (эктодерму, мезодерму и эндодерму) в ходе процесса, именуемого гаструляцией. Такие ткани, как, например, щитовидная железа, тимус, поджелудочная железа, кишечник и печень, будут развиваться из эндодермы через промежуточную стадию. Промежуточной стадией данного процесса является образование сформированной эндодермы. Клетки сформированной эндодермы экспрессируют ряд маркеров, таких как HNF-3beta, GATA4, MIXL1, CXCR4 и SOX17.
Формирование поджелудочной железы происходит при дифференцировании сформированной эндодермы в панкреатическую эндодерму. Клетки панкреатической эндодермы экспрессируют ген панкреатическо-дуоденального гомеобокса, PDX1. В отсутствие PDX1 развитие поджелудочной железы не идет дальше формирования вентрального и дорсального зачатков. Таким образом, экспрессия PDX1 характеризует критическую стадию органогенеза поджелудочной железы. Зрелая поджелудочная железа содержит, помимо других типов клеток, экзокринную ткань и эндокринную ткань. Экзокринная и эндокринная ткани образуются при дифференцировании панкреатической эндодермы.
По имеющимся данным, клетки, обладающие свойствами островковых клеток, были получены из эмбриональных клеток мыши. Например, в публикации Lumelsky et al. (Science 292:1389, 2001) сообщается о дифференцировании эмбриональных стволовых клеток мыши в инсулин-секретирующие структуры, сходные с островками поджелудочной железы. В публикации Soria et al. (Diabetes 49:157, 2000) сообщается, что инсулин-секретирующие клетки, полученные из эмбриональных стволовых клеток мыши, нормализовали гликемию у мышей с диабетом, вызванным стрептозотоцином.
В одном примере, в публикации Hori et al. (PNAS 99: 16105, 2002), отмечается, что обработка эмбриональных стволовых клеток мыши ингибиторами фосфоинозитид 3-киназы (LY294002) приводила к получению клеток, сходных с β-клетками.
В другом примере, в публикации Blyszczuk et al. (PNAS 100:998, 2003), сообщается о получении инсулин-продуцирующих клеток из эмбриональных стволовых клеток мыши с конститутивной экспрессией Pax4.
В публикации Micallef et al. сообщается, что ретиноевая кислота может регулировать способность эмбриональных стволовых клеток формировать Pdx1-положительную панкреатическую эндодерму. Ретиноевая кислота с наибольшей эффективностью индуцирует экспрессию Pdx1 при добавлении в культуру на 4 день дифференцирования эмбриональных стволовых клеток в течение периода, соответствующего концу гаструляции эмбриона (Diabetes 54:301, 2005).
В публикации Miyazaki et al. сообщается о линии эмбриональных стволовых клеток мыши со сверхэкспрессией Pdx1. Эти результаты показывают, что экспрессия экзогенного Pdx1, очевидно, повышает экспрессию генов инсулина, соматостатина, глюкокиназы, нейрогенина 3, p48, Pax6 и HNF6 в образующихся дифференцированных клетках (Diabetes 53: 1030, 2004).
В публикации Skoudy et al. сообщается, что активин А (входящий в суперсемейство TGF-β) повышает экспрессию экзокринных панкреатических генов (p48 и амилаза) и эндокринных генов (Pdx1, инсулин и глюкагон) в эмбриональных стволовых клетках мыши.
Максимальный эффект наблюдался при использовании 1 нМ активина A. Также авторы наблюдали, что на уровень экспрессии мРНК инсулина и Pdx1 не влияла ретиноевая кислота; однако обработка раствором 3 нМ FGF7 приводила к повышению уровня транскрипта Pdx1 (Biochem. J. 379: 749, 2004).
В работе Shiraki et al. изучались эффекты факторов роста, специфически ускоряющих дифференцирование эмбриональных стволовых клеток в Pdx1-положительные клетки. Авторы наблюдали, что TGFβ2 приводил к воспроизводимому увеличению доли Pdx1-положительных клеток (Genes Cells. 2005 June; 10(6): 503-16).
В публикации Gordon et al. продемонстрирована индукция образования brachyury-[положительных]/HNF-3beta-[положительных] эндодермальных клеток из эмбриональных стволовых клеток мыши в отсутствии сыворотки и в присутствии активина в сочетании с ингибитором сигнального пути Wnt (США № 2006/0003446A 1).
В публикации Gordon et al. (PNAS, Vol 103, page 16806, 2006) говорится: «Для образования передней первичной полоски одновременно требовались сигнальные пути Wnt и TGF-beta/nodal/активин».
Однако модель развития эмбриональных стволовых клеток на мышах может не имитировать в точности программу развития у высших млекопитающих, например у человека.
В работе Thomson et al. эмбриональные стволовые клетки выделяли из человеческих бластоцист (Science 282:114, 1998). Параллельно Gearhart и соавторы получили клеточные линии эмбриональных зародышевых клеток человека (hEG) из ткани половых желез эмбриона (Shamblott et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998). В отличие от эмбриональных стволовых клеток мыши, воспрепятствовать дифференцированию которых можно путем простого культивирования с фактором торможения лейкемии (LIF), эмбриональные стволовые клетки человека должны культивироваться в очень специфических условиях (Патенты США №№ 6200806; WO 99/20741; WO 01/51616).
В публикации D'Amour et al. описывается производство обогащенных культур сформированной эндодермы, производной от эмбриональных стволовых клеток человека, в присутствии высокой концентрации активина и низкой концентрации сыворотки (D'Amour K A et al. 2005). Трансплантация этих клеток под почечную капсулу мышей привела к их дифференцированию в более зрелые клетки, обладающие характерными особенностями некоторых эндодермальных органов. Клетки сформированной эндодермы, производные от эмбриональных стволовых клеток человека, могут подвергаться дальнейшему дифференцированию в Pdx1-положительные клетки после добавления FGF-10 (США № 2005/0266554A1).
В публикации D'Amour et al. (Nature Biotechnology - 24, 1392-1401 (2006)) говорится: «Мы разработали процесс дифференцирования, преобразующий эмбриональные клетки человека (hES) в эндокринные клетки, способные синтезировать гормоны поджелудочной железы: инсулин, глюкагон, соматостатин, панкреатический полипептид и грелин. Данный процесс имитирует органогенез поджелудочной железы in vivo, проводя клетки через стадии, напоминающие образование сформированной эндодермы, эндодермы кишечной трубки, панкреатической эндодермы и превращение предшественников эндокринных клеток в клетки, экспрессирующие эндокринные гормоны».
В другом примере, в публикации Fisk et al., сообщается о системе для производства островковых клеток поджелудочной железы из эмбриональных стволовых клеток человека (США № 2006/0040387A1). В данном случае процесс дифференцирования был разделен на три стадии. Сначала эмбриональные стволовые клетки человека были дифференцированы до эндодермы с помощью сочетания н-бутирата и активина А. Далее клетки культивировались с антагонистами TGF-β, такими как Noggin, в сочетании с EGF или бетацеллюлином с получением Pdx1-положительных клеток. Окончательное дифференцирование запускалось никотинамидом.
В одном примере, в публикации Benvenistry et al., сообщается: «Мы делаем вывод, что сверхэкспрессия PDX1 увеличивала экспрессию панкреатических обогащенных генов, а для индукции экспрессии инсулина могут требоваться дополнительные сигналы, присутствующие только in vivo» (Benvenistry et al, Stem Cells 2006; 24:1923-1930).
Активин А является членом семейства TGF-beta и демонстрирует широкий спектр биологических эффектов, включая регуляцию клеточной пролиферации и дифференцирования, а также стимуляцию выживания нейронов. Выделение и очистка активина А часто сложна и часто может иметь низкий выход продукта. Например, авторы S.A. Pangas и T.K. Woodruff сообщают: «Ингибин и активин являются белковыми гормонами с различающимися физиологическими функциями, включая регуляцию секреции гипофизарного ФСГ. Подобно другим членам семейства генов трансформирующего фактора роста-β, они подвергаются процессингу из более крупных молекул-предшественников, а также объединяются в функциональные димеры. При выделении ингибина и активина из природных источников можно получать лишь ограниченное количество биологически активного белка» (J. Endocrinol. 172 (2002) 199-210).
В другом примере, в публикации K.Y. Arai et al, сообщается: «Активины представляют собой многофункциональные факторы роста, принадлежащие к суперсемейству трансформирующего фактора роста-β. Выделение активинов из природных источников включает в себя множество этапов, а получаемое количество белка ограничено. Хотя в последних работах используются рекомбинантные препараты, очистка рекомбинантных активинов, тем не менее, требует множества этапов» (Protein Expression and Purification 49 (2006) 78-82).
Следовательно, по-прежнему сохраняется значительная потребность в альтернативах активина А, используемых при дифференцировании плюрипотентных стволовых клеток.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления настоящее изобретение предлагает способ дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, включая культивирование плюрипотентных стволовых клеток в среде, содержащей достаточное количество GDF-8 для стимуляции дифференцирования плюрипотентных стволовых клеток в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы.
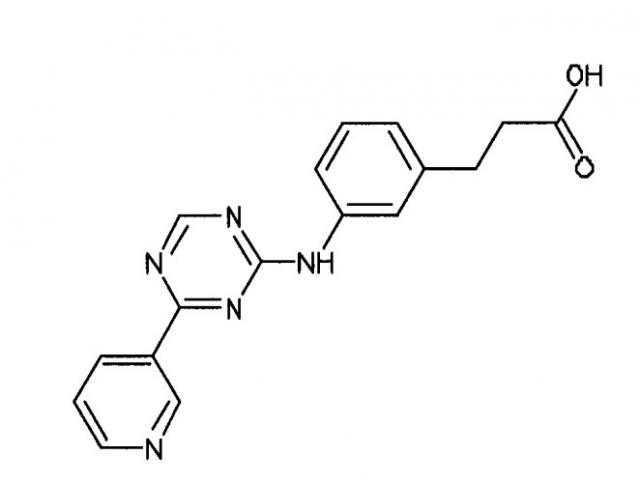
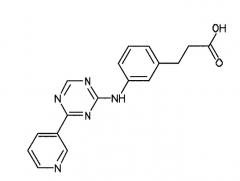
В одном из вариантов осуществления среда, содержащая достаточное количество GDF-8, также содержит по меньшей мере одно другое соединение. В одном из вариантов осуществления такое по меньшей мере одно другое соединение представляет собой анилин-пиридинотриазин. В альтернативном варианте осуществления такое по меньшей мере одно другое соединение представляет собой циклический анилин-пиридинотриазин.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг. 1 показано дифференцирование эмбриональных стволовых клеток человека H1 в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы. Дифференцирование определяли путем измерения числа клеток (часть A) и интенсивности сигнала SOX17 (часть B) с использованием анализатора IN Cell Analyzer 1000 (GE Healthcare). Эмбриональные стволовые клетки человека обрабатывали в течение четырех дней средой, содержащей 20 нг/мл Wnt3a и активин A в обозначенных концентрациях (черные столбцы), или средой, не содержащей Wnt3a, но содержащей активин A в обозначенных концентрациях (белые столбцы).
На фиг. 2 показана зависимость доза-эффект для активина A и GDF8, используемых для дифференцирования эмбриональных стволовых клеток человека линии H1 в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы. Клетки обрабатывали в течение трех дней активином A или GDF8 в указанных концентрациях в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день анализа. Дифференцирование определяли путем измерения интенсивности сигнала SOX17 с использованием флуоресцентного антительного зонда и одновременного многопараметрического анализа на анализаторе IN Cell Analyzer (GE Healthcare).
На фиг. 3 показаны уровни экспрессии CXCR4 в клетках после первого этапа дифференцирования, проводимого в соответствии со способами, описанными в Примере 12. Клетки H1 обрабатывали 100 нг/мл активина А или 200 нг/мл GDF-8 в течение трех дней в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение всех трех дней. Экспрессию CXCR4 измеряли с помощью флуоресцентного антительного зонда и проточной цитометрии, получая в результате показанную процентную долю положительных клеток.
На фиг. 4 показаны уровни экспрессии SOX17 в клетках после трех дней дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 12. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 200 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение всех трех дней. Дифференцирование определяли путем измерения интенсивности сигнала SOX17 (черные столбцы) и итогового числа клеток (белые столбцы) с использованием флуоресцентного антительного зонда и одновременного многопараметрического анализа на анализаторе IN Cell Analyzer (GE Healthcare).
На фиг. 5 показаны уровни экспрессии PDX1 и белка CDX2 в клетках после третьего этапа дифференцирования, проводимого в соответствии со способами, описанными в Примере 12. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 200 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение всех трех дней, с последующим проведением клеток через второй и третий этапы дифференцирования. Для каждой из экспериментальных групп показаны уровни экспрессии белков и число клеток, измеренные с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа. С целью сравнения значения нормированы по отношению к обработке активином A/Wnt3a.
На фиг. 6 показаны уровни экспрессии белка PDX1 (белые столбцы) и число клеток (черные столбцы) после четвертого этапа дифференцирования, проводимого в соответствии со способами, описанными в Примере 12. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 200 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение всех трех дней, с последующим проведением клеток через второй, третий и четвертый этапы дифференцирования. Для каждой из экспериментальных групп показаны уровни экспрессии белков и число клеток, измеренные с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа. С целью сравнения значения нормированы по отношению к обработке активином A/Wnt3a.
На фиг. 7 показаны уровни экспрессии белков инсулина и глюкагона и число клеток, дифференцированных в соответствии со способами, описанными в Примере 12. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 200 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение всех трех дней, с последующим проведением клеток через второй, третий, четвертый и пятый этапы дифференцирования. Для каждой из экспериментальных групп показаны уровни экспрессии белков и число клеток, измеренные с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа. С целью сравнения значения нормированы по отношению к обработке активином A/Wnt3a.
На фиг. 8 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека и число этих клеток после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 13. Клетки H1 обрабатывали в течение четырех дней 100 нг/мл активина А или 100 нг/мл фактора роста GDF в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или 2,5 мкМ Соединения 34, или 2,5 мкМ Соединения 56, добавляемого в течение первых двух дней анализа. Для каждой из экспериментальных групп показаны уровни экспрессии белка SOX17 (черные столбцы) и число клеток (белые столбцы), измеренные с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа. С целью сравнения значения нормированы по отношению к обработке активином A/Wnt3a. В части 8A показана серия контрольных сред для дифференцирования в отсутствие любых факторов роста (NONE), с обработкой активином A/Wnt3a (AA/Wnt3a) или с добавлением реагентов по отдельности. В части 8B показано дифференцирование с добавлением GDF-3, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56. В части 8С показано дифференцирование с добавлением GDF-5, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56. В части 8D показано дифференцирование с добавлением GDF-8, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56. В части 8E показано дифференцирование с добавлением GDF-10, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56. В части 8F показано дифференцирование с добавлением GDF-11, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56. В части 8G показано дифференцирование с добавлением GDF-15, как отдельно, так и в разнообразных сочетаниях с Wnt3a, Соединением 34 или Соединением 56.
На фиг. 9 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 14. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или различными факторами роста в указанных концентрациях в сочетании с 20 нг/мл Wnt3a или 2,5 мкМ Соединения 34, добавляемого в первый день. Для каждой из экспериментальных групп показаны уровни экспрессии белка SOX17 (черные столбцы) и число клеток (белые столбцы), измеренные с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа. С целью сравнения значения нормированы по отношению к обработке активином A/Wnt3a. В части 9А показана серия контрольных сред для дифференцирования только с Wnt3a в отсутствие любых факторов роста (None) или с обработкой активином A/Wnt3a (AA/Wnt3a). В части 9B показано дифференцирование с GDF-8 (PeproTech) в указанных концентрациях в сочетании с 20 нг/мл Wnt3a. В части 9C показано дифференцирование с GDF-8 (Shenendoah) в указанных концентрациях в сочетании с 20 нг/мл Wnt3a. В части 9D показано дифференцирование с TGFβ1 в указанных концентрациях в разнообразных сочетаниях с Wnt3a или Соединением 34. В части 9E показано дифференцирование с BMP2 в указанных концентрациях в разнообразных сочетаниях с Wnt3a или Соединением 34. В части 9F показано дифференцирование с BMP3 в указанных концентрациях в разнообразных сочетаниях с Wnt3a или Соединением 34. В части 9G показано дифференцирование с BMP4 в указанных концентрациях в разнообразных сочетаниях с Wnt3a или Соединением 34.
На фиг. 10 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл активина А или 100 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a. Определенная с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа экспрессия белка SOX17 представлена в виде суммарных значений интенсивности для каждой из экспериментальных групп: для контрольных сред дифференцирования без добавления факторов роста (без обработки), только с Wnt3a, только с активином A или GDF-8, или с обработкой активином A/Wnt3a или GDF-8/Wnt3a, причем, как показано, Wnt3a добавлялся только в первый день анализа или в течение всех трех дней анализа.
На фиг. 11 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя разное время воздействия, 100 нг/мл активина А в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось только в первый день анализа. Определенная с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа экспрессия белка SOX17 представлена в виде суммарных значений интенсивности.
На фиг. 12 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл активина А в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось в течение всех трех дней анализа. Определенная с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа экспрессия белка SOX17 представлена в виде суммарных значений интенсивности.
На фиг. 13 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл GDF-8 в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось только в первый день анализа. Определенная с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа экспрессия белка SOX17 представлена в виде суммарных значений интенсивности.
На фиг. 14 показаны уровни экспрессии белка SOX17 в эмбриональных стволовых клетках человека после дифференцирования в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл GDF-8 в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось в течение всех трех дней анализа. Определенная с помощью флуоресцентных антительных зондов и одновременного многопараметрического анализа экспрессия белка SOX17 представлена в виде суммарных значений интенсивности.
На фиг. 15 показан выход по числу клеток после дифференцирования эмбриональных стволовых клеток человека в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл активина А или 100 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a. Определенное с помощью флуоресцентного ядерного зонда и одновременного многопараметрического анализа число клеток показано для каждой из экспериментальных групп: для контрольных сред дифференцирования без добавления факторов роста (без обработки), только с Wnt3a, только с активином A или GDF-8, или с обработкой активином A/Wnt3a или GDF-8/Wnt3a, причем, как показано, Wnt3a добавлялся только в первый день анализа или в течение всех трех дней анализа.
На фиг. 16 показан выход по числу клеток после дифференцирования эмбриональных стволовых клеток человека в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл активина А в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось только в первый день анализа. Показаны значения выхода по числу клеток, определенные с помощью флуоресцентного ядерного зонда и одновременного многопараметрического анализа.
На фиг. 17 показан выход по числу клеток после дифференцирования эмбриональных стволовых клеток человека в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл активина А в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось в течение всех трех дней анализа. Показаны значения выхода по числу клеток, определенные с помощью флуоресцентного ядерного зонда и одновременного многопараметрического анализа.
На фиг. 18 показан выход по числу клеток после дифференцирования эмбриональных стволовых клеток человека в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл GDF-8 в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось только в первый день анализа. Показаны значения выхода по числу клеток, определенные с помощью флуоресцентного ядерного зонда и одновременного многопараметрического анализа.
На фиг. 19 показан выход по числу клеток после дифференцирования эмбриональных стволовых клеток человека в сформированную эндодерму, проводимого в соответствии со способами, описанными в Примере 15. Клетки H1 обрабатывали в течение трех дней, используя различное время воздействия, 100 нг/мл GDF-8 в сочетании с тестовым соединением (Соединение 181 (часть A), Соединение 180 (часть B), Соединение 19 (часть C), Соединение 202 (часть D), Соединение 40 (часть E), Соединение 34 (часть F) или ингибитор GSK3 BIO (часть G)) в указанных концентрациях, причем тестовое соединение добавлялось в течение всех трех дней анализа. Показаны значения выхода по числу клеток, определенные с помощью флуоресцентного ядерного зонда и одновременного многопараметрического анализа.
На фиг. 20 показаны уровни экспрессии различных белковых маркеров в клетках в ходе множества этапов дифференцирования, проводимого в соответствии со способами, описанными в Примере 16. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 100 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или в сочетании с 2,5 мкМ различных соединений (Соединение 19, Соединение 202, Соединение 40 или ингибитор GSK3 BIO), которые добавлялись только в первый день. На фиг. 20 в части A показано содержание маркера сформированной эндодермы, CXCR4, в клетках после первого этапа дифференцирования, измеренное методом FACS. Экспрессию CXCR4 измеряли с помощью антительного флуоресцентного зонда и проточной цитометрии, получая в результате показанную процентную долю положительных клеток. На фиг. 20 в части B показаны полученные с помощью одновременного многопараметрического анализа нормированные данные по экспрессии белка SOX17 (черные столбцы) и числу полученных клеток (белые столбцы) после первого этапа дифференцирования для различных видов обработки. На фиг. 20 в части C показано полученное с помощью одновременного многопараметрического анализа относительное число клеток, полученных из культур, которые подвергались обработке до 5 этапа дифференцирования. На фиг. 20 в части D показаны полученные с помощью одновременного многопараметрического анализа данные по экспрессии белка глюкагона в клетках из культур, которые подвергались обработке до 5 этапа дифференцирования. На фиг. 20 в части E показаны полученные с помощью одновременного многопараметрического анализа данные по экспрессии белка инсулина в клетках из культур, которые подвергались обработке до 5 этапа дифференцирования. На фиг. 20 в части F показано отношение экспрессии глюкагон/инсулин в клетках из культур, которые подвергались обработке до 5 этапа дифференцирования. Для сравнения значения экспрессии в частях B, C, D, E и F нормированы по отношению к контрольной обработке активином А и Wnt3a в ходе 1 этапа.
На фиг. 21 показаны уровни экспрессии различных белковых маркеров и маркеров ОТ-ПЦР в клетках в ходе множества этапов дифференцирования, проводимого в соответствии со способами, описанными в Примере 17. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 100 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или в сочетании с различными соединениями в указанных концентрациях (Соединение 181, Соединение 180, Соединение 19, Соединение 202, Соединение 40, Соединение 56 или ингибитор GSK3 BIO), которые добавлялись только в первый день. Показано измеренное методом FACS содержание маркера сформированной эндодермы, CXCR4, в клетках после первого этапа дифференцирования, при котором обработка включала сочетание активина A (часть A) или GDF-8 (часть B) с Wnt3a или различными соединениями. Экспрессию CXCR4 измеряли с помощью флуоресцентного антительного зонда и проточной цитометрии, получая в результате показанную процентную долю положительных клеток. В следующих частях фиг. 21 представлены нормированные данные ОТ-ПЦР по различным маркерам дифференцирования при соответствующей обработке активином A или GDF-8 на первом этапе дифференцирования: маркеры, присутствующие в конце первого этапа дифференцирования при обработке активином A (часть C) или GDF-8 (часть D); маркеры, присутствующие в конце третьего этапа дифференцирования при обработке активином A (часть E) или GDF-8 (часть F); маркеры, присутствующие в конце четвертого этапа дифференцирования при обработке активином A (часть G) или GDF-8 (часть H); маркеры, присутствующие в конце пятого этапа дифференцирования при обработке активином A (часть I) или GDF-8 (часть J). После завершения пятого этапа дифференцирования был проведен одновременный многопараметрический анализ для измерения числа полученных клеток после обработки их на первом этапе дифференцирования активином А (часть K) или GDF-8 (часть M). Одновременный многопараметрический анализ также использовался для измерения интенсивности сигнала глюкагона и инсулина в конце пятого этапа дифференцирования в полученных клеточных популяциях, которые обрабатывались на первом этапе дифференцирования активином A (часть L) или GDF-8 (часть N).
На фиг. 22 показаны уровни экспрессии различных белковых маркеров и маркеров ОТ-ПЦР в клетках, обработанных в соответствии со способами, описанными в Примере 18. Клетки H1 обрабатывали в течение трех дней 100 нг/мл активина А или 100 нг/мл GDF-8 в сочетании с 20 нг/мл Wnt3a, добавляемого в первый день, или в сочетании с 2,5 мкМ Соединения 40, или 2,5 мкМ Соединения 202, добавляемого только в первый день. На фиг. 22 в части A показано содержание маркера сформированной эндодермы, CXCR4, в клетках после первого этапа дифференцирования, измеренное методом FACS. Экспрессию CXCR4 измеряли с помощью флуоресцентного антительного зонда и проточной цитометрии, получая в результате показанную процентную долю положительных клеток. На фиг. 22 в части B представлены нормированные данные ОТ-ПЦР по различным маркерам дифференцирования в клетках, полученных после четвертого этапа дифференцирования, при соответствующей обработке сочетаниями активин A/Wnt3a или GDF-8/Соединение 40, или GDF-8/Соединение 202 на первом этапе дифференцирования.
На фиг. 23 показаны уровни C-пептида у мышей с синдромом тяжелого комбинированного иммунодефицита, обусловленного врожденным отсутствием клеток-киллеров (SCID-beige), которые получали клетки в конце четвертого этапа протокола дифференцирования, описанного в Примере 18.
На фиг. 24 в части A показаны уровни экспрессии CXCR4, измеренные методом FACS в клетках в конце первого этапа протокола дифференцирования, описанного в Примере 19. В части B показаны уровни экспрессии различных генов, измеренные методом ОТ-ПЦР в клетках в конце четвертого этапа протокола дифференцирования, описанного в Примере 19. Показаны две различные повторности эксперимента (Rep-1 и Rep-2), в которых протоколы обработки были идентичными. В части C показаны уровни C-пептида у мышей SCID-beige, получавших клетки в конце четвертого этапа протокола дифференцирования, обработанные GDF-8 и Wnt3a в ходе первого этапа дифференцирования in vitro. В части D показаны уровни C-пептида у мышей SCID-beige, получавших клетки в конце четвертого этапа протокола дифференцирования, обработанные GDF-8 и Соединением 28 в ходе первого этапа дифференцирования in vitro.
На фиг. 25 показано число клеток (часть A) и экспрессия CXCR4 (часть B) для клеток, выращенных на гранулах микроносителя и обработанных в соответствии со способами, составляющими предмет настоящего изобретения, описанными в Примере 22. Клетки выращивались на гранулах Cytodex3 без обработки (недифференцированные) или с обработкой сочетанием 100 нг/мл активина A и 20 нг/мл Wnt3a (AA/Wnt3a), или с различными типами обработки GDF-8: 50 нг/мл GDF-8 с 2,5 мкМ Соединения 34 (Cmp 34+8); или 50 нг/мл GDF-8 с 2,5 мкМ Соединения 34 и 50 нг/мл PDGF (Cmp 34+8+D); или 50 нг/мл GDF-8 с 2,5 мкМ Соединения 34 и 50 нг/мл PDGF и 50 нг/мл VEGF (Cmp 34+8+D+V); или 50 нг/мл GDF-8 с 2,5 мкМ Соединения 34 и 50 нг/мл PDGF и 50 нг/мл VEGF и 20 нг/мл мусцимола (Cmp 34+8+D+V+M).
На фиг. 26 показана пролиферация клеток после обработки соединениями, составляющими предмет настоящего изобретения, как описано в Примере 23. В частях с B по I показаны данные для обработки с применением соединения в сочетании с GDF-8, где показания оптической плотности в тесте MTS измерялись через 1, 2 и 3 дня после начала анализа дифференцирования.
На фиг. 27 показана экспрессия различных белков и генов в клетках, выращенных на гранулах микроносителя и обработанных в соответствии со способами, составляющими предмет настоящего изобретения. В части A показана процентная доля положительной экспрессии CXCR4, CD99 и CD9, измеренная методом FACS в клетках в конце первого этапа протокола дифференцирования, описанного в Примере 24. В части B показано число клеток, полученных в результате указанной обработки и дифференцированных до третьего этапа протокола дифференцирования. В части C показаны значения ddCT для различных генных маркеров, экспрессированных в клетках, прошедших указанную обработку и дифференцированных до третьего этапа протокола.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания, а не в ограничение изобретения, приведенное ниже подробное описание изобретения разделено на следующие подразделы, описывающие или иллюстрирующие определенные особенности, варианты осуществления или области применения настоящего изобретения.
Определения
Стволовые клетки представляют собой недифференцированные клетки, определяемые по их способности на уровне единичной клетки как самообновляться, так и дифференцироваться с образованием клеток-потомков, таких как самообновляющиеся клетки-предшественники, необновляющиеся клетки-предшественники и окончательно дифференцированные клетки. Стволовые клетки также характеризуются способностью дифференцироваться in vitro в функциональные клетки различных клеточных линий дифференцирования из нескольких зародышевых листков (эндодермы, мезодермы и эктодермы), а также после трансплантации давать начало тканям, происходящим от нескольких зародышевых листков, и вносить существенный вклад в формирование большинства, если не всех, тканей после инъекции в бластоцисты.
По потенциалу развития стволовые клетки классифицируются следующим образом: (1) тотипотентные, т.е. способные давать начало всем эмбриональным и внеэмбриональным типам клеток; (2) плюрипотентные, т.е. способные давать начало всем эмбриональным типам кле