Антагонистические антитела против рецептора il-7 и способы
Иллюстрации
Показать всеИзобретение относится к области иммунологии и биотехнологии. Предложены варианты антагонистических антител, которые связываются с рецептором интерлейкина-7 (IL-7R). Описаны: варианты нуклеиновых кислот, кодирующих антитела; клетка-хозяин, рекомбинантно продуцирующая антитело; фармацевтическая композиция, ингибирующая функцию человеческого IL-7R, и способы лечения и/или предупреждения: аутоиммунного заболевания, выбранного из группы диабета 1 типа, волчанки, рассеянного склероза, ревматоидного артрита; диабета 2 типа или реакции «трансплантат против хозяина», основанные на использовании антитела. Изобретение обеспечивает антагонистические антитела против IL-7R, что может найти применение в медицине. 9 н. и 8 з.п. ф-лы, 15 ил., 8 табл., 13 пр.
Реферат
Область изобретения
Настоящее изобретение относится к антителам, например к полноразмерным антителам или их антигенсвязывающим участкам, которые антагонизируют активность рецептора интерлейкина-7 (IL-7R), включая его взаимодействие с IL-7. Изобретение также относится к композициям, содержащим антагонист IL-7R, такой как антагонистическое антитело против IL-7R, и способам применения антагониста IL-7R в качестве лекарственного средства. Антагонист IL-7R может быть использован для предупреждения и/или лечения диабета 2 типа, реакции "трансплантат против хозяина" (GVHD) и аутоиммунных расстройств, включая диабет 1 типа, рассеянный склероз, ревматоидный артрит и волчанка.
Предшествующий уровень техники
Комплекс IL-7R представляет собой гетерод и мерный рецептор, состоящий из альфа-цепи IL-7R (IL-7Rα) и общей гамма-цепи (γс) (Mazzucchelli et al., Nat Rev Immunol., 2007, 7:144-54). IL-7R связывается интерлейкином-7 (IL-7), который представляет собой цитокин, необходимый для развития и гомеостатического поддержания Т- и В-лимфоцитов (Fry et al., J Immunol., 2005, 174:6571-6). Связывание IL-7 с IL-7R активирует многочисленные пути, которые регулируют выживание, потребление глюкозы, пролиферацию и дифференцировку лимфоцитов.
IL-7R экспрессируется как на дендритных клетках, так и на моноцитах и, по-видимому, действует во множественных гемопоэтических линиях дифференцировки (Reche PA, et al., J Immunol., 2001, 167:336-43). В дендритных клетках IL-7R играет иммуномодулирующую роль, тогда как лимфоциты нуждаются в IL-7R - сигнальном пути для выживания, пролиферации и дифференцировки. Оба Jak-Stat и PI3K-Akt пути активируются связыванием IL-7 с IL-7R (Jian et al., Cytokine Growth Factor Rev., 2005, 16:513-533). Эти пути вовлекают взаимодействие (crosstalk) путей передачи сигналов, общие домены взаимодействия, петли обратной связи, интегрированную генную регуляцию, мультимеризацию и конкуренцию лигандов. Некоторые мишени IL-7-сигнального пути, включая Вс12 и Pyk2, вносят вклад в клеточное выживание. Другие мишени, такие как PI3 киназа, киназы семейства src (Ick и fyn) и STAT5, вносят вклад в клеточную пролиферацию. Транскрипционный фактор STAT5 вносит вклад в активацию множества различных генов, регулирующих последующие звенья сигнальных каскадов в В- и Т-клетках, и может вносить вклад в VDJ-рекомбинацию посредством изменения структуры хроматина. Сигналы клеточного выживания и клеточной пролиферации, индуцируемые IL-7, объединяются для индукции развития нормальных Т-клеток. Детали сигнальной сети комплекса IL-7 и ее взаимодействия с другими сигнальными каскадами в клетках иммунной системы все еще полностью не выяснены.
Из информации, имеющейся в данной области техники и предшествующей настоящему изобретению, остается неясно, является ли введение антагонистического антитела к IL-7R в кровоток для селективного блокирования IL-7R эффективным для лечения диабета 2 типа, диабета 1 типа, GVHD, волчанки и ревматоидного артрита, и, если это так, то какие свойства антитела против IL-7R необходимы для такой эффективности in vivo.
Краткое изложение сущности изобретения
Предложены антагонистические антитела, которые селективно взаимодействуют и ингибируют функцию IL-7R. Впервые показано, что некоторые антагонистические антитела к IL-7R эффективны in vivo для лечения диабета 1 типа, диабета 2 типа, ревматоидного артрита, GVHD и волчанки.
В некоторых воплощениях предложены антагонистические антитела, которые селективно взаимодействуют и ингибируют функцию IL-7R. В некоторых воплощениях антитело специфически связывается с IL-7R и содержит антигенсвязывающий участок, который конкурирует с моноклональным антителом, выбранным из группы, состоящей из C1GM, С2М3, Р3А9, Р4В3, P2D2, Р2Е11, HAL403a и HAL403b, для связывания с IL-7R. В некоторых воплощениях антитело содержит полипептид, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 42 или SEQ ID NO: 43. В других воплощениях антитело специфически связывается с IL-7R и распознает эпитоп, который перекрывает эпитоп IL-7R, который распознается моноклональным антителом, выбранным из группы, состоящей из C1GM, С2М3, Р3А9, Р4 В3, P2D2, Р2Е11, HAL403a и HAL403b. В некоторых воплощениях антитело связывается с эпитопом, содержащим остатки 182, K84, K100, Т105, и Y192 альфа-цепи рецептора интерлейкина-7 (IL-7Ra). В некоторых воплощениях эпитоп дополнительно содержит один или более дополнительных остатков, выбранных из группы, состоящей из остатков D190, Н191 и K194 человеческого IL-7Ra.
В некоторых воплощениях IL-7R представляет собой человеческий IL-7R.
В некоторых воплощениях антитело специфически связывается с альфа-цепью рецептора интерлейкина-7 (IL-7Rα) и содержит определяющий комплементарность участок один (CDR1) вариабельной области тяжелой цепи (VH), имеющий аминокислотную последовательность X1X2VMH, где X1 представляет собой D или N; Х2 представляет собой S или Y (SEQ ID NO: 50), CDR2 VH, имеющий аминокислотную последовательность X1X2X3X4X5GX6X7TYYADSVKG, где X1 представляет собой L или А; Х2 представляет собой V или I; Х3 представляет собой G или S; Х4 представляет собой W или G; Х5 представляет собой D или S; Х6 представляет собой F, G или S; Х7 представляет собой F, А или S (SEQ ID NO: 51), и CDR3 VH, имеющий аминокислотную последовательность Х1Х2Х3Х4Х5Х6Х7Х8, где X1 представляет собой Q или D; Х2 представляет собой G или I; Х3 представляет собой D или S; Х4 представляет собой Y или G; Х5 представляет собой М, V или G; Х6 представляет собой G или F; Х7 представляет собой N, D или М; Х8 представляет собой N, Y или D (SEQ ID NO: 52), CDR1 вариабельной области легкой цепи (VL), имеющий аминокислотную последовательность TX1SSGX2IX3SSYVQ, где X1 представляет собой R или G; Х2 представляет собой S или R; Х3 представляет собой D или A (SEQ ID NO: 53), CDR2 VL, имеющий аминокислотную последовательность EDX1QRPS, где X1 представляет собой D или N (SEQ ID NO: 54), и CDR3 VL, имеющий аминокислотную последовательность X1X2YX3X4X5X6LX7, где X1 представляет собой Q или М; Х2 представляет собой S или Q; Х3 представляет собой D или А; Х4 представляет собой F или S; Х5 представляет собой Н или S; Х6 представляет собой Н или S; Х7 представляет собой V или W (SEQ ID NO: 55), где указанное антитело блокирует фосфорилирование STAT5 в анализе активации STAT5. В некоторых воплощениях каркасный участок между CDR2 VH и CDR3 VH содержит аминокислотную последовательность аланин-аргинин, где аргинин примыкает к первому аминокислотному остатку CDR3 VH. В некоторых воплощениях каркасный участок между CDR2 VH и CDR3 VH содержит аминокислотную последовательность цистеин-аланин-аргинин, где аргинин примыкает к первому аминокислотному остатку CDR3 VH.
В некоторых воплощениях антитело содержит CDR-контактирующий участок один тяжелой цепи, имеющий аминокислотную последовательность X1X2VMH, где представляет собой D или N; Х2 представляет собой S или Y (SEQ ID NO: 50), CDR-контактирующий участок два тяжелой цепи, имеющий аминокислотную последовательность GWDGFF (SEQ ID NO: 57), и CDR-контактирующий участок три тяжелой цепи, имеющий аминокислотную последовательность ARX1X2X3X4 (SEQ ID NO: 58), CDR-контактирующий участок один легкой цепи, имеющий аминокислотную последовательность SGSIDSSY (SEQ ID NO: 59), CDR-контактирующий участок два легкой цепи, имеющий аминокислотную последовательность EDDQRPSGV (SEQ ID NO: 60), и CDR-контактирующий участок три легкой цепи, имеющий аминокислотную последовательность FHHL (SEQ ID NO: 61), где указанное антитело блокирует фосфорилирование STAT5 в анализе активации STAT5.
В некоторых воплощениях антитело специфически связывается с IL-7Rα и содержит определяющий комплементарность участок один (CDR1) вариабельной области тяжелой цепи (VH), имеющий аминокислотную последовательность DSVMH (SEQ ID NO: 19), GFTFDDS (SEQ ID NO: 46) или GFTFDDSVMH (SEQ ID NO: 47), CDR2 VH, имеющий аминокислотную последовательность LVGWDGFFTYYADSVKG (SEQ ID NO: 23) или GWDGFF (SEQ ID NO: 48), и CDR3 VH, имеющий аминокислотную последовательность QGDYMGNN (SEQ ID NO: 49), или его вариант, имеющий одну или более консервативных аминокислотных замен в CDR1, CDR2 и/или CDR3.
В некоторых воплощениях антитело содержит CDR1 вариабельной области легкой цепи (VL), имеющий аминокислотную последовательность TRSSGSIDSSYVQ (SEQ ID NO: 29), CDR2 VL, имеющий аминокислотную последовательность EDDQRPS (SEQ ID NO: 31), и/или CDR3 VL, имеющий аминокислотную последовательность QSYDFHHLV (SEQ ID NO: 36), или его вариант, имеющий одну или более аминокислотных замен в CDR1, CDR2, и/или CDR3. В некоторых воплощениях антитело дополнительно содержит CDR1 VH, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 19, 46 или 47, CDR2 VH, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 23 или 48, и CDR3 VH, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 49, или его вариант, имеющий одну или более аминокислотных замен в CDR1, CDR2 и/или CDR3.
В некоторых воплощениях антитело специфически связывается с IL-7Ra и содержит определяющий комплементарность участок один (CDR1) вариабельной области тяжелой цепи (VH), имеющий аминокислотную последовательность, представленную в SEQ ID NO: 19, 46 или 47, CDR2 VH, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 23 или 48, и CDR3 VH, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 49, CDR1 вариабельной области легкой цепи (VL), имеющий аминокислотную последовательность, представленную в SEQ ID NO: 29, CDR2 VL, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 31, и CDR3 VL, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 36. В некоторых воплощениях VH-область содержит аминокислотную последовательность EVQLVESGGGLVKPGGSLRLSCAASGFTFDDSVMHWVRQAPGKGLEWVSLVGWD GFFTYYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARQGDYMGNNWG QGTLVTVSS (SEQ ID NO: 40), и VL-область содержит аминокислотную последовательность
NFMLTQPHSVSESPGKTVTISCTRSSGSIDSSYVQWYQQRPGSSPTTVIYEDDQRP SGVPDRFSGSIDSSSNSASLTISGLKTEDEADYYCQSYDFHHLVFGGGTKLTVL (SEQ ID NO: 41). В некоторых воплощениях антитело содержит легкую цепь, имеющую аминокислотную последовательность
NFMLTQPHSVSESPGKTVTISCTRSSGSIDSSYVQWYQQRPGSSPTTVIYEDDQRP SGVPDRFSGSIDSSSNSASLTISGLKTEDEADYYCQSYDFHHLVFGGGTKLTVLQPK AAPSVTLFPPSSEELQANKATLVCLISDFYPGAVWAWKADSSPVKAGVETTTPSKQ SNNKYAASSYLSLTPEQWKSHRSYSCQVTHEGSTVEKTVAPTECS (SEQ ID NO: 43), и тяжелую цепь, имеющую аминокислотную последовательность EVQLVESGGGLVKPGGSLRLSCAASGFTFDDSVMHWVRQAPGKGLEVWSLVGWD GFFTYYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARQGDYMGNNWG QGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALT SGVHTFPAVLQSSGLYSLSSWTVPSSSLGTQTYICNVNHKPSNTKVDKKVAPELLG GPSVFLFPPKPKDTLMISRTPEVTCVWDVSHEDPEVKFNWYVDGVEVHNAKTKPR EEQYNSTYRWSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQV YTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSF FLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 42), с С-концевым лизином или без С-концевого лизина в SEQ ID NO: 42.
В некоторых воплощениях антитело может представлять собой человеческое антитело, гуманизированное антитело или химерное антитело. В некоторых воплощениях антитело представляет собой моноклональное антитело.
В некоторых воплощениях антитело содержит константную область. В некоторых воплощениях антитело состоит из человеческого IgG1 или IgGΔα подкласса. В некоторых воплощениях антитело содержит гликозилированную константную область. В некоторых воплощениях антитело содержит константную область, имеющую увеличенную аффинность связывания с человеческим Fc-гамма рецептором.
В некоторых воплощениях предложена фармацевтическая композиция, содержащая антитело, которое селективно взаимодействует и ингибирует функцию IL-7R.
В некоторых воплощениях предложена клеточная линия, которая рекомбинантно продуцирует антитело, которое селективно взаимодействует и ингибирует функцию IL-7R.
В некоторых воплощениях предложена нуклеиновая кислота, кодирующая антитело, которое селективно взаимодействует и ингибирует функцию IL-7R.
В некоторых воплощениях предложены способы снижения уровней глюкозы в крови у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого снижение уровней глюкозы в крови.
В некоторых воплощениях предложены способы повышения толерантности к глюкозе у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого повышение толерантности к глюкозе.
В некоторых воплощениях предложены способы предупреждения или лечения диабета 1 типа у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов диабета 1 типа.
В некоторых воплощениях предложены способы предупреждения или лечения диабета 2 типа у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагониста IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов диабета 2 типа. В некоторых воплощениях антагонист IL-7R представляет собой антагонистическое антитело к IL-7R.
В некоторых воплощениях предложены способы предупреждения или лечения ревматоидного артрита у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов ревматоидного артрита.
В некоторых воплощениях предложены способы предупреждения или лечения реакции "трансплантат против хозяина" (GVHD) у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов GVHD.
В некоторых воплощениях GVHD представляет собой хроническую GVHD или острую GVHD.
В некоторых воплощениях предложены способы предупреждения или лечения волчанки у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов волчанки.
В некоторых воплощениях волчанка представляет собой кожную красную волчанку, системную красную волчанку, медикаментозную красную волчанку или неонатальную волчанку.
В некоторых воплощениях предложены способы предупреждения или лечения рассеянного склероза у индивидуума. В некоторых воплощениях способ включает введение терапевтически эффективного количества антагонистического антитела к IL-7R индивидууму, нуждающемуся в таком лечении, посредством этого предупреждение или лечение одного или более симптомов рассеянного склероза и сокращение и/или истощение "наивных" и/или активированных Т-клеточных популяций у индивидуума. В некоторых воплощениях сокращенные или истощенные Т-клеточные популяции у индивидуума содержат Тн1- и/или Тн17-клетки. В некоторых воплощениях введение антагонистического антитела к IL-7R не приводит к расширению популяции Тн17-клеток у индивидуума.
В некоторых воплощениях антитело можно вводить парентерально. В некоторых воплощениях индивидуум представляет собой человека.
Краткое описание графических материалов
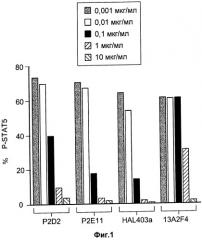
На Фиг.1 показан дозозависимый эффект антагонистических моноклональных антител к IL-7R - P2D2, Р2Е11 и HAL403a - на IL-7-опосредованное фосфорилирование STAT5 в человеческих мононуклеарных клетках периферической крови (PBMCs). На оси х указан процент CD4+ клеток, экспрессирующих фосфо-STAT5 (p-STAT).
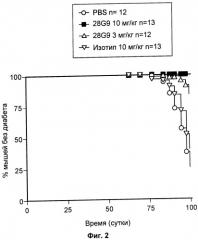
На Фиг.2 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на развитие диабета у нетучных диабетических (NOD) мышей.
На Фиг.3 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на (А) уровни глюкозы в крови (мг/дл) и (Б) массу тела (г) у NOD мышей.
На Фиг.4 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на популяции (А) "наивных" CD8+Т - клеток и (Б) CD8+Т-клеток памяти у NOD мышей. На оси х общая популяция CD8+Т - клеток принята за 100%.
На Фиг.5 показан эффект антагонистического моноклонального антитела против к IL-7R - 28G9 - на популяцию "наивных" CD4+Т - клеток у NOD мышей. На оси х общая популяция CD4+Т-клеток принята за 100%.
На Фиг.6 показан эффект антагонистических моноклональных антител к IL-7R - 28 В6 и 28G9 - на клиническую тяжесть ЕАЕ (экспериментальный аутоиммунный энцефаломиелит) у животных. Клиническую тяжесть ЕАЕ оценивали ежесуточно с помощью системы балльной оценки от 0 до 5:0 -нормальный; 1 - вялый хвост; 2 - частичный паралич задних конечностей; 3 - полный паралич задних конечностей; 4 - паралич четырех конечностей; 5 - состояние угасания или смерть.
На Фиг.7 показан дозозависимый эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на клиническую тяжесть ЕАЕ у животных.
На Фиг.8 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на клиническую тяжесть ЕАЕ у животных.
На Фиг.9 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на животных с установленным ЕАЕ.
На Фиг.10 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - в низкой дозе на животных с установленным ЕАЕ.
На Фиг.11 показан эффект антагонистических моноклональных антител к IL-7R - 28G9 и 28В6 - на популяции (A) CD4 Т-клеток и (Б) CD8 Т-клеток из костного мозга (ВМ), селезенки, крови и лимфатических узлов (LNs) у ЕАЕ животных. На оси х общая популяция лимфоцитов принята за 100%.
На Фиг.12А-В показан эффект антагонистического моноклонального антитела к IL-7 - 28G9 - на популяции (А) "наивных" Т-клеток, (Б) Т-клеток памяти и (В) активированных Т-клеток из костного мозга, селезенки и лимфатических узлов у ЕАЕ животных. На оси х популяция CD8+Т - клеток принята за 100%.
На Фиг.13 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на популяции Тек клеток (левый график) и Treg клеток (правый график) из костного мозга, селезенки и лимфатических узлов у ЕАЕ животных. На оси х популяция CD4+Т - клеток принята за 100%. "*" означает Р<0,05 по сравнению с контролем.
На Фиг.14 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на уровни глюкозы в крови (мг/дл) у мышей с ожирением, индуцированным диетой с высоким содержанием жиров (DIO).
На Фиг.15 показан эффект антагонистического моноклонального антитела к IL-7R - 28G9 - на толерантость к глюкозе у мышей с ожирением, индуцированным диетой с высоким содержанием жиров (DIO).
Подробное описание изобретения
В данной заявке раскрыты антитела, которые демонстрируют антагонистическую активность в отношении функции IL-7R, включая его взаимодействие с IL-7. Предложены способы получения антагонистических антител к IL-7R, композиций, содержащих эти антитела, и способы применения этих антител в качестве лекарственного средства. Антагонисты IL-7R, например антагонистические антитела к IL-7R, могут быть использованы для предупреждения и/или лечения диабета 2 типа, GVHD и аутоиммунных расстройств, включая рассеянный склероз (MS), ревматоидный артрит, диабет 1 типа и волчанку.
Общие методы
При практическом осуществлении настоящего изобретения будут использоваться, если не указано иное, обычные методы молекулярной биологии (включая рекомбинантные методы), микробиологии, клеточной биологии, биохимии и иммунологии, которые находятся в пределах компетенции специалистов в данной области техники. Такие методы описаны в полной мере в литературе, например Molecular Cloning: A Laboratory Manual, second edition (Sambrook et al., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J.Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E.Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I.Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P.Mather and P.E.Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A.Doyle, J.B.Griffiths, and D.G.Newell, eds., 1993-1998) J. Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M.Weir and C.C.Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M.Miller and M.P.Calos, eds., 1987); Current Protocols in Molecular Biology (F.M.Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E.Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A.Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D.Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P. Shepherd and C.Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E.Harlow and D.Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M.Zanetti and J.D.Capra, eds., Harwood Academic Publishers, 1995).
Определения
"Антитело" представляет собой молекулу иммуноглобулина, способную специфически связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и т.д., посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельной области молекулы иммуноглобулина. Используемый в данной заявке термин охватывает не только интактные поликлональные или моноклональные антитела, но и их фрагменты (такие как Fab, Fab', F(ab')2 , Fv), одноцепочечные (ScFv) и доменные антитела (включая, например, антитела акул и верблюдовых) и слитые белки, содержащие антитело, и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антитело включает антитело любого класса, такое как IgG, IgA или IgM (или его подкласс), и антитело не обязательно должно быть какого-либо конкретного класса. В зависимости от аминокислотной последовательности константной области тяжелых цепей антитела иммуноглобулины можно отнести к различным классам. Имеется пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них также могут быть разделены на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
Как используовано в данной заявке, "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, т.е. индивидуальных антител, содержащих идентичную популяцию, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными, направленными против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Определение "моноклональное" указывает на характер антитела как полученного по существу из гомогенной популяции антител и не должно толковаться как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler и Milstein, 1975, Nature 256:495, или могут быть получены методами рекомбинантных ДНК, как описано в патенте США №4816567. Например, моноклональные антитела также могут быть выделены из фаговых библиотек, полученных с использованием методов, описанных в McCafferty et al., 1990, Nature 348:552-554.
Как использовано в данной заявке, "гуманизированное" антитело относится к формам нечеловеческих (например, мышиных) антител, которые представляют собой химерные иммуноглобулины, иммуноглобулиновые цепи или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие последовательности антител), которые содержат минимальную последовательность, происходящую из нечеловеческого иммуноглобулина. Предпочтительно гуманизированные антитела представляют собой человеческие иммуноглобулины (антитело реципиента), в которых остатки из определяющего комплементарность участка (CDR) реципиента заменены остатками из CDR вида, не являющегося человеком (антитело донора), такого как мышь, крыса или кролик, имеющего желаемую специфичность, аффинность и эффективность. В некоторых случаях остатки Fv каркасного участка (FR) человеческого иммуноглобулина заменены нечеловеческими остатками. Кроме того, гуманизированное антитело может содержать остатки, которые не обнаружены ни в антителе реципиента, ни в импортированном CDR или каркасных последовательностях, но включены для дальнейшего совершенствования и оптимизации свойств антитела. В целом, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно двух вариабельных доменов, в которых все или по существу все CDR участки соответствуют таковым в нечеловеческом иммуноглобулине и все или по существу все FR участки представляют собой участки из человеческой консенсусной последовательности иммуноглобулина. Гуманизированное антитело оптимально также содержит по меньшей мере часть константной области или домена (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Предпочтительными являются антитела, имеющие Fc-области, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют один или более CDRs (CDR L1, CDR L2, CDR L3, CDR Н1, CDR H2 или CDR Н3), которые изменены относительно первоначального антитела, которые также называются как один или более CDRs, "происходящих из" одного или более CDRs из первоначального антитела.
Как использовано в данной заявке, "человеческое антитело" означает антитело, имеющее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, продуцируемого человеком, и/или которое было получено с использованием любого из методов получения человеческих антител, известных специалистам в данной области или раскрытых в данной заявке. Это определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид человеческой тяжелой цепи или по меньшей мере один полипептид человеческой легкой цепи. Один такой пример представляет собой антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи. Человеческие антитела можно получать с использованием различных методов, известных в данной области техники. В одном воплощении человеческое антитело селектируют из фаговой библиотеки, где эта фаговая библиотека экспрессирует человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, Proc. Natl. Acad. Sci. (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., 1991, J. Mol. Biol., 222:581). Человеческие антитела также могут быть получены посредством иммунизации животных, которым локусы человеческих иммуноглобулинов были трансгенно введены вместо эндогенных локусов, например мышей, у которых эндогенные гены иммуноглобулинов были частично или полностью инактивированы. Такой подход описан в патентах США №№5545807; 5545806; 5569825; 5625126; 5633425; и 5661016. Альтернативно, человеческое антитело может быть получено посредством иммортализации человеческих В-лимфоцитов, которые продуцируют антитело, направленное против целевого антигена (такие В-лимфоциты можно выделить из индивидуума или, возможно, были иммунизированы in vitro). См., например, Cole et al. Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77, 1985; Boerner et al., 1991, J. Immunol., 147 (1):86-95; и патент США №5750373.
Используемый в данной заявке термин "IL-7R" относится к любой форме IL-7R и его вариантам, которые сохраняют по меньшей мере часть активности IL-7R. Если не указано иное, например, посредством конкретной ссылки на человеческий IL-7R, IL-7R включает нативные последовательности IL-7R всех видов млекопитающих, например человека, собак, кошек, лошадей и крупного рогатого скота.
Используемый в данной заявке "антагонист IL-7R" относится к антителу или молекуле, которая способна ингибировать биологическую активность IL-7R и/или нижележащий(е) путь(и), опосредованный(е) IL-7R сигнальным путем, включая связывание с IL-7, фосфорилирование STAT5, Src киназы, PI3 киназу и Рук2 и активацию белка Вс12. Примеры антагонистов IL-7R включают, без ограничения, антагонистические антитела к IL-7R, siRNA (малые интерферирующие РНК) IL-7R, shRNA (короткие РНК, образующие шпильки) IL-7R и антисмысловые олигонуклеотиды IL-7R.
Антагонистические антитела к IL-7R охватывают антитела, которые блокируют, антагонизируют, подавляют или уменьшают (в любой степени, в том числе значительно) биологическую активность IL-7R, включая нижележащие пути, опосредованные IL-7R-cnmanbHbiM путем, такие как взаимодействие с IL-7 и/или индукция клеточного ответа на IL-7. Для целей настоящего изобретения будет очевидно, что термин "антагонистическое антитело к IL-7R" (взаимозаменяемо называемое "IL-7R антагонистическим антителом", "антагонистическим антителом против IL-7R" или "aHTH-IL-7R антагонистическим антителом") охватывает все ранее идентифицированные термины, названия и функциональные состояния и характеристики, в соответствии с которыми IL-7R сам, биологическая активность IL-7R (включая, но не ограничиваясь этим, взаимодействие с IL-7, его способность опосредовать любой аспект фосфорилирования STAT5, активации пути фосфатидилинозитол-3-киназы (PI3K)-Akt, понижающей регуляции p27Kip1, повышающей регуляции Bcl-2, гиперфосфорилирования Rb и повышающей регуляции CXCR4) или последствия биологической активности по существу отменяются, уменьшаются или нейтрализуются в любой значимой степени. В некоторых воплощениях антагонистическое антитело к IL-7R связывает IL-7R и предупреждает взаимодействие с IL-7. Примеры антагонистических антител к IL-7R представлены в данной заявке.
Как использовано в данной заявке, "полный антагонист" представляет собой антагонист, который при эффективной концентрации практически полностью блокирует измеряемый эффект IL-7R. Под "частичным антагонистом" подразумевают антагонист, который способен частично блокировать измеряемый эффект, но который даже при самой высокой концентрации не является полным антагонистом. "Практически полностью" означает по меньшей мере примерно 80%, предпочтительно по меньшей мере примерно 90%, более предпочтительно по меньшей мере примерно 95% и наиболее предпочтительно по меньшей мере примерно 98% измеряемого эффекта блокируется.
Термины "полипептид", "олигопептид", "пептид" и "белок" используются взаимозаменяемо в данной заявке в отношении цепей аминокислот любой длины, предпочтительно относительно коротких (например, 10-100 аминокислот). Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может прерываться неаминокислотами. Эти термины также охватывают аминокислотную цепь, которая была модифицирована естественно или посредством вмешательства; например, образования дисульфидных связей, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как сопряжение с меченым компонентом. В пределах определения также находятся, например, полипептиды, содержащие один или более аналогов аминокислоты (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области техники. Понятно, что полипептиды могут встречаться в виде одиночных цепей или ассоциированных цепей.
Как известно в данной области техники, "полинуклеотид" или "нуклеиновая кислота", используемые взаимозаменяемо в данной заявке, относятся к цепям нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в цепь с помощью ДНК- или РНК-полимеразы. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. При наличии модификация в нуклеотидной структуре может быть включена до или после сборки цепи. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например путем сопряжения с меченым компонентом. Другие типы модификаций включают, например, "кэпы", замену одного или более встречающихся в природе нуклеотидов аналогом, межнуклеотидными модификациями, такими как, например, модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и т.д.) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), модификации, содержащие боковые группировки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), модификации с интеркаляторами (например, акридином, псораленом и т.д.), модификации, содержащие хелатирующие агенты (например, металлы, радиоактивные металлы, бор, окислительные металлы и т.д.), модификации, содержащие алкилирующие агенты, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида(ов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть замещена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми носителями. 5'- и 3'-концевой ОН может быть фосфорилирован или замещен аминами или органическими кэп-группировками, содержащими от 1 до 20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды также могут содержать аналогичные формы сахаров рибозных или дезоксирибозных сахаров, которые, как правило, известны в данной области техники, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахара, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги нуклеозидов без азотистых оснований, такие как метилрибозид. Одна или более фосфодиэфирных связей могут быть замещены альтернативными связывающими группами. Эти альтернативные связывающие группы включают, но не ограничиваются этим, воплощения, где фосфат замещен P(О)S ("тиоат"), P(S)S ("дитиоат"), (O)NR2 ("амидат"), P(O)R, P(O)OR', CO или CH2 ("формацеталь"), в котором каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), возможно содержащий простую эфирную (-O-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть идентичными. Предшествующее описание относится ко всем полинуклеотидам, упомянутым в данной заявке, включая РНК и ДНК.
"Вариабельная область" антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, либо одной, либо в комбинации. Как известно в данной области техники, каждая из вариабельных областей тяжелой и легкой цепи состоит из четырех каркасных участков (FR), соединенных тремя определяющими комплементарность участками (CDRs), также известными как гипервариабельные участки. CDRs в каждой цепи находятся вместе в непосредственной близости к FRs и с CDRs из другой цепи, вносят вклад в образование антигенсвязывающего сайта антител. Имеется по меньшей мере два метода определения CDRs: (1) подход, основанный на межвидовой изменчивости последовательностей (т.е. Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) подход, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani et al., 1997, J. Molec. Biol. 273:927-948). Как использовано в данной заявке, CDR может относиться к CDRs, определяемым любым из подходов или комбинацией обоих подходов.
Как известно в данной области техники, "константная область" антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, по отдельности или в комбинации.
Используемое в данной заявке антитело "взаимодействует с" IL-7R, когда равновесная константа диссоциации равна или меньше 20 нм, предпочтительно меньше чем примерно 6 нм, более предпочтительно меньше чем примерно 1 нм, наиболее предпочтительно меньше чем примерно 0,2 нм, как измерено методами, описанными в данной заявке в Примере 2.
Эпитоп, который "предпочтительно связывается" или "специфически связывается" (используются взаимозаменяемо в данной заявке) с антителом или полипептидом представляет собой термин, хорошо известный в данной области техники, и методы определения такого специфического или предпочтительного связывания также хорошо известны в данной области техники. Считается, что молекула демонстрирует "специфическое связывание" или "предпочтительное связывание", если она взаимодействует или ассоциирует чаще, быстрее, с боль