Способ прогнозирования эффективности лечения пациентов с неходжкинской лимфомой высокой степени злокачественности
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой способ прогнозирования эффективности лечения пациентов с неходжкинскими злокачественными лимфомами высокой степени злокачественности. Предложенное изобретение может использоваться в медицинской генетике, онкологии и онкогематологии. Эффективность лечения пациентов с неходжкинскими злокачественными лимфомами высокой степени злокачественности определяют по вероятности достижения ремиссии, а также 5-летнему общему и безрецидивному выживанию. Способ включает исследование полиморфизма G13494A 6-го интрона гена ТР53 пациента. При выявлении у пациента гомозиготного генотипа G/G в данном локусе прогнозируют низкую эффективность лечения, а именно малую вероятность 5-летнего выживания пациента и малую вероятность отсутствия рецидива. В случае выявления у пациента генотипа А/А или G/A в данном локусе прогнозируют высокую эффективность лечения, а именно высокую вероятность наступления ремиссии и 5-летнего выживания пациента. Предложенное изобретение позволяет оценить эффективность лечения пациентов с неходжкинскими злокачественными лимфомами высокой степени злокачественности по полиморфизму G13494A 6-го интрона гена ТР53. 5 ил., 10 табл., 2 пр.
Реферат
Изобретение относится к области медицины, конкретнее к медицинской генетике, онкологии и онкогематологии.
Неходжкинские злокачественные лимфомы (НХЗЛ) - это опухоли системы крови с первичным поражением периферических органов кроветворения, опухолевым субстратом которых являются подвергшиеся злокачественной трансформации Т-, В- или NK-лимфоциты различных фаз дифференцировки.
Согласно последней классификации ВОЗ (WHO classification of tumors of haematopoietic and lymphoid tissues in 2008: an overview. Sabbatini E., Bacci F., Sagramoso C., Pileri S.A. \\ Pathologica. 2010. 102. (3). P.83-87), известно более 60 вариантов лимфом, которые в зависимости от зрелости опухолевых клеток могут быть разделены на группы лимфом высокой или низкой степени злокачественности. К лимфомам высокой степени злокачественности относятся: диффузная крупноклеточная, беркиттоподобная, плеоморфная, лимфобластная лимфома/лейкемия, центробластная, иммунобластная, плазмобластная, анапластическая, фолликулярная 3-го цитологического типа, мантийноклеточная и др. К лимфомам низкой степени злокачественности относятся лимфома из малых лимфоцитов/хронический лимфолейкоз, пролимфоцитарная, центроцитарная, лимфоплазмоцитарная, фолликулярная 1-го цитологического типа, грибовидный микоз, маргинальноклеточная, MALT-лимфома и др.
Пациенты с НХЗЛ составляют более 50% контингента гематологических клиник.
Результат лечения данных больных зависит как от применяемых терапевтических средств, которые могут быть менее и более интенсивными, так и от особенностей организма пациента, которые обусловливают большую или меньшую чувствительность к лечению. Обычно терапию начинают с менее интенсивных протоколов, предназначенных для данного вида НХЗЛ. В ряде случаев такой подход оказывается оправданным, лечение эффективным и приводит к ремиссии заболевания. Однако в ряде других случаев такой подход является ошибочным, лечение не приносит должного результата, а пациентом потеряно время на неэффективное лечение. Кроме того, применяющиеся в терапии больных НХЗЛ препараты оказывают токсический эффект на здоровые органы и ткани пациентов. А в случае неэффективности первого курса терапии в опухолевой ткани возникает множественная лекарственная устойчивость (МЛУ). «Общеизвестно, что для уничтожения опухолевых клеток применяются высокотоксичные препараты. Опухолевая клетка, при попадании в нее любого токсина, в том числе противоопухолевого препарата, испытывает состояние стресса. В ответ на это включается механизм защитной-регуляции не только к применявшимся ранее препаратам, но и другим противоопухолевым средствам, отличающимся по структуре и механизму действия. МЛУ - это сохранение опухолевыми клетками жизнеспособности в ответ на воздействие различных лекарственных веществ» (http://www.magericmed.ru/todikamp.html).
Таким образом, при неадекватном выборе самой первой программы лечения, оказавшейся недостаточно действенной, эффективность последующей программы терапии будет значительно снижаться.
Важным этапом решения проблем эффективности терапии, возникновения вторичной МЛУ является оценка некоторых особенностей организма пациента, с которыми связаны указанные проблемы, до начала специфической терапии. Такая оценка позволяет прогнозировать бόльшую или меньшую эффективность лечения и делать вывод о целесообразности первоначального лечения менее сильными или сразу более сильно действующими противоопухолевыми средствами.
На совместной конференции Национального института рака США (NCI) и Американского общества клинической онкологии (ASCO) в 1996 году эффекты противоопухолевой терапии, в том числе и терапии НХЗЛ, были разделены на 4 группы по мере убывания значимости: 1-5-летняя общая выживаемость, 2 - качество жизни, 3 - достижение ремиссии, 4-5-летняя безрецидивная выживаемость (ASCO. Autcomes of cancer treatment of technology assessment and cancer treatment guidelines // J. Clin.Oncology. - 1996. - Vol.14, №3. - P.671-679).
Для НХЗЛ был разработан и до последнего времени с успехом применялся во врачебной практике ряд клинических и лабораторных прогностических моделей эффективности терапии НХЗЛ.
К клиническим моделям относятся следующие:
- FLIPI (Solal-Celigny et al. Follicular lymphoma international prognostic index. Blood 2004; 104(5):1258-1265.),
- MIPI (Hoster et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008; 111(2):558-565),
- IPI (A predictive model for aggressive non-Hodgkin's lymphoma. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. N Engi J Med 1993; 329(14):987-94).
FLIPI является прогностическим индексом только для фолликулярной лимфомы и не применим к другим вариантам НХЗЛ. В качестве неблагоприятных прогностических факторов учитываются возраст более 60 лет, III и IV стадия заболевания, более 4 пораженных зон лимфатических узлов, уровень гемоглобина менее 120 г/л и повышенный уровень лактатдегидрогеназы (ЛДГ) в сыворотке крови пациента. Каждый неблагоприятный прогностический фактор соответствует 1 баллу.
Сумма баллов дает возможность отнести пациента к одной из следующих групп риска неудачного лечения:
- низкий риск (0-1 баллов),
- средний риск (2 балла),
- высокий риск (3-5 баллов).
MIPI является прогностическим индексом только для мантийноклеточных лимфом и не применим к другим вариантам НХЗЛ. Выделяют четыре неблагоприятных прогностических фактора: возраст, общее состояние (ECOG функциональный статус), уровень ЛДГ и лейкоцитов крови. Эти факторы оцениваются следующим образом:
- 0 баллов: возраст менее 50 лет, ECOG функциональный статус 0-1, ЛДГ не более 0,67 от верхней границы нормы, или лейкоцитоз менее 6700 клеток / мкл;
- 1 балл: возраст 50-59 лет, ЛДГ в 0.67-0.99 раза больше верхней границы нормы, или лейкоцитоз от 6700 до 9999 клеток / мкл;
- 2 балла: возраст 60-69 лет, ECOG функциональный статус 2-4, ЛДГ в 1-1.49 раза выше верхней границы нормы, или лейкоцитоз 10,000-14,000 клеток / мкл;
- 3 балла: возраст 70 лет или больше, ЛДГ в 1,5 раза и более выше верхней границы нормы, лейкоцитоз от 15000 клеток / мкл и более.
Сумма баллов дает возможность отнести пациента к одной из следующих группы риска неудачного лечения:
- низкий риск (0-3 балла),
- средний риск (4-5 баллов),
- высокий риск (6-11 баллов).
Для больных с агрессивными вариантами неходжкинских лимфом во всем мире используется способ прогнозирования тяжести течения заболевания, эффективности терапии с помощью суммы независимых факторов риска, которые были положены в основу Международного прогностического индекса (International prognostic index, IPI) (Shipp M.A., Harrington D.P., Andersen J. et al. International Non-Hodgkin's lymphoma prognostic factors project. A predictive model for aggressive non-Hodgkin's lymphoma / N. Engl. J. Med. 1993; 329: 987-94; Поддубная И.В. Клиническая онкогематология/ Под ред. M.A. Волковой. - Москва: «Медицина», 2007 г., с.344-345). Наиболее значимыми из этих факторов являются: возраст старше 60 лет, повышение уровня сывороточной лактатдегидрогеназы (ЛДГ), общее состояние больного, соответствующее 2-4 степени по шкале ECOG, III-IV стадии болезни, наличие более одного экстранодального очага поражения, размер опухоли более 5 см (табл.1).
| Таблица 1 | ||
| Международный прогностический индекс (IPI) | ||
| Факторы | Градация фактора | Прогностическая оценка(в баллах) |
| Возраст | Менее 60 лет | 0 |
| Более 60 лет | 1 | |
| Стадия лимфомы | I||/II | 0 |
| III/IV | 1 | |
| Число экстранодальных поражений | 0 или 1 | 0 |
| 2 и более | 1 | |
| Общесоматический статус по ВОЗ | 0 или 1 | 0 |
| 2 и более | 1 | |
| Уровень общей ЛДГ | Нормальный | 0 |
| Повышен | 1 | |
| Максимальный размер опухоли | Менее 5 см | 0 |
| 5 см и более | 1 |
На основании количества имеющихся неблагоприятных факторов делают прогноз о степени тяжести течения заболевания, эффективности терапии:
- отсутствие неблагоприятных факторов или присутствие лишь одного из них позволяет прогнозировать низкую степень тяжести заболевания, хороший эффект от терапии (1-ая группа по IPI);
- наличие 2-х факторов позволяет прогнозировать низкую/промежуточную степень тяжести заболевания, хороший/промежуточный эффект от терапии (2-я группа по IPI);
- наличие 3-х факторов позволяет прогнозировать промежуточную/ высокую степень тяжести заболевания, промежуточный/низкий эффект от терапии (3-я группа по IPI);
- наличие 4-х факторов позволяет прогнозировать высокую степень тяжести заболевания, неэффективность терапии (4-я группа по IPI).
Наличие двух и более факторов отчетливо отрицательно сказывается на прогнозе тяжести течения заболевания, эффективности лечения независимо от морфологического варианта опухоли. При 1Р1=0-1 частота полных ремиссий после 1-й линии полихимиотерапии (ПХТ) составляет 80%, а 5-летняя выживаемость - 73%. При IРI=4-5 полные ремиссии достигаются у 40% больных, 5-летняя выживаемость составляет всего 25% (И.В. Поддубная. Клиническая онкогематология/ Под ред. М.А. Волковой. - М.: Медицина, 2007 г., с.345).
К лабораторным маркерам неблагоприятного прогноза эффективности лечения относятся следующие:
- уровень экспрессии опухолевыми клетками.антигена Ki-67, который определяется иммуногистохимической окраской (Role and prognostic significance of the Ki-67 index in non-Hodgkin's lymphoma. Broyde A, Boycov O, Strenov Y, Okon E, Shpilberg O, Bairey O. Am J Hematol. 2009 Jun; 84(6):338-43). Повышение его уровня при диффузной В-крупноклеточной лимфоме позволяет разграничить пациентов с благоприятным и неблагоприятным прогнозом. В группе лиц с уровнем экспрессии лимфомными клетками антигена Ki-67 более 70% выживаемость статистически значимо ниже, чем у лиц с уровнем экспрессии Ki-67 менее 70%. Точных критериев применения его при других вариантах НХЗЛ не описано;
- концентрация сывороточного бета2-микроглобулина, лактатдегидрогеназы и тимидинкиназы (Risk classification for large cell lymphoma using lactate dehydrogenase, beta-2 microglobulin, and thymidine kinase. Suki S, Swan F Jr, Tucker S, Fritsche HA, Redman JR, Rodriguez MA, McLaughlin P, Romaguera J, Hagemeister FB, Velasquez WS, et al. Leuk Lymphoma. 1995 Jun; 18(1-2):87-92). Нормальный уровень всех показателей соответствует низкому риску (трехлетняя выживаемость 91%), повышение концентрации одного или двух показателей - среднему риску (трехлетняя выживаемость 36%), а повышение концентрации трех показателей - высокому риску (трехлетняя выживаемость 0%).
Определение бета2-микроглобулина проводится дорогостоящим методом иммунопреципитации. Также следует учесть, что повышение его концентрации может происходить при различных аутоиммунных заболеваниях;
- об ухудшении прогноза заболевания свидетельствует обнаружение в опухоли хромосомных перестроек. Хромосомные аномалии специфичны для вариантов НХЗЛ. Так, например, t(8;22) (транслокация генетического материала между 8 и 22 хромосомами) встречается при лимфоме Беркитта (Breakpoints ofBurkitt's lymphoma t(8;22) translocations map within a distance of 300 kb downstream of MYC. Zeidler R, Joos S, Delecluse HJ, Klobeck G, Vuillaume M, Lenoir GM, Bomkamm GW, Lipp M. Genes Chromosomes Cancer. 1994 Apr; 9(4):282-7). Способ предполагает цитогенетическое исследование, до получения результата которого требуется несколько недель. Этого времени нет, когда речь идет о необходимости выбора терапии у больного с быстро прогрессирующей, агрессивной опухолью.
Кроме того, в уровне техники авторами обнаружены следующие способы прогнозирования эффективности лечения пациентов НХЗЛ высокой степени злокачественности.
1. «Способ ультразвукового прогнозирования лечения неходжкинских лимфом» (патент РФ на изобретение №2211665). Способ основан на том, что на различных этапах противоопухолевого лечения проводится ультразвуковой мониторинг типа кровотока в пораженных лимфоузлах брюшной полости больных лимфобластными лимфомами, на основании которого и устанавливаются клинические критерии неблагоприятного прогноза эффективности терапии.
Помимо того, что данный способ не применим к другим вариантам НХЗЛ высокой степени злокачественности, он не дает возможности установить прогноз до начала специфического лечения с целью профилактики вторичной плейотропной лекарственной устойчивости опухоли к терапии.
2. «Способ прогнозирования эффективности терапии лимфом» (патент РФ на изобретение №2349263). Способ основан на определении в сыворотке крови пациента до начала лечения активности цистеиновых протеаз лизосом катепсинов В и L. При превышении их активности более установленного уровня делают прогноз о низкой эффективности лечения.
Данный способ дает возможность прогнозировать вероятность достижения ремиссии, но не дает возможность прогнозировать отсроченные результаты лечения, такие как 5-летние общая и безрецидивная выживаемость.
3. «Способ прогнозирования тяжести течения и эффективности лечения лимфом» (патент РФ на изобретение №2345367). Способ основан на том, что до лечения в сыворотке крови пациента определяют концентрации провоспалительных цитокинов интерлейкинов IL-1 и IL-6, а в мазках костного мозга определяют относительную долю лимфоидных опухолевых клеток, несущих на своей поверхности рецепторы к цитокинам IL-1 и IL-6. В зависимости от концентрации IL-1 и относительной доли лимфоидных опухолевых клеток, несущих рецепторы к цитокинам IL-1 и IL-6, прогноз является благоприятным или нет.
Данный способ, как и предыдущий, не дает возможности прогнозировать отсроченные результаты лечения (5-летние общую и безрецидивную выживаемость). Кроме того, уровень цитокинов и их рецепторов, которые являются средствами межклеточного взаимодействия элементов иммунной системы, может меняться на фоне различной сопутствующей патологии или осложнений НХЗЛ, например инфекционных заболеваний. Поэтому требуется широкий спектр дообследования пациентов с целью исключения влияния сопутствующей патологии на уровень измеряемых показателей.
4. «Methods for identifying, diagnosing, and predicting survival of lymphomas» (WO 03/021229). Способ основан на использовании микрочипа Lymph Dx для анализа экспрессии совокупности генов. По картине экспрессии генов прогнозируют выживаемость и возможность индивидуализации терапевтического подхода.
Осуществление данного способа требует приобретения дорогостоящих микрочипов, специализированного компьютерного оборудования и программного обеспечения.
5. «Using plasma proteomic pattern for diagnosis, classification, prediction of response to therapy and clinical behavior, stratification of therapy, and monitoring disease in hematologic malignancies» (WO 2004/029575). Способ основан на анализе протеинового профиля больных и обнаружении в нем белков-маркеров, используемых для диагностики и прогнозирования течения и эффективности лечения лимфобластных лимфом.
Данный способ не применим к другим вариантам агрессивных НХЗЛ.
6. «Antibodies against APRIL as biomarkers for early prognosis of lymphoma patients» (WO 2007039489). Способ основан на использовании антител против мембранного рецептора APRIL для диагностики резистентности к терапии и прогнозирования клинического течения диффузной В-крупноклеточной лимфомы у пациентов из группы высокого риска (возраст старше 60 лет и имеющих более 2 баллов, согласно IPI).
Как указано выше, данный способ не применим к другим вариантам агрессивных НХЗЛ.
7. «Method and Kit for the Prognosis of Mantle Cell Lymphoma» (WO 2011012763). Данный способ основан на определении уровня экспрессии опухолевыми клетками, по крайней мере, одного из следующих генов: RNGTT, HDGFRP3, FARP1, HMGB3, LGALS3BP, PON2, CDK2AP1, DBN1, CNR1, CNN3, SOX11, SETMAR и CSNK1E, и применяется для отнесения пациента с диагнозом мантийноклеточной лимфомы в категорию медленно прогрессирующего течения и хорошего ответа на лечение или обычного течения заболевания и более плохого ответа на лечение. Как и предыдущие способы, он не применим к другим вариантам агрессивных НХЗЛ.
8. «Pellino I as a marker for the diagnosis or prognosis of lymphoma» (KR 20120004286). Способ основан на измерения уровня мРНК Pellino 1 в биологическом образце пациента с лимфоидной опухолью и сравнении уровня мРНК в ней с контролем и прогнозировании на основании полученных данных эффективности лечения.
Следует отметить нестабильность молекул РНК, что значительно затрудняет проведение методики и оценку результатов.
9. «Types of lymphoma and method for prognosis thereof» (US 20080068434, 20080206). Способ определения прогноза для пациентов с диффузной В-крупноклеточной лимфомой основан на исследовании хромосомных перестроек и экспрессии маркера CD5. При обнаружении 13q21.1-q31.3 или 1p36.21-p36.13 в сочетании с CD5+делают вывод о плохом прогнозе и вероятной неэффективности лечения, а при обнаружении 5р 15.33-р14.2 в сочетании с CD5- - о благоприятном прогнозе и хорошем ответе на терапию. Использование данного способа также ограничивается лишь одним вариантом НХЗЛ, метод крайне трудоемок, требует дорогостоящего оборудования и реактивов.
10. «Molecule mark for diffuse large b-cell lymphoma treating guide and prognosis judgment» (CN 20071173601). Данный спосрб основан на исследовании маркеров p-Akt и/или YB-1 на поверхности опухолевых клеток больного диффузной В-крупноклеточной лимфомой с целью определения прогноза эффективности терапии и выбора адекватной схемы лечения.
Использование данного способа, как и нескольких предыдущих, ограничивается лишь одним вариантом НХЗЛ.
11. «Methods for Diagnosis and Prognosis of Malignant Lymphoma» (US 2008004208). Способ основан на том, что при обнаружении в процессе массивной геномной сравнительной гибридизации перестроек в хромосомах 1 от р36.23 до р36.32, хромосоме 1 от q42.2 до q43, хромосоме 2 р11.2, хромосоме 2 q13, хромосоме 17 от р11.2 до р 13.3 и хромосоме 19 от р13.2 до р13.3 делают вывод о неудовлетворительном прогнозе ответа на лечение больных НХЗЛ.
Для осуществления данного способа требуется приобретение дорогостоящих специализированного оборудования и программного компьютерного обеспечения.
12. «Method of diagnosis primary mediastinal B-cell lymphoma or classical Hodgkin lymphoma. by detecting functional mutation at CIITA locus» (WO/2012/113064). Способ основан на выявлении мутаций в гене, которые могут применяться для диагностики, прогнозирования течения и мониторирования первичной В-крупноклеточной лимфомы средостения в процессе терапии, а также прогнозирования эффективности лечения.
Использование данного способа ограничивается лишь данным вариантом НХЗЛ с локализацией в средостении. 13. «Hematological cancer profiling system» (EP 1805197 A1). Способ основан на использовании набора полинуклеотидных зондов для целого ряда генов для диагностики, классификации, лечения, мониторинга прогрессирования заболевания, предсказывания исхода заболевания или осложнения лимфом и лейкозов.
Данный способ трудоемок и сложен технически, а также дорогостоящ.
14. «Compositions and methods relating to CNS lymphoma» (WO/2006/091861). Способ предназначен для диагностики, прогнозирования эффективности лечения лимфом центральной нервной системы.
Использование данного способа ограничивается НХЗЛ с локализацией в центральной нервной системы.
Кроме вышеуказанных ограничений способов, известных из уровня техники, следует сказать еще о том, что все они разработаны на больных, которых лечили без применения препаратов моноклональных антител (иммунотерапии). Как оказалось, при использовании препаратов моноклональных антител методы прогнозирования эффективности лечения у больных НХЗЛ, разработанные на больных, в отношении которых применяли только химиотерапию, не работают или работают недостаточно эффективно. Подробнее об этом сказано ниже.
До недавнего времени основным методом терапии НХЗЛ являлась программная полихимиотерапия (ПХТ), которая неспецифична в отношении опухоли и оказывает токсическое действие на здоровые ткани организма, что делает невозможным увеличение дозировок химиопрепаратов с целью преодоления МЛУ.
В последние годы появились высокоактивные лекарственные препараты моноклональных антител, способных воздействовать исключительно на лимфоидные клетки и уничтожать их, не повреждая другие ткани.
За рубежом в рамках иммунохимиотерапии уже более десятка лет применяются препараты моноклональных антител, связывающихся с фосфопротеином В-лимфоцитов CD20 и запускающих апоптоз (комплемент зависимая, прямая и иммунологическая цитотоксичность) (Blood. 1997 Sep 15;90(6):2188-95. IDEC-C2B8 (Rituximab) anti-CD20 monoclonal antibody therapy in patients with relapsed low-grade non-Hodgkin's lymphoma. Maloney DG, Grillo-Lopez AJ, White CA, Bodkin D, Schilder RJ, Neidhart JA, Janakiraman N, Foon KA, Liles TM, Dallaire BK, Wey K, Royston I, Davis T, Levy R). CD20 экспрессируется В-клетками, начиная с ранних пре-В-клеток и далее на всех этапах дифференцировки, исключая плазмоциты, и является прекрасной мишенью для лечения В-клеточных лимфом.
В России в 2005 году была введена программа «Дополнительного лекарственного обеспечения» и в 2008 году - программа «7 нозологии», что позволило включить препарат CD20 антитело (ритуксимаб) в протоколы лечения большинства больных В-клеточными СD20-позитивными лимфомами в России.
Применяемый с этого момента комплексный терапевтический подход, предусматривающий применение традиционных химиотерапевтических воздействий вместе с описанной иммунотерапией, безусловно, улучшает результаты терапии данной категории пациентов. Так, например, при диффузной В-крупноклеточной лимфоме, являющейся одной из наиболее распространенных вариантов НХЗЛ, в настоящее время 5-летняя выживаемость составляет 58% против 45% до применения препаратов моноклональных антител (The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Sehn LH, Berry B, Chhanabhai M, Fitzgerald C, Gill K, Hoskins P, Klasa R, Savage KJ, Shenkier T, Sutherland J, Gascoyne RD, Connors JM. Blood. 2007 Mar 1; 109(5): 1857-61. Epub 2006 Nov 14). Одним из основных препятствий для дальнейшего прогресса в лечении НХЗЛ по-прежнему является приобретение клетками опухоли резистентности, но уже не только к цитостатической и лучевой, но и иммунной терапии, т.е. плейотропной резистентности.
Одновременно с началом клинического применения иммунохимиотерапии стали появляться сообщения о том, что хорошо зарекомендовавшие себя ранее методы прогнозирования эффективности химиотерапевтического лечения у больных НХЗЛ при использовании иммунохимиотерапии утратили свое значение (Prognostic models for diffuse large B-cell lymphoma in the rituximab era: a never-ending story. Ban A, Marcheselli L, Sacchi S, Marcheselli R, Pozzi S, Ferri P, Balleari E, Musto P, Neri S, Aloe Spiriti MA, Cox MC. Ann Oncol. 2010 Jul; 21(7): 1486-91).
Был переработан индекс IPI для оценки тяжести заболевания и эффективности терапии у пациентов с агрессивными лимфомами, которые получали препарат моноклональных антител ритуксимаб. Пересмотренный R-IPI использует те же факторы, но делит пациентов только на 3 группы риска:
- очень хороший прогноз (без неблагоприятных прогностических факторов),
- хороший прогноз (1 или 2 неблагоприятных прогностических факторов),
- плохой прогноз (3 и более неблагоприятных прогностических факторов).
В исследовании, на основании которого был разработан R-IPI, около 95% больных из группы очень хорошего прогноза жили не менее 4 лет, в то время, как только около 55% больных из группы плохого прогноза жили не менее 4 лет (The revised International Prognostic Index (R-IPI) is a better predictor of outcome than the standard IPI for patients with diffuse large B-cell lymphoma treated with R-CHOP. Sehn LH, Berry B, Chhanabhai M, Fitzgerald C, Gill K, Hoskins P, Klasa R, Savage KJ, Shenkier T, Sutherland J, Gascoyne RD, Connors JM.Blood. 2007 Mar 1; 109(5): 1857-61. Epub 2006 Nov 14.; Relevance of the International Prognostic Index in the rituximab era. Tay K, Tai D, Tao M, Quek R, Ha TC, Lim ST.J Clin Oncol. 2011 Jan 1; 29(1):e14;).
Кроме переработанного индекса IPI, лишь два способа (они приведены ниже) из обнаруженных в результате патентно-информационного поиска дают возможность прогнозировать выживаемость пациентов с агрессивными НХЗЛ в случае применения как схем полихимиотерапии с включением антрациклинов, так и в случае схем иммунохимиотерапии, сочетающих антрациклины и анти-СD20 антитела:
1. Alizadeh A.A. et al. изучали ассоциацию уровня экспрессии LMO2 и TNFRSF9 с прогнозом выживаемости больных диффузной В-крупноклеточной лимфомой (Prediction of survival in diffuse large B-cell lymphoma based on the expression of 2 genes reflecting tumor and microenvironment. Alizadeh AA, Gentles AJ, Alencar AJ, Liu CL, Kohrt HE, Houot R, Goldstein MJ, Zhao S, Natkunam Y, Advani RH, Gascoyne RD, Briones J, Tibshirani RJ, Myklebust JH, Plevritis SK, Losses IS, Levy R. Blood. 2011 Aug.4; 118(5):1350-8). На основании полученных данных авторами разработан способ «Methods of Prognosis for Non-Hodgkin Lymphoma» (US 2012134986), основанный на измерении уровня экспрессии опухолевыми клетками маркера LMO2 и уровня экспрессии клетками микроокружения маркера TNFRSF9. В работе показано, что повышение уровня LMO2 и TNFRSF9 коррелирует с хорошим ответом на терапию, состоящую из схем с антрациклинами, как включающую так и не включающую препараты анти-CD20 антител, и увеличением 10-летней общей выживаемости.
Данный способ пригоден только для пациентов с диффузной В-крупноклеточной лимфомой и не дает возможность прогнозировать вероятность достижения ремиссии, а также безрецидивную выживаемость пациентов.
2. Сообщение Barrans S. et al. свидетельствует о том, что у пациентов с диффузной В-крупноклеточной лимфомой, получающих терапию R-CHOP (т.е. лечение с применением ритуксимаба), перестройки гена MYC являются неблагоприятным прогностическим фактором (Rearrangement of MYC is associated with poor prognosis in patients with diffuse large B-cell lymphoma treated in the era of rituximab., Crouch S, Smith A, Turner K, Owen R, Patmore R, Roman E, Jack A.J Clin Oncol. 2010 Jul 10; 28(20):3360-5. Epub 2010 May 24) (прототип). Трехлетняя выживаемость пациентов составила 35% против 61% без перестройки гена MYC.
Данный способ пригоден, как уже указано выше, только для пациентов с диффузной В-крупноклеточной лимфомой и требует одновременного применения двух методов: иммуногистохимического метода для определения экспрессии гена MYC и FISH-метода (fluorescent in situ hybridization - (флюоресценция в месте гибридизации) для непосредственного выявления перестройки данного гена. FISH-метод требует дорогостоящего оборудования, компьютерной базы с программным обеспечением.
Способ позволяет прогнозировать только 3-летнюю общую выживаемость, тогда как в онкологии общепринятым периодом наблюдения является 5-летний. Данный способ не дает возможность прогнозировать безрецидивную выживаемость, а также вероятность достижения ремиссии.
В качестве прототипа указан последний способ (сообщение Barrans S. et al.). Он основан, как и предлагаемый способ, на генетическом признаке пациента, разработан на больных, получавших лечение ритуксимабом, и прогнозирует выживаемость. Однако данный способ предназначен только для больных с диффузной В-крупноклеточной лимфомой.
Близким к предлагаемому является также переработанный IPI - R-IPI. Данный способ не использует генетический признак, но разработан на больных, получавших лечение ритуксимабом, позволяет прогнозировать выживаемость и, как и предлагаемый способ, предназначен для больных с различными формами агрессивных НХЗЛ.
На основе анализа уровня техники можно резюмировать, что существующие способы имеют те или иные ограничения:
1. Предназначены для отдельных гистологических вариантов агрессивных НХЗЛ (только лимфобластные, только мантийноклеточная, только диффузная В-крупноклеточная) или даже для лимфом определенной локализации (средостение, центральная нервная система);
2. В то время, как в онкологии и онкогематологии одними из важнейших показателей эффективности терапии являются достижение ремиссии, время жизни больного (5-летняя выживаемость), качество этой жизни, которое напрямую зависит от рецидивирования опухолевого процесса, прогностичность вышерассмотренных способов основана на анализе только частоты достижения ремиссии, либо только общей выживаемости пациентов, без возможности прогнозирования рецидивов;
3. Способы, основанные на сравнительной геномной гибридизации, изучении хромосомных перестроек и использовании микрочипов трудоемки, требуют приобретения дорогостоящих материалов, специализированного компьютерного оборудования и программного обеспечения;
4. Осуществление способов, основанных на манипуляциях с молекулами РНК, затруднено нестабильностью данных молекул;
5. Ряд способов не дают возможности прогнозирования эффективности лечения заболевания до начала специфической терапии;
6. Применение способа, основанного на исследовании уровня цитокинов и их рецепторов на поверхности лимфоцитов, ограничено необходимостью широкого спектра дообследования пациента с целью исключения влияния сопутствующей патологии на уровень измеряемых показателей. В случае наличия у пациента осложнений инфекционных НХЗЛ влияние на уровень измеряемых показателей инфекционного и опухолевого процесса разграничить практически невозможно;
7. Наконец, все описанные выше способы, кроме последних двух и переработанного IPI, не дают возможности прогнозировать эффективность терапии в случае применения иммунохимиотерапии, включающей препараты моноклональных анти-СD20 антител (ритуксимаб), в то время, как иммунохимиотерапия сейчас является золотым стандартом лечения всех В-клеточных НХЗЛ.
Предлагаемое изобретение основано на исследовании связи между наличием у человека однонуклеотидной замены G13494A в 6 интроне антионкогена ТР53 и прогнозом эффективности лечения пациентов с неходжкинскими лимфомами высокой степени злокачественности.
Ген ТР53 - ключевой регулятор постоянства генома клетки. Дефицит его функции способен вызывать МЛУ опухолевых клеток, по меньшей мере, тремя способами: отменяя апоптоз, учащая мутационный процесс и повышая активность генов, определяющих те или иные механизмы лекарственной устойчивости (Многоликий р53: разнообразие форм, функций, опухольсупрессирующих и онкогенных активностей. Б.П. Копнин, П.Б. Копнин, Н.В. Хромова, Л.С. Агапова // Гематология. Т.1, №1, 2008).
В последовательности гена ТР53 были обнаружены 19 олигонуклеотидных полиморфизмов, один из которых находится в 13494 позиции 6 интрона антионкогена ТР53 и состоит в замене гуанина на аденин G13494A) (A novel polymorphism in intron 6 of the human р53 gene: a possible association with cancer predisposition and susceptibility / S. Peller [et al.] // DNA Cell Biol.- 1995, Dec. - Vol.14, №12. - P. 983-90). Замена G на А в 61 паре нуклеотидов 6 интрона (основание номер 13494) гена ТР53 определяется по рестрикции ферментом MspI. Этот фермент способен распознавать и разрезать нить ДНК при нахождении в 61 паре нуклеотидов 6 интрона гена ТР53 гуанина (G). В случае замены G на аденин (А) рестрикция данным ферментом становится невозможной.
Относительно полиморфизма G13494A 6 интрона гена ТР53 в уровне техники имеются следующие сведения:
1. Показана ассоциация комбинации гетерозиготого генотипа G/A полиморфного локуса G13494A 6 интрона гена ТР53 в сочетании с гетерозиготностыо по двум другим полиморфным локусам dupl6bp 3 интрона (w/dupl6) и Arg72Pro 4 экзона (Arg/Pro) гена ТР53 с более высокими показателями общей выживаемости больных немелкоклеточным раком легкого по сравнению с комбинацией гомозиготных генотипов по частым аллелям 3 интрона, 4 экзона и 6 интрона (w/w-Arg/Arg-G/G) (p<0,04) (Гервас П.А. Генетический полиморфизм гена-онкосупрессора р53 и функционально связанных с ним генов CCR5 и XRCC1 при раке легкого. Автореферат диссертации на соискание ученой степени кандидата медицинских наук. Томск - 2007, с.22).
2. При хроническом лимфолейкозе/лимфоме из малых лимфоцитов, который относится к НХЗЛ низкой степени злокачественности, А/А генотип полиморфизма G13494A 6 интрона гена ТР53 ассоциирован с начальными стадиями заболевания, CD38 негативым статусом и более длительным периодом до необходимости начала специфического лечения, что свидетельствует о благоприятном течении заболевания. Однако влияния данного полиморфизма на общую выживаемость не отмечено (Leuk Res. 2006 Sep; 30(9):1113-8. Two germ line polymorphisms of the tumour suppressor gene p53 may influence the biology of chronic lymphocytic leukaemia. Kochethu G, Delgado J, Pepper C, Starczynski J, Hooper L, Krishnan S, Fegan C, Pratt G).
Наличие, по меньшей мере, 9 разных изоформ белка ТР53, имеющих тканеспецифический характер, несомненно, не позволяет экстраполировать результаты, полученные на других видах опухолевых заболеваний, на пациентов с агрессивными НХЗЛ.
Данные о роли полиморфизма G13494A гена ТР53 при агрессивных неходжкинских лимфомах, в уровне техники отсутствуют.
Раскрытие изобретения
Сущность предлагаемого способа прогнозирования эффективности лечения пациентов с неходжкинскими злокачественными лимфомами высокой степени злокачественности, а именно вероятности достижения ремиссии, 5-летнего общего и безрецидивного выживания, состоит в следующем. Исследуют полиморфизм G13494A 6-го интрона гена ТР53 пациента и при выявлении у пациента гомозиготного генотипа G/G в данном локусе прогнозируют низкую эффективность лечения, а именно малую вероятность 5-летнего выживания пациента и малую вероятность отсутствия рецидива, а при выявлении у пациента генотипа А/А или G/A в данном локусе прогнозируют высокую эффективность лечения, а именно высокую вероятность наступления ремиссии и 5-летнего выживания пациента.
По сравнению с аналогами предлагаемый способ:
- эффективен в отношении различных вариантов агрессивных НХЗЛ;
- дает возможность получить более полную картину прогноза эффективности лечения пациентов с агрессивными НХЗЛ, включающую вероятность достижения ремиссии, общую и безрецидивную 5-летнюю выживаемость, от которой зависит качество жизни пациента,
- осуществление предлагаемого способа предполагает манипуляции с молекулами ДНК, которые значительно более стабильны во внешней среде, в сравнении с молекулами РНК, что не требует строгого соблюдения очень коротких (несколько десятков минут) временных интервалов от момента забора материала для исследования до выделения ДНК и выполнения анализа,
- предлагаемый способ дает возможность прогнозирования эффективности лечения заболевания до начала специфической терапии,
- в отличие от уровня цитокинов в крови и их рецепторов на поверхности лейкоцитов, генотип полиморфизма G13494A в 6 интроне гена ТР53, на определении которого основан предлагаемый способ, является постоянной, не изменяющейся в течение всей жизни человека характеристикой,
- предлагаемый способ дает возможность прогнозировать эффективность терапии агрессивных НХЗЛ в случае применения иммунохимиотерапии, включающей препараты моноклональных анти-СD20 антител (ритуксимаб).
По сравнению с прототипом предлагаемый способ:
- эффективен в отношении различных вариантов агрессивных НХЗЛ;
- технически существенно проще и малозатратнее по времени и средствам, т.к. использует ПЦР-ПДРФ анализ (ПЦР - полимеразная цепная реакция; ПДРФ - полиморфизм длин рестрикционных фрагментов),
- дает возможность получить более полную картину прогноза эффективности лечения. Как выше уже было указано, выделяют 4 показателя эффективности противоопухолевой терапии. В прототипе используется только один -3-летняя выживаемость, хотя в онкологии общепринятым периодом наблюдения является 5-летний период (ASCO. Autcomes of cancer treatment of technology assessment and cancer treatment guidelines // J. Clin.Oncology. - 1996. - Vol.14, №3. - P.671-679). В предлагаемом способе используют 3 показателя эффективности терапии - прогнозируется вероятность достижения ремиссии, вероятность дожития больным 5-летнего срока от даты постановки диагноза, а также вероятность безрецидивного дожития больным данного срока, от чего зависит и 4-й показатель - качество жизни пациента.
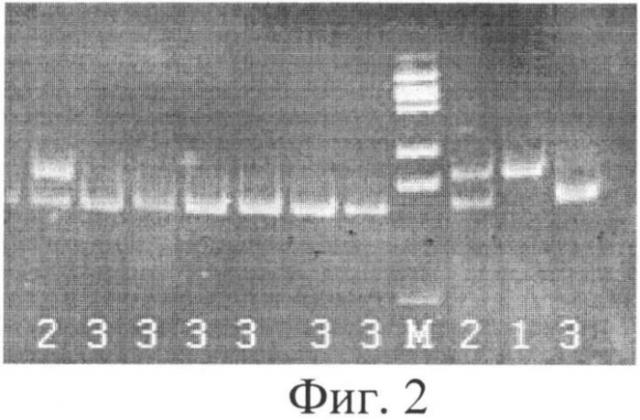
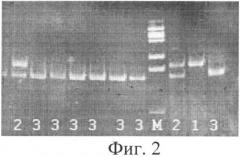
При осуществлении предлагаемого способа на первом этапе в ПЦР реакции получают фрагмент гена ТР53 обследуемого пациента длиной 404 пары нуклеотидов (п.н.). Этот фрагмент может содержать в позиции 13494 G (гуанин) (частый аллель) либо А (аденин)(редкий аллель). Затем проводят рестрикцию полученного на первом этапе ампликона с использованием эндонуклеазы рестрикции MspI, которая расщепляет только частый вариант аллеля (содержащий G в позиции 13494) и разрезает его на два фрагмента длиной 336 п.н. и 68 п.н. Далее проводят электрофорез продуктов гидролиза. Могут получиться три варианта картин электрофореза. Наличие на электрофорезе одной полосы длиной 404 п.н. свидетельствует об отсутствии гидролиза ампликона и гомозиготном минорном генотипе А/А у пациента;
одной полосы длиной 336 п.н. - о гидролизе всего ампликона и гомозиготном частом генотипе G/G; наличие двух полос длиной 404 п.н. и 336 п.н. - о частичном гидролизе ампликона и гетерозиготном генотипе G/A у пациента.
Перечень фигур иллюстративного материала:
Фиг.1. Электрофоретический анализ результатов ПЦР фрагмента ДНК, содержащего полиморфизм G13494A в 6 интроне гена ТР53. М - ДНК-маркер молекулярного веса (100 п.н.).
Фиг.2. Результаты электрофоретического анализа продуктов MspI-гидролиза ампликонов, полученных на предыдущем этапе. 1 - 404 п.н. (А/А); 2 - 404+336+68 п.н. (G/A); 3 - 336+68 п.н. (G/G); М - ДНК маркер по 100 п.н.
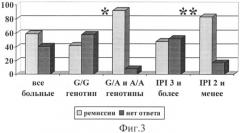
Фиг.3. Частота ремиссии в группе больных агрессивными НХЗЛ в зависимости от генотипа локуса 13494 6 интрона гена ТР53 и IPI. Первые два столбца относятся ко всей обследованной группе больных; вторые - к подгруппе больных с G/G-генотипом; третьи - к подгруппе больных с генотипами G/A или А/А; четвертые - к подгруппе больных с величиной индекса R-IPI или IPI, равной 3 и более; пятые - с величиной индекса R-IPI или IPI, равной 2 и менее.
Примечание: * уровень значимости отличия р<0,005 группы больных с G/G генотипом в сравнении с больными с G/A и А/А генотипами; ** уровень значимости отличия р<0,05 группы больных с 3 и более и 2 и менее неблагоприятными факторами прогноза, согласно R-IPI (IPI).
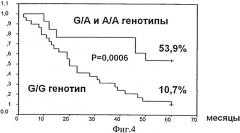
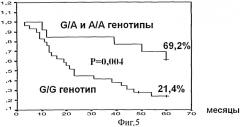
Фиг.4. Безрецидив