Способ хирургического лечения глаукомы с малоинвазивным спонч-дренированием передней камеры
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологической хирургии, и может быть использовано для хирургического лечения глаукомы с малоинвазивным спонч-дренированием передней камеры. Для этого выкраивают эписклеральный лоскут. Полость передней камеры заполняют стерильным воздухом. Затем формируют фильтрующие отверстия у основания выкроенного эписклерального ложа. Данные отверстия формируют, производя вкол-выкол изогнутой атравматичной иглой с нитью через полость передней камеры, параллельно лимбу. Затем укладывают биоматериал Аллоплант для спонч-дренирования в склеро-склеральное пространство. Эписклеральный лоскут фиксируют к краям донорского ложа швами. Далее пилящими движениями осуществляют дозированное увеличение фильтрующих отверстий. Нити удаляют. Конъюнктивальную рану ушивают. Способ повышает эффективность хирургического лечения глаукомы за счет дозированной фильтрации камерной влаги, исключает острую декомпрессию передней камеры глаза, что, в свою очередь, предотвращает развитие интра- и послеоперационных осложнений, а также предотвращает формирование склеро-склеральных сращений. 5 ил., 2 пр.
Реферат
Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано для хирургического лечения глаукомы с малоинвазивным спонч-дренированием передней камеры.
Известны хирургические способы лечения глаукомы, основанные на создании путей оттока внутриглазной жидкости хирургическим путем (Нестеров А.П. Глаукома. 1995. 256 с.), суть которых заключается в создании сообщения полости передней камеры с субконъюнктивальным и/или супрахориоидальным пространствами. Однако указанные операции сопряжены с обязательным интраоперационным вскрытием передней камеры и неминуемо приводят к декомпрессии полости последней, порой на длительное время, вследствие чего очень часто развиваются такие осложнения, как выраженная гипотония; цилио-хориоидальная отслойка; гифема; супрахориоидальное кровотечение и экспульсивная геморрагия (Линник Л.Ф., Григорьянц Т.Н., Лейкина С.А., Безпальчий А.Н. К вопросу об экспульсивной геморрагии. /Клинические аспекты патогенеза и лечения глаукомы: Сб. научн.статей МНИИ МП. - М.,1984.- С.118-123; Астахов Ю.С. - Экспериментальное изучение гемодинамики глаза: Дисс.канд.мед.наук. - Л., 1969; Брошевский Т.И. Первичная глаукома и осложнения после операции. / Офтальмол. журнал. - 976. - К6. - С.403-407).
Очевидным является факт, что в случае потери пациентом зрения, особенно в единственном глазу, хирурга и пациента посещает мысль о целесообразности испытанного риска. В то же время в случае потери зрения от глаукомы, не поддающейся медикаментозной коррекции, все понимают, что своевременно выполненная антиглаукомная операция могла спасти зрение, но в то же время понятно, что для этого, обязательным условием является отсутствие интра и/или послеоперационных осложнений, от которых пациент не застрахован. Хирургами предприняты попытки по разработке методов лечения глаукомы, исключающих выраженную декомпрессию передней камеры, из которых наиболее популярными являются непроникающие антиглаукомные операции, одним из основателей которых является М.М. Краснов (Краснов М.М. Синусотомия при глаукоме // Вестн. офтальмол. 1964. С.37-41). В последующем безопасность операции привлекла многих хирургов-последователей, которые дополнительно модифицировали указанную методику с целью ускорения фильтрации внутриглазной жидкости. Так, Б.Н. Алексеев использовал кроме синусотомии «синусокюретаж», при котором с помощью специального шероховатого зонда через Шлемов канал удалялся слой эндотелия, и трабекула становилась тоньше и более проницаемой для камерной влаги (Алексеев Б.Н. Микрохирургия внутренней стенки шлеммова канала при открытоугольной глаукоме / /Вестн. офт. 1978. №4. С.14-20).
Известно использование гипотензивной операции - непроникающей глубокой склерэктомии (НГСЭ) (Соколовская Т.В., Тимошкина Н.Т., Ерескин Н.Н., Иванова Е.С. Непроникающая микрохирургия первичной открытоугольной глаукомы./Клиническая офтальмология.- 2003 - №2 - С.84-86; Федоров С.Н., Козлов В.И., Тимошкина Н.Т., Шарова А.Б., Ерескин Н.Н., Козлова Е.Е. Непроникающая глубокая склерэктомия при открытоугольной глаукоме // Офтальмохирургия. 1989-№3-4. С.52-55.), в ходе выполнения которой, дополнительно к трабекулярной, формируется отток внутриглазной жидкости через водопроницаемую периферическую часть десцеметовой мембраны.
Общим недостатком вышеописанных способов является невыраженный и нестойкий гипотензивный эффект.
Известен способ лечения открытоугольной глаукомы (патент РФ №2394534, МПК A61F 9/007, опубл. 20.07.2010), в ходе выполнения которого под эписклеральным лоскутом отсепаровывается глубокий склеральный лоскут с обнажением трабекулярной сети и крайней периферии десцеметовой оболочки, после чего удаляется слой эндотелия шлеммова канала с юкстаканаликулярной тканью, далее, проходя микрошпателем между корнеосклероувеальными и увеальными трабекулами, формируется «тоннель» с меридиональной порцией цилиарной мышцы, открывая ход в межмышечные щели. На завершающем этапе через новообразованное пространство пропускают нить при помощи иглы, производя два «вкола-выкола» по краям интрасклерального ложа, после чего проведенными нитями крест-накрест фиксируют дренаж, уложенный в интрасклеральном ложе, одновременно подтягивая склеральную шпору с корнеосклероувеальными трабекулами, что обеспечивает дополнительную активацию увеосклерального пути оттока внутриглазной жидкости.
Недостатком вышеуказанного способа является то, что он не обеспечивает интенсивной фильтрации внутриглазной жидкости в силу малого диаметра просвета между сохраненными в ходе операции трабекулами, которые при глаукоме патологически изменены, что и послужило одной из причин возникновения глаукомы, в то время как отверстия, наносимые иглой, не являются сквозными и служат для проведения ниток и их подтягивания с целью активации увеосклерального пути оттока вследствие деформации склеральной шпоры с корнеосклероувеальными трабекулами. Активированный при данной операции увеосклеральный путь оттока не может взять на себя функцию основного дренажа внутриглазной жидкости, так как в этом случае избыточное поступление внутриглазной жидкости в указанное пространство приведет к отслойке цилиарного тела, сосудистой оболочки с развитием гипотонии (описано выше), что в конечном итоге кульминируется субатрофией и потерей глаза как органа. Кроме того, применение дренажа и наличие ниток в фильтрационной зоне заведомо определяет временный характер гипотензивного эффекта данной антиглаукомной операции в силу того, что эволюционно выработанной ответной реакцией организма на введение любого инородного тела является местная воспалительная реакция и формирование вокруг инородного тела капсулы с активным участием фибробластов, приводящее к рубцовому заращению хирургически созданных путей оттока камерной влаги. По очевидным причинам данная операция также неэффективна при глаукоме с органическим блоком угла передней камеры.
Наиболее близким к предложенному является способ хирургического лечения глаукомы с использованием микроинвазивной техники непроникающей глубокой склерэктомии, где для ускорения оттока камерной влаги применяется дополнительная лазерная десцеметогониопунктура (Тахчиди Х.П., Иванов Д.И., Бардасов Д.Б. Отдаленные результаты микроинвазивной непроникающей глубокой склерэктомии // Материалы III евроазиатской конференции по офтальмохирургии. - часть I. - раздел II. Екатеринбург. 2003. - С.90-91). Его недостатком является непредсказуемый гипотензивный эффект за счет невозможности точного определения дозопоглощающего эффекта ткани. Вскрытие передней камеры при помощи лазера производится в условиях слабой фильтрации камерной влаги и, как следствие, отсутствия гидравлического клина, препятствующего склеро-склеральному контакту, вследствие чего начинают формироваться склеро-склеральные сращения, приводящие к заращению хирургически созданных путей оттока. Кроме того, на фоне глаукомы роговица часто отечна, а десцеметова мембрана после антиглаукомной операции имеет складчатость, вследствие чего качественное выполнение лазерной десцеметогониопунктуры с учетом дозопоглащающего эффекта не представляется возможным, не говоря о случаях наличия дооперационного бельма роговицы.
Техническим результатом изобретения является повышение эффективности хирургического лечения глаукомы за счет дозированной фильтрации камерной влаги.
Технический результат достигается способом хирургического лечения глаукомы, включающим выкраивание эписклерального лоскута, формирование в углу передней камеры фильтрующих отверстий для оттока внутриглазной жидкости, последующую фиксацию лоскута к краям донорского ложа швами, ушивание конъюктивальной раны непрерывным швом. В отличие от прототипа фильтрующие отверстия выполняют после тампонады передней камеры стерильным воздухом путем сквозного проведения нитей через переднюю камеру при помощи изогнутой атравматичной иглы, производя «вкол-выкол» параллельно лимбу, после чего укладывают биоматериал Аллоплант для спонч-дренирования в склеро-склеральном пространстве, а после фиксации эписклерального лоскута дозированно увеличивают фильтрующие отверстия, осуществляя пилящие движения нитями перед их удалением.
Известен биоматериал Аллоплант для спонч-дренирования при глаукоме, который изготовлен из губчатого биоматериала и имеет губчатую структуру («спонч»). Благодаря микропористой структуре Аллоплант интенсивно впитывает влагу передней камеры и способствует ее оттоку в супрахориоидальное пространство, т.е. в задний отдел глазного яблока (Биоматериалы «Аллоплант для регенеративной хирургии», информационное письмо Москва-Уфа-2006 г., с.15, 33). Технический результат изобретения достигается благодаря тому, что созданные в ходе операции фильтрующие отверстия становятся деятельными в условиях, когда эписклеральный лоскут уже надежно зафиксирован в донорском обеспечивает дозированную фильтрацию камерной влаги, предотвращая склеро-склеральное сращение и, как следствие, потерю эффективности механизмов, заложенных в проводимой операции. Кроме того, используемый в качестве спонч-дренажа биоматериал Аллоплант, известный своими регенеративными свойствами (патент РФ №2189257, МПК A61L 27/00, опубл. 20.09.2002 г.), не вызывает перифокального воспаления и рубцевания.
Первый этап исследований эффективности предложенного способа был экспериментальный.
Экспериментальные исследования
Эксперименты проведены на 22 взрослых кроликах мужского пола (22 глаза) породы Шиншилла весом 3-4 кг, содержащихся в стандартных условиях вивария. Методом случайного отбора животные были разделены на 2 группы. В исследуемой и контрольной группах было по 11 кроликов. Была смоделирована модель кортикостероидной глаукомы (Brini A., 1980).
Для определения нормальных значений внутриглазного давления (ВГД) до операции была проведена тонометрия на обоих глазах у 15-ти кроликов с использованием тонометра Маклакова весом в 10,0 г. При выполнении манипуляции веки раздвигали мануально, чтобы исключить компрессию на глазное яблоко. Для устранения препятствия, создаваемого третьим веком, оттягивали наружный угол глазной щели. Тонометрию производили два - три раза и фиксировали среднюю величину из 4-6 аппланационных кружков. Кружки, в которых разница превышала 0,2 мм, не учитывались. К тому же фиксировались только те данные, которые были получены на выпущенных глазах, что достигалось при полном покое животного, так как при втягивании глазного яблока в орбиту, вследствие сокращения ретрактора, ВГД может значительно подниматься. Как известно, м. retractor является маленькой круглой мышцей, которая окружена 4-мя прямыми мышцами и разделяется на 4 части: верхняя, нижняя, передняя, задняя и прикрепляется на склере внутри от места прикрепления прямых мышц. Влияние сокращения указанной мышцы на уровень ВГД была проиллюстрирована в опытах Каменецкой Ц.Ю. в 1967 году, где для сокращения ретрактора производилось раздражение последнего фарадическим током, который получался из катушки Дюбуа-Реймонда. Была выявлена пропорциональная зависимость между силою тока, сокращением ретрактора и повышением ВГД. В ходе опыта повышение силы тока вследствие сокращения ретрактора сопровождалось втягиванием глаза в орбиту с одновременным повышением ВГД. Последующие опыты для исключения влияния наружных мышц глаза на колебания ВГД проводились с предварительной перерезкой последних. Давление по сравнению с исходной величиной повышалось до 20 мм рт.ст. в опытах без перерезки наружных мышц и до 12,2-19,4 мм рт.ст. с перерезкой последних, что позволило определить практическое отсутствие влияния наружных мышц глаза на уровень ВГД, при этом разница ВГД при втягивании и выпускании глазного яблока достигала 14-22 мм рт.ст. Минимальная величина ВГД на выпущенных глазах составила 15,6 мм рт.ст.; максимальная - 26,4 мм рт.ст. Таким образом, за нормальное значение у кроликов было принято ВГД в промежутке 15-26 мм рт.ст.
Животным в исследуемой и контрольной группах еженедельно вводили 0,5 мл дексаметазона под конъюнктиву правого глаза в различные квадранты глазного яблока в течение 3-х недель, а второй глаз оставался интактным. На фоне инъекций дексаметазона внутриглазное давление постепенно поднималось и стабилизировалось в пределах значений 29-38 мм рт.ст.
В исследуемой группе животным на одном глазу (правый глаз) была выполнена антиглаукомная операция с укладкой спонч-дренажа в склеро-склеральном пространстве и активацией созданных дренажных отверстий после удаления нитей, а просвет последних увеличен проведением пилящих движений нитями перед их удалением.
В контрольной группе кроликам также на одном глазу (правый глаз) была проведена непроникающая глубокая склерэктомия с лазерной десцеметогониопунктурой по способу-прототипу. Практически в половине случаев из-за отека роговицы проведение качественной лазерной десцеметогониопунктуры с первого раза было невозможно, а превышение дозопоглощающего эффекта грозило альтерацией прилегающих тканей, в том числе перфорацией эписклерального лоскута. Только после медикаментозного снижения внутриглазного давления и проведения корнеодегидратационной терапии удалось выполнить вышеуказанную манипуляцию в полном объеме, однако длительная экспозиция грозила развитием секлеро-склеральных сращений и нивелированию эффекта операции.
Животных выводили из эксперимента путем передозировки барбитуратов через 1, 3, 6, 12 месяцев.
В исследуемой группе у 8 кроликов внутриглазное давление оставалось нормальным, а в 3 случаях внутриглазное давление повторно повысилось, ввиду склеро-склерального сращения по периметру дренажной губки, что было связано с наложением абсолютно герметичных фиксирующих эписклеральный лоскут швов, исключающих фильтрацию внутриглазной жидкости.
В контрольной группе у 7 кроликов в разные сроки наблюдения после операции в оперированных глазах повторно повысилось внутриглазное давление ввиду рубцового заращения внутренней фистулы в углу передней камеры из-за отсутствия интенсивной фильтрации вследствие склеро-склерального сращения.
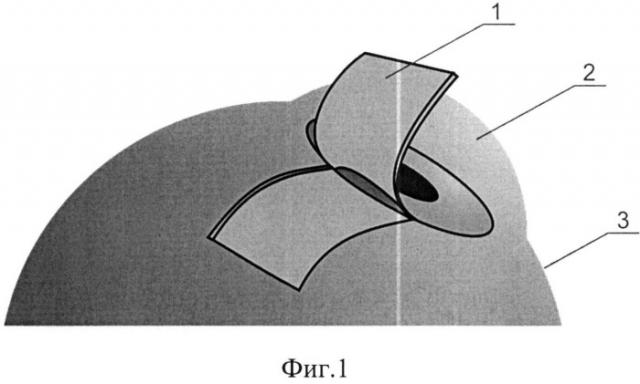
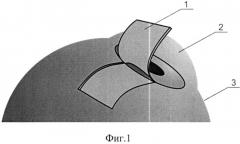
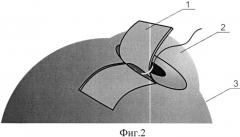
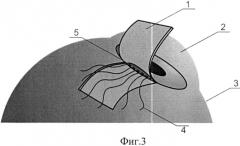
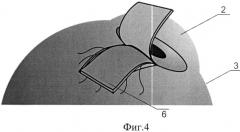
Сущность изобретения поясняется схематичным изображением этапов хирургического лечения глаукомы с малоинвазивным спонч-дренированием передней камеры: фиг.1 - формирование эписклерального лоскута, фиг.2 - формирование фильтрационных отверстий, фиг.3 - фильтрационные отверстия, обтурированные нитями, фиг.4 - укладка спонч-дренажа из биоматериала в донорском ложе, фиг.5 - фиксация эписклерального лоскута.
На чертежах обозначено: 1 - эписклеральный лоскут, 2 - роговица, 3 - склера, 4 - нити, 5 - фильтрационные отверстия, 6 - спонч-дренаж.
Способ осуществляют следующим образом.
Операцию производят преимущественно в верхних квадрантах глазного яблока между прямыми глазными мышцами. Под наркозом после наложения блефаростата доступ к эписклере осуществляли в 8 мм от лимба, концентрично ему длиной 9-10 мм. Выделяли и брали на уздечные швы смежные прямые мышцы глаза. Глазное яблоко ротировали и фиксировали таким образом, что выбранный сектор располагался центрально на операционном поле. Из поверхностных слоев склеры 3 формировали прямоугольный эписклеральный лоскут 1 размером 14×7-8 мм основанием к лимбу (фиг.1).
После предварительной тампонады передней камеры стерильным воздухом у основания выкроенного эписклерального лоскута в проекции трабекулы или на границе корня радужки и роговицы при закрытоугольной глаукоме делали «вкол-выкол» изогнутой атравматичной иглой круглого сечения «Суржипро-7» параллельно лимбу с проведением нитей через полость передней камеры (фиг.2, 3), тем самым создав фильтрационные отверстия 5, обтурированные нитью и расположенные по всей ширине лоскута на расстоянии 1 мм друг от друга (фиг.3). После этого в донорском ложе укладывали спонч-дренаж 6 из биоматериала (фиг.4). Эписклеральный лоскут фиксировали к краям донорского ложа по углам (фиг.5). После проведения пилящих движений с целью увеличения созданных ранее фильтрационных отверстий 5 нити 4 удаляли, а конъюнктивальную рану ушивали непрерывным швом.
Пример 1. Больной М., 54 года с диагнозом: Открытоугольная глаукома II «с» (м) левого глаза, терминальная глаукома правого глаза. Ранее хирургическое лечение на левом глазу не выполнялось ввиду наличия высокого зрения (0.8), в то время как медикаментозное лечение в различных комбинациях имело временный эффект, а правый глаз ослеп от глаукомы. По данным предоперационного обследования: острота зрения правого глаза - 0,0 не коррегирует, левого глаза - 0,5, не коррегирует; поля зрения правого глаза не определяются, левого глаза 220 гр. по 8 меридианам; внутриглазное давление по Маклакову правого глаза 32 мм рт.ст., левого - 37 ммрт.ст. При проведении световой биомикроскопии глазное дно просматривается некачественно из-за отека роговицы. Диск зрительного нерва бледноват, границы четкие, артерии узкие, вены умеренно расширены, глаукомная экскавация со смещением сосудистого пучка, макулярный рефлекс сохранен. При гониоскопии - профиль угла передней камеры узкий, местами угол закрыт корнем радужки, отложения пигмента.
После проведенного обследования была предложена операция с малоинвазивным спонч-дренированием передней камеры левого глаза. Произведена операция левого глаза с использованием биоматериала Аллоплант для спонч-дренирования. Доступ к эписклере осуществлялся в 8 мм от лимба, концентрично ему длиной 9-10 мм. Выделялись и брались на уздечные швы смежные прямые мышцы глаза. Глазное яблоко ротировалось и фиксировалось таким образом, что выбранный сектор располагался центрально на операционном поле. Из поверхностных слоев склеры формировался прямоугольный лоскут размером 14×7-8 мм основанием к лимбу. У основания выкроенного эписклерального лоскута в проекции трабекулы (или на границе корня радужки и роговицы при закрытоугольной глаукоме) производился «вкол-выкол» изогнутой атравматичной (круглого сечения) иглой с нитью «Суржипро - 7» параллельно лимбу с проведением нитей через полость передней камеры, тем самым создав отверстия, обтурированные нитью, расположенные по всей ширине лоскута на расстоянии 1 мм друг от друга. Для исключения коллапса передней камеры вследствие ультрафильтрации камерной влаги вдоль нити непосредственно перед проколом, через парацентез, полость передней камеры заполнялась стерильным воздухом. В силу эластичности роговицы и тампонирующих свойств воздуха передняя камера оставалась сохранной. После этого в донорском ложе укладывали спонч-дренаж из биоматериала Аллоплант, эписклеральный лоскут фиксировали к краям донорского ложа по углам. После проведения пилящих движений с целью увеличения созданных ранее отверстий нити удаляли, а конъюнктивальная рана ушивалась непрерывным швом.
При осмотре в динамике через 6,12 месяцев внутриглазное давление в оперированном глазу компенсировано и составляло 15,17 мм рт.ст. соответственно, поля зрения расширились до 320 гр. по 8 меридианам, а острота зрения повысилась до 0,7. При проведении световой биомикроскопии глазное дно просматривалось качественно. Диск зрительного нерва бледноват, границы четкие, соотношение артерий и вен 2/3, глаукомная экскавация со смещением сосудистого пучка, макулярный рефлекс сохранен, признаков гипотонической макулопатии не выявлено. При гониоскопии просвет фильтрующих отверстий сохранен, иридоангулярный блок в зоне операции не обнаружен. Идентичный результат сохранился через 1 год 9 мес.
Пример 2. Больной Ф., 64 года с диагнозом: Открытоугольная глаукома I «в» (м) правого глаза. Левый глаз без патологии. Ранее хирургическое лечение не выполнялось ввиду наличия высокого зрения (0,7), в то время как медикаментозное лечение в различных комбинациях имело временный эффект. По данным предоперационного обследования: острота зрения - 0,7, не коррегирует; поля зрения 247 гр. по 8 меридианам; внутриглазное давление по Маклакову 30 мм рт.ст. При проведении световой биомикроскопии глазное дно просматривается некачественно из-за отека роговицы. Диск зрительного нерва бледноват, границы четкие, артерии узкие, вены умеренно расширены, глаукомная экскавация со смещением сосудистого пучка, макулярный рефлекс сохранен. При гониоскопии - профиль угла передней камеры узкий, отложения пигмента.
Произведена операция на правый глаз по предлагаемому способу, как в примере 1. Доступ к эписклере осуществлялся в 8 мм от лимба, концентрично ему длиной 9-10 мм. Выделялись и брались на уздечные швы смежные прямые мышцы глаза. Глазное яблоко ротировалось и фиксировалось таким образом, что выбранный сектор располагался центрально на операционном поле. Из поверхностных слоев склеры формировался прямоугольный лоскут размером 14×7-8 мм основанием к лимбу. У основания выкроенного эписклерального лоскута в проекции трабекулы (или на границе корня радужки и роговицы при закрытоугольной глаукоме) производился «вкол-выкол» изогнутой атравматичной (круглого сечения) иглой с нитью «Суржипро-7» параллельно лимбу с проведением нитей через полость передней камеры, тем самым создав отверстия, обтурированные нитью, расположенные по всей ширине лоскута на расстоянии 1 мм друг от друга. Для исключения коллапса передней камеры вследствие ультрафильтрации камерной влаги вдоль нити непосредственно перед проколом, через парацентез, полость передней камеры заполнялась стерильным воздухом. В силу эластичности роговицы и тампонирующих свойств воздуха передняя камера оставалась сохранной. После этого в донорском ложе укладывался спонч-дренаж из биоматериала Аллоплант, эписклеральный лоскут фиксировался к краям донорского ложа по углам, нити удалялись после проведения пилящих движений с целью увеличения созданных ранее отверстий, а конъюнктивальная рана ушивалась непрерывным швом. Послеоперационное течение гладкое. При осмотре в динамике через 3-10 месяцев внутриглазное давление в оперированном глазу компенсировано и составляло 19,15 мм рт.ст. соответственно, поля зрения расширились до 337 гр. по 8 меридианам, а острота зрения поднялась до 0,8. При проведении световой биомикроскопии глазное дно просматривается качественно. Диск зрительного нерва бледноват, границы четкие, соотношение артерий и вен 2/3, глаукомная экскавация со смещением сосудистого пучка, макулярный рефлекс сохранен, признаков гипотонической макулопатии не выявлено. При гониоскопии просвет фильтрующих отверстий сохранен, иридоангулярный блок в зоне операции не обнаружен. Идентичный результат сохранился через 1 год 6 мес.
С применением предлагаемого способа к настоящему моменту прооперировано 15 пациентов. У всех больных отмечен положительный результат операции в виде компенсации внутриглазного давления и повышения остроты зрения с расширением полей зрения.
Таким образом, предложенный способ хирургического лечения глаукомы позволяет создать пути оттока внутриглазной жидкости, исключив острую декомпрессию передней камеры, что обуславливает отсутствие интраокулярных интра и/или послеоперационных геморрагических и др. осложнений, а укладка спонч-дренажа из биоматериала предотвращает формирование склеро-склеральных сращений как основной причины рецидива глаукомы.
Способ хирургического лечения глаукомы, включающий выкраивание эписклерального лоскута, формирование в углу передней камеры фильтрующих отверстий для оттока внутриглазной жидкости, последующую фиксацию лоскута к краям донорского ложа швами, ушивание конъюктивальной раны непрерывным швом, отличающийся тем, что фильтрующие отверстия выполняют после тампонады передней камеры стерильным воздухом путем сквозного проведения нитей через переднюю камеру при помощи изогнутой атравматичной иглы, производя «вкол-выкол» параллельно лимбу, после чего укладывают биоматериал Аллоплант для спонч-дренирования в склеро-склеральном пространстве, а после фиксации эписклерального лоскута дозированно увеличивают фильтрующие отверстия, осуществляя пилящие движения нитями перед их удалением.