Вещество, связывающее микотоксин
Иллюстрации
Показать всеИзобретение относится к веществу, связывающему микотоксины в кормовых продуктах. Вещество включает гуминовые вещества, содержащие 45% или более гуминовой кислоты, комбинированные с адсорбентом, с максимальной растворимостью 20% при pH в пределах от 1,5 до 7,0. Адсорбция при биологическом pH желудка моногастричных животных составляет, по меньшей мере, 80% и десорбция при нейтральном рН не более чем 10%. Эффективность связывания зеараленона in vitro составляет, по меньшей мере, 80% и предпочтительно 90%. 3 з.п. ф-лы, 5 ил., 37 табл., 9 пр.
Реферат
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ИЗОБРЕТЕНИЯ
По настоящей заявке испрашивается приоритет по патентной заявке США № 61/345186, поданной 17 мая 2010, включенный здесь путем ссылки в полном объеме.
Настоящее изобретение относится к веществам, связывающим микотоксины, в частности к веществам, связывающим микотоксины при использовании гуминовых соединений.
Микотоксины невидимы, не имеют запаха и не могут быть определены по запаху или по вкусу, но могут привести к значительным экономическим потерям на всех уровнях производства кормов в сельском хозяйстве и, в частности, для животноводства. Микотоксины представляют вторичные метаболиты, продуцируемые мицелиальными грибами, такими как Fusarium, Aspergillus и Penicillium, перед или во время сбора урожая, или во время (неправильного) хранения. Их токсическое воздействие очень разнообразно (Akande, K.E., Abubakar, M.M., Adegbola, T.A., and Bogoro, S.E. 2006 Nutritional and Health Implications of Mycotoxins in Animal Feeds: A Review. Pakistan Journal of Nutrition, 5: 398-403). При потреблении кормового продукта сельскохозяйственными животными микотоксины оказывают негативное воздействие на показатели продуктивности и физиологическое состояние животных, уровень воспроизведения, способность к росту, иммунологическую защиту, а также оказывают канцерогенное, мутагенное, тератогенное воздействие, вызывая тремор или повреждения центральной нервной системы, геморрагические проявления наряду с повреждением печени и почек. Микотоксины метаболизируются в печени и почках, а также микроорганизмами желудочно-кишечного тракта. Следовательно, часто химическая структура и связанная с этим токсичность остатков микотоксинов, выделяемых из организма животных или обнаруживаемых в тканях, отличается от таковой первичной молекулы (Ratcliff, J. The Role of Mycotoxins in Food and Feed Safety. Presented at Animal Feed Manufacturers Association, August 16, 2002). Различные микотоксины могут встречаться одновременно, в зависимости от условий окружающей среды и субстрата (Sohn, H.В., Seo, J.A., and Lee, Y.W. 1999 Co-occurrence of Fusarium Mycotoxins in Mouldy and Healthy Corn from Korea. Food Additives and Contaminants, 16: 153-158). Принимая во внимание это одновременное продуцирование, очень вероятно, что животные подвергнутся воздействию смесей, а не отдельных соединений. Полевые исследования показали, что более тяжелые токсикозы у животных могут быть результатом суммарного и синергетического воздействия различных микотоксинов (Ratcliff, 2002). Проблема микотоксинов касается не только кормового продукта или сниженных показателей продуктивности животных, многие из них концентрируются в мясе, яйцах и молоке животных и могут представлять угрозу для здоровья человека. Растет обеспокоенность по поводу уровней микотоксинов в пищевых продуктах как в продуктах растительного, так и животного происхождения.
Хотя существуют географические и климатические различия в продуцировании и распространенности микотоксинов, воздействие этих веществ очень распространено в мире. Согласно оценкам ежегодно вплоть до 25 процентов мирового урожая сельскохозяйственных культур подвергаются воздействию микотоксинов (Akande, 2006). Большинство стран имеют строгие нормы по уровням микотоксинов в кормовых продуктах, и главной целью сельскохозяйственной и пищевой индустрии является предотвращение загрязнения в поле. На практике для существенного снижения загрязнения микотоксинами требуется правильная стратегия управления для повышения продуктивности растений и снижения стрессовых воздействий на растения. Это включает культивирование адаптированных сортов, использование правильных удобрений, борьбу с сорными растениями, необходимую ирригацию и правильное чередование культур (Edwards, S.G. 2004 Influence of Agricultural Practices on Fusarium Infection of Cereals and Subsequesnt Contamination of Grain by Tricothecenes Mycotoxins. Toxicology Letters, 153: 29-35). Но даже правильная стратегия управления не устраняет загрязнение микотоксинами в годы, благоприятные для развития болезней.
Среди различных микотоксинов, в частности, определены оказывающие воздействие на птицу, некоторые из которых присутствуют в значительном количестве в загрязненных естественным путем пищевых и кормовых продуктах. Они представляют афлатоксин; охратоксин, зеараленон, токсин T-2, вомитоксин и фумонизин. Они оказывают вредное воздействие на птиц, такое как замедление роста, подавление иммунитета и бледность у бройлеров, что в конечном итоге приводит к экономическим потерям.
Афлатоксин Bl - метаболит грибка Aspergillus flavus и Aspegillus parasiticus, представляет чрезвычайно гепатоксичное соединение, которое часто на низких уровнях загрязняет кормовые продукты для птицы. Другое семейство митоксинов, продуцируемое Penicillium и Aspergillus, представляет охратоксин. Охратоксин является самым сильным токсином, оказывающим негативное воздействие на показатели продуктивности и здоровье птицы. Потребление охратоксинов вызывает тяжелые поражения почек. Токсин T-2 индуцирует тяжелые воспалительные реакции и повреждения нервов у животных и людей, в то время как зеараленон не оказывает воздействия на здоровье и продуктивность птицы. Рационы птицы с высокими уровнями загрязнения Fusarium ассоциируются с низкой продуктивностью, отказом от кормового продукта, диареей, слабостью лап, поражением ротовой полости и/или высокой смертностью.
Токсичность и клинические признаки, наблюдаемые у животных в случае присутствия более чем одного микотоксина, взаимосвязаны и отличаются разнообразием. Микотоксины, как правило, сопровождаются другими неизвестными метаболитами, которые могут проявлять синергетическое или суммарное воздействие. Способность связывающих веществ снижать негативное воздействие некоторых комбинаций микотоксинов, присутствующих изначально в кормовом продукте, на продуктивность и биохимические, и гематологические показатели сыворотки требуют дополнительных исследований.
В настоящее время недоступны практические методы детоксикации зерна, загрязненного микотоксином, в промышленных масштабах и экономически эффективным способом. В данный момент одним из наиболее перспективных и практичных подходов является использование адсорбентов. Однако было установлено, что некоторые адсорбенты нарушают усваивание питательных веществ (Kubena, L. F., R. B. Harvey, T. D. Phillips, D. E. Corrier, and W. E. Huff. Diminution of aflatoxicosis in growing chickens by the dietary addition of hydrated sodium calcium aluminosilicate. Poult. Sci. 69:727-735. 1990) и адсорбцию минеральных веществ (Chestnut, А. В., P. D.Anderson, M. A. Cochran, H. A. Fribourg, and K. D. Twinn. 1992. Effects of hydrated sodium calcium aluminosilicate on fescue toxicosis and mineral absorption. J. Anim. Sci. 70:2838-2846), и на практике отсутствует связывающее воздействие на комплекс микотоксинов (Edrington, T.S.; Sarr, А.В.; Kubena, L.F.; Harvey, R.B.; Phillips, T.D. (1996). Hydrated sodium calcium aluminosilicate (HSCAS), acidic HSCAS, and activated charcoal reduce urinary excretion of aflatoxin Ml in turkey poults. Lack of effect by activated charcoal on aflatoxicosis. Toxicology letter, 89: 115-122).
Зеараленон (ZEA) вызывает гиперэстрогенизм у свиней при потреблении таких низких уровней, как мкг/г в кормовом продукте. Патология у свиней более выражена у препубертатных свинок и характеризуется опуханием вульвы, пролапсом вагины и ректума и увеличением молочных желез. У репродуктивных животных зеараленон вызывает неудачное оплодотворение, ложную беременность и аборт. Считается, что метаболизм ZEA по существу происходит в печени, приводя к образованию α и β зеаталенола. Ферментом, катализирующим превращение ZEA в зеараленол, является 3-α- гидроксистероид дегидрогеназа (3α-HSD). Также известно, что этот фермент расщепляет 5-α-андростан-3,17-дион - продукт метаболизма стероидного гормона. Как известно из ряда исследований, ZEA и его метаболиты выводятся из организма, главным образом, через фекалии и мочу. Свиньи более чувствительны к ZEA, чем другой домашний скот, и желательны режимы кормления минимизирующие потери, вызванные непроизводительным расходом кормов и низкой продуктивностью. Некоторые соединения (например, пищевые волокна, формалин, карбонат натрия и монометиламин) продемонстрировали защиту от ряда ксенобиотиков, включая ZEA.
Использование ингибиторов плесени или консервации кислотами может только сократить количество плесени, но не влияет на содержание микотоксинов, продуцированных до проведения обработки. В случае, когда микотоксины уже продуцированы, на них не может быть оказано воздействия в любой форме ингибиторами плесени или смесями кислот, поскольку они представляют очень стабильные соединения. Таким образом, эти токсичные соединения остаются в ранее загрязненных продуктах, даже если плесень не видна и не определяется. Наиболее используемой стратегией снижения воздействия микотоксинов является снижение их биодоступности за счет включения различных агентов, связывающих микотоксины, или адсорбентов, что приводит к снижению потребления микотоксинов и проникновение в кровь и органы-мишени. Основные преимущества адсорбентов включают стоимость, безопасность и простоту добавления в кормовые продукты для животных. Для этой цели были протестированы и использованы различные группы веществ, алюмосиликаты, в частности, самыми используемыми группами являются глиняные и цеолитовые минералы.
Гуминовые кислоты встречаются повсеместно и могут быть найдены в любом веществе, в котором происходит разложение, или они преобразуются как в случае осадочных отложений. Они представляют натуральные компоненты питьевой воды, почвы и лигнита. Гуминовые вещества обладают сильной аффинностью связывания различных, таких как тяжелые металлы, гербициды, различные мутагены, моноароматические и полициклические ароматические соединения и минеральные вещества. Уже в течение многих лет фермеры используют гуматы для ускорения прорастания семян и улучшения роста корневищ (Islam, K.M., Schuhmacher, S.A., and Gropp, M.J. 2005 Humic Substances in Animal Culture. Pakistan Journal of Nutrition, 4: 126-134). Материалы способны стимулировать транспорт кислорода, усиление дыхания и способствуют эффективному использованию нутриентов растениями (Osterberg, R. and Mortensen, K. 1994 The Growth of Fractal Humic Acids: Cluster Correlation and Gel Formation. Radiation and Environmental Biophysics, 33: 269-276). Эти наблюдения натолкнули ученых на исследование специфических свойств гуматов и возможного их положительного влияния на здоровье и хорошее самочувствие людей и животных. Гуминовые вещества используют в качестве противодиарейных, анальгетических, иммуностимулирующих и промотирующих рост агентов в ветеринарной практике в Европе (Islam, 2005). Гуминовые кислоты ингибируют рост бактерий и грибков, таким образом, косвенно снижая уровни микотоксинов в кормовом продукте (Riede, U.N., Zeck-Keapp, G., Freudenberg, N., Keller, H.U., and Seubert, B. 2007 Humate Induced Activation of Human Granulocytes. Virchows Archives of Biology: Cell Pathology, 60: 27-34). Описана способность некоторых гуминовых веществ и их солей взаимодействовать напрямую с микотоксинами за счет их способности связывать микотоксины (Sabater-Vilar, M., Malekinejad, H., Selman, M.H.J., Ven Der Doelen, M.A.M., and Fink-Gremmels, J. 2007, In Vitro Assessment of Absorbents Aiming to Prevent Deoxynivalenol and Zearalenone Mycotoxicosis. Micropathologia, 163: 81-90; Ye, S., Lv, X., and Zhou, A. 2009 In Vitro Evaluation of the Efficacy of Sodium Humate as an Aflatoxin Bl Adsorbent. Australian Journal of Basic and Applied Sciences, 3: 1296-1300; Jansen van Rensburg, C, Van Rensburg, C.E.J., Van Ryssen, J.B.J., Casey, N.H., and Rottinghaus, G.E. 2006 In Vitro and In Vivo Assessment of Humic Acid as an Aflatoxin Binder in Broiler Chickens. Poultry Science, 85:1576-1583).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новой группе веществ, связывающих микотоксины, представляющей вещества, содержащие гуминовую кислоту. Предпочтительно вещества, связывающие микотоксины, имеют минимальное содержание гуминовой кислоты 45%, максимальную растворимость около 20% при pH 1,5; 3,0 и 7,0 и in vitro эффективность связывания микотоксинов по меньшей мере 80% и предпочтительно 90%, с минимальной адсорбцией при pH желудка моногастричных животных по меньшей мере 80%, и предпочтительно по меньшей мере 85%, и максимальной десорбцией при нейтральном pH не более чем 10%. В предпочтительном варианте воплощения настоящего изобретения гуминовые вещества комбинируют с адсорбентом, таким как глина, для обеспечения эффективного вещества, связывающего in vivo микотоксины.
КРАТКОЕ ОПИСАНИЕ ФИГУР
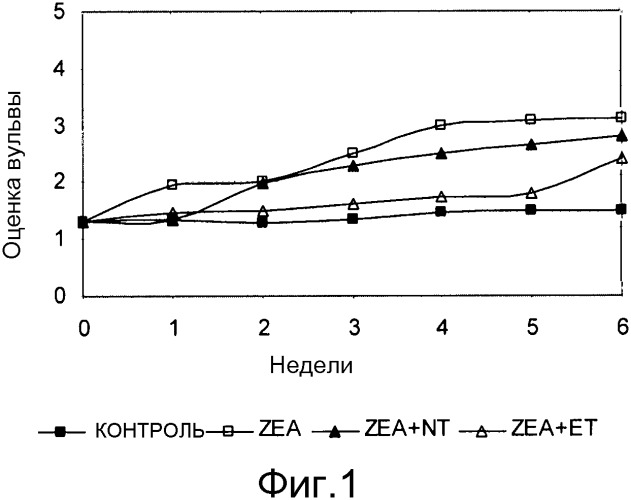
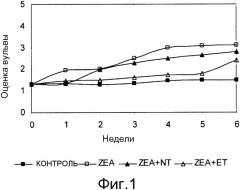
Фиг. 1 - график средних еженедельных оценок вульвы всех групп свинок; стандартные ошибки составляют в пределах от 0,3 до 0,5.
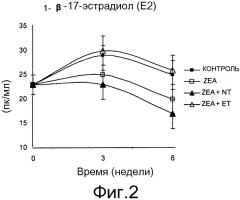
Фиг. 2 - график изменения средней концентрации этрадиола-17β в плазме для различных партий.
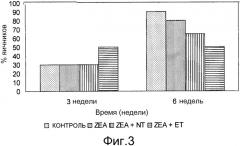
Фиг. 3 - график процентного соотношения фолликул размером ≤6 мм для различных партий.
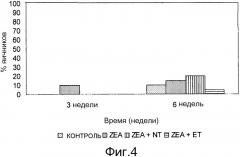
Фиг. 4 - график процентного соотношения фолликул размером >6 мм для различных партий.
Фиг. 5 - график процентного соотношения свинок с гипоплазией яичников и фолликулами размером >6 мм.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение включает композиции для добавления в кормовые продукты для животных, которые могут быть загрязненные одним или более микотоксинами. Композиции включают гуминовые вещества, предпочтительно гуминовые вещества с содержанием в пределах от 45% до 99% гуминовых кислот, включая все значения в этих пределах. Композиции должны иметь высокую аффинность к специфическим микотоксинам с образованием, в результате, прочного комплекса между композицией и целевым микотоксином, который не растворяется в желудочно-кишечном тракте, таким образом, микотоксин будет выведен с фекалиями. Следовательно, предпочтительно, чтобы композиции имели растворимости не более чем 20% при pH в пределах от 1,5 до 7,5. Было установлено, что композиции по настоящему изобретению эффективны in vivo и обладают эффективностью in vitro более чем 80%, и предпочтительно более чем 90%, с минимальной абсорбцией при pH 3,0 по меньшей мере 80%, и предпочтительно 85%, и максимальной десорбцией при pH 6,8 не более чем 10%.
Гуминовые вещества, подходящие для настоящего изобретения, могут быть получены из множества источников, но предпочтительным источником является леонардит. Гуминовые вещества предпочтительно скомбинированы с одним или более источником ионов металла, оксидов и глиняных минералов. Предпочтительно в пределах от 10% до 90% источника гуминовых веществ скомбинировано с глиной, такой как бентонит или сепиолит, в пределах от 90% до 10%, включая все значения в этих пределах.
Гуминовые кислоты в натуральных веществах
Гуминовые кислоты образуются в процессе химической и биологической гумификации органического вещества, в частности, растений за счет биологической активности микроорганизмов. Они находятся в буром органическом веществе различных почв, наряду с торфом, компостом, лигнитом, леонардитом и бурым углем. В почвах они также могут быть образованы за счет определенных вторичных процессов, таких как полимеризация полифенолов при выщелачивании дождем из поверхностного слоя листовой подстилки и конденсация фенолов, хинонов и белков, происходящая при воздействии почвенных микроорганизмов и мелких животных на почвенные углеводы.
Гуминовые кислоты не имеют единой, свойственной им структуры, а представляют смесь промежуточных химических продуктов, полученных в результате распада и превращения лигнина и других растительных материалов в каменный уголь. Они представляют трехмерные макроколлоидные молекулы с полиароматическим центром, содержащим изо- и гетероциклические структуры и периферические боковые цепи. Органическая структура гуминовой кислоты естественным образом окислена и отрицательно заряжена. Положительные ионы притягиваются к разрушенным связям в местах окисления, создавая места для прикрепления микронутриентов и микрофлоры. Низкокачественный уголь, называемый лигнитом, содержит больше кислот, чем высококачественный уголь. Леонардит представляет специфическое образование сильно окисленного лигнита. Этот материал имеет самое высокое содержание гуминовых кислот из всех натуральных источников.
Пример 1
Эксперимент проводят для определения содержания гуминовой кислоты в пяти натуральных веществах, содержащих гуминовую кислоту. Гуминовые кислоты измеряют при использовании объемного метода с титрованием экстрактов согласно международному стандарту (ISO 5073:1999 Brown coals and lignites. Determination of humic acids).
Результаты анализов веществ, содержащих гуминовую кислоту, приведены в Таблице 1. Указанное минимальное требование 45% гуминовой кислоты было превышено всеми продуктами, за исключением HS3 (28,34%) и HS4 (44,62%).
| Таблица 1Содержание гуминовой кислоты, определенное согласно ISO 5073:1999 | |
| Вещество, содержащее гуминовую кислоту | Содержание гуминовой кислоты (%) |
| HS1 | 46,31 |
| HS2 | 64,84 |
| HS3 | 28,34 |
| HS4 | 44,62 |
| HS5 | 67,45 |
Растворимость веществ, содержащих гуминовые кислоты, при различных pH
В большинстве веществ гуминовые кислоты химически прикреплены к неорганическим компонентам (глина или оксиды), и меньшая часть растворена в растворах или почве, в частности, в щелочных условиях. Важной особенностью гуминовых веществ является то, что они могут быть скомбинированы с ионами металлов, оксидов и глины с получением водорастворимых или нерастворимых комплексов и могут взаимодействовать с органическими соединениями, такими как щелочи, жирные кислоты, капиллярно-активные вещества и пестициды.
Адсорбенты, используемые для того чтобы препятствовать желудочно-кишечной адсорбции микотоксинов, имеют высокую аффинность к специфическим микотоксинам, с образованием в результате прочных комплексов, которые не разрушаются и будут выведены из организма с фекалиями. Это подразумевает, что гуминовые кислоты, как основные активные соединения, не могут быть растворены где-либо в желудочно-кишечном тракте. Описанные вещества гуминовых кислот могут иметь растворимость не выше, чем 20% при pH 1,5; 3,0 и 7,0 (то есть минимальный выход ретентата 80%).
Пример 2
Эксперимент проводят для определения нерастворимой части веществ, содержащих гуминовую кислоту. Кратко, 0,15 г продукта растворяют в 75 мл 0,1M фосфатного буфера (отрегулированного до pH 1,5; 3,0 или 7,0), инкубируют в течение одного часа при комнатной температуре на магнитном устройстве для перемешивания (600 оборотов в минуту). Все суспензии фильтруют через 55 мм фильтр (Macherey-Nagel, MN GF-4). Ретентат сушат в течение двух часов при температуре 130°C. Количество ретентата рассчитывают как разницу между пустым фильтром и фильтром+высушенный ретентат. Выход (%) рассчитывают как соотношение «количество ретентата/масса продукта» и выражают в процентах. Проводят трехкратный анализ образцов и рассчитывают среднее. Контрольный материал представляет очищенную гуминовую кислоту (HA, Sigma Aldrich. Lot 0001411101, cas number: 1415-93-6).
Извлечение нерастворимой фракции суспензии HA при pH 7 невозможно. Фильтрация этой суспензии не может быть проведена, поскольку образовавшиеся на стадии инкубации «флотирующие вещества» делают фильтр непроницаемым. Эксперимент повторяют в цитратном буфере, отрегулированном до pH 6,2. Однако результаты были такими же. Суспензии других продуктов легко фильтруются при каждом тестируемом pH. Результаты по выходу ретентатов приведены в Таблице 2. Все, за исключением двух продуктов отвечают минимальным требованиям по выходу ретентата 80% при различных условиях pH. Выход ретентата HS1 при pH 1,5 слишком низкий; выход ретентатов HS3 при всех тестируемых уровнях pH слишком низкий.
| Таблица 2Нерастворимая фракция веществ, содержащих гуминовую кислоту, при различных pH, выраженная как мас.% от извлеченного ретентата | ||||||
| pH | ||||||
| 1,5 | 3 | 7 | ||||
| Среднее | Стандарт-ное отклонение | Среднее | Стандарт-ное отклонение | Среднее | Стандарт-ное отклонение | |
| HA | 80,97 | 4,13 | 84,65 | 3,18 | НО | НО |
| HS1 | 78,41 | 0,97 | 80,46 | 1,14 | 85,40 | 0,48 |
| HS2 | 85,02 | 1,21 | 86,54 | 0,80 | 84,23 | 0,75 |
| HS3 | 67,80 | 0,78 | 68,16 | 0,93 | 64,14 | 2,62 |
| HS4 | 80,75 | 1,58 | 84,54 | 2,30 | 92,13 | 0,42 |
| HS5 | 83,24 | 0,85 | 84,73 | 0,46 | 86,47 | 2,02 |
| ND: выход ретентата HA при pH 7 не определен |
Пример 3
Во втором эксперименте на растворимость веществ, содержащих гуминовые кислоты, 0,015 г (вместо 0,15 г) продуктов HS2, HS3 и HA растворяют в 75 мл 0,1M фосфатного буфера (pH 1,5; 3,0 или 7,0).
После выдержки в течение одного часа при комнатной температуре на устройстве для магнитного перемешивания морфология суспензий трех протестированных продуктов имеет явные отличия (Фигура 1). Результаты по выходу ретентатов приведены в Таблице 3. Темно-коричневый цвет суспензии HA при pH 7 соответствует высокой растворимости продукта при этом pH (Таблица 3).
| Таблица 3Нерастворимая фракция веществ, содержащих гуминовые кислоты, при различных pH, выраженная как мас.% от извлеченного ретентата | ||||||
| pH | ||||||
| 1,5 | 3 | 7 | ||||
| Среднее | Стандартное отклонение | Сред-нее | Стандартное отклонение | Среднее | Стандарт-ное отклонение | |
| HA | 103,17 | 2,69 | 128,41 | 8,93 | 54,82 | 5,74 |
| HS2 | 107,86 | 10,44 | 115,98 | 7,56 | 121,25 | 11,06 |
| HS3 | 106,88 | 8,59 | 126,59 | 9,57 | 91,24 | 2,02 |
Способность in vitro связывать микотоксины веществ, содержащих гуминовые кислоты
В процессе адсорбции микотоксины в действительности не связываются с поверхностью связывающего вещества. Электростатические силы, которые соединяют токсин и связывающее вещество, не дают постоянных связей, что означает, что процесс адсорбции обратим. Изменение окружающей среды, в которой находится вещество, связывающее микотоксин (например, в желудочно-кишечном тракте), может оказать очень сильное воздействие на эффективность связывания. Основным параметром, оказывающим воздействие, является pH окружающей среды. Изменения pH могут изменить оба - как микотоксин, так и поверхность связывающего вещества, вызывая изменения притяжения между ними. У животного в передней кишке условия низкого pH могут способствовать адсорбции микотоксинов, в то время как далее в пищеварительном тракте (более нейтральный pH) микотоксин может снова выделиться. Очень сильное влияние pH на адсорбцию является чрезвычайно важным для использования in vitro системы, которая имитирует изменение условий pH в желудочно-кишечном тракте.
Пример 4
Исследование проводят in vitro, оценивая эффективность детоксикации микотоксина потенциальными связывающими веществами, содержащими гуминовую кислоту, в отношении зеараленона. Измеряют адсорбцию в кислой окружающей среде (pH 3,0), имитирующей pH желудка моногастричного животного, и десорбцию при близком к нейтральному pH (pH 6,8), имитирующем условия pH в кишечнике моногастричного животного. Чистый процент эффективности детоксикации микотоксина определяют как процент адсорбции минус процент десорбции.
При двукратном повторе аликвоты 0,1 M фосфатного буфера (отрегулированные до pH 3,0), содержащие 300 частей на миллиард зеараленона в растворе (10 мл), добавляют в 15 мл полипропиленовые пробирки Falcon с навинчивающейся крышкой, в которые был добавлен 0,05 грамм каждого адсорбента. Тестируемые пробирки помещают в орбитальный встряхиватель на 60 минут при комнатной температуре. Каждый тестируемый раствор микотоксина центрифугируют при 4000 оборотов в минуту в течение 10 минут. Для анализа микотоксина (адсорбция) выделяют водный супернатант. Осадок ресуспендируют в 0,1 M фосфатном буфере при pH 6,8. Тестируемые пробирки снова помещают в орбитальный встряхиватель на 60 минут при комнатной температуре и затем центрифугируют при 4000 оборотах в минуту в течение 10 минут. Водный супернатант анализируют на зеараленон (десорбция). Концентрацию зеараленона определяют при использовании ELISA (Euro-Diagnostica). В качестве стандарта используют тестируемые буферные растворы зеараленона (pH 3,0 или 6,8) без адсорбентов.
Краткое описание in vitro адсорбции микотоксина пятью образцами представлено в Таблице 4. Результаты показывают, что все продукты эффективно адсорбировали зеараленон при рН 3,0 (адсорбция выше минимально требуемого показателя 85%), за исключением HS3. Значительные различия наблюдаются для десорбции при pH 6,8. Продукты HS3 и HS4 - оба демонстрируют превышение максимального показателя 10% десорбции. Другие три образца отвечают требованиям. Только продукты HS2 и HS5 отвечают минимальным требованиям in vitro эффективности связывания 90%.
| Таблица 4 In vitro связывание зеараленона веществами, содержащими гуминовую кислоту, при pH 3,0 и 6,8 | |||||
| Адсорбент | in vitro связывание ZEA | ||||
| Абсорбция (%) | Десорбция (%) | Эффективность (%) | |||
| Среднее | Стандар-тное отклонение | Среднее | Стандар-тное отклонение | Среднее | |
| HS1 | 92,32 | 5,01 | 8,91 | 0,48 | 83,40 |
| HS2 | 96,20 | 2,39 | 3,12 | 1,77 | 93,08 |
| HS3 | 80,68 | 35,70 | 44,99 | ||
| HS4 | 86,65 | 13,54 | 26,57 | 0,40 | 59,95 |
| HS5 | 96,78 | 2,07 | 1,70 | 0,28 | 96,36 |
Пример 5
Два вещества гуминовых кислот (HS2 и HS3) сравнивают с очищенной гуминовой кислотой (HA, Sigma Aldrich. Lot 0001411101, каталожный номер: 1415-93-6) в исследовании in vitro связывания микотоксина, аналогично тесту, описанному в Примере 4, только с одной модификацией, состоящей в том, что зеараленон определяют при использовании анализа ВЭЖХ после выделения микотоксина при использовании колонки AOZ (VICAM, USA).
Анализ ВЭЖХ проводят при использовании системы доставки растворителя с дегазацией гелием SP8800 Ternary LC (Spectra Physics, USA), с 20 мкл петлевым автодозатором SP 8880 (Spectra Physics, USA), интегратором Chromjet (Thermo, USA), нагревателем колонки Croco CilTM (Cluzeau Info Labo, France) и УВ-флуоресцентным детектором FP-920 (Jasco, Japan), колонками Chromsep Nucleosil 100-5 CI8 SS 250*4,6 мм (L*ID) (Varian, the Netherlands) или эквивалентом. Колонки защищены защитной колонкой. В качестве стандарта ВЭЖХ используют аликвоту оригинального тестируемого забуференного раствора зеараленона.
Результаты приведены в Таблице 5. Данные HS2 и HS3 подтверждают результаты Примера 4. Адсорбция зеараленона на очищенной гуминовой кислоте при PH 6,8 очень высокая (96,93%). Однако при pH 6,8 снова выделяется 30,83% связанного зеараленона.
| Таблица 5 In vitro связывание зеараленона веществами, содержащими гуминовую кислоту, при pH 3,0 и 6,8. Результаты представляют средние показатели дважды повторенных анализов. Для HS3 доступны только однократные анализы | |||||
| Адсорбент | in vitro связывание ZEA | ||||
| Адсорбция (%) | Десорбция (%) | Эффективность (%) | |||
| Среднее | Стандар-тное отклонение | Среднее | Стандар-тное отклонение | Среднее | |
| HS2 | 94,40 | 0,56 | 2,96 | 0,48 | 91,44 |
| HS3 | 86,03 | 31,71 | 54,33 | ||
| HA | 96,93 | 0,36 | 30,83 | 0,51 | 66,10 |
В заключение, два продукта HS2 и HS5 отвечают всем трем предпочтительным характеристикам для улучшенных веществ, связывающих микотоксины по настоящему изобретению.
Пример 6
Материалы и методы
Для определения общих гуминовых кислот в веществах, содержащих гуминовые кислоты, используют растворы.
Гуминовые кислоты измеряют при использовании объемного метода с титрованием экстрактов по Международному стандарту (ISO 5073:1999 Brown coals and lignites. Determination of humic acids). В Таблице 6 приведено краткое описание различных растворов, используемых в процедуре.
| Таблица 6Растворы, используемые для определения гуминовой кислоты | |
| Раствор | Композиция |
| Пирофосфат натрия | 15 г Na4P2O7 (10H2O)+7 г NaOH в H2O вплоть до 1 л |
| Гидроксид натрия | 10 г NaOH в H2O вплоть до 1 л |
| Стандартный раствор дихромата калия | 4,9036 г K2Cr2O7, предварительно высушенный при температуре 130°C, в H2O вплоть до 1 л |
| Окисляющий раствор дихромата калия | 20 г K2Cr2O7 в H2O вплоть до 1 л |
| 1,10-фенантролиновый индикатор | 1,5 г 1,10-фенантролина+1 г (NH4)2Fe(SO4)2-6H2O |
| Серная кислота | Концентрированная, p20=1,84 г/мл |
| Двойная соль сернокислого аммония и сернокислого железа | 40 г (NH4)2Fe(SO4)2-6H2O+20 мл H2SO4 в H2O вплоть до 1 л |
Для каждой партии анализируемых образцов титрационный раствор двойной соли сернокислого аммония и сернокислого железа стандартизируют по стандартному раствору дихромата калия. Двадцать пять мл стандартного раствора дихромата калия прокапывают пипеткой в 300 мл коническую колбу. Семьдесят мл добавляют до 80 мл водой. Осторожно добавляют 10 мл концентрированной серной кислоты и 3 капли 1,10- фенантролинового индикатора. После охлаждения раствор титруют стандартным раствором двойной соли сернокислого аммония и сернокислого железа с получением раствора красного цвета. Концентрацию раствора двойной соли сернокислого аммония и сернокислого железа рассчитывают в молях на л следующим образом (1): где концентрацию раствора двойной соли сернокислого аммония и сернокислого железа выражают в молях на л; V представляет раствор двойной соли сернокислого аммония и сернокислого железа, требуемый для титрования.
Экстракция общих гуминовых кислот
Получают пять веществ, содержащих гуминовую кислоту, здесь и далее называемых леонардит. В Таблице 7 приведено краткое описание источника каждого леонардита. Для экстракции гуминовых кислот в конические колбы отвешивают образцы 0,2±0,0002 г. Добавляют и перемешивают сто пятьдесят мл щелочного экстракционного раствора пирофосфата натрия (общие гуминовые кислоты) до равномерного увлажнения образцов. На колбу помещают небольшую воронку и нагревают на бане с кипящей водой в течение 2 часов, часто встряхивая, для обеспечения осаждения нерастворимого материала. Колбу удаляют с водяной бани, охлаждают до комнатной температуры и перемещают экстракт и осадок в 200 мл мерную колбу. Экстракт разводят водой до метки и встряхивают для обеспечения тщательного перемешивания.
Определение общих гуминовых кислот
Для определения гуминовых кислот в экстрактах в коническую колбу от 250 мл до 300 мл пипеткой прокапывают 5 мл экстракта. В колбу добавляют пять мл окисляющего раствора дихромата калия. Осторожно добавляют 15 мл концентрированной серной кислоты. Раствор помещают на баню с кипящей водой на 30 минут, затем раствор охлаждают до комнатной температуры и разводят до около 100 мл. В раствор добавляют три капли 1,10- фенантролинового индикатора и титруют титрационным раствором двойной соли сернокислого аммония и сернокислого железа с получением раствора кирпично-красного цвета. В контрольных образцах на общие гуминовые кислоты 5 мл экстракта заменяют на 5 мл пирофосфата натрия.
Расчет общих гуминовых кислот
Общее содержание гуминовой кислоты (WHA,t) рассчитывают как процент по массе от анализируемого образца, по следующей формуле (2), где 0,003 представляет массу углерода в миллимолях, в г/ммоль; Vo представляет объем титрационного раствора двойной соли сернокислого аммония и сернокислого железа, используемого в качестве контрольного титра, в мл; V1 представляет объем титрационного раствора двойной соли сернокислого аммония и сернокислого железа, используемого в титре экстракта, в мл; с представляет концентрацию титрационного раствора двойной соли сернокислого аммония и сернокислого железа, в моль/л; Ve представляет объем экстракта, в мл; Va представляет объем аликвоты, взятой для титрования, в мл; 0,59 представляет среднее соотношение содержания углерода в гуминовых кислотах для бурого угля и лигнитов; m представляет массу образца, взятого для тестирования, в г.
|w HA = ( V 0 − V 1 ) × 0,003 × c 0,59 × m × V e V a × 100
| Таблица 7Источники леонардита | |
| Леонардит | Источник |
| HS1 | Xuguang Jieneng Co., Ltd, Yunnan Province, China |
| HS2 | Poortershaven, Rotterdam, The Netherlands |
| HS3 | HuminTech, Düsseldorf, Germany |
| HS4 | Pingxiang Jiali Ceramic Materials Co., Ltd, Jiangxi Province, China |
| HS5 | Double Dragons Humic Acid Co.Ltd. Xinjiang, China |
Растворимость образцов леонардита при различных pH
Эксперимент проводят для определения нерастворимой части образцов леонардита. Кратко, 0,15 г образца растворяют в 75 мл раствора, отрегулированного до pH 1,5; 3,0 или 7,0. Раствор при pH 1,5 представляет раствор Кларка и Любса, состоящий из 25 мл 0,2M KCl, 20,7 мл 0,2M HCl, разведенного до 100 мл водой MilliQ (Millipore, Brussels, Belgium). Раствор при pH 3,0 представляет 0,1M NaH2PО4, отрегулированный до pH при использовании H3PO4 (Acros, Geel, Belgium); раствор при pH 7,0 представляет 0,1M Na2HPО4.2H2О отрегулированный до pH при использовании 0,1M NaH2PО4. Все химические реагенты от VWR International, Leuven, Belgium). Суспензию выдерживают в течение одного часа при комнатной температуре на устройстве для магнитного перемешивания (600 оборотов в минуту). Через один час все суспензии фильтруют через 55 мм стекловолоконный фильтр (GF-92, Whatman, Dassel, Germany). Ретентат сушат в течение двух часов в сушильной камере при температуре 130°C. Количество ретентата рассчитывают как разницу массы между пустым фильтром и фильтром+высушенный ретентат. Выход (%) рассчитывают как соотношение «количество ретентата/масса продукта» и выражают в процентах. Проводят трехкратный анализ образцов и рассчитывают среднее. Контрольный материал представляет очищенную гуминовую кислоту (HA, Sigma Aldrich, Bornem, Belgium). Извлечение нерастворимой фракции суспензии HA при pH 7 невозможно. Фильтрация этой суспензии не может быть проведена, поскольку образовавшиеся на стадии инкубации «флотирующие вещества» делают фильтр непроницаемым. Эксперимент повторяют в 0,1M растворе цитрата (C6H5Na3O7.2H2O в воде MilliQ), отрегулированном до pH 6,2 при использовании C6H8O7.H2O, для образцов HS2, HS3 и HA. Однако результаты были такими же. Суспензии других продуктов легко фильтруются при каждом тестируемом pH. Для решения вопроса о растворимости гуминовой кислоты при pH 7 эксперимент повторяют при использовании только 0,02г образца вместо 0,15 г. Повторы делают только для образцов HS2, HS3 и HA. Все другие условия теста остаются такими же.
In vitro способность веществ, содержащих гуминовую кислоту, связывать микотоксин
Детали способа in vitro могут быть найдены во внутренней инструкции LB-IV-20/142-E2; Определение эффективности детоксикации микотоксина в «двух фазной процедуре» проводят в сочетании с анализом ВЭЖХ. Однако необходима модификация этой процедуры, поскольку леонардит, включенный в новый продукт - связывающее токсины вещество - сильно препятствует ВЭЖХ определению микотоксинов при инжекции супернатантов непосредственно в систему ВЭЖХ. Следовательно, на стадии очистки используют иммуноаффинную колонку (1AC, Vicam, USA) (более детально смотрите ниже).
Измеряют адсорбцию в кислой среде (pH 3,0), имитирующей pH желудка моногастричного животного, и десорбцию при pH, близком к нейтральному (pH 6,8), имитирующем условия pH в кишечнике моногастричного животного. Чистый процент эффективности детоксикации микотоксина определяют как процент адсорбции минус процент десорбции. При двукратном повторе аликвоты 0,1M раствора фосфата (отрегулированные до pH 3,0), содержащие 300 частей на миллиард зеараленона в растворе (10 мл), добавляют в 15 мл полипропиленовые пробирки Falcon с навинчивающейся крышкой, в которые был добавлен 0,05 грамм каждого адсорбента. Тестируемые пробирки помещают в орбитальный встряхиватель на 60 минут при комнатной температуре. Каждый тестируемый раствор микотоксина центрифугируют (5000-12000 g) в течение 10 минут с получением прозрачного раствора. Для анализа микотоксина (адсорбция) выделяют водный супернатант. Осадок ресуспендируют в 0,1M раствора фосфата при pH 6,8. Тестируемые пробирки снова помещают в орбитальный встряхиватель на 60 минут при комнатной температуре и затем центрифугируют. Водный супернатант анализируют на зеараленон (десорбция). После центрифугирования раствора при pH 3,0 и 6,8 проводят стадию промывки IAC. После удаления защитной жидкости из колонок IAC колонки промывают 8 мл раствора фосфатно-солевого буфера (PBS) с pH 7,4. Затем в колонку вводят 3 мл супернатанта. После этого колонку промывают 20 мл mQ воды и сушат при умеренном вакууме в течение нескольких секунд. Зеара