Способы лечения висцеральной боли путем введения антител-антагонистов, направленных против пептида, связанного с геном кальцитонина
Иллюстрации
Показать всеПредложенная группа изобретений относится к области медицины. Предложен способ лечения висцеральной боли и/или одного или более чем одного симптома висцеральной боли, включающий введение терапевтически эффективного количества антитела-антагониста против пептида, связанного с геном кальцитонина (CGRP), индивиду, страдающему от висцеральной боли, или индивиду с риском висцеральной боли, где антитело-антагонист против CGRP изготовлено для периферического введения. Предложена также фармацевтическая композиция, содержащая антитело-антагонист против CGRP и фармацевтически приемлемый носитель, изготовленная для периферического введения. Предложенная группа изобретений обеспечивает эффективное лечение висцеральной боли без использования опиатов. 2 н. и 16 з.п. ф-лы, 3 ил., 2 табл., 3 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способу лечения и/или предотвращения висцеральной боли и/или симптомов висцеральной боли с использованием антитела против CGRP и к антителу против CGRP для использования в предотвращении и/или лечении висцеральной боли и/или симптомов висцеральной боли.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Висцеральная боль является ведущей причиной визитов пациентов в клинику, тем не менее, эффективное лечение висцеральной боли ограничено. Клинически лечение висцеральной боли затруднительно и часто требует использования опиатоз. Несмотря на их широкое применение, тяжелые дозолимитирующие нежелательные эффекты опиатов часто приводят к снижению их эффективности. Кроме того, опиаты связаны с риском злоупотребления и физической зависимости и приводят к запору и другим нежелательным побочным эффектам, что во многих случаях противопоказано и снижает качество жизни.
Висцеральная боль связана с внутренними органами, включающими внутренние органы организма. Эти органы включают, например, сердце, легкие, репродуктивные органы, мочевой пузырь, мочеточники, органы пищеварительной системы, печень, поджелудочную железу, селезенку и почки. Висцеральная боль может возникать при множестве состояний, таких как, например, панкреатит, роды, хирургические вмешательства на органах брюшной полости, связанные с кишечной непроходимостью, цистит, менструация или дисменорея. Сходным образом, висцеральной болью можно считать почечную боль, эпигастральную боль, плевральную боль и болезненные желчные колики, боль при аппендиците. Загрудинные боль или давление, обусловленные ранним инфарктом миокарда, также являются висцеральными. К висцеральной боли могут приводить заболевания желудка, двенадцатиперстной кишки или толстой кишки. Распространенные расстройства желудочно-кишечного тракта (ЖКТ), приводящие к висцеральной боли, включают функциональное расстройство кишечника (ФРК) и воспалительное заболевание кишечника (ВЗК). Эти расстройства ЖКТ включают широкий спектр болезненных состояний, эффективность лечения которых в настоящее время ограничена, включающих, относительно ФРК, гастроэзофагеальный рефлюкс, диспепсию, синдром раздраженного кишечника (СРК) и синдром функциональной абдоминальной боли (СФАБ), и, относительно ВЗК, болезнь Крона, илеит и неспецифический язвенный колит, каждое из которых регулярно приводит к висцеральной боли.
СРК поражает 10-20% взрослых и подростков во всем мире (Longstreth et al., 2006, Gastroenterology 130(5):1480-91). Основной причиной обращения этих пациентов к врачу является хроническая висцеральная боль, обусловленная, как полагают, повышенной висцеральной чувствительностью (Aziz, 2006, Gastroenterology 131(2):661-4). Показано, что у пациентов с СРК снижен порог висцеральной чувствительности к растяжению толстой и прямой кишки, и это сильно коррелирует с симптомами висцеральной боли (Delafoy et al, 2006, Gut 55(7):940-5). Колит, индуцированный у крыс растяжением толстой и прямой кишки после введения тринитробензолсульфокислоты (TNBS), представляет собой животную модель, используемую многими исследователями для изучения механизмов висцеральной гиперчувствительности (Gay et al, 2006, Neuroimmunomodulation 23;13(2):114-121; Delafoy et al, 2006; Adam et al., 2006, Pain 123(1-2):179-86).
Интерстициальный цистит (ИЦ) представляет собой синдром боли в мочевом пузыре, клиническими признаками которого являются неотложные позывы к мочеиспусканию, частое мочеиспускание и хроническая тазовая боль. Клинические исследования показывают, что в это вовлечена гиперчувствительность висцеральных сенсорных афферентных нервов, при которой ощущение наполнения мочевого пузыря возникает при меньших, чем в норме, объемах, и восприятие наполнения мочевого пузыря становится болезненным. У пациентов с ИЦ показаны увеличение количества нервных окончаний в подслизистом слое мочевого пузыря и признаки нейрогенного воспаления. Гистопатология ИЦ позволяет предполагать вовлечение в патологический процесс висцеральных афферентных нервов.
Висцеральная боль может возникать в ответ на, например, воспаление, растяжение или повышенное давление. Она не всегда вызвана повреждением внутренних органов. Кроме того, висцеральная боль является диффузной, может иррадиировать в другие области и может быть связана с другими вегетативными и двигательными рефлексами (например, тошнотой, напряжением мышц поясницы при почечной колике) (Lancet 1999, 353, 2145-48).
CGRP (пептид, связанный с геном кальцитонина) представляет собой нейропептид из 37 аминокислот, принадлежащий к семейству пептидов, включающему кальцитонин, адреномедуллин и амилин. У людей существуют две формы CGRP (α-CGRP и β-CGRP), обладающие сходными активностями. Они отличаются тремя аминокислотами и по-разному распределены. Отличия активностей могут также быть обусловлены по меньшей мере двумя подтипами рецепторов CGRP. CGRP является нейромедиатором в центральной нервной системе, и показано, что он действует как сильный вазодилататор на периферии, где нейрональные процессы, включающие CGRP, тесно связаны с кровеносными сосудами. CGRP-опосредованная вазодилатация также связана с нейрогенным воспалением в качестве части цепи событий, приводящих к выходу плазмы из сосудов и расширению микрососудов и происходящих при мигрени.
Показано, что спинальное введение селективных антагонистов CGRP, имеющих небольшие молекулы, полезно при лечении состояний с невропатической и ноцицептивной болью (Adwanikar et al, Pain, 2007, 132(1-2):53-66), позволяя предположить, что устранение сигнализации, связанной с эндогенным CGRP, в спинном мозге оказывает антиноцицептивный эффект. В сообщениях установлено, что блокада CGRP-сигнализации эффективна при устранении висцеральной гиперчувствительности (VH) путем системного введения CGRP 8-37, антагониста рецепторов CGRP (Delafoy et al., 2006; Plourde et al., 1997, Am J Physiol. 273(1 Pt 1):G191-6; Julia and Bueno, 1997, Am J Physiol. 272(1 Pt 1):G141-6). Однако CGRP 8-37 имеет очень короткий период полувыведения in vivo и по этой причине неприменим в качестве лекарственного средства. Таким образом, существует насущная медицинская необходимость в установлении новых лекарственных средств для лечения и предотвращения висцеральной боли.
В данной заявке присутствуют ссылки на различные публикации (включая патенты и заявки на патенты). Содержание этих публикаций полностью включено сюда посредством ссылки.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно настоящему изобретению предложен способ предотвращения и/или лечения висцеральной боли и/или симптомов висцеральной боли у индивида, включающий введение терапевтически эффективного количества антитела-антагониста против CGRP индивиду, страдающему от висцеральной боли, или индивиду с риском висцеральной боли.
В некоторых воплощениях антитело-антагонист против CGRP вводят периферически. В других воплощениях антитело-антагонист против CGRP вводят перорально, сублингвально, ингаляцией, трансдермально, подкожно, внутривенно, внутриартериально, интраартикулярно, периартикулярно, местно и/или внутримышечно.
В некоторых воплощениях висцеральная боль связана с функциональным расстройством кишечника (ФРК). ФРК может представлять собой гастроэзофагеальный рефлюкс, диспепсию, синдром раздраженного кишечника (СРК) и синдром функциональной абдоминальной боли (СФАБ). В некоторых воплощениях висцеральная боль связана с воспалительным заболеванием кишечника (ВЗК). ВЗК может представлять собой болезнь Крона, илеит или неспецифический язвенный колит. В некоторых воплощениях висцеральная боль связана с почечной коликой, дисменореей, циститом, менструацией, родами, менопаузой, простатитом или панкреатитом. В некоторых воплощениях висцеральная боль связана с интерстициальным циститом (ИЦ).
В некоторых воплощениях антитело-антагонист против CGRP связывается с CGRP; блокирует связывание CGRP с его рецептором; блокирует или ослабляет активацию рецепторов CGRP; ингибирует, блокирует, подавляет или снижает биологическую активность CGRP; усиливает клиренс CGRP и/или ингибирует синтез, образование или высвобождение CGRP.
В некоторых воплощениях антитело-антагонист против CGRP представляет собой человеческое антитело или гуманизированное антитело. В некоторых воплощениях антитело-антагонист против CGRP представляет собой моноклональное антитело. В некоторых воплощениях антитело-антагонист против CGRP может связываться с CGRP с КD 50 нМ или менее (как измерено поверхностным плазменным резонансом при 37°С) и/или имеет период полувыведения in vivo по меньшей мере 7 суток.
В некоторых воплощениях антитело-антагонист против CGRP специфично связывается с С-концевой областью CGRP. В некоторых воплощениях антитело-антагонист против CGRP специфично распознает эпитоп, определенный последовательностью GSKAF (SEQ ID NO:39). В некоторых воплощениях антитело-антагонист против CGRP содержит вариабельный домен тяжелой цепи (VH), аминокислотная последовательность которого по меньшей мере на 90% идентична SEQ ID N0:1 или 19.
В некоторых воплощениях антитело-антагонист против CGRP содержит вариабельный домен легкой цепи (VL), аминокислотная последовательность которого по меньшей мере на 90% идентична SEQ ID NO:2 или 20. В некоторых воплощениях антитело-антагонист против CGRP дополнительно содержит домен VH, аминокислотная последовательность которого по меньшей мере на 90% идентична SEQ ID NO:1 или 19. В других воплощениях антитело против CGRP содержит по меньшей мере один гипервариабельный участок (CDR), выбранный из группы, состоящей из: (а) гипервариабельного участка 1 тяжелой цепи (CDR H1), как изложено в SEQ ID NO:3, 21, 33, 34, 36 или 37; (6) гипервариабельного участка 2 тяжелой цепи (CDR H2), как изложено в SEQ ID NO:4, 22, 35 или 38; (в) гипервариабельного участка 3 тяжелой цепи (CDR Н3), как изложено в SEQ ID NO:5 или 23; (г) гипервариабельного участка 1 легкой цепи (CDR L1), как изложено в SEQ ID NO:6 или 24; (д) гипервариабельного участка 2 легкой цепи (CDR L2), как изложено в SEQ ID NO:7 или 25; и (е) гипервариабельного участка 3 легкой цепи (CDR L3), как изложено в SEQ ID NO:8 или 26; и (ж) вариантов L1, L2 и H2.
В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность тяжелой цепи антитела G1, показанную в SEQ ID NO:11, с С-концевым лизином или без него. В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность легкой цепи антитела G1, показанную в SEQ ID NO:12. В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность тяжелой цепи антитела G1, показанную в SEQ ID NO:11, с С-концевым лизином или без него; и полноразмерную аминокислотную последовательность легкой цепи антитела G1, показанную в SEQ ID NO:12.
В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность тяжелой цепи антитела G2, показанную в SEQ ID NO:29, с С-концевым лизином или без него. В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность легкой цепи антитела G2, показанную в SEQ ID NO:30. В некоторых воплощениях антитело против CGRP содержит полноразмерную аминокислотную последовательность тяжелой цепи антитела G2, показанную в SEQ ID NO:29; и полноразмерную аминокислотную последовательность легкой цепи антитела G2, показанную в SEQ ID NO:30.
В некоторых воплощениях антитело-антагонист против CGRP содержит домен VH, аминокислотная последовательность которого по меньшей мере на 90% идентична SEQ ID NO:1, и домен VL, аминокислотная последовательность которого по меньшей мере на 90% идентична SEQ ID NO:2. В некоторых воплощениях антитело-антагонист против CGRP содержит тяжелую цепь, полученную с использованием вектора экспрессии с регистрационным номером в Американской коллекции типовых культур (АТСС) РТА-6867. В некоторых воплощениях антитело-антагонист против CGRP содержит легкую цепь, полученную с использованием вектора экспрессии с регистрационным номером в АТСС РТА-6866. В некоторых воплощениях антитело-антагонист против CGRP получено с использованием векторов экспрессии с регистрационными номерами в АТСС РТА-6867 и РТА-6866.
В некоторых воплощениях антитело-антагонист против CGRP вводят подкожной или внутривенной инъекцией один, два, три или четыре раза в месяц. В некоторых воплощениях антитело-антагонист против CGRP вводят в концентрации 5-100 мг/мл. В некоторых воплощениях антитело-антагонист против CGRP вводят в концентрации 1-100 мг/кг массы тела/
В некоторых воплощениях антитело-антагонист против CGRP не приводит к связанному с центральной нервной системой (ЦНС) расстройству координации движений или внимания. В некоторых воплощениях антитело-антагонист против CGRP не вводят центрально, спинально или интратекально. В некоторых воплощениях антитело-антагонист против CGRP не является центрально, спинально или интратекально проникающей молекулой.
В некоторых воплощениях антитело-антагонист против CGRP вводят раздельно, последовательно или одновременно в комбинации с одним или более чем одним дополнительным фармакологически активным соединением. В некоторых воплощениях одно или более чем одно дополнительное фармакологически активное соединение выбрано из: опиоидного анальгетика, например морфина, героина, гидроморфона, оксиморфона, леворфанола, леваллорфана, метадона, меперидина, фентанила, кокаина, кодеина, дигидрокодеина, оксикодона, гидрокодона, пропоксифена, налмефена, налорфина, налоксона, налтрексона, бупренорфина, буторфанола, налбуфина или пентазоцина; нестероидного противовоспалительного лекарственного средства (НПВС), например аспирина, диклофенака, дифлунизала, этодолака, фенбуфена, фенопрофена, флуфенизала, флурбипрофена, ибупрофена, индометацина, кетопрофена, кеторолака, меклофенамовой кислоты, мефенамовой кислоты, набуметона, напроксена, оксапрозина, фенилбутазона, пироксикама, сулиндака, толметина или зомепирака либо их фармацевтически приемлемой соли; барбитуратного седативного средства, например амобарбитала, апробарбитала, бутабарбитала, бутабитала, мефобарбитала, метарбитала, метогекситала, пентобарбитала, фенобарбитала, секобарбитала, талбутала, тиамилала или тиопентала либо их фармацевтически приемлемой соли; бензодиазепина, обладающего седативным действием, например хлордиазепоксида, клоразепата, диазепама, флуразепама, лоразепама, оксазепама, темазепама или триазолама либо их фармацевтически приемлемой соли; Н1-антагониста, обладающего седативным действием, например дифенгидрамина, пириламина, прометазина, хлорфенирамина или хлорциклизина либо их фармацевтически приемлемой соли; седативного средства, такого как глутетимид, мепробамат, метэквалон или дихлоралфеназон или их фармацевтически приемлемая соль; средства, расслабляющего скелетные мышцы, например баклофена, карисопродола, хлорзоксазона, циклобензаприна, метокарбамола или орфренадина либо их фармацевтически приемлемой соли; антагониста рецепторов N-метил-D-аспартата (NMDA), например декстрометорфана ((+)-3-гидрокси-N-метилморфинана) или его метаболита декстрорфана ((+)-3-гидрокси-N-метилморфинана), кетамина, мемантина, пирролохинолинхинона или цис-4-(фосфонометил)-2-пиперидинкарбоновой кислоты либо их фармацевтически приемлемой соли; альфа-адренергического средства, например доксазозина, тамсулозина, клонидина или 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)-хиназолина; трициклического антидепрессанта, например дезипрамина, имипрамина, амитриптилина или нортриптилина; противосудорожного средства, например карбамазепина или вальпроага; антагониста тахикинина (NK), в частности антагониста NK-3, NK-2 или NK-1, например (αR,9R)-7-[3,5-бис(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7Н-[1,4]диазоцино[2,1 -g][1,7]нафтиридин-6-13-диона (ТАК-637), 5-[[(2R,3S)-2-[(1R)-1-[3,5-бис(трифгорметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]-1,2-дигидро-3Н-1,2,4-триазол-3-она (МК-869), ланепитанта, дапитанта или 3-[[2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S); антагониста мускариновых рецепторов, например оксибутина, толтеродина, пропиверина, хлорида тропсия или дарифенацина, ингибитора циклооксигеназы-2 (ЦОГ-2), например целекоксиба, рофекоксиба или вальдекоксиба; неселективного ингибитора ЦОГ (предпочтительно с защитным действием на ЖКТ), например нитрофлурбипрофена (НСТ-1026); анальгетика, являющегося производным анилина, в частности парацетамола; нейролептика, такого как дроперидол; агониста (например, резинфератоксина) или антагониста (например, капсазепина) ваниллоидных рецепторов; бета-адренергического средства, такого как пропранолол; местного анестетика, такого как мексилетин; кортикостероида, такого как дексаметазон; агониста или антагониста серотониновых рецепторов; холинергического (никотинового) анальгетика; Tramadol®; ингибитора фосфодиэстеразы-5 (ФДЭ-5), такого как силденафил, варденафил или таладафил; альфа-2-дельта-лиганда, такого как габапентин или прегабалин; и каннабиноида.
Согласно настоящему изобретению также предложено применение антитела-антагониста против CGRP для изготовления лекарственного средства для предотвращения и/или лечения висцеральной боли и/или симптомов висцеральной боли. В некоторых воплощениях лекарственное средство изготовлено для периферического введения. В некоторых воплощениях антитело-антагонист против CGRP оказывает при введении периферическое действие.
Согласно настоящему изобретению также предложена фармацевтическая композиция для лечения и/или предотвращения висцеральной боли и/или симптомов висцеральной боли у индивида, содержащая антитело-антагонист против CGRP и фармацевтически приемлемый носитель. В некоторых воплощениях композиция изготовлена для периферического введения.
Согласно настоящему изобретению также предложен набор, включающий фармацевтическую композицию для лечения и/или предотвращения висцеральной боли и/или симптомов висцеральной боли у индивида и инструкции для периферического введения терапевтически эффективного количества указанной фармацевтической композиции индивиду для лечения и/или предотвращения висцеральной боли и/или симптомов висцеральной боли.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
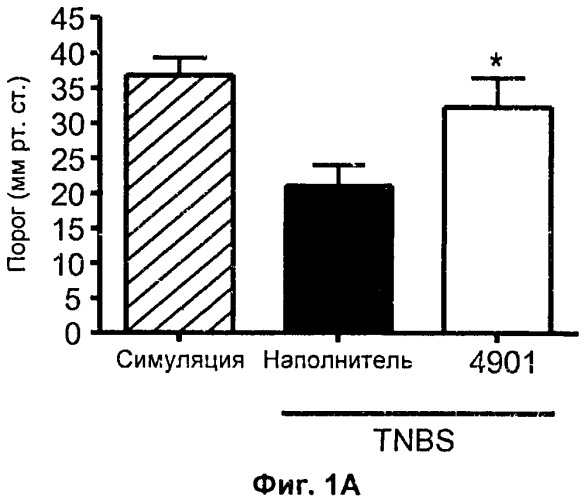
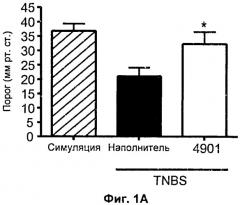
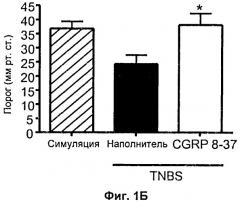
На Фиг.1А и 1Б показана модель висцеральной боли. (А) Антитело 4901 («4901») или контроль PBS («наполнитель») внутривенно вводили животным, получившим инъекции тринитробензолсульфокислоты (TNBS) после лапаротомии. Висцеральный болевой порог у животных исследовали с использованием баллонного растяжения. Болевой порог указан в мм рт. ст. (ось y). «Симуляция» означает, что после лапаротомии вместо TNBS животным вводили контрольный раствор (30% этанол). (Б) Антагонист рецепторов CGRP CGRP 8-37 или контроль PBS («наполнитель») внутривенно вводили животным, получившим TNBS после лапаротомии. Как в (А), висцеральный болевой порог у животных исследовали с использованием баллонного растяжения, и болевой порог указан в мм рт. ст. (ось y).
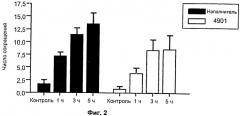
На Фиг. 2 показана модель висцеральной боли. Животным внутривенно вводили антитело 4901 («4901») или контроль PBS («наполнитель»). Моторику мочевого пузыря, измеряемую как число сокращений (ось у), определяли через 1 ч, 3 ч и 5 ч после индуцированного терпентином воспаления мочевого пузыря.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно изобретению, раскрытому здесь, предложены способы лечения и/или предотвращения висцеральной боли у индивида путем введения индивиду терапевтически эффективного количества антитела-антагониста против CGRP.
Согласно изобретению, раскрытому здесь, также предложены антитела-антагонисты против CGRP и полипептиды, имеющие происхождение из G1 или его вариантов, показанных в Таблице 6 WO 2007/054809, полностью включенной сюда посредством ссылки. Согласно изобретению также предложены способы изготовления и применения этих антител и полипептидов.
Общие методики
При практическом использовании настоящего изобретения будут применять, если не указано иное, обычные методики молекулярной биологии (включая рекомбинантные методики), микробиологии, клеточной биологии, биохимии и иммунологии, входящие в компетенцию специалистов в данной области техники. Такие методики подробно описаны в литературе, такой как Molecular Cloning: A Laboratory Manual, second edition (Sambrook et ai., 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J.Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E.Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I.Freshney, ed., 1987); Introduction to Cell and Tissue Culture (J.P.Mather and P.E.Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A.Doyle, J.B.Griffiths, and D.G.Newell, eds., 1993-1998) J.Wiley and Sons; Methods in Enzymology (Academic Press, Inc.); Handbook of Experimental Immunology (D.M.Weir and C.C.Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M.Miller and M.P.Calos, eds., 1987); Current Protocols in Molecular Biology (F.M. Ausubel et al., eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E.Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A.Janeway and P.Travers, 1997); Antibodies (P.Finch, 1997); Antibodies: a practical approach (D.Catty., ed., IRL Press, 1988-1989); Monoclonal antibodies: a practical approach (P.Shepherd and C.Dean, eds., Oxford University Press, 2000); Using antibodies: a laboratory manual (E.Harlow and D.Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M.Zanetti and J.D.Capra, eds., Harwood Academic Publishers, 1995).
Определения
«Антитело» представляет собой молекулу иммуноглобулина, способную специфично связываться с мишенью, такой как углевод, полинуклеотид, липид, полипептид и так далее, через по меньшей мере один сайт распознавания антигена, расположенный в вариабельной области молекулы иммуноглобулина. При использовании здесь этот термин включает не только интактные поликлональные или моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные фрагменты (ScFv), их мутантные варианты, слитые белки, содержащие часть антитела (такую как однодоменные антитела)? и любую другую модифицированную форму молекулы иммуноглобулина, содержащую сайт распознавания антигена. Антитело включает антитело любого класса, такого как IgG, IgA или IgM (или их подклассы), и нет необходимости в том, чтобы антитело представляло собой антитело какого-либо определенного класса. В зависимости от аминокислотной последовательности константного домена тяжелых цепей иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены далее на подклассы (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, называют альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
При использовании здесь «моноклональное антитело» относится к антителу, полученному из совокупности по существу однородных антител, то есть отдельные антитела, составляющие совокупность, идентичны, за исключением возможных естественных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела высокоспецифичны и направлены против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Модификатор «моноклональный» указывает на то, что антитело было получено из по существу однородной совокупности антител, и его не следует толковать как требующего получения антитела каким-либо определенным способом. Например, моноклональные антитела для использования в настоящем изобретении могут быть получены гибридомным способом, впервые описанным Kohler and Milstein, 1975, Nature, 256:495, или могут быть получены способами рекомбинантных ДНК, такими как описанные в патенте США № 4816567. Например, моноклональные антитела могут также быть выделены из фаговых библиотек, полученных с применением методик, описанных в McCafferty et al., 1990, Nature, 348:552-554.
При использовании здесь «гуманизированные» антитела относятся к формам антител от источника, не являющегося человеком (например, мыши), которые представляют собой определенные химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антиген-связывающие подпоследовательности антител), содержащие минимальную последовательность, имеющую происхождение из иммуноглобулина от источника, не являющегося человеком. Большей частью гуманизированные антитела представляют собой человеческие иммуноглобулины (антитела-реципиенты), в которых остатки гипервариабельного участка (CDR) реципиента заменены остатками CDR вида, не являющегося человеком (антитела-донора), такого как мышь, крыса или кролик, имеющего желаемую специфичность, аффинность и биологическую активность. В некоторых случаях остатки каркасной области (FR) человеческого иммуноглобулина заменены соответствующими остатками от источника, не являющегося человеком. Кроме того, гуманизированное антитело может содержать остатки, не входящие ни в антитело-реципиент, ни во вносимые последовательности CDR или каркасных областей, но включенные для дополнительного улучшения и оптимизации свойств антитела. В целом, гуманизированное антитело будет содержать по существу все из по меньшей мере одного и обычно двух вариабельных доменов (например, вариабельного домена тяжелой цепи и вариабельного домена легкой цепи), где все или по существу все CDR-участки соответствуют CDR-участкам иммуноглобулина от источника, не являющегося человеком, и все или по существу все FR-области представляют собой FR-области консенсусной последовательности человеческого иммуноглобулина. В оптимальном случае гуманизированное антитело также будет содержать по меньшей мере часть константной области или домена иммуноглобулина (Fc), обычно константной области или домена человеческого иммуноглобулина. Антитела могут иметь Fc-области, модифицированные, как описано в WO 99/58572. Другие формы гуманизированных антител имеют один или более чем один CDR (один, два, три, четыре, пять, шесть), измененные относительно исходного антитела, которые также называют одним или более чем одним CDR, «имеющим происхождение» из одного или более чем одного CDR исходного антитела.
При использовании здесь «человеческое антитело» означает антитело, имеющее аминокислотную последовательность, соответствующую аминокислотной последовательности антитела, образованного у человека и/или полученного с применением любой из методик получения человеческих антител, известных в данной области техники или раскрытых здесь. Это определение человеческого антитела включает антитела, содержащие по меньшей мере один полипептид человеческой тяжелой цепи или по меньшей мере один полипептид человеческой легкой цепи. Одним таким примером является антитело, содержащее полипептиды мышиной легкой цепи и человеческой тяжелой цепи. Человеческие антитела могут быть получены с применением множества методик, известных в данной области техники. В одном воплощении человеческое антитело выбрано из фаговой библиотеки, экспрессирующей человеческие антитела (Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, PNAS, (USA) 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et ai,, 1991, J. Mol. Biol., 222:581). Человеческие антитела могут также быть получены путем введения локусов человеческих иммуноглобулинов в трансгенных животных, например мышей, у которых собственные гены иммуноглобулинов были частично или полностью инактивированы. Этот способ описан в патентах США №5545807; 5545806; 5569825; 5625126; 5633425 и 5661016. Альтернативно, человеческое антитело может быть получено иммортализацией человеческих В-лимфоцитов, продуцирующих антитело, направленное против антигена-мишени (такие В-лимфоциты могут быть получены от индивида или могут быть иммунизированы in vitro). См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R, Liss, p. 77, 1985; Boerner et al., 1991, J. Immunol., 147 (1):86-95; и патент США № 5750373.
При использовании здесь термин «пептид, связанный с геном кальцитонина» и «CGRP» относятся к любой форме пептида, связанного с геном кальцитонина, и его вариантам, сохраняющим, по меньшей мере частично, активность CGRP. Например, CGRP может представлять собой α-CGRP или β-CGRP. При использовании здесь CGRP включает нативную последовательность CGRP всех видов млекопитающих, например человека, собаки, кошки, лошади и коровы.
При использовании здесь «антитело-антагонист против CGRP» (взаимозаменяемо называемое «антителом против CGRP») относится к антителу, способному связываться с CGRP и ингибировать биологическую активность CGRP и/или последующий(ие) метаболический(ие) путь (пути), опосредованный(ые) CGRP-сигнализацией. Антитело-антагонист против CGRP включает антитела, блокирующие, антагонизирующие, подавляющие или снижающие (включая значительное снижение) биологическую активность CGRP, включая последующие метаболические пути, опосредованные CGRP-сигнализацией, такой как связывание с рецепторами и/или индукция клеточного ответа на CGRP. В целях настоящего изобретения однозначно подразумевают, что термин «антитело-антагонист против CGRP» охватывает все вышеуказанные термины, названия и функциональные состояния и свойства, по существу устраняющие, снижающие или нейтрализующие CGRP самого по себе, биологическую активность CGRP (включая, без ограничения, его способность опосредовать любой аспект висцеральной боли) или последствия его биологической активности в любой значимой степени. В некоторых воплощениях антитело-антагонист против CGRP связывается с CGRP и предотвращает связывание CGRP с рецептором CGRP. В других воплощениях антитело против CGRP связывается с CGRP и предотвращает активацию рецептора CGRP. Здесь приведены примеры антител-антагонистов против CGRP.
При использовании здесь термины «G1» и «антитело G1» использованы взаимозаменяемо для обозначения антитела, полученного с использованием векторов экспрессии, имеющих депозитарные номера АТСС-РТА-6867 и АТСС-РТА-6866. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи показаны в SEQ ID NO:1 и 2. CDR-участки антитела G1 (включая CDR по Chothia и Kabat) схематично показаны на Фиг.5 WO 2007/054809, содержание которой полностью включено сюда посредством ссылки. Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепи, показаны в SEQ ID NO:9 и 10. Свойства антитела G1 описаны в Примерах WO 2007/054809.
При использовании здесь термины «G2» и «антитело G2» использованы взаимозаменяемо для обозначения мышиного моноклонального антитела против крысиного CGRP, как описано в Wong НС et al. Hybridoma 12:93-106, 1993. Аминокислотные последовательности вариабельных областей тяжелой цепи и легкой цепи показаны в SEQ ID NO:19 и 20. Полинуклеотиды, кодирующие вариабельные области тяжелой и легкой цепи, показаны в SEQ ID NO:27 и 28. CDR-участки антитела G2 приведены в SEQ ID NO:21-26.
Термины «полипептид», «олигопептид», «пептид» и «белок» использованы здесь взаимозаменяемо для обозначения цепей аминокислот любой длины, предпочтительно относительно коротких (например, 10-100 аминокислот). Цепь может быть линейной или разветвленной, она может содержать модифицированные аминокислоты и/или может быть прервана компонентами, не являющимися аминокислотами. Термины также охватывают цепь аминокислот, модифицированную естественным образом или в результате вмешательства; например, образованием дисульфидных связей, гликозилированием, липидизацией, ацетилированием, фосфорилированием или любой другой манипуляцией или модификацией, такой как конъюгация с компонентом-меткой. Определение также включает, например, полипептиды, содержащие один или более чем один аналог аминокислот (включая, например, искусственные аминокислоты и так далее), а также другие модификации, известные в данной области техники. Подразумевают, что полипептиды могут иметь форму отдельных цепей или связанных цепей.
Как известно в данной области техники, «полинуклеотид» или «нуклеиновая кислота», как они взаимозаменяемо использованы здесь, относятся к цепям нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги или любой субстрат, который может быть включен в цепь ДНК- или РНК-полимеразой. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае присутствия модифицированных нуклеотидов модификация структуры нуклеотидов может быть проведена до или после сборки цепи. Последовательность нуклеотидов может быть прервана компонентами, не являющимися нуклеотидами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, как, например, конъюгацией с компонентом-меткой. Другие типы модификаций включают, например, «копирование», замещение одного или более чем одного встречающегося в природе нуклеотида аналогом, межнуклеотидные модификации, такие как, например, модификации с незаряженными связями (например, метилфосфонаты, фосфотриэфиры, фосфоамидаты, карбаматы и так далее) и с заряженными связями (например, фосфоротиоаты, фосфородитиоаты и так далее), модификации, включающие боковые группировки, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и так далее), модификации с интеркаляторами (например, акридином, псораленом и так далее), модификации, включающие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и так далее), модификации, включающие алкилирующие агенты, модификации с модифицированными связями (например, альфа-аномерные нуклеиновые кислоты и так далее), а также немодифицированные формы полинуклеотида (полинуклеотидов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахарах, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для образования дополнительных связей с дополнительными нуклеотидами или может быть конъюгирована с твердыми подложками. 5'- и 3'-концевые ОН-группы могут быть фосфорилированы или замещены аминами или органическими кэпирующими группировками из 1-20 атомов углерода. Другие гидроксильные группы могут также быть дериватизированы с использованием стандартных защитных групп. Полинуклеотиды могут также содержать аналоги рибозы или дезоксирибозы, в целом известные в данной области техники, включая, например, 2'-O-метил-, 2'-O-аллил-, 2'-фтор- или 2'-азидорибозу, карбоциклические аналоги сахаров, альфа- или бета-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги нуклеозидов без оснований, такие как метилрибозид. Одна или более чем одна фосфодиэфирная связь может быть заменена альтернативными связывающими группами. Эти альтернативные связывающие группы включают, без ограничения, воплощения, где фосфат заменен на P(O)S («тиоат»), P(S)S («дитиоат»), (O)NR2 («амидат»), P(O)R, P(O)OR', СО или СН2 («формацеталь»), где каждый R или R' независимо представляет собой Н или замещенный или незамещенный алкил (1-20 С), возможно содержащий простую эфирную связь (-O-), арил, алкенил, циклоалкил, циклоалкенил или аралкил. Нет необходимости в том, чтобы все связи в полинуклеотиде были идентичными. Предшествующее описание применимо ко всем полинуклеотидам, названным здесь, включая РНК и ДНК.
«Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, самим по себе или в комбинации. Каждая вариабельная область тяжелой и легкой цепи состоит из четырех каркасных областей (FR), соединенных тремя областями, определяющими комплементарность (CDR), также известными как гипервариабельные участки. В каждой цепи FR удерживают CDR вместе в непосредственной близости, и эти CDR вместе с CDR другой цепи вовлечены в образование антиген-связывающего сайта антител. Существует по меньшей мере две методики определения CDR: (1) способ, основанный на межвидовой вариабельности последовательности (то есть Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda MD)); и (2) способ, основанный на кристаллографических исследованиях комплексов антиген-антитело (Al-lazikani etal (1997) J. Moiec. Biol. 273:927-948)). При использовании здесь CDR может относиться к CDR, определенным любым способом или комбинацией обоих способов.
«Константная область» антитела относится к константной области легкой цепи антитела или константной области тяжелой цепи антитела, самим по себе или в комбинации.
При использовании здесь «иммунологически специфичное» связывание антител относ