Композиция для трансдермальной доставки в организм лекарственных веществ и лекарственная форма на ее основе
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описана композиция для трансдермального введения лекарственных веществ (ЛВ) в организм человека и животных, включая случаи неотложного лекарственного лечения и профилактики острых патологических состояний. Композиция состоит из раствора одного или нескольких ЛВ в смеси по меньшей мере двух растворителей: диалкиламида низшей карбоновой кислоты и (или) алкилпирролидона и монотерпенов и (или) монотерпеноидов. При этом суммарная объемная концентрация N,N-диалкиламидов низших карбоновых кислот или N-алкилпирролидонов составляет от 1% до 99% от объема смеси. Композиция позволяет осуществить неотложное лекарственное лечение и профилактику острых патологических состояний организма человека и животных простым в исполнении, безопасным и недорогим способом. 2 н. и 10 з.п. ф-лы, 6 ил., 4 пр.
Реферат
Группа изобретений относится к области медицины и ветеринарии, в частности к сфере разработки новых лекарственных форм, и может быть использована для оказания неотложной помощи человеку или животным при острых патологических состояниях, требующих быстрого введения в организм лекарственных веществ (ЛВ).
Для профилактики или лечения ряда острых патологических состояний организма требуется системное (направленное на удаленные от места введения органы и ткани) действие ЛВ. В медицинской и ветеринарной практике для достижения системного действия ЛВ их вводят в организм через рот (перорально), с помощью инъекций, через верхние дыхательные пути (ингаляционно), через слизистые оболочки (трансмукозально) либо через кожу (трансдермально). Последние три пути введения применяются также для достижения местного (реализуемого в зоне введения) действия ЛВ.
Скорость развития системного фармакологического эффекта ЛВ, вводимых через рот, как правило, недостаточна для оказания неотложной помощи [Машковский М.Д. Лекарственные средства. Пособие для врачей. 15-е изд. - М.: Издательство “Новая волна”, 2005]. Введение ЛВ через рот невозможно при судорогах, бессознательном состоянии больного и при острых патологических состояниях, проявляющихся многократной рвотой или непроходимостью пищеварительного тракта на отрезке между ротовой полостью и двенадцатиперстной кишкой.
Внутривенное введение в организм обеспечивает быстрое (с латентным периодом в несколько минут) системное действие ЛВ. Однако при судорогах пунктирование вен для внутривенного введения ЛВ затруднено движениями пациента. Внутривенное введение ЛВ затруднено также в связи с уменьшением диаметра пунктируемых вен при патологических состояниях, сопровождающихся снижением венозного давления крови.
С целью профилактики или терапии острых патологических состояний организма применяют внутримышечное введение ЛВ [Инструкция по этапному лечению пораженных с боевой терапевтической патологией. Утверждена Начальником ЦВМУ МО СССР. - М., 1983]. В этом случае системное действие ЛВ может быть обеспечено с латентным периодом от нескольких минут до десятков минут [Машковский, 2005], что в большинстве случаев отвечает условиям оказания неотложной помощи при острых патологических состояниях организма.
Общим недостатком внутривенного и внутримышечного введения ЛВ является необходимость навыков выполнения инъекций, что затрудняет применение этих способов людьми, не имеющими таких навыков, - в частности ранеными и больными, в порядке само- и взаимопомощи. Выполнение инъекций в отсутствие соответствующих навыков создает опасность инфекционных осложнений, повреждения крупных кровеносных сосудов или нервных стволов. Другим недостатком внутривенного и внутримышечного введения ЛВ является эпидемиологическая опасность, которую представляют использованные шприцы, шприц-тюбики и инъекционные иглы.
Недостатков, присущих инъекционным способам, лишены способы ингаляционного, трансмукозального и трансдермального введения ЛВ в организм. Все три способа являются самыми старыми в медицинской практике и отличаются разнообразием используемых лекарственных форм, включая жидкие лекарственные формы (растворы, линименты, эмульсии, аэрозоли) и мягкие лекарственные формы (мази и пластыри) [Государственная Фармакопея СССР. 11-е изд. - М.: Медицина, 1990, с.136-162; Виноградов В.М., Каткова Е.Б., Мухин Е.А. Фармакология с рецептурой. - СПб.: Спецлит, 2000, с.34-68]. Подавляющее большинство вышеназванных трансдермальных и трансмукозальных лекарственных форм предназначены для введения ЛВ местного, а не системного действия. Сравнительно новая лекарственная форма - трансдермальная терапевтическая система (ТТС) - является дозированной формой, из которой ЛВ поступают в кровь с заданной скоростью через кожу [Машковский, 2005, с.13]; она предназначена для введения ЛВ как местного, так и системного действия.
Однако ингаляционное и трансмукозальное введение ЛВ в организм имеют ряд ограничений. В частности они неприменимы в случаях нахождения пациента в противогазе или респираторе (например, если атмосфера заражена отравляющими, радиоактивными веществами или бактериальными аэрозолями) или в случае, когда пациент находится в бессознательном состоянии.
Ограничения, присущие инъекционным, ингаляционному и трансмукозальному способам введения ЛВ в организм, могут быть преодолены с помощью ТТС. Примерами промышленно выпускаемых ТТС являются системы, содержащие гормональные (эстрадиол, тестостерон), обезболивающие (фентанил, бупренорфин, лидокаин), сосудорасширяющие (нитроглицерин, нитросорбид), гипотензивные (клонидин), антипаркинсонические (селегилин, ривастигмин), противорвотные (гранисетрон), противовоспалительные (диклофенак), психотропные (метилфенидат), холинолитические (скополамин, оксибутинин) средства [Нu L. Transdermal and transbuccal drug delivery: enhancement using iontophoresis and chemical enhances Doctor's degree thesis, New Jersey, 2010].
К преимуществам ТТС относятся отсутствие специальных требований к навыкам их применения и возможность пролонгированной - от нескольких часов до нескольких суток - подачи ЛВ в организм. Однако имеющиеся на рынке в настоящее время ТТС имеют незначительное быстродействие по сравнению со средствами, применяемыми путем инъекций, ингаляционно или трансмукозально. Как правило латентный период фармакологического эффекта известных ТТС составляет несколько часов или даже суток [Bailey P.L. et al. Transdermal scopolamine reduces nausea and vomiting after outpatient laparoscopy // Anesthesiology, 1990. - Vol.72, №6. - P. 977- 980; Horwitz E. et al. A clinical evaluation of a novel liposomal carrier for acyclovir in the topical treatment of recurrent herpes labialis // Oral Medicine, 1999. - Vol.87. - P. 700-708.; Muijsers et al. Transdermal fentanyl: an updated review of its pharmacological properties and therapeutic efficacy in chronic cancer pain control // Drugs, 2001. - Vol.61. - P.2289-2307.; Durand C. et al. Practical Considerations for Optimal Transdermal Drug Delivery // Am. J. Health Syst. Pharm, 2012. - Vol.69, N2. P. 116-124].
Большее быстродействие (латентный период 5-30 мин) декларируется очень редко и почти исключительно для ТТС, рассчитанных не на системное, а на местное действие содержащихся в них ЛВ. Примерами могут служить ТТС для местной анестезии [Патент США 8273390; Заявка США 20120108664; Заявка США 20060140986; Патент США 5985860; Патент США 5667799; Патент США 8273390].
Представленные данные демонстрируют возможность получения с помощью ТТС не только местных, но и системных фармакологических эффектов, продолжительность латентного периода которых не важна для пользователя. Вместе с тем, эти данные свидетельствуют о том, что существующие ТТС не обеспечивают быстродействия ЛВ, достаточного для неотложного лечения и профилактики острых патологических состояний организма. Для решения этой задачи необходима лекарственная форма, скорость трансдермальной подачи ЛВ из которой в кровь обеспечила бы латентный период фармакологического эффекта, сопоставимый с таковым для внутримышечного введения ЛВ.
Вопрос интенсификации подачи в организм ЛВ через кожу актуален, что отражено в ряде патентных документов. В частности, известно использование внешних физических воздействий, не травмирующих кожу (тепловое, соно-, электро- и ионофорез) для ускорения трансдермально го переноса ЛВ. Воздействие электрического поля применено в одной из двух ТТС с фентанилом, выпускаемых компанией Alza. Одна из них (Дюрогезик®Матрикс для самостоятельного использования) дозирует ЛВ трое суток с латентным периодом анальгетического эффекта 12 ч [Дюрогезик-матрикс. Инструкция по применению]. Вторая (Ionsys® с ионофоретическим усилением) имеет втрое меньшую продолжительность действия, но при этом латентный период анальгетического эффекта сокращен до 10 мин [Herndon СМ., Iontophoretic drug delivery system: focus on fentanyl // Pharmacotherapy. 2007. - Vol.27, N 5. P. 745-754]. Упомянутые трансдермальные терапевтические системы требуют использования специального оборудования и могут применяться только медицинским персоналом, что не отвечает условиям оказания неотложной помощи в порядке само- или взаимопомощи.
Другой подход к ускорению подачи в организм ЛВ через кожу состоит в лекарственной интенсификации местного кровотока. Повышение проницаемости кожи для ЛВ обеспечивают сочетанным введением ЛВ и фармакологического агента, усиливающего местный кровоток. Например, в заявке на изобретение США 20120108664 описан способ трансдермального введения ибупрофена совместно с донорами оксида азота (II), при котором латентный период местного (но не системного) фармакологического эффекта ибупрофена составляет 10-30 мин.
Для интенсификации трансдермального поступления ЛВ предложено также применение микротравмирования кожи. Так, в соответствии с заявкой США 20080008745, роговой слой кожи повреждают специальными аппликаторами с микроиглами. Использование от 50 до 100 микроигл диаметром 75 мкм для интенсификации введения водорастворимых производных налтрексона позволило сократить время достижения его терапевтической концентрации в плазме крови с 25 часов до 5 ч, увеличив в 150 раз количество ЛВ, доставляемого в организм за 40 ч. В другом изобретении [Патент США 6142939] микроиглами названы устройства, проделывающие в коже отверстия диаметром до 1000 мкм. Тем не менее, как видно из приведенного примера, даже при использовании в составе ТТС микроигл, срок достижения терапевтической концентрации ЛВ в плазме крови (5 ч) остается на порядок больше, чем при внутримышечном введении (0,5 ч), что не отвечает условиям оказания неотложной помощи. К недостаткам описанного метода относится и его эпидемиологическая опасность, сопряженная с повреждением кожи микроиглами.
Известно, что микронизация фазы, содержащей ЛВ, в ряде случаев ускоряет его поступление через кожу. При применении масляных дисперсий атропина или дексаметазона с размером частиц ЛВ 0,05-0,30 мкм латентный период действия препаратов был втрое меньше, чем при размере частиц 20-50 мкм. Однако, несмотря на это, он составлял несколько часов [Патент США 6113921], что существенно превышает латентный период при внутримышечном введении ЛВ и не отвечает условиям оказания неотложной помощи при острых патологических состояниях организма.
Другим известным способом интенсификации поступления ЛВ через кожу является комбинация ЛВ с «ускорителями всасывания». К ускорителям всасывания относятся сульфоксиды, спирты, полиолы, алканы, жирные кислоты и их эфиры, амины, амиды (включая мочевину и пирролидоны), терпены, циклодекстрины и поверхностно активные вещества [Sinha V.R. Permeation Enhancers for Transdermal Drug Delivery. Drug Development and Industrial Pharmacy, 2000. - Vol.26, N 11. - P.1131-1140]. К ускорителям всасывания природного происхождения относятся эфирные масла, терпены и полисахариды [Fox L.T. et al. Transdermal Drug Delivery Enhancement by Compounds of Natural Origin. Molecules, 2011. - Vol.16, N12. - P. 10507-10540]. Терпены отнесены к «ускорителям всасывания» в связи с их положительным влиянием на проницаемость кожи для различных соединений, а также в связи с тем, что природные терпены квалифицированы FDA как безопасные вещества [Fox L.T., 2011].
Другим известным ускорителем чрезкожного всасывания ЛВ являются алкиламиды низших карбоновых кислот, так как они обладают высокой сольватирующей способностью и удовлетворительной биосовместимостью [Sinha V.R, 2000; N,N-dimethylacetamide toxnet data]. Однако вещества подобной структуры используют обычно не индивидуально, а в комбинации с другими растворителями или растворами [Shemlale A.J. et al. Useful permeation enhancers for transdermal drug delivery // Internat. J. Pharma Research & Development-Online, 2010. - Vol.2, N 5. P.1-6].
Известен прием одновременного использования не одного, а двух или более веществ-ускорителей всасывания. Так, для доставки в организм хелатирующих агентов (метионина, глутатиона) с целью связывания тяжелых металлов, предложено использовать композицию с тремя растворителями (вода, низший спирт и диметилсульфоксид) [Международная заявка WO2005107723 и заявка США 20080260653]. При этом декларируется высокая скорость поступления ЛВ из нее через кожу (0,1-1,0 мг/см2 за 20 мин, то есть до 3 мг/(см2·ч)).
Для трансдермальной доставки в организм наркотического анальгетика бупренорфина в патенте США 6004969 предложено использовать жидкую или полужидкую композицию, содержащую растворитель из группы терпенов и растворитель из группы жирных спиртов или гликолей. Выявлены соотношения указанных растворителей, обеспечивающие максимальную скорость трансдермальной резорбции ЛВ, однако латентный период терапевтического эффекта при таком введении составлял несколько часов.
Известна жидкая композиция в лекарственной форме пластыря компрессного типа для трансдермальной доставки в организм антагонистов мускариновых рецепторов с целью расслабления гладкой мускулатуры мочевыводящих путей [Европейская заявка ЕР1072260]. Композиция, предназначенная для многочасового использования, включает в себя водный раствор этанола и масло чайного дерева. В случае определенного соотношения этих растворителей, по данным экспериментов in vitro, терапевтическая концентрация ЛВ достигалась при площади пластыря 5-50 см2, что в 40 раз меньше, чем при использовании растворителей порознь.
Включение до 2% лимонена в состав жидкой фармацевтической композиции, содержащей незамещенные или моно-, ди- или тризамещенные амины или неорганические основания, в 16 раз увеличивало скорость трансдермальной резорбции нестероидных противовоспалительных ЛВ. При этом время достижения терапевтической концентрации ЛВ кислотного характера в плазме крови составляло 0,5-1,0 ч [Патент США 5164416].
По сведениям, приведенным в международной заявке WO 2012066537, включение лимонена (до 5%) в состав жидкой фармацевтической композиции, содержащей октанол (10%), на порядок увеличивает скорость трансдермальной резорбции ЛВ, содержащих в структуре молекулы первичную, вторичную или третичную аминогруппы. При этом по данным экспериментов in vitro расчетный срок достижения терапевтической концентрации ЛВ в плазме крови составляет несколько часов.
Из патентной документации известны примеры трансдермального или трансмукозального применения некоторых ЛВ, играющих важную роль в качестве средств неотложной профилактики или неотложного лечения острых патологических состояний организма. В числе этих ЛВ - стероидные противовоспалительные средства, например дексаметазон; холинолитики, например атропин; антидоты наркотических средств опиоидного ряда, например налтрексон; нейролептики, например дроперидол [Машковский, 2005, с.572, 209, 65, 157].
В соответствии с данными некоторых изобретений, описывающих ТТС матричного типа, либо содержащие ускорители проницаемости, латентный период фармакологического эффекта декстаметазона составляет 12 ч [Патент США 4537776] или 16 ч [Патент США 7794738], что не отвечает условиям оказания неотложной помощи при острых патологических состояниях организма.
Единственным примером композиции для применения дексаметазона с целью оказания неотложной помощи, в том числе в порядке само- или взаимопомощи, является композиция, предназначенная для трансмукозального (но не трансдермального) применения ЛВ, обеспечивающая латентный период фармакологического эффекта 5-10 мин [Европейская заявка ЕР2468266].
Известны фармацевтические композиции для трансмукозального (но не трансдермального) введения в организм атропина, обеспечивающие столь же быстрый фармакологический эффект, как и при его внутримышечном введении. [Заявка США 20070048229 и патенты США 5288497 и 5288498]. В Заявке США 20070048229, растворитель атропина представляет собой смесь полярного растворителя и терпена. Другой пример трансмукозального введения атропина приведен в заявке на изобретение РФ 2010136974.
Известны композиции для трансмукозального (но не трансдермального) применения дроперидола, обеспечивающие быстродействие ЛВ, близкое к таковому при внутримышечном введении дроперидола [Патены США 5288497, 5288498 и Заявка РФ 2008105830].
Налтрексон упоминается в числе ЛВ, предназначенных для пролонгированного трансдермального введения из полимерной матрицы, содержащей жидкие и твердые компоненты; латентный период фармакологического эффекта составляет несколько часов [Патент США 5446070]. При трансдермальном применении в составе композиции удалось ввести в организм налтрексон в дозе, составляющей не более трети рекомендованной суточной дозы, за двое суток [Патент США 4573995]. Заявлена композиция для применения налтрексона различными способами, включая трансдермальный, для лечения хронических воспалительных процессов [Заявка РФ 2010136974]. Трансдермальное введение налтрексона в терапевтических дозах обеспечивалось лишь использованием микроигл и требовало значительного времени, а именно 0,5-7,0 суток [Заявка США 20080008745]. Как и в упомянутых случаях с дексаметазоном, атропином и дроперидолом, только при трансмукозальном применении налтрексона в составе композиции удавалось получить фармакологический эффект в сроки, сопоставимые с таковыми при внутримышечной инъекции этого ЛВ [Международная заявка WO820376, Патент США 6113921 и Заявка РФ 2010136974].
Известен также патент США 5240932, в котором описано достижение продолжительной (1-7 суток) анальгезии путем накожной аппликации фармацевтической композиции, содержащей хлористоводородную соль морфина и другие опиоидные анальгетики. Эффект был достигнут благодаря использованию жидкой композиции, содержащей растворители двух типов - неполярные (терпены или пахучие масла, их содержащие, в концентрации 1-20%) и полярные (водные растворы низших спиртов или низших гликолей). Было испытано четыре ЛВ, и для каждого из них был установлен оптимальный по скорости подачи ЛВ качественный и количественный состав растворителей. В описании показано, что соотношение концентраций полярных и неполярных растворителей оказывает существенное влияние на скорость трансдермальной резорбции ЛВ. Однако ни одна из описанных в патенте композиций не оказалась пригодной для оказания неотложной помощи. В частности, за 30 мин после аппликации трансдермальное поступление морфина через 10 см2 поверхности кожи составило не более 1/10 его разовой терапевтической дозы.
Поскольку в патенте США 5240932, в отличие от других приведенных выше аналогов, описаны композиции, содержащие в качестве растворителей ЛВ одновременно используемую смесь полярных и неполярных растворителей, и при этом обеспечивается эффект системного воздействия введенного ЛВ, этот патент является наиболее близким аналогом заявляемой композиции и принят в качестве прототипа.
Недостаток прототипа состоит в том, что он не может быть применен в ситуациях неотложной терапии или неотложной профилактики острых патологических состояний организма.
Целью заявляемой группы изобретений является разработка композиции, которая обеспечила бы возможность оказания неотложной помощи, требуемой в случаях острых патологических состояний организма. При этом решаемая техническая задача - увеличение скорости трансдермального введения лекарственных веществ системного действия.
Поставленную задачу решает композиция, состоящая из раствора соответствующих виду патологии одного или нескольких лекарственных веществ в смеси, по меньшей мере, двух растворителей, при этом первый растворитель выбран из N-алкиламидов или представляет собою их смесь, а второй растворитель выбран из монотерпенов или монотерпеноидов или представляет собою их смесь.
При этом в качестве первого растворителя может быть выбран N,N-диалкиламид низшей карбоновой кислоты или N-алкилпирролидон общей формулы
где:
R2=R1, R1 означает метил или этил, a R3: означает Н, метил, этил
или
R1 означает метил или этил, a R2+R3 означает триметилен; или
их смесь.
Состав смеси растворителей композиции характеризуется тем, что объемное соотношение первого и второго растворителя можно выбрать от примерно 1/99 до примерно 99/1.
Оптимальный состав смеси двух растворителей зависит от вводимого ЛВ и определяется опытным путем. Так, например, в случае использования в качестве ЛВ дроперидола, объемное соотношение первого и второго растворителя можно выбрать от примерно 1/1 до 99/1. В случае использования в качестве ЛВ дексаметазона объемное соотношение первого и второго растворителя можно выбрать от примерно 4/21 до примерно 99/1. А в случаях использования ЛВ атропина и налтрексона объемное соотношение первого и второго растворителей можно выбрать от примерно 1/99 до примерно 99/1.
Вводимыми в состав заявляемой композиции ЛВ могут быть лекарства для оказания неотложной помощи, средства, действующие на центральную или периферическую нервную систему, сердечно-сосудистую систему, выделительную систему, средства, влияющие на обмен веществ, иммунную систему, противомикробные, противопаразитные и противовирусные средства. ЛВ, вводимое трансдермально в составе заявляемой композиции, выбирается в соответствии с существующими рекомендациями по лечению, оказанию неотложной помощи или проведению профилактики.
Заявляемая композиция является самостоятельной лекарственной формой, а именно раствором, если в ее состав входят низковязкие растворители, или линиментом, если в ее составе присутствуют вязкие растворители.
Вторым объектом группы изобретений является новая лекарственная форма для трансдермального введения ЛВ, характеризующаяся тем, что содержит композицию, состоящую из раствора соответствующих виду патологии одного или нескольких ЛВ в смеси по меньшей мере двух растворителей, при этом первый растворитель выбран из N,N-диалкиламидов низших карбоновых кислот или N-алкилпирролидонов или представляет собою их смесь, а второй растворитель выбран из монотерпенов или монотерпеноидов или представляет собою их смесь.
При этом в качестве первого растворителя может быть выбран N,N-диалкиламид низшей карбоновой кислоты или N-алкилпирролидон общей формулы
где:
R2=R1, Ri означает метил или этил, a R3: означает Н, метил, этил
или
R1 означает метил или этил, a R2+R3 означает триметилен; или
их смесь.
Состав смеси растворителей композиции характеризуется тем, что объемное соотношение первого и второго растворителя можно выбрать от примерно 1/99 до примерно 99/1.
Упомянутая лекарственная форма может быть выполнена в виде мази, линимента, крема, геля или аэрозоля.
Осуществление группы изобретений можно выполнить различными путями. Например, первым растворителем смеси может быть N,N-диметилацетамид. Однако вместо него или вместе с ним могут использоваться в любом сочетании N,N-диметиламиды муравьиной, пропионовой кислот, или N,N-диэтиламиды муравьиной, уксусной, или пропионовой кислот, или N-этилпирролидон, либо смесь любых из указанных органических амидов. Все перечисленные органические амиды карбоновых кислот обладают сходными физико-химическими свойствами, существенными для реализации заявляемого способа: высокой полярностью, водорастворимостью, способностью смешиваться в любых соотношениях с малополярными соединениями, нейтральной реакцией водных растворов, высокой (более 150°C) температурой кипения.
Вторым растворителем смеси, используемой для растворения ЛВ, могут быть монотерпены, или кислородсодержащие производные монотерпенового ряда, либо смеси терпенов и (или) терпеноидов указанных групп. Например, (+)-лимонен, терпинеол, ментон, карвон, пинен, камфор, вербенол, вербеной, вербанон, цинеол, скипидар, содержащий до 78% терпенов и терпеноидов, либо эвкалиптовое масло, содержащее не менее 60% терпеноидов 1,8-цинеола, 1,8-эпокси-пара-ментана и 1,4-цинеола.
Заявляемая композиция, содержащая ЛВ, необходимые для оказания неотложной помощи или профилактики, может быть получена известным способом растворения ЛВ в одном из растворителей, или в смеси растворителей, с последующим добавлением требуемого количества одного или нескольких растворителей. Также указанная композиция может быть приготовлена путем растворения определенного количества ЛВ в определенном объеме уже готовой смеси растворителей, приготовленной предварительно. Указанный раствор ЛВ в смеси растворителей может храниться в соответствии с известными требованиями фармакопеи.
Заявляемая композиция, содержащая раствор ЛВ в смеси двух растворителей, может быть нанесена на поверхность кожи с помощью известных дозирующих устройств (мерных емкостей, включая пипетки и дозаторы, пульверизаторы, аэрозольные баллончики и др.).
Заявляемая композиция ЛВ в смеси вышеуказанных растворителей может быть использована и в виде других известных лекарственных форм, полученных на ее основе: аэрозоля, эмульсии, мази (включая гель, крем или линимент), приготовленных по известным методикам с использованием стандартных для данной лекарственной формы ингредиентов [Виноградов В.М., Каткова Е.Б., Мухин Е.А. Фармакология с рецептурой. - СПб.: Спецлит, 2000. С.34-68]. В этом случае при изготовлении известных лекарственных форм «активным ингредиентом» («действующим началом») в них является заявляемая композиция ЛВ в смеси растворителей.
Так, например, лекарственная форма, выполненная в виде мази, может содержать не более 90% мазевой основы, ПАВ и стабилизаторов и не менее 10% активного ингредиента, то есть раствора определенного ЛВ в смеси первого и второго растворителей. Указанный раствор ЛВ предварительно растворяют в липофильном компоненте липофильно-гидрофильной мазевой основы или в части липофильной основы, затем известным для мазей способом вводят оставшуюся гидрофильную или липофильную часть основы, ПАВы и стабилизаторы [Государственная Фармакопея. - 1990. С.145-146; Виноградов В.М. - 2000. С.60-69].
Другой пример: лекарственная форма, выполненная в виде аэрозоля, может содержать биологически активный компонент - заявляемую композицию ЛВ в смеси растворителей, по необходимости компонент, облегчающий диспергирование (ПАВ) и сжатый газ-пропеллент в соответствующей емкости с дозирующим клапаном [Государственная Фармакопея, 1990. - С.136-138; Виноградов В.М. - 2000. С.57-59].
Заявляемая композиция была изготовлена и испытана в форме раствора. Экспериментально было определено, что при нанесении заявляемой композиции на кожу тыльной поверхности кисти человека в объеме 0,04 мл на 1 см2 при комнатной температуре, она полностью впитывается менее чем за 10 с, что позволяет использовать для ее распределения по поверхности кожи известные технические устройства - спрейеры (пульверизаторы), аэрозольные баллончики, шпатели, роллы, тампоны и другие.
Воздействие изготовленной композиции на организм при ее трансдермальном введении было апробировано экспериментально. Испытания проводили на беспородных крысах. Животных разбивали на несколько групп, содержащих не менее шести особей, включая и две контрольные группы. В одной контрольной группе животных не лечили (или, в зависимости от цели эксперимента, не осуществляли профилактику). Во второй контрольной группе животным внутримышечно вводили лечебное или профилактическое лекарственное средство в той же дозе, что и животным опытных групп. В каждой опытной группе экспериментальных животных трансдермально вводили (путем нанесения в объеме 0,1 мл на участок вентральной поверхности шеи площадью 5 см2 с помощью пипетки и трафарета) композицию, содержащую заданную дозу определенного ЛВ в смеси первого и второго растворителей. В каждом эксперименте с определенным видом помощи или профилактики использовали одно ЛВ для нескольких групп. Опытные группы животных, трансдермально получавших одно и то же ЛВ, различались качественным составом выбранных растворителей. Для композиции одного и того же ЛВ в смеси двух растворителей одинакового качественного состава варьировали объемное соотношение двух растворителей и исследовали зависимость биологического действия композиций одинакового качественного состава от количественного содержания растворителей. Результаты сопоставляли как с результатом контрольной группы, не получившей лечения или профилактику, так и с результатом контрольной группы, получившей лечение или профилактику ЛВ в той же дозе, но введенным внутримышечно.
Смесь растворителей готовили объемным методом, смешивая первый и второй растворители. При этом как первый, так и второй растворители могли состоять из смеси растворителей (N,N-диалкиламидов, N-алкилпирролидонов, терпенов, терпеноидов), включая смеси природного происхождения - скипидар или эфирные масла. Приготовление заявляемой композиции осуществляли, добавляя известный объем заранее приготовленной смеси первого и второго растворителей к навеске выбранного ЛВ (в химической форме основания) в виале. Смесь перемешивали до полного растворения ЛВ и использовали в экспериментах.
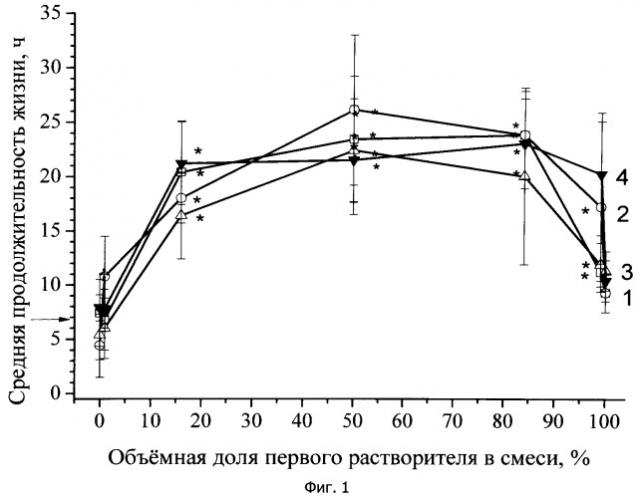
Пример 1. Оценивалось профилактическое действие дексаметазона в составе заявляемой трансдермальной композиции при отравлении животных циклофосфаном (результат экспериментов отражен на Фиг.1).
Готовили раствор дексаметазона в смеси растворителей концентрацией 20 мг/мл. Доза дексаметазона составила 10 мг/кг массы тела крысы. Крысам контрольной группы профилактику не проводили. Крысам 28 опытных групп трансдермально вводили композицию с дексаметазоном. В 29-й группе животным внутримышечно вводили инъекционный дексаметазон в дозе 10 мг/кг. Через 15 мин после введения инъекционного дексаметазона или трансдермальной композиции с дексаметазоном внутрибрюшинно вводили циклофосфан в дозе 600 мг/кг в виде водного раствора (10 мл/кг). За животными наблюдали 2 сут, регистрируя сроки гибели. Рассчитывали сред негрупповые значения (М±m, n=6) продолжительности жизни после введения циклофосфана.
На Фиг.1 отражены кривые зависимости средней продолжительности жизни животных от качественного (кривые 1-4) состава растворителей введенных композиций с дексаметазоном. Количественное соотношение растворителей для каждой из 7 групп животных в каждой серии обозначено точками.
Кривая 1 на Фиг.1 (результаты обозначены квадратами) соответствует композиции с дексаметазоном, содержащей N,N-диметилацетамид (первый растворитель) и лимонен (второй растворитель, монотерпен) в разных концентрациях.
Кривая 2 на Фиг.1 (результаты обозначены кружками) соответствует композиции с дексаметазоном, содержащей N,N-диметилацетамид (первый растворитель) и терпентинное масло (второй растворитель, содержит смесь монотерпенов пиненов и каренов и монотерпеноидов) в разных концентрациях.
Кривая 3 на Фиг.1 (результаты обозначены треугольниками) соответствует композиции с дексаметазоном, содержащей N,N-диметилацетамид (первый растворитель) и скипидар (второй растворитель, содержит неочищенный экстакт эфирных масел хвойных деревьев, включая смесь монотерпенов пиненов и каренов и монотерпеноидов) в разных концентрациях.
Кривая 4 на Фиг.1 (результаты обозначены зачерненными треугольниками) соответствует композиции с дексаметазоном, содержащей N,N-диметилацетамид (первый растворитель) и эфирное масло эвкалипта (второй растворитель, содержит смесь монотерпеноида цинеола с терпеноидами) в разных концентрациях.
Кроме того, экспериментально определяли среднюю продолжительность жизни крыс в контрольной группе, не получившей профилактики - она составила 6,9±0,4 ч (на Фиг.1 это значение обозначено стрелкой у оси ординат), и в группе, получившей профилактически внутримышечно дексаметазон в дозе 10 мг/кг - она составила 19,8±2,3 ч. Статистическая значимость различий между каждой из экспериментальных групп и контрольной группой, а также между 29-й экспериментальной и каждой из двадцати восьми опытных групп оценена с помощью критерия Даннета; значимое различие с контролем (р≤0,05) показано на Фиг.1 знаками астрикса.
Сравнение значений продолжительности жизни крыс, получивших трансдермально профилактически композицию дексаметазона, а затем подвергшихся воздействию токсиканта (кривые 1-4 Фиг.1), со значением средней продолжительности жизни крыс, не получивших профилактики (6,9±0,4 ч, что отмечено стрелкой по оси ординат Фиг.1), убедительно показывает профилактическую эффективность трансдермального введения дексаметазона в составе заявляемой композиции.
При концентрации N,N-диметилацетамида в составе смеси более 16% и до 99% включительно, терапевтический эффект был статистически значимым; средняя продолжительность жизни не отличалась (р≤0,05) от таковой при внутримышечном профилактическом введении дексаметазона (19,8±2,3 ч). Как видно из Фиг.1, терапевтический эффект трансдермального введения композиции дексаметазона существенно не зависел от качественного состава второго растворителя (индивидуальный монотерпен кривой 1, смесь терпенов и терпеноидов кривых 2-4). Средняя продолжительность жизни крыс, которым ЛВ вводилось профилактически внутримышечно или трансдермально в составе композиции, была значимо выше, чем у животных, не получавших профилактики дексаметазоном (6,9±0,4 ч, р≤0,05). Животные, которым ЛВ вводилось трансдермально или внутримышечно, не различались по средней продолжительности жизни. Таким образом, профилактическое трансдермальное введение в организм дексаметазона с использованием заявляемой композиции отсрочивало летальный эффект циклофосфана в той же мере, что и внутримышечное введение дексаметазона в той же дозе.
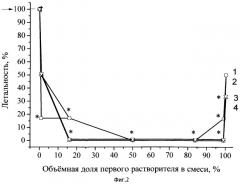
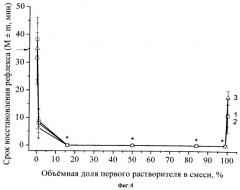
Пример 2. Оценивались результаты лечения атропином в составе заявляемой трансдермальной композиции при отравлении животных фосфорилтиохолином (результат экспериментов отражен на Фиг.2).
Готовили раствор основания атропина в смеси растворителей концентрацией 48 мг/мл. Доза атропина составила 24 мг/кг массы тела крысы. Крысам в мышцы бедра вводили раствор фосфорилтиохолина в дозе 16 мкг/кг. Животных контрольной группы не лечили. Крысам 28 опытных групп трансдермально вводили композицию с атропином. В 29-й группе животным внутримышечно вводили атропина сульфат в дозе 24 мг/кг (в расчете на основание). За животными наблюдали в течение суток, после чего подсчитывали число павших. Значимость различий летальности в опытных группах с летальностью в контроле оценивали с использованием точного критерия Фишера.
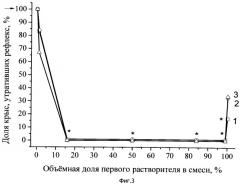
На Фиг.2 отражены кривые зависимости летальности у крыс, получивших отравление фосфорилтиохолином, от качественного (кривые 1-4) состава растворителей введенных композиций с атропином. Количественное соотношение растворителей для каждой из 7 групп животных в каждой серии обозначено точками.
Кривая 1 на Фиг.2 (результаты обозначены квадратами) соответствует композиции с атропином, содержащей N-диметилацетамид (первый растворитель) и лимонен (второй растворитель, монотерпен) в разных концентрациях.
Кривая 2 на Фиг.2 (результаты обозначены кружками) соответствует композиции с атропином, содержащей N,N-диметилацетамид (первый растворитель) и терпентинное масло (второй растворитель, содержит смесь монотерпенов пиненов и каренов и монотерпеноидов) в разных концентрациях.
Кривая 3 на Фиг.2 (результаты обозначены треугольниками) соответствует композиции с атропином, содержащей N,N-диметилацетамид (первый растворитель) и скипидар (второй растворитель, содержит цельный экстракт эфирных масел хвойных деревьев, включая смесь монотерпенов пиненов и каренов и монотерпеноидов) в разных концентрациях.
Кривая 4 Фиг.2 (результаты обозначены зачерненными треугольниками) соответствует композиции с атропином, содержащей N,N-диметилацетамид (первый растворитель) и эфирное масло эвкалипта (второй растворитель, содержит смесь монотерпеноида цинеола с другими терпеноидами) в разных концентрациях.
Кроме того, экспериментально определяли летальность крыс в течение суток после введения фосфорилтиохолина в группе, не получившей лечения (в ней наблюдалась 100% летальность; на Фиг.2 это значение обозначено стрелкой у оси ординат), а также летальность крыс в группе, получившей лечение внутримышечным введением атропина в дозе 24 мг/кг (летальность составляла 0%). Статистическая значимость различий летальности в каждой экспериментальной группе по сравнению с контролем оценена с помощью точного критерия Фишера, и, в случаях p≤0,05, показана на Фиг.2 знаками астрикса. Статистическая значимость различий летальности в двадцати восьми опытных группах с летальностью в 29-й группе оценена аналогично.
Как видно из данных Фиг.2, нанесение на кожу композиции атропина в смеси первого растворителя и любого второго растворителя из числа примененных (кривые 1-4 Фиг.2) повышало