Фотосенсибилизатор и способ его получения
Иллюстрации
Показать всеИзобретение относится к получению новой светочувствительной композиции, пригодной для фотодинамической терапии рака. Заявлен способ получения фотосенсибилизатора, заключающийся в том, что 3-пиридилкарбоксальдегид конденсируют с пирролом в смеси пропионовая кислота - пропионовый ангидрид при их соотношении 3-4:1-2 при кипении в течение 80-100 мин. Продукт конденсации восстанавливают п-толуолсульфонилгидразидом в среде пиридина в присутствии карбоната калия при его 30-35-кратном избытке и 5-10% хинолина при температуре 85-95°C в течение 4-5 час. Затем полученный продукт N-метилируют в диметилформамиде при кипении в течение 50-65 мин, осаждают бензолом, фильтруют и сушат. Заявлен также фотосенсибилизатор, полученный по этому способу, который содержит 5,10,15,20-тетракис(N-метил-3'-пиридил)хлорин в количестве 15-25% и 5,10,15,20-тетракис(N-метил-3'-пиридил)бактериохлорин в количестве 75-85%. Технический результат изобретений заключается в повышении выхода целевого продукта, снижении темпа роста и метастазирования опухолей, препятствии некротизации опухолевой ткани, в полном и равномерном насыщении опухолевой ткани препаратом. 2 н. и 1 з.п. ф-лы, 1 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к получению новой фармацевтически приемлемой светочувствительной композиции, содержащей 5,10,15,20-тетракис(N-метил-3'-пиридил)хлорин и 5,10,15,20-тетракис(N-метил-3'-пиридил)бактериохлорин.
Фотосенсибилизаторы - класс веществ, производных порфиринов и родственных им гетероароматических структур, применяемых для методов фотодинамической терапии и флуоресцентной диагностики злокачественных опухолей, трофических язв и некоторых других патологий. При активации лазерным излучением фотосенсибилизатора, накопившегося в опухоли, в ее клетках развиваются фотохимические процессы, при которых молекула фотосенсибилизатора, поглотив квант света, переходит в возбужденное триплетное состояние, энергия которого способствует образованию молекулярного синглетного кислорода. Являясь мощным окислителем в клетке и околоклеточном пространстве, он выступает универсальным поражающим фактором как внутри патологической клетки, так и вне ее.
Основные требования к оптимальному фотосенсибилизатору:
1) низкая темновая и световая токсичность;
2) высокая селективность накопления в злокачественных тканях;
3) сильное поглощение в спектральном диапазоне, где биологические ткани имеют наибольшее пропускание (красный и ближний ИК-диапазоны);
4) высокий квантовый выход образования синглетного кислорода в условиях in vivo;
5) доступность получения или синтеза, а также однородный воспроизводимый химический состав;
6) растворимость в воде или разрешенных для внутривенного введения жидкостях и кровезаменителях;
7) стабильность при световом воздействии и хранении.
Известны различные фотосенсибилизаторы - производные хлорина e6, например РАДАХЛОРИН (патент РФ 2183956 от 27.06.2002 г.). Однако степень его чистоты недостаточна, что приводит к размыванию четкой границы между раковой опухолью и близкорасположенной здоровой тканью, снижая эффективность фотодинамической терапии.
Известны также ФОТОДИТАЗИН (патент РФ 2144538 от 20.01.1998 г.) и фотосенсибилизатор по патенту РФ 2276976, опубл. 2006 г. Однако их водные растворы неустойчивы из-за протекания радикальных процессов, приводящих к частичной деструкции и трансформации тетрапиррольного макроцикла, и обладают ограниченным сроком хранения даже при температуре 4-8°C.
Известны фотосенсибилизаторы - производные бактериохлорина, поглощающие свет в наиболее оптимальном диапазоне 740-820 нм, например фотосенсибилизаторы по Евразийскому патенту №002910, опубл. 2002 г., патенту РФ 2382787, опубл. 2010 г. Однако эти фотосенсибилизаторы тоже содержат лишь одно активное вещество.
Фотосенсибилизаторы на основе производных либо хлорина e6, либо бактериохлорина вводят внутривенно, устанавливают по меньшей мере один пластиковый катетер в опухоль и проводят лазерное облучение через стенки катетера.
Однако при этом имеет место травматичность, предполагающая проведение общего анестезиологического пособия, а также недостаточная эффективность фотосенсибилизаторов, поскольку достигается лишь торможение роста опухоли.
Наиболее перспективными для практического использования считаются производные бактериохлорина.
Существуют два подхода к получению производных бактериохлорина:
1) направленная модификация природных бактериохлорофиллов. Однако наиболее доступный природный тетрагидропорфирин - бактериохлорофилл «а» склонен к окислению до соответствующих хлоринов и порфиринов, что существенно ограничивает их внедрение в клиническую практику. Высокая гидрофобность и связанная с ней низкая растворимость в полярных растворителях также осложняют практическое использование известных бактериохлоринов;
2) синтетический, включающий восстановление в различных порфиринах двойных связей в пиррольных кольцах. Так, известен способ получения 5,10,15,20-тетракис(1”-алкил-3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирин-тетра-n-толуолсульфоната алкилированием 5,10,15,20-тетракис(3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирина метил-п-толуолсульфонатом в нитрометане (Евразийский патент №002910 от 1998 г.).
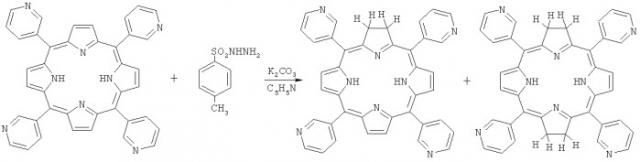
Наиболее близким к изобретению является способ получения 5,10,15,20-тетракис(N-метил-3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирин-тетра-n-толуолсульфоната (Дудкин С.В. «Синтез и некоторые свойства гидрированных производных тетраазапорфина и мезо-тетра(3-пиридил)порфина», канд. дисс. М.: 2012 г., с.129-131). Он заключается в последовательном проведении следующих операций:
- восстановление 5,10,15,20-тетракис(3'-пиридил)-21H,23H-порфина п-толуолсульфонилгидразидом в присутствии 30-35-кратного избытка поташа в пиридине при T=110°C;
- хроматографическое выделение 5,10,15,20-тетракис(3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирина, который может быть также назван тетракис-мезо-(3'-пиридил)бактериохлорин;
- N-метилирование тетракис-мезо-(3'-пиридил)бактериохлорина метил-п-толуолсульфонатом в нитрометане при кипении в течение 1 ч;
- охлаждение реакционной массы до комнатной температуры, разбавление бензолом до соотношения 1:1;
- фильтрование;
- промывка бензолом;
- сушка.
Целевой продукт - 5,10,15,20-тетракис-(N-метил-3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирин-тетра-п-толуолсульфонат. Это соединение может быть также названо 5,10,15,20-тетракис-(N-метил-3'-пиридил)бактериохлорин.
Однако выход целевого продукта невысок - 29%, и его эффективность при использовании в качестве фотосенсибилизатора невысока, так как он не обеспечивает снижение агрессии роста и метастазирования опухолей, не препятствует некротизации опухолевой ткани, не позволяет полностью и равномерно насыщать опухолевый объем и регионарные метастазы, не позволяет одновременно с лечением проводить и диагностику распространенности регионарного метастазирования.
Задачей изобретения является поиск способа получения фотосенсибилизатора с более высоким выходом, который был бы лишен вышеназванных недостатков.
Поставленная задача решена способом получения фотосенсибилизатора, который заключается в том, что 3-пиридилкарбоксальдегид конденсируют с пирролом в смеси пропионовая кислота - пропионовый ангидрид при их соотношении от 3-4 до 1-2 при кипении в течение 80-100 мин, продукт конденсации восстанавливают п-толуолсульфонилгидразидом в среде пиридина в присутствии карбоната калия при его 30-35-кратном избытке и 5-10% хинолина при T=85-95°C, в течение 4-5 часов, полученный продукт N-метилируют в диметилформамиде при кипении в течение 50-65 мин, осаждают бензолом, фильтруют и сушат.
Эта задача решена также фотосенсибилизатором, полученным этим способом.
При этом фотосенсибилизатор, полученный по заявленному способу, содержит 5,10,15,20-тетракис(N-метил-3'-пиридил)хлорин в количестве 15-25% и 5,10,15,20-тетракис(N-метил-3'-пиридил)бактериохлорин в количестве 75-85%.
Структура этих соединений доказана электронным спектром поглощения в воде.
ЭСП λmax, нм (ε.10-3): 761(46,4); 655(7,1); 516(27,3); 417(118,9); 374(64,0).
Технический результат изобретения заключается в том, что:
- значительно повышается выход целевого продукта до 90-92%;
- полученный по этому способу фотосенсибилизатор позволяет:
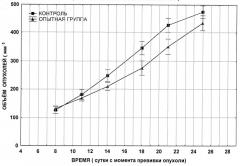
- снизить темп роста и метастазирования опухолей;
на фиг. показан рост первичного узла опухоли карциномы легких Льюис у мышей BDF;
- препятствовать некротизации опухолевой ткани;
- поскольку фотосенсибилизатор хорошо растворим в воде, он может быть введен непосредственно в опухолевый объем и доступные метастатические очаги, поэтому появляется возможность создания концентрации препарата непосредственно в опухолевой ткани ~ в 1000 раз выше, чем при внутривенном введении, что безусловно повышает эффект лечения. Это контролируется оптическим прибором за счет добавления небольшого (5-7%) количества флуоресцирующих примесей;
- проводить одновременно с лечением и диагностику регионарного метастазирования.
К тому же получаемый фотосенсибилизатор работает в самом оптимальном диапазоне 760-762 нм, т.к. не рассеивается естественно окрашенными тканями (гемоглобин, миоглобин и др.), что безусловно повышает КПД излучения. У продукта отсутствует световая токсичность. Высокий процент выхода синглетного кислорода определяет ускорение начала реактивного изменения опухолевой ткани уже через несколько часов. Выход синглетного кислорода определяли, главным образом, путем сравнения со стандартом -тетракис-(п-сульфофенил)порфирином. В качестве источника возбуждающего света применяли осветительную часть флуориметра Perkin-Elmer MPF-44B. Ширина щели - 5 нм. Заявленный фотосенсибилизатор имеет квантовый выход ~ в 1,5 раза выше, что подтверждает, что он является более эффективным фотогенератором синглетного кислорода.
Сведения, подтверждающие возможность воспроизведения изобретения
Для реализации способа используют следующие вещества:
- 3-пиридилкарбоксальдегид - коммерческий продукт TCI EUROPE N.V.;
- пиррол - ТУ 6-09-07-242-84;
- пропионовая кислота - ТУТ CP 1150Н-63, хч;
- пропионовый ангидрид - ТУ 6-09-08-1176-77;
- оксид алюминия - ТУ 6-09-426-75;
- хлороформ - ТУ 263-44493179-01 с изм. №1, 2;
- метанол - ГОСТ 2222-95;
- п-толуолсульфонилгидразид - ТУ 6-09-10-541-76;
- пиридин - ГОСТ 13647-78 с изм. №1;
- поташ (карбонат калия) - ГОСТ 4221-76;
- оксид алюминия - ТУ 6-09-426-75;
- хлористый метилен - ТУ 2631-44493179-98 с изм. №1, 2, 3;
- гексан - ТУ 6-09-06-4521-77;
- метилтозилат (метиловый эфир п-толуолсульфокислоты) - ТУ 6-09-86-75;
- диметилформамид - ГОСТ 20289-74 с изм. №1, 2;
- бензол - ГОСТ 5955-75 с изм. №1, 2;
- аргон - ГОСТ 10157-79 с изм. №1, 2, 3, 4.
Пример 1.
а) получение 5,10,15,20-тетракис(3'-пиридил)21H,23H-порфина.
При кипении к смеси 500 мл уксусной кислоты, 150 мл нитробензола и 27 мл (0,286 моль) уксусного ангидрида постепенно добавляют смесь 10 мл (0,144 моль) пиррола и 13,7 мл (0,144 моль) 3-пиридилкарбоксальдегида. Смесь кипятят 1,5 ч, затем охлаждают, отгоняют уксусную кислоту, разбавляют остаток водой, нитробензол отгоняют с водяным паром. Остаток отфильтровывают, осадок промывают водой и высушивают на воздухе. Затем остаток при перемешивании кипятят с метанолом, осадок отфильтровывают, промывают метанолом и высушивают. Выход 16,2 г. Осадок экстрагируют хлороформом в аппарате Сокслета до бесцветного вытека. Экстракт упаривают до 200 мл и отфильтровывают выпавший осадок. Раствор хроматографируют на оксиде алюминия II степени активности по Брокману. Элюат упаривают до минимального объема, осаждают метанолом, отфильтровывают порфирин, промывают метанолом и высушивают при 70°C. Выход - 5,6 г (25,1%).
Продукт идентифицирован по данным ЭСП и ЯМР-спектра.
5,10,15,20-тетракис-(3'-пиридил)21H,23H-порфин
Rf (силуфол): 0,92 (хл-ме, 5:1); 0,40 (бз-ме, 10:1)
ЭСП λmax, нм. (е.10-3): 647(3,4); 590(6,1); 550(7,6); 516(18,3); 419(439,3) хлороформ.
1H ЯМР (вн.ст. ТМС) δ, м.д.: 9,50s (4H, 2'-H); 9,10dd (4H, 6'-H, 1J=5,6Hz, 2J=1,4Hz); 8,56 d (4H, 4'-H, 1J=5,6Hz); 7,81t (4н, 5'-H, 1J=5,6Hz); -2,80bs (CDCl3)
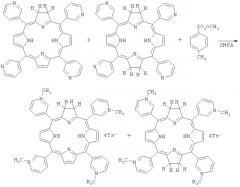
б) восстановление 5,10,15,20-тетракис(3'-пиридил)21H,23H-порфина с получением смеси 5,10,15,20-тетракис(3'-пиридил)хлорина и 5,10,15,20-тетракис(3'-пиридил)бактериохлорина.
При нагревании и перемешивании к смеси 0,5 г (0,808 ммоль) 5,10,15,20-тетракис(3'-пиридил)порфина (Мм - 618,704) и 3,7 г (26,8 ммоль) карбоната калия в 30 мл пиридина постепенно прибавляют раствор 5,0 г (26,8 ммоль) п-толуолсульфонилгидразида (Мм - 186,23) в 20 мл пиридина, затем реакционную массу выдерживают при Т=85-95°C, в течение 4-5 часов. Смесь выливают в 300 мл воды, центрифугируют, промывают водой и высушивают на воздухе при комнатной температуре.
Состав смеси идентифицировали по данным ЭСП, количественный состав определяли по соотношению интенсивности полос в ЭСП.
ЭСП λmax, нм, (ε.10-3): 746(52,9); 654(7,5); 520(33,3); 418(78,0); 379(76,8); 356(62,1) (хлороформ).
5,10,15,20-тетракис(3'-пиридил)хлорин - 15-25% и 5,10,15,20-тетракис(3'-пиридил)бактериохлорин - 75-85%.
в) N-метилирование для получения смеси 5,10,15,20-тетракис(N-метил-3'-пиридил)хлорина и 5,10,15,20-тетракис(N-метил-3'-пиридил)бактериохлорина.
408 мг (0,43 ммоль) 5,10,15,20-тетракис(3'-пиридил)-21H,23H-7,8,17,18-тетрагидропорфирина растворяют в 20 мл ДМФА, добавляют 1,0 г (5,37 ммоль) метилтозилата (Мм - 186,23), нагревают до 110°C при перемешивании под аргоном 1 ч, охлаждают, добавляют 20 мл бензола, выдерживают 2 ч, осадок отфильтровывают, промывают бензолом и высушивают на воздухе. Выход 1,0 г (90,63%).
Полученный целевой продукт идентифицирован по данным ЭСП.
Пример использования заявленного фотосенсибилизатора при фотодинамической терапии.
Пациент О., 1951 г.р. В течение нескольких лет установлен диагноз: папиллярный рак (высоко дифференцированная форма опухоли) щитовидной железы с MTS в регионарный л/у шеи. От хирургического лечения отказался.
При первом сеансе фотодинамической терапии в опухолевую ткань размерами 3,2×3,5×3,7 см введено 50 мг (из расчета 1,2 мг на 1 г опухоли) заявленного фотосенсибилизатора и в регионарный метастаз в развилке сонной артерии размерами 3,0×1,7 см введено 30 мг препарата (из расчета 5 мг на 1 г опухоли) - исходя из понимания метастаза как более агрессивной ткани, т.е. аналогично признакам снижения дифференцировки. После 20 минут экспозиции проведен сеанс облучения в опухоли и метастазе ИК лазерным излучением длиной волны 760 нм в низкоинтенсивном режиме в течение 20 и 15 минут соответственно.
Через 7 дней проведен цитологический контроль. В опухолевой ткани имеются выраженные признаки реактивных клеточных изменений, резко снизился пул клеток с повышенной митотической активностью, определяются единичные комплексы первоначального строения опухоли. В цитологическом материале из метастаза в л/у - картина папиллярного рака. Проведен повторный сеанс ФДТ. Результат положительный.
В последующем цитологическом мониторинге нарастали явления апоптоза, реактивных изменений. В динамике клеточный состав из метастаза характеризовался как клетки кубического эпителия без признаков атипии, вплоть до полного отсутствия данных за патологическую ткань. При УЗИ в развилке сонной артерии имеется фрагмент банального л/у плоской формы размерами не более 0,5×0,3 см.
| Таблица | |||||||||
| № | Параметры способа | Выход, % | *Состав Хл/БХл, % | ||||||
| Конденсация | Восстановление | N-метилирование | |||||||
| *Соотношение ПК-ПА | Время, τ, мин | Избыток поташа, кратность | Хинолин, % | Температура, °C | Время, τ, ч | Время, τ, мин | |||
| 1 | 3 | 80 | 30 | 5 | 85 | 4 | 50 | 91 | 15/85 |
| 2 | 4 | 90 | 35 | 7 | 85 | 4,5 | 50 | 90 | 20/80 |
| 3 | 3 | 100 | 33 | 7 | 90 | 4 | 60 | 90,63 | 17/83 |
| 4 | 3 | 90 | 30 | 10 | 95 | 5 | 65 | 92 | 25/75 |
| 5 | 4 | 90 | 35 | 10 | 95 | 5 | 65 | 92 | 21/79 |
| *Примечание:Пропионовая кислота - ПКПропионовый ангидрид - ПА5,10,15,20-тетракис(3'-пиридил)хлорин - Хл5,10,15,20-тетракис(3'-пиридил)бактериохлорин - БХл |
1. Способ получения фотосенсибилизатора, заключающийся в том, что 3-пиридилкарбоксальдегид конденсируют с пирролом в смеси пропионовая кислота - пропионовый ангидрид при их соотношении 3-4:1-2 при кипении в течение 80-100 мин, продукт конденсации восстанавливают п-толуолсульфонилгидразидом в среде пиридина в присутствии карбоната калия при его 30-35-кратном избытке и 5-10% хинолина при температуре 85-95°C, в течение 4-5 часов, полученный продукт N-метилируют в диметилформамиде при кипении в течение 50-65 мин, осаждают бензолом, фильтруют и сушат.
2. Фотосенсибилизатор, полученный по п.1.
3. Фотосенсибилизатор по п.2, отличающийся тем, что он содержит 5,10,15,20-тетракис(N-метил-3'-пиридил)хлорин в количестве 15-25% и 5,10,15,20-тетракис(N-метил-3'-пиридил)бактериохлорин в количестве 75-85%.