Антиоксидантная композиция
Иллюстрации
Показать всеИзобретение относится к области косметологии. Описана стабильная и безопасная антиоксидантная композиция, которую можно применять ежедневно. Конкретно, описана антиоксидантная композиция, которая содержит одно или более соединений, выбранных из группы, состоящей из D-аспарагиновой кислоты, ее производных и/или ее солей. Композицию можно применять с целью подавления и/или облегчения состояния кожи. Состояния кожи могут включать, но не ограничиваются ими, мелкие морщины, шершавую кожу, сухую кожу, рак кожи, кожную аллергию, воспаление кожи и светочувствительный дерматоз. Композицию можно применять в качестве препарата для наружного применения на коже. Изобретение обеспечивает повышение антиоксидантного эффекта композиции. 3 з.п. ф-лы, 5 ил., 31 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к антиоксидантной композиции, которая содержит одно или более соединений, выбранных из группы, состоящей из D-аспарагиновой кислоты, ее производных и/или солей, способу облегчения состояния кожи, включающему стадию введения соединения, и способу лечения и/или предотвращения катаракты, включающему стадию введения соединения.
Уровень техники
Активные формы кислорода (ROS) неселективно окисляют биологически активные вещества, подобные нуклеиновым кислотам, белкам и липидам, вызывая нарушения функционирования живого тела или структуры органа и ткани. Известно, что ROS являются причиной заболеваний кожи, таких как рак кожи, кожная аллергия, воспаление кожи и светочувствительный дерматоз (непатентный документ 1). Также известно, что, влияя на эпидермис, они вызывают состояния кожи, подобные мелким морщинкам, шершавой коже, сухой коже и подобным.
Документы предшествующего уровня техники
Непатентный документ 1: Bickers, D. R. and Athar, M., Invest. Dermatolog., 126:2565 (2006)
Описание настоящего изобретения
Проблема, которую будет решать настоящее изобретение
Аскорбиновую кислоту (витамин C), (альфа)токоферол (витамин E) или подобные традиционно применяют в косметической продукции и фармацевтическом продукте в качестве антиоксидантной композиции. Однако стабильность является недостаточной и, следовательно, существует необходимость в разработке стабильной и безопасной композиции, которую можно применять регулярно.
Способы решения данной проблемы
В этой связи настоящее изобретение предлагает композицию, содержащую одно или более соединений, выбранных из группы, состоящей из D- и/или L-аспарагиновой кислоты, их производных и/или солей.
Антиоксидантную композицию настоящего изобретения можно применять для подавления и/или облегчения состояния кожи.
Относительно антиоксидантной композиции настоящего изобретения состояние кожи включает, но не ограничивается, мелкие морщины, шершавую кожу, сухую кожу, рак кожи, кожную аллергию, воспаление кожи и светочувствительный дерматоз.
Антиоксидантную композицию настоящего изобретения можно применять для препарата для наружного применения для кожи.
Антиоксидантную композицию настоящего изобретения можно применять в пищу.
Антиоксидантную композицию настоящего изобретения можно применять для фармацевтического продукта для катаракты.
Относительно антиоксидантной композиции настоящего изобретения, фармацевтический продукт для катаракты может представлять собой терапевтический агент для катаракты или профилактический агент для катаракты.
Антиоксидантную композицию настоящего изобретения можно применять для глазных капель для катаракты.
Катаракта может представлять собой старческую катаракту.
Настоящее изобретение предлагает способ облегчения состояния кожи, включающий стадию введения антиоксидантной композиции, состоящей из одного или более соединений, выбранных из группы, состоящей из D- и/или L-аспарагиновой кислоты, их производных и/или солей.
Состояние кожи, которое подавляют и/или облегчают способом настоящего изобретения, включает, но не ограничивается, мелкие морщины, шершавую кожу, сухую кожу, рак кожи, кожную аллергию, воспаление кожи и светочувствительный дерматоз.
Относительно способа настоящего изобретения антиоксидантную композицию настоящего изобретения можно применять для препарата для внешнего применения на коже.
Относительно способа настоящего изобретения антиоксидантную композицию настоящего изобретения можно применять для пищевой композиции.
Настоящее изобретение также предлагает способ лечения и/или предотвращения катаракты, включающий стадию введения композиции, состоящей из одного или более соединений, выбранных из группы, состоящей из D- и/или L-аспарагиновой кислоты, их производных и/или солей.
Относительно способа лечения и/или предотвращения катаракты настоящего изобретения фармацевтический продукт для катаракты может представлять собой глазные капли.
Относительно способа лечения и/или предотвращения катаракты настоящего изобретения катаракта может представлять собой старческую катаракту.
Как применяют в настоящем описании, термин "соль" аспарагиновой кислоты обозначает любую соль, включая соль металла, соль амина и подобные, при условии, что антиоксидантный эффект аспарагиновой кислоты не ослабляется. Соль металла может включать соль щелочного металла, соль щелочноземельного металла и подобные. Соль амина может включать соль триэтиламина, соль бензиламина и подобные.
Как применяют в настоящем описании, термин "производные" аспарагиновой кислоты обозначает молекулу аспарагиновой кислоты, которая ковалентно соединена с любой группой атомов через ее аминогруппу, карбоксильную группу или боковую цепь, при условии, что антиоксидантный эффект аспарагиновой кислоты не ослабляется. Группа атомов включает, но не ограничивает, защитную группу, такую как N-фенилацетильная группа и 4,4'-диметокситритильная (DMT) группа, биополимер, такой как белок, пептид, сахарид, липид и нуклеиновая кислота; синтетический полимер, такой как полистирол, полиэтилен, поливинил и полиэстер; и функциональную группу, такую как эфирная группа. Эфирная группа может включать, например, сложный алифатический эфир, такой как сложный метиловый эфир и сложный этиловый эфир, и сложный ароматический эфир.
Аминокислота имеет оптические изомеры, которые представляют собой L-форму и D-форму. Природный белок содержит L-аминокислоты, соединенные пептидными связями, и можно применять только L-аминокислоты, исключая некоторые случаи, такие как бактериальная клеточная стенка. Следовательно, считается, что у млекопитающего, включая человека, присутствуют только L-аминокислоты и применяются только L-аминокислоты (Kinouchi, T. et al., TANPAKUSHITSU KAKUSAN KOSO (PROTEIN, NUCLEIC ACID AND ENZYME), 50:453-460 (2005), Lehninger Principles of Biochemistry [Vol.1] 2nd ed., p.132-147 (1993), Japanese-language translation, Hirokawa Shoten Ltd., Harper's Biochemistry, Original version, 22nd ed., p. 21-30 (1991), Japanese-language translation Maruzen Co., Ltd.). Соответственно, в течение долгого времени в качестве аминокислот главным образом применяют академически и промышленно только L-аминокислоты.
Исключительным случаем, когда применяют D-аминокислоту, является, например, случай применения неочищенного вещества для антибиотиков, продуцированных микроорганизмом, и случая пищевой добавки, применяя D-аминокислоту в DL-аминокислотной смеси, с целью снижения стоимости выделения только L-аминокислоты из смеси L- и D-аминокислот, которые получают в эквимолярных количествах синтезом аминокислот. Тем не менее, отсутствуют случаи промышленного применения только D-аминокислоты в качестве биоактивного вещества.
Обнаружено, что D-аспарагиновая кислота локализуется в семеннике или пинеальной железе и известно, что она участвует в регулировании гормональной секреции (нерассмотренная японская патентная публикация № 2005-3558). Однако физиологическая активность D-аспарагиновой кислоты в коже точно не выяснена.
Как показано в следующих примерах, до сих пор неизвестно, могут ли L- и D-аспарагиновые кислоты подавлять окислительные повреждения. Таким образом, антиоксидантная композиция, содержащая L- и/или D-аспарагиновую кислоту, согласно настоящему изобретению представляет собой новое изобретение.
Недавно, сообщалось, что ddY мышам давали свободно 10 мМ водный раствор D-аминокислоты две недели и затем исследовали на концентрацию D-аминокислоты в каждом органе, которая составляла 3-1000 пмоль на железу в пинеальной железе и 2-500 нмоль на грамм жидкости в мозговой ткани (Morikawa, A. et al., Amino Acids, 32:13-20 (2007)). На основании этого нижний предел количества суточного потребления L- и D-аспарагиновых кислот, которые содержатся в композиции настоящего изобретения, рассчитывают, как описано ниже.
Аспарагиновая кислота настоящего изобретения влияет на подавление окислительных повреждений в культивируемых клетках человека при концентрациях 0,1 мкМ (микромолярный) - 10 мкМ (микромолярный), как показано в следующих примерах.
Таким образом, количество аспарагиновой кислоты, которое содержится в агенте для облегчения состояния кожи, препарате для наружного применения на коже и пищевой композиции настоящего изобретения, может представлять собой любое количество, при условии, что аспарагиновая кислота в вышеуказанном диапазоне концентраций распределяется в клетках фибробластов в ткани кожи живого организма.
Когда композиция настоящего изобретения представляет собой препарат для наружного применения, содержание аспарагиновой кислоты может представлять собой 0,000015% по весу - 50% по весу, или вплоть до максимальной весовой концентрации, которую можно формулировать, от суммарного количества композиции настоящего изобретения. Конкретно, когда композиция представляет собой препарат для наружного применения, содержание аспарагиновой кислоты предпочтительно составляет 0,00003% по весу - 30% по весу и наиболее предпочтительно 0,0003% по весу - 3% по весу. Когда композиция настоящего изобретения представляет собой средство для наружного применения, содержание аспарагиновой кислоты может составлять 0,00001% по весу - 100% по весу. Когда композиция настоящего изобретения представляет собой средство для наружного применения, содержание аспарагиновой кислоты предпочтительно составляет 0,00002% по весу - 80% по весу и наиболее предпочтительно 0,0002% по весу - 60% по весу. Кроме того, нижний предел количества суточного потребления D-аспарагиновой кислоты, которая содержится в композиции настоящего изобретения, может составлять 0,01 нг, предпочтительно 0,1 нг, и более предпочтительно 1 нг на 1 кг веса тела. Нижний предел количества суточного потребления L-аспарагиновой кислоты, которая содержится в композиции настоящего изобретения, представляет собой количество, которое является меньшим, чем обычная доза имеющихся в продаже лекарственных средств (20 мг на 1 кг веса тела), например 0,01 мг, предпочтительно 0,1 мг и более предпочтительно 1 мг на 1 кг веса тела.
Композиция настоящего изобретения может дополнительно содержать, в дополнение к свободной аспарагиновой кислоте, соль аспарагиновой кислоты и/или производное, способное высвобождать аспарагиновую кислоту ферментом, метаболизирующим лекарственное средство, и подобными in vivo, одну или более фармацевтически приемлемых добавок, при условии, что антиоксидантный эффект аспарагиновой кислоты на окислительные повреждения не нарушается. Такая добавка включает, но не ограничивается, разбавитель и наполнитель, связующее и клейкое вещество, лубрикант, глидант, пластификатор, разрыхлитель, растворитель, являющийся носителем, буферное средство, краситель, ароматизатор, подсластитель, консервант и стабилизатор, адсорбент, а также другие фармацевтические добавки, известные специалистам в данной области техники.
Композицию настоящего изобретения можно получить применяя в качестве активного ингредиента аспарагиновую кислоту, соли аспарагиновой кислоты и/или производные, способные высвобождать аспарагиновую кислоту ферментом, метаболизирующим лекарственное средство, и подобными in vivo. Однако в пределах диапазона, в котором влияние на окислительные повреждения настоящего изобретения не ослабляется, ее можно соответствующим образом формулировать с другими компонентами, которые применяют для препарата для наружного применения на коже, подобного косметике, включая лечебно-профилактическую косметику и фармацевтические продукты, в случае необходимости. Примеры других ингредиентов (т.е. необязательно вводимых в состав компонентов) включают масло, поверхностно-активный агент, порошок, краситель, воду, спирты, загуститель, хелатирующий агент, силиконы, антиоксидант, средство, поглощающее УФ-излучение, увлажняющий агент, ароматизатор, различные фармацевтически активные агенты, консервант, агент, регулирующий pH, и нейтрализующий агент.
Лекарственная форма антиоксидантной композиции настоящего изобретения, которую применяют для подавления и/или облегчения состояния кожи (в настоящем изобретении ниже называют "средство для облегчения состояния кожи"), может быть любой лекарственной формой, которую обычно применяют для композиции для лечебно-профилактической косметики и фармацевтической композиции, содержащей препарат для наружного применения для кожи, подобной мази, крему, эмульсии, лосьону, компрессу, гелю и пластырю; и пероральным препаратом, подобным порошку, гранулам, мягкой капсуле и таблетке; препаратом для назального применения, подобного назальному спрею; и раствором.
Лекарственная форма препарата для наружного применения согласно настоящему изобретению конкретно не ограничена, при условии, что ее обычно применяют в качестве препарата для наружного применения для кожи, и она включает мазь, крем, эмульсию, лосьон, компресс, гель и пластырь.
Пищевая композиция настоящего изобретения может дополнительно содержать, в дополнение к аспарагиновой кислоте, соли аспарагиновой кислоты и/или производные, способные высвобождать аспарагиновую кислоту ферментом, метаболизирующим лекарства, и подобными in vivo, ароматизатор, краситель, консервант и другие компоненты, которые можно применять для пищевого продукта, при условии, что эффект аспарагиновой кислоты на окислительные повреждения не ослабляется.
Пищевая композиция настоящего изобретения может быть любой пищевой композицией, обычно применяемой в качестве пищевой композиции, включая, но не ограничиваясь, конфеты, печенье, бобовую пасту, французскую приправу, майонез, французский хлеб, соевый соус, йогурт, высушенный порошок-приправа для риса, приправочный соус/соус для соевого сыра (японские ферментированные соевые бобы), соевый сыр, неочищенный черный уксус.
Известно, что ROS вызывает не только заболевания кожи, но также катаракту. Считают, что они не только нарушают липидное строение синтезом липидных пероксидов из полиненасыщенных жирных кислот снаружи хрусталика глаза за счет восстановления пероксида водорода и свободнорадикальных цепных реакций, но также ухудшают мембранную функцию за счет денатурирования белков, что, в конечном счете, вызывает помутнение хрусталика. ("SUISHOTAI SONO SEIKAGAKUTEKI KIKO (BIOCHEMICAL MECHANISM OF CRYSTALLINE LENS", p.318-323, by Maesato Takami and Iwata Shuzo, edited by Iwata Shuzo, published by Medical-Aoi Publications, Inc., Tokyo (1986)). Согласно полученным результатам выше и примерам, описанным ниже, D- и/или L-аспарагиновая кислота, обладающая антиоксислительной активностью, является эффективной для профилактики или лечения катаракты.
Краткое описание чертежей
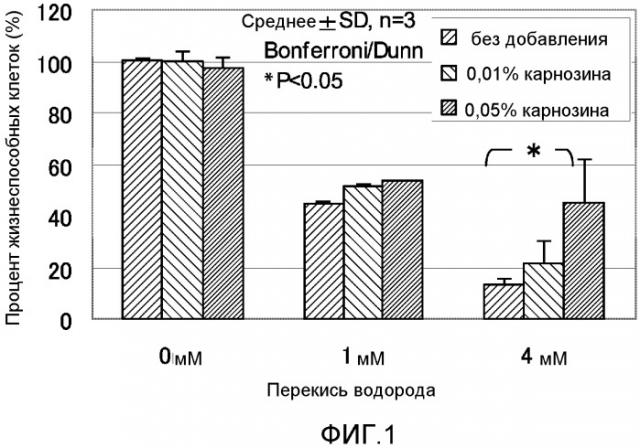
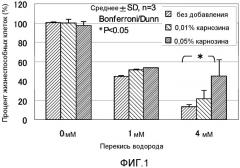
ФИГ. 1 представляет собой график, показывающий эффект карнозина на окислительные повреждения, вызванные пероксидом водорода, в нормальных фибробластных клетках кожи человека.
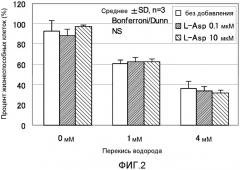
ФИГ. 2 представляет собой график, показывающий эффект L-аспарагиновой кислоты на окислительные повреждения, вызванные пероксидом водорода, в нормальных фибробластных клетках кожи человека.
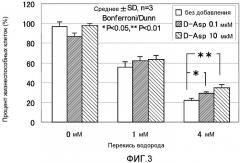
ФИГ. 3 представляет собой график, показывающий эффект D-аспарагиновой кислоты на окислительные повреждения, вызванные пероксидом водорода, в нормальных фибробластных клетках кожи человека.
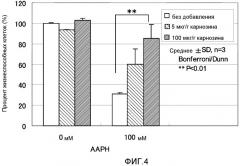
ФИГ. 4 представляет собой график, показывающий эффект карнозина на окислительные повреждения AAPH в нормальных фибробластных клетках кожи человека.
ФИГ. 5 представляет собой график, показывающий эффект L- и D-аспарагиновых кислот на окислительные повреждения AAPH в нормальных фибробластных клетках кожи человека.
Описание вариантов осуществления изобретения
Предполагается, что примеры настоящего изобретения, описанные ниже, только иллюстрируют настоящее изобретение, а не ограничивают его технический объем. Технический объем настоящего изобретения ограничивается только описанием в формуле изобретения.
Пример 1
Эксперимент для оценки антиоксидантного эффекта
1. Цель исследования
ROS включают активные формы кислорода в узком смысле, включая супероксидант анион, гидроксильный радикал, гидропероксид и синглетный кислород, и активные формы кислорода в широком смысле, включая алкокси радикал, гидропероксильный радикал, перекисный радикал, гидропероксид и кислородный комплекс с переходным металлом и подобные. Среди ROS гидроксильный радикал обладает самой большой окисляющей активностью, но имеет очень короткое время жизни. В этой связи, он неселективно окисляет составные части тканей тела, подобные нуклеиновым кислотам, белкам и липидам, которые присутствуют вблизи места его генерирования. Однако пероксильный радикал обладает слабой окисляющей активностью, но он относительно стабильный. В этой связи, он может диффундировать и вызывать повреждение клеточной мембраны посредством свободнорадикальной цепной реакции полиненасыщенных жирных кислот. Между тем, гидроксильный радикал генерирует пероксильный радикал, но гидроксильный радикал не генерируется из пероксильного радикала. Поскольку механизм действия является различным для гидроксильного радикала и пероксильного радикала, эффективный антиоксидант может также отличаться для каждого из них. По этим причинам, в настоящих примерах, антиоксидантный эффект оценивали и для перекиси водорода, и для дигидрохлоридной соли 2,2'-азобис(2-амидинопропана) (называемой в настоящем изобретении ниже "AAPH"), которые является типичными примерами соединения, которое может генерировать гидроксильный радикал и пероксильный радикал, соответственно. В качестве положительного контроля применяли карнозин, обладающий известной антиоксидантной активностью.
2. Материалы и способы
2-1. Клетки
Для оценки антиоксидантного эффекта на перекись водорода человеческие неонатальные фибробластные клетки кожи (торговое название: Cryo NHDF-Neo, полученные Sankyo Junyaku Co., Ltd.) засевали в 24-луночный планшет, чтобы получить 1 × 105 клеток на лунку. Затем клетки культивировали в течение четырех часов в среде для клеточной культуры (торговое название: D-MEM (1 г/л глюкозы), полученной Wako Pure Chemical Industries), дополненной 10% бычьей фетальной сывороткой (называемой в настоящем изобретении "стандартной средой") в 5% CO2 и в атмосфере насыщенного водяного пара при 37°C (градусы Цельсия). Для оценки антиоксидантного эффекта на AAPH антибиотики (пенициллин, стрептомицин и фунгизон) добавляли к стандартной среде, и клетки культивировали в течение одного дня.
2-2. Среда для оценки антиоксидантного эффекта
Затем культуральную среду заменяли на среду для клеточной культуры (торговое название: D-MEM (1 г/л глюкозы), полученной Wako Pure Chemicals Industries), снабженной 0,5% бычьей фетальной сывороткой (называемую в настоящем изобретении "среда с низким содержанием сыворотки"), к которой добавляли 0,01% или 0,05% карнозина, или 0,1 мкМ (микромолярный), или 10 мкМ (микромолярный) D- или L-аспарагиновой кислоты, и клетки культивировали в течение двух дней в атмосфере 5% CO2 и насыщенной влажности при 37°C (градусы Цельсия). Для экспериментов по оценке окислительного повреждения на AAPH культуральную среду заменяли средой для клеточной культуры, к которой дополнительно добавляли 5 мкг/г или 100 мкг/г карнозина или 10 мкМ (микромолярный) D- или L-аспарагиновой кислоты, и клетки культивировали в течение двух дней. Среду, содержащую низкую концентрация сыворотки, описанную выше, к которой добавляли или карнозин, или аспарагиновую кислоту, применяли в качестве отрицательного контроля.
2-3. Добавление оксиданта
После культивирования в течение двух дней, 1 мМ или 4 мМ перекиси водорода, или 50 мМ, или 100 мМ AAPH добавляли к среде для оценки антиоксидантного эффекта и антиоксидантный эффект оценивали для карнозина или аспарагиновой кислоты. Среду, содержащую низкую концентрацию сыворотки, описанную выше, к которой добавляли или карнозин, или аспарагиновую кислоту, применяли в качестве контроля для оценки токсичности антиоксиданта без добавления оксиданта.
2-4. Количественное определение окислительных повреждений
Через два часа после добавления перекиси водорода или AAPH AlarmarBlue (торговое название: Biosource, полученный Biosource International Inc.) добавляли получая конечную концентрацию 10%. Через 2-3 часа, согласно способам Ahmed S. A. et al. (J. Immunol. Method., 170, 211-224 (1994)) и инструкциям, предоставленным производителем, интенсивность кондиционированной среды измеряли с длиной волны возбуждения 544 нм и длиной волны излучения 590 нм.
3. Результаты
3-1. Антиоксидантный эффект карнозина на перекись водорода
Фигура 1 показывает результаты эксперимента, полученные исследованием антиоксидантного эффекта карнозина на перекись водорода в Cryo NHDF-Neo клетках. Планки погрешности для каждого условия эксперимента показывают стандартное отклонение экспериментально измеренных величин, полученных повторяющимся три раза экспериментом в идентичных условиях. Звездочка (*) показывает, что t является меньшим, чем 5% Bonferroni/Dunn тестом.
Отношение жизнеспособных клеток для контрольной группы для оценки токсичности антиоксиданта без добавления оксиданта составляло 102% без добавления карнозина. Когда концентрация карнозина была 0,01%, отношение составляло 100%. Когда концентрация карнозина была 0,05%, отношение составляло 97%. Отношение жизнеспособных клеток в случае добавления 1 мМ перекиси водорода составляло 45% без добавления карнозина. Когда концентрация карнозина была 0,01%, отношение составляло 51%. Когда концентрация карнозина была 0,05%, отношение составляло 53%. Отношение жизнеспособных клеток в случае 4 мМ перекиси водорода было 14% без добавления карнозина. Когда концентрация карнозина была 0,01%, отношение составляло 21%. Когда концентрация карнозина была 0,05%, отношение составляло 45%. Таким образом, когда концентрация перекиси водорода была 4 мМ, наблюдали значительное различие в отношении жизнеспособных клеток для случая, в котором добавляли 0,05% карнозина, по сравнению с отношением без добавления карнозина. На основе результатов выше эффект карнозина на перекись водорода подтверждался в экспериментальной системе настоящего примера.
3-2. Антиоксидантный эффект L-аспарагиновой кислоты на перекись водорода
Фигура 2 показывает результаты эксперимента, полученные исследованием антиоксидантного эффекта L-аспарагиновой кислоты на перекись водорода в Cryo NHDF-Neo клетках. Планки погрешности для каждого условия эксперимента показывают стандартное отклонение экспериментально измеренных величин, полученных повторяющимся три раза экспериментом в идентичных условиях.
Отношение жизнеспособных клеток для контрольной группы для оценки токсичности антиоксиданта без добавления оксиданта составляло 93% без добавления L-аспарагиновой кислоты. Когда концентрация L-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 88%. Когда концентрация L-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 97%. Отношение жизнеспособных клеток в случае 1 мМ перекиси водорода было 61% без добавления L-аспарагиновой кислоты. Когда концентрация L-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 62%. Когда концентрация L-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 62%. Отношение жизнеспособных клеток в случае 4 мМ перекиси водорода было 36% без добавления L-аспарагиновой кислоты. Когда концентрация L-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 33%. Когда концентрация L-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 32%. На основании результатов выше, статистически значимый антиоксидантный эффект L-аспарагиновой кислоты на перекись водорода не наблюдали.
3-3. Антиоксидантный эффект D-аспарагиновой кислоты на перекись водорода
Фигура 3 показывает результаты эксперимента, полученного исследованием антиоксидантного эффекта D-аспарагиновой кислоты на окислительные повреждения, вызванные перекисью водорода в Cryo NHDF-Neo клетках. Планки погрешности для каждого условия эксперимента показывают стандартное отклонение экспериментально измеренных величин, полученных повторяющимся три раза экспериментом в идентичных условиях. Звездочка (*) показывает, что p является меньшим, чем 5% Bonferroni/Dunn тестом. Двойная звездочка (**) показывает, что p является меньшим, чем 1% Bonferroni/Dunn тестом.
Отношение жизнеспособных клеток для контрольной группы для оценки токсичности антиоксиданта без добавления оксиданта составляло 97% без добавления D-аспарагиновой кислоты. Когда концентрация D-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 86%. Когда концентрация D-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 97%. В случае 1 мМ перекиси водорода, отношение жизнеспособных клеток было 55% без добавления D-аспарагиновой кислоты. Когда концентрация D-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 62%. Когда концентрация D-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 63%. В случае 4 мМ перекиси водорода, отношение жизнеспособных клеток было 22% без добавления D-аспарагиновой кислоты. Когда концентрация D-аспарагиновой кислоты была 0,1 мкМ (микромолярная), оно составляло 29%. Когда концентрация D-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 34%. Таким образом, когда концентрация перекиси водорода составляла 4 мМ, наблюдали значительное отличие отношения жизнеспособных клеток для случая, в котором добавляли 0,1 мкМ (микромолярная) или 10 мкМ (микромолярная) D-аспарагиновой кислоты, по сравнению с отношением без добавления D-аспарагиновой кислоты. На основании результатов выше, наблюдали зависящий от концентрации антиоксидантный эффект D-аспарагиновой кислоты на перекись водорода.
3-4. Антиоксидантный эффект карнозина в эксперименте для оценки окислительных повреждений, вызванных AAPH
Фигура 4 показывает эксперимент, полученный исследованием антиоксидантного эффекта карнозина в эксперименте по оценке окислительного повреждения, вызванного AAPH в Cryo NHDF-Neo клетках. Планки погрешности для каждого условия эксперимента показывают стандартное отклонение экспериментально измеренных величин, полученных повторяющимся три раза экспериментом в идентичных условиях. Двойная звездочка (**) показывает, что p является меньшим, чем 1% Bonferroni/Dunn тестом.
Отношение жизнеспособных клеток для контрольной группы для оценки токсичности антиоксиданта без добавления оксиданта составляло 100% без добавления карнозина. Когда концентрация карнозина была 5 мкг/г, оно составляло 93%. Когда концентрация карнозина была 100 мкг/г, оно составляло 103%. Отношение жизнеспособных клеток в случае 100 мМ AAPH было 31% без добавления карнозина. Когда концентрация карнозина была 5 мкг/г, оно составляло 60%. Когда концентрация карнозина была 100 мкг/г, оно составляло 85%. Когда AAPH имела концентрацию 100 мМ, наблюдали заметное отличие отношения жизнеспособных клеток для случая, в котором добавляли карнозин при концентрации 100 мкг/г, по сравнению с отношением без добавления карнозина. На основе результатов выше, эффект карнозина на AAPH подтверждали экспериментальной системой представленного примера.
3-5. Антиоксидантный эффект L- и D-аспарагиновых кислот в эксперименте по оценке окислительных повреждений, вызванных AAPH
Фигура 5 показывает эксперимент, полученный исследованием антиоксидантного эффекта L- и D-аспарагиновых кислот в эксперименте по оценке окислительных повреждений, вызванных AAPH в Cryo NHDF-Neo клетках. Планки погрешности для каждого условия эксперимента показывают стандартное отклонение экспериментально измеренных величин, полученных повторяющимся три раза экспериментом в идентичных условиях. Звездочка (*) показывает, что p является меньшим, чем 5% Bonferroni/Dunn тестом. Тройная звездочка (***) показывает, что p является меньшим, чем 0,1% Bonferroni/Dunn тестом.
Отношение жизнеспособных клеток для контрольной группы для оценки токсичности антиоксиданта без добавления оксиданта было 95% без добавления L- и D-аспарагиновых кислот. Когда концентрация D-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 102%. Когда концентрация L-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 80%. В случае 100 мМ AAPH, отношение жизнеспособных клеток было 51% без добавления L- и D-аспарагиновых кислот. Когда концентрация D-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 96%. Когда концентрация L-аспарагиновой кислоты была 10 мкМ (микромолярная), оно составляло 69%. Когда AAPH имела концентрацию 100 мМ, наблюдали заметное отличие отношения жизнеспособных клеток для случая, в котором добавляли L- и D-аспарагиновые кислоты при концентрации 10 мкМ (микромолярная), по сравнению с отношением без добавления L- и D-аспарагиновых кислот. На основании результатов выше, было показано, что D-аспарагиновая кислота обладает более сильным антиоксидантным эффектом на AAPH по сравнению с L-аспарагиновой кислотой
4. Выводы
На основании экспериментальных результатов примеров выше, было обнаружено, что D-аспарагиновая кислота обладает антиоксидантным эффектом на перекись водорода и AAPH. Однако было обнаружено, что L-аспарагиновая кислота обладает антиоксидантным эффектом только на AAPH. Таким образом, было показано, что D-аспарагиновая кислота является эффективной относительно и гидроксильного радикала, и пероксильного радикала, но L-аспарагиновая кислота является эффективной только относительно пероксильного радикала.
Пример 2
Примеры составов композиции, содержащей аспарагиновую кислоту, согласно настоящему изобретению, а именно, препарат на основе эмульсии, пластырь, таблетка, мягкая капсула, гранула, напиток, конфета, печенье, бобовая паста, французская приправа, майонез, французский хлеб, соевый соус, йогурт, сухой порошок-приправа для риса, специя/соус для соевого сыра, соевый сыр, неочищенный черный уксус, крем, крем для тела, гель, отшелушивающая маска, увлажняющая маска, эмульсия, лосьон для кожи и препарат на основе аэрозоля, приведены ниже. Аспарагиновая кислота в примерах составов представляет собой или D-форму и/или L-форму.
Все данные примеры составов являются иллюстративными и не предполагается, что они ограничивают технический объем настоящего изобретения.
Пример состава 1 (препарат на основе эмульсии)
| (Композиция) | Содержание (% по весу) |
| Аспарагиновая кислота | 0,42 |
| Бегениловый спирт | 0,2 |
| Кетанол | 0,5 |
| Моноэфир жирной кислоты и глицерина | 1,8 |
| Гидрогенизированное касторовое масло POE (60) | 1,0 |
| Белый вазелин | 2,0 |
| Жидкий парафин | 10,0 |
| Изопропилмиристат | 3,0 |
| Метилполисилоксан (6cs) | 1,5 |
| Концентрированный глицерин | 13,0 |
| Дипропиленгликоль | 2,0 |
| Карбоксивиниловый полимер | 0,25 |
| Гиалуронат натрия | 0,005 |
| Калия гидроксид | подходящее количество |
| Молочная кислота | подходящее количество |
| Эдетат натрия | подходящее количество |
| Этилпарабен | подходящее количество |
| Очищенная вода | остаток |
| 100,000 |
Пример состава 2 (пластырь)
| (Композиция) | Содержание (% по весу) |
| Аспарагиновая кислота | 0,3 |
| Полиакриловая кислота | 3,0 |
| Полиакрилат натрия | 2,5 |
| Желатин | 0,5 |
| Карбоксиметилцеллюлоза натрия | 4,0 |
| Поливиниловый спирт | 0,3 |
| Концентрированный глицерин | 14,0 |
| 1,3-Бутиленгликоль | 12,0 |
| Гидроксид алюминия | 0,1 |
| Эдетат натрия | 0,03 |
| Метилпарабен | 0,1 |
| Очищенная вода | остаток |
| 100,00 |
Пример состава 3 (таблетка)
| (Композиция) | Содержание (мг/таблетка) |
| Аспарагиновая кислота | 360,5 |
| Лактоза | 102,4 |
| Карбоксиметилцеллюлоза кальция | 29,9 |
| Гидроксипропилцеллюлоза | 6,8 |
| Стеарат магния | 5,2 |
| Кристаллическая целлюлоза | 10,2 |
| 515,0 |
Пример состава 4 (таблетка)
| (Композиция) | Содержание (мг/таблетка) |
| Эфир сахарозы | 70 |
| Кристаллическая целлюлоза | 74 |
| Метилцеллюлоза | 36 |
| Глицерин | 25 |
| Аспарагиновая кислота | 475 |
| N-Ацетилглюкозамин | 200 |
| Гиалуроновая кислота | 150 |
| Витамин E | 30 |
| Витамин B6 | 20 |
| Витамин B2 | 10 |
| α(альфа)-липоевая кислота | 20 |
| Коэнзим Q10 | 40 |
| Церамид (экстракт коньяка) | 50 |
| L-пролин | 300 |
| 1500 |
Пример состава 5 (мягкая капсула)
| (Композиция) | Содержание (мг/капсула) |
| Пищевое соевое масло | 530 |
| Экстракт эвкоммии ильмовидной | 50 |
| Экстракт женьшеня | 50 |
| Аспарагиновая кислота | 100 |
| Маточное молочко | 50 |
| Мака | 30 |
| GABA | 30 |
| Пчелиный воск | 60 |
| Желатин | 375 |
| Глицерин | 120 |
| Эфир жирной кислоты и глицерина | 105 |
| 1500 |
Пример состава 6 (мягкая капсула)
| (Композиция) | Содержание (мг/капсула) |
| Масло из семян коричневого риса | 659 |
| Аспарагиновая кислота | 500 |
| Ресвератрол | 1 |
| Экстракт из семян лотоса | 100 |
| Эластин | 180 |
| ДНК | 30 |
| Фолиевая кислота | 30 |
| 1500 |
Пример состава 7 (гранула)
| (Композиция) | Содержание (мг/упаковка) |
| Аспарагиновая кислота | 400 |
| Витамин C | 100 |
| Соевый изофлавон | 250 |
| Восстановленная лактоза | 300 |
| Соевый олигосахарид | 36 |
| Эритритол | 36 |
| Декстрин | 30 |
| Ароматизатор | 24 |
| Лимонная кислота | 24 |
| 1200 |
Пример состава 8 (напиток)
| (Композиция) | Содержание (г/60 мл) |
| Экстракт эвкоммии ильмовидной | 1,6 |
| Экстракт женьшеня | 1,6 |
| Аспарагиновая кислота | 0,25 |
| Восстановленный мальтозный сироп | 28 |
| Эритритол | 8 |
| Лимонная кислота | 2 |
| Ароматизатор | 1,3 |
| N-Ацетилглюкозамин | 1 |
| Гиалуронат натрия | 0,5 |
| Витамин E | 0,3 |
| Витамин B6 | 0,2 |
| Витамин B2 | 0,1 |
| α(альфа)-липоевая кислота | 0,2 |
| Коэнзим Q10 | 1,2 |
| Церамид (экстракт коньяка) | 0,4 |
| L-пролин | 2 |
| Очищенная вода | остаток |
| 60 |
Пример состава 9 (конфета)
| (Композиция) | Содержание (% по весу) |
| Сахар | 50 |
| Патока | 48 |
| Аспарагиновая кислота | 1 |
| Ароматизатор | 1 |
| 100 |
Пример состава 10 (печенье)
| (Композиция) | Содержание (% по весу) |
| Невсхожая мука | 45,0 |
| Масло | 17,5 |
| Кристаллический сахар | 20,0 |
| Аспарагиновая кислота | 4,0 |
| Яйцо | 12,5 |
| Ароматизатор | 1,0 |
| 100,0 |
Способ получения состава примера 10 (печенье)
Гранулированный сахар добавляют порциями к маслу при перемешивании, к которому добавляют и перемешивают яйцо, аспарагиновую кислоту и ароматизатор. После тщательного перемешивания равномерно добавляют просеянную невсхожую муку и перемешивают при низкой скорости и оставляют в виде массы в холодильнике. После этого ей придают форму и выпекают в течение 15 минут при 170°C (градусы Цельсия) для получения печенья.
Пример состава 11 (бобовая паста)
| (Композиция) | Содержание (г) |
| Соевые бобы | 1000 |
| Соложенный рис | 1000 |
| Соль | 420 |
| Аспарагиновая кислота | 16,8 |
| Вода | остаток |
| 4000 |
Способ получения состава примера 11 (бо