Способ получения холерогена-анатоксина
Иллюстрации
Показать всеИзобретение относится к технологии производства медицинских иммунобиологических препаратов и касается способа получения холерогена-анатоксина. Способ включает выделение холерогена-анатоксина методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 300 кДа, концентрирование методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа с последующей очисткой диафильтрацией трехкратным объемом стерильной очищенной водой методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа. Изобретение обеспечивает увеличение выхода холерогена-анатоксина, сокращение времени и количества технологических стадий его получения. 1 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к технологии производства медицинских иммунобиологических препаратов, в частности к технологии получения холерогена-анатоксина, и может быть использовано в практике производства вакцины оральной холерной бивалентной химической таблетированной.
Холероген-анатоксин используется для получения вакцины холерной бивалентной химической, таблетированной (одним из компонентов которой он является), включенной в Национальный календарь профилактических прививок по эпидемическим показаниям в соответствии с Приказом Минздрава России №229 от 27.06.2001 г. Вакцина холерная бивалентная химическая, таблетки, покрытые кишечнорастворимой оболочкой, представляет собой смесь холерогена-анатоксина и O-антигенов, полученных из инактивированных формалином бульонных культур холерных вибрионов O1 серогруппы - Vibrio cholerae 569 В классического биовара серовара Инаба и V. cholerae M-41 классического биовара серовара Огава.
Известен способ получения очищенного холерного экзотоксина (В.В. Строганов и др. Применение метода ультрафильтрации на отечественных полупроницаемых мембранах марки УАМ для отделения соматического O-антигена от экзотоксина холерного вибриона - Пробл. особо опасных инф., 1978, вып.4, с.52-55), сущность которого заключается в том, что из нативной культуры, содержащей O-антиген и холерный экзотоксин, удаляют ультрафильтрацией O-антиген. Полученный холерный экзотоксин используется только для получения антихолерогенной сыворотки, а не как компонент вакцины.
Известен способ производства химической вакцины, состоящей из холерогена-анатоксина вместе с O-антигеном серовара Инаба, описанный в патенте России №2076734, A61K 39/00, согласно которому холерный вибрион выращивают в условиях глубинного культивирования на питательной среде, состоящей из ферментативного перевара казеина или мяса. В начале стационарной фазы роста выращивание прекращают добавлением 0,6% формалина. Убитые формалином микробные тела через 12 ч отделяют в центрифуге при 15000 об/мин, а надосадочную жидкость выдерживают 25-30 дней при концентрации формалина 0,2%, pH 6,7, температуре 10-12°C для образования устойчивого анатоксина и снижения токсичности O-антигена. После этого приступают к выделению, очистке и концентрации иммуногенов (холерогена-анатоксина и O-антигена). Поэтапное осаждение антигенов холерного вибриона состоит в выполнении следующих операциях. На первом этапе добавляют сульфат аммония до 0,37 насыщения (281±7,6 г соли на 1 л), перемешивают, оставляют на 18-20 ч и центрифугируют при 8000 об/мин. Полученный на роторе осадок «O-антигенсодержащая фракция» используют в дальнейшем для получения O-антигена. На втором этапе из центрифугата выделяют фракцию, содержащую термолабильные белки, условно названную «холероген-анатоксин», путем последующего осаждения до 0,80 насыщения (327±38 г соли на 1 л исходного раствора). После центрифугирования осадок диализуют, разводят дистиллированной водой до 10 мг белка в 1 мл и проводят стерилизующую фильтрацию через мембранные фильтры. Полученную жидкую фракцию «холероген-анатоксин» лиофильно высушивают и используют для конструирования таблеток вакцины.
Недостатками способа являются существенные потери холерогена-анатоксина и O-антигена и применение значительного (608±45,7 г на 1 дм3 безмикробного центрифугата) количества сульфата аммония, затрачиваемого на осаждение.
Описанные недостатки устранены в способе по патенту RU 2451522, в соответствии с которым осуществляют предварительное концентрирование нативных холерогена-анатоксина и О-антигена путем проточной фильтрации через мембранные модули с номинальной отсечкой по молекулярной массе 50 кДа под давлением 0,23-0,25 МПа со средней удельной скоростью освобождения нативных холерогена-анатоксина и O-антигена от балластных примесей - 60-70 дм3/м2/ч, с последующим осаждением балластной (O-антигенсодержащей) фракции путем добавления 281±7,6 г сульфата аммония на 1 дм3 безмикробного центрифугата с последующим удалением этой фракции центрифугированием; осаждением холерогена-анатоксина и O-антигена из полученного центрифугата путем добавления 327±38 г сульфата аммония на 1 дм3 безмикробного центрифугата и концентрированием центрифугированием. После концентрирования центрифугированием полученный продукт диализуют, разводят дистиллированной водой до 10 мг белка в 1 мл и проводят стерилизующую фильтрацию через мембранные фильтры, лиофильно высушивают и используют для конструирования таблеток вакцины. Балластную (O-антигенсодержащую) фракцию используют в дальнейшем для получения O-антигена. O-антиген, полученный с использованием двух вышеописанных способов, обладает стандартностью и используется в дальнейшем для конструирования таблеток вакцины холерной бивалентной химической, таблетированной.
Недостатком описанных способов являются потери холерогена-анатоксина, возникающие за счет того, что его концентрирование проводят центрифугированием. Кроме того, технологический процесс получения холерогена-анатоксина длительный и многостадийный.
Технический результат заключается в увеличении выхода холерогена-анатоксина, с сохранением показателей качества препарата при сокращении времени и количества технологических стадий его получения.
Одним из перспективных направлений, применяемых в технологиях производства химических вакцин, является внедрение метода тангенциальной ультрафильтрации. Фильтрация в проточном (тангенциальном) потоке является разделительным методом, в котором поток жидкости направляется вдоль мембраны, омывая ее поверхность. Применение мембранных модулей с разным размером пор (номинальной отсечкой по молекулярной массе) позволяет использовать данный метод для разделения и концентрирования антигенов с различной молекулярной массой.
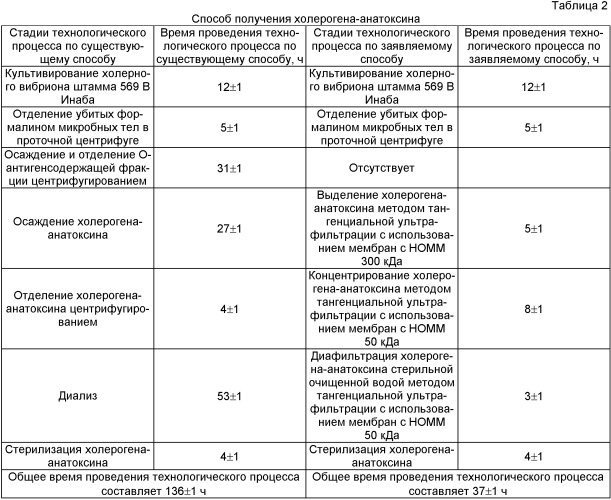
Технический результат достигается тем, что в способе получения холерогена-анатоксина, включающем выращивание холерного вибриона штамма 569 В Инаба в условиях глубинного культивирования, отделение убитых формалином микробных тел в проточной центрифуге, согласно изобретению холероген-анатоксин выделяют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 300 кДа, концентрируют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа, очищают диафильтрацией трехкратным объемом стерильной очищенной водой методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа с последующей стерилизующей фильтрацией.
Возможность практического использования заявляемого изобретения подтверждается примером.
Пример. Холерный вибрион V. cholerae 569 В классического биовара серовара Инаба выращивают в условиях глубинного культивирования в реакторе с 200 л бульона из ферментативного перевара казеина, с аэрацией и автоматической подкормкой глюкозой и аммиаком. В первые четыре часа роста поддерживают температуру 37°C, а затем в течение 5-7 ч снижают до 34-35°C для сохранения в культуральной жидкости термолабильного токсина. В начале стационарной фазы роста (10-11 ч выращивания), когда концентрация микробных тел, достигнув 70-100 млрд в 1 мл, остается постоянной 2-3 ч, выращивание прекращают добавлением 0,6% формалина.
Убитые формалином микробные тела через 12 ч отделяют в проточной центрифуге при 15000 об/мин, а надосадочную жидкость выдерживают 20-30 дней при концентрации формалина 0,2%, pH 6,7, температуре 10-12°C для образования устойчивого холерогена-анатоксина и снижения токсичности O-антигена. После этого приступают к выделению, очистке и концентрации иммуногенов.
Технологические операции тангенциальной ультрафильтрации проводили с использованием ультра- и микрофильтрационной установки на базе фильтродержателя АСФ-020, которая дает возможность:
проводить технологический процесс в асептических условиях;
осуществлять стерилизацию оборудования химическим и термическим способами и их сочетанием, что соответствует требованиям GMP (ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств»);
быстро заменять фильтрующие элементы в случае их выхода из строя во время проведения технологического процесса, благодаря модульной системе фильтров установки на базе фильтродержателя АСФ-020.
Выделение холерогена-анатоксина осуществляют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по молекулярной массе 300 кДа под давлением 0,24-0,26 МПа. Образующийся фильтрат, содержащий холероген-анатоксин, концентрируют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по молекулярной массе 30 кДа под давлением 0,24-0,26 МПа. Далее осуществляют очистку концентрированного холерогена-анатоксина диафильтрацией трехкратным объемом стерильной очищенной водой методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по молекулярной массе 30 кДа под давлением 0,24-0,26 МПа. Очищенную диафильтрацией фракцию «холероген-анатоксин» подвергают стерилизующей фильтрации, лиофильно высушивают и используют для конструирования таблеток вакцины холерной бивалентной химической, таблетированной.
Количество безмикробного центрифугата штамма V. cholerae O1 569 В классического биовара серовара Инаба для получения холерогена-анатоксина по существующему способу (патент RU 2451522) и заявляемому способу составляло по 100 дм3. Контроль качества лиофилизированных препаратов «холероген-анатоксин» (таблица 1) показал на соответствие их требованиям нормативной документации, при этом количество препарата холерогена-анатоксина, полученного по заявляемому способу, на 25% больше.
Проверка препаратов методом гель-хроматографии (чертеж) выявила, что профили элюции представляли собой подобные пики, оба препарата (I - полученный по заявляемому способу; II - полученный по существующему способу (патент RU 2451522)) выходили с колонки практически с одинаковой задержкой во времени, что говорит об их одинаковом качественном составе.
Характеристики проведения процесса получения холерогена-анатоксина по существующему и заявленному способам технологии представлены в таблице 2. Как видно из данных, представленных в таблице 2, использование предложенного способа сокращает время получения холерогена-анатоксина из культуральной жидкости и всего технологического процесса в целом на 100 ч по сравнению с существующим способом технологии, при этом количество стадий производственного процесса сокращается.
| Таблица 1 | |||
| Способ получения холерогена-анатоксина | |||
| Наименование показателя | Требования нормативной документации | Значение показателя качества препарата холерогена-анатоксина | |
| полученного по существующему способу (патент RU 2451522) | полученного по заявляемому способу | ||
| Специфическая безвредность | безвреден | безвредны | |
| Специфическая активность холерогена-анатоксина, единиц связывания анатоксина | от 2000 до 12000 в 1 мг препарата | 7000 | 7000 |
| Содержание O-антигена, обратный показатель титра в реакции непрямой агллютинации с O1 сывороткой | отсутствует | 156 | 156 |
| Количество продукта, г | отсутствует | 23 | 29 |
Способ получения холерогена-анатоксина, включающий глубинное культивирование холерного вибриона штамма 569 В Инаба, отделение убитых формалином микробных тел в проточной центрифуге, выделение холерогена-анатоксина, отличающийся тем, что холероген-анатоксин выделяют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 300 кДа, концентрируют методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа, очищают диафильтрацией трехкратным объемом стерильной очищенной водой методом тангенциальной ультрафильтрации с использованием мембран с номинальной отсечкой по мол. массе 30 кДа с последующей стерилизующей фильтрацией.