Способ моделирования энтероэнтероанастомоза у мелких лабораторных животных
Иллюстрации
Показать всеИзобретение относится к медицине и биологии и может быть использовано для изучения физиологических функций всасывания различных веществ и моторики в изолированном участке тонкого кишечника по Тири-Велла в эксперименте. Вскрывают брюшную полость. Выполняют на передней поверхности желудка кисетный шов в виде круга. В центре кисетного шва рассекают стенку желудка. Через полость желудка в просвет тонкого кишечника вводят катетер-проводник с шариком на конце до места формирования энтероэнтероанастомоза. Пересекают тонкую кишку с брыжейкой. После выделения изолированного участка тонкой кишки закрепляют на катетере-проводнике с шариком на конце болюс-трубку. Формируют энтероэнтероанастомоз между проксимальным и дистальным концами тонкой кишки на болюсе-трубке. Восстанавливают целостность кишечника и его герметичность накладыванием однорядных узловых серозно-мышечно-подслизистых швов. Катетер-проводник с шариком на конце и болюс-трубку удаляют через отверстие в желудке, ограниченное кисетным швом. Проверяют герметичность и состоятельность энтероэнтероанастомоза. Закрепляют фистульные трубки на проксимальном и дистальном концах изолированного участка тонкой кишки. Способ позволяет сохранить нормальный просвет тонкой кишки при формировании энтероэнтероанастомоза «конец в конец» у мелких лабораторных животных и интраоперационно проверить состоятельность и герметичность сформированного анастомоза, а также более длительно сохранить созданную модель для изучения функций тонкого кишечника за счет выполнения кисетного шва на желудке, использования катетера-проводника с шариком на конце и болюс-трубки, надежных кишечных швов. 1 пр., 5 ил.
Реферат
Изобретение относится к области медицины, биологии, а именно к экспериментальной хирургии желудочно-кишечного тракта на мелких лабораторных животных, и может быть использовано для изучения процессов всасывания и моторной функции желудочно-кишечного тракта (ЖКТ).
Исследование процесса всасывания различных веществ является одной из актуальных проблем физиологии и медицины. Это связано как с теоретическими аспектами, так и с практическими запросами медицины, например оптимизацией нутритивной поддержки больных с различной патологией, изучения всасывания различных фармакологических препаратов.
Известен способ формирования энтероэнтероанастомоза в эксперименте на животных, включающий формирование анастомоза путем сшивания участков тонкого кишечника «конец в конец» или «конец в бок» (1). Недостатком этого способа является то, что он применим для крупных животных с развитой и толстой стенкой тонкого кишечника. Однако, очень часто в экспериментальных исследованиях необходимо формирование энтероэнтероанастомоза и изолированного участка кишки у мелких лабораторных животных. Это связано с экономической целесообразностью (меньшая стоимость животных и их содержания, меньший расход субстрата для изучения функций кишечника).
При формировании энтероэнтероанастомоза способом «конец в конец» у мелких лабораторных животных с использованием известных технологий существуют трудности во время выполнения операции наложения кишечных швов, что в последующем приводит к формированию стеноза кишечника и гибели животного.
Наиболее близким к предлагаемому является способ моделирования энтероанастомоза у мелких лабораторных животных (2), включающий формирование анастомоза тонкого кишечника методом «конец в конец» с использованием крахмального стержня, введенного в просвет тонкого кишечника. Оперативное вмешательство проводят на фоне нембуталового наркоза (3,5 мг на 100 г массы тела животного). Соблюдая правила асептики, вскрывают брюшную полость по средней линии живота и изолируют отрезок тонкой кишки длиной 10-30 см. Перед рассечением кишки перевязывают сосуды, питающие соответствующие участки кишки. В оба конца изолированного отрезка тонкой кишки вставляют фистулы. Для предупреждения выпадения фистул и развития околосвищевых ходов дополнительно используют нейлоновые или капроновые сетки для внешнего крепления фистульных трубок. Эти сетки не препятствовали прорастанию тканей. Фистульные трубки выводят сбоку через узкие отверстия в мышцах и коже на 2-3 см латеральное средней линии живота. На концы фистульных трубок с наружной стороны накладывают фиксирующие повязки из бинта, которые через 3-4 дня снимают. Непрерывность пищеварительной трубки восстанавливают с помощью энтероанастомоза по типу «конец в конец». При наложении швов в концы сшиваемых отделов тонкой кишки вводят специальную рассасывающуюся крахмальную пробку для уменьшения трудоемкости наложения швов на кишку мелких лабораторных животных.
Недостатком известного способа является использование крахмала, материала мягкого по плотности, и поэтому не гарантирующего сохранение просвета тонкого кишечника при наложении и завязывании кишечных швов, который у мелких лабораторных животных очень мал, что может привести к развитию кишечной непроходимости, а также невозможность интраоперационно проверить герметичность сфомированного кишечного анастомоза, что приводит к гибели животного.
Исходя из того, что существующие способы формирования энтероэнтероанастамоза имеют указанные недостатки, была поставлена задача: обеспечить более простое и качественное получение модели энтероэнтероанастомоза, сохраняющей нормальный просвет тонкой кишки у мелких лабораторных животных, возможность проверки герметичности сформированного энтероэнтероанастомоза интраоперационно, что позволяет более длительно сохранить созданную модель для изучения функций тонкого кишечника.
Поставленную задачу решают следующим образом.
Моделирование энтероэнтероанастомоза у мелких лабораторных животных включает следующие манипуляции: вскрытие брюшной полости, изоляцию отрезка тонкой кишки, формирование фистул на концах изолированного отрезка тонкой кишки и восстановление непрерывности пищеварительной трубки по типу «конец в конец» с использованием наполнителя просвета тонкой кишки. Новым в решении поставленной задачи является то, что при вскрытии брюшной полости выполняют на передней поверхности желудка кисетный шов в виде круга, в центре которого рассекают стенку желудка, через полость желудка в просвет тонкого кишечника вводят катетер-проводник с шариком на конце до места формирования энтероэнтероанастомоза. Затем пересекают тонкую кишку с брыжейкой, выделяют изолированный участок тонкой кишки, закрепляют на катетере-проводнике с шариком на конце болюс-трубку и формируют энтероэнтероанастомоз между проксимальным и дистальным концами тонкой кишки на болюсе-трубке. Восстанавливают целостность кишечника и его герметичность накладыванием однорядных узловых серозно-мышечно-подслизистых швов. Катетер-проводник с шариком на конце и болюс-трубку удаляют через отверстие в желудке, ограниченное кисетным швом, проверяют герметичность и состоятельность энтероэнтероанастомоза, на проксимальном и дистальном концах изолированного участка тонкой кишки закрепляют фистульные трубки.
Поясняем существенные отличительные признаки предлагаемого «Способа моделирования энтероэнтероанастомоза у мелких лабораторных животных».
При вскрытии брюшной полости на передней поверхности желудка накладывают кисетный шов в виде круга, в ицентре которого рассекают стенку желудка, что позволяет в дальнейшем провести катетер-проводник с шариком на конце в выбранный участок тонкого кишечника и после формирования энтероэнтероанастомоза атравматично удалить его вместе с болюсом-трубкой. До введения катетера-проводника с шариком на конце через полость желудка в просвет тонкого кишечника вводят полиэтиленовый катетер, соединенный со шприцем, наполненным изотоническим раствором хлорида натрия, продвигают катетер в начальную часть 12-перстной кишки и вводят 1,0 мл раствора. Это позволяет в дальнейшем атравматично провести катетер-проводник с шариком на конце по кишке и извлечь болюс-трубку на более позднем этапе операции.
После проведения катетера-проводника с шариком на конце до места формирования энтероэнтероанастомоза и выделения изолированного участка кишки, на катетере закрепляют плотную полиэтиленовую болюс-трубку длиной 10 мм и диаметром 4 мм. На болюс-трубке формируют энтероэнтероанастомоз между проксимальным и дистальным участками тонкой кишки, затем накладывают однорядные узловые серозно-мышечно-подслизистые швы с шагом 1,5 мм. Использование достаточно плотной болюс-трубки, позволяет избежать стенозирования просвета тонкой кишки при формировании энтероэнтероанастомоза, а значит и последующего развития кишечной непроходимости и гибели животного. Наличие шарика на конце катетера-проводника позволяет уменьшить повреждение слизистой желудка и кишечника при продвижении катетера-проводника до места формирования энтероэнтероанастомоза.
Последующее введение через отверстие, сформированное на передней поверхности желудка, полиэтиленового катетера, надетого на шприц, продвижение катетера в 12-перстную кишку и введение 1 мл изотонического раствора хлорида натрия позволяет проверить герметичность и состоятельность кишечного энтероэнтероанастомоза. Возможность проверки герметичности анастомоза является важным преимуществом предлагаемого способа, так как позволяет избежать еще одного грозного осложнения - несостоятельности энтероэнтероанастомоза с последующим развитием перитонита, что также приводит к гибели животного.
На заключительном этапе операции на проксимальном и дистальном концах изолированной петли тонкого кишечника закрепляют фистульные трубки, дистальные концы которых выводят наружу на 4 мм выше поверхности кожи, что позволяет в дальнейшем проводить исследования различных функций тонкого кишечника.
Проведенные патентные исследования по классу G09B 23/28 и анализ научно-медицинской информации, отражающие существующие способы формирования энтероэнтероанастомоза у мелких лабораторных животных, не выявили идентичных технологий. Таким образом, предлагаемый способ моделирования энтероэнтероанастомоза является новым.
Взаимодействие и взаимосвязь отличительных приемов в осуществлении предлагаемого способа формирования энтероэнтероанастомоза позволяют достичь решения поставленной задачи, а именно: разработать более простой и эффективный способ, который позволяет сохранить нормальный просвет тонкой кишки при формировании энтероэнтероанастомоза «конец в конец» у мелких лабораторных животных. Модель энтероэнтероанастомоза сохраняет свои свойства длительный срок и тем самым возможность исследования различных функций тонкого кишечника в эксперименте. Таким образом, предлагаемый способ имеет изобретательский уровень.
Предлагаемый способ моделирования энтнроэнтероанастомоза прост в исполнении и может широко, многократно применяться в экспериментальной практике, дает возможность уменьшить количество использованных животных в эксперименте, так как имеет почти 100% получение положительного результата. А также проводить длительный хронический эксперимент на мелких лабораторных животных (1 месяц) и, тем самым, получать более значимые сведения о физиологии и патологии процессов всасывания и моторики тонкого кишечника.
Сущность предлагаемого способа поясняется следующими иллюстрациями:
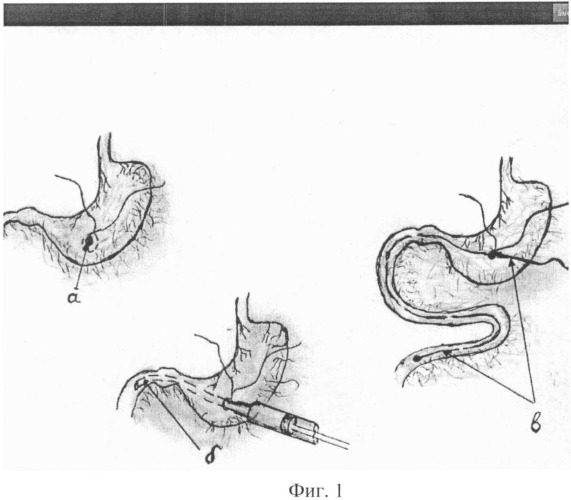
Фиг.1 - схематичное изображение начальных этапов операции: а) формирование гастростомы, б) введение жировой эмульсии на изотоническом растворе хлорида натрия через гастростому, в) проведение катетера-проводника с шариком на конце в просвете тонкого кишечника;
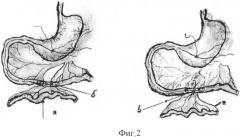
Фиг.2 - схематичное изображение последующих этапов операции: а) выделение изолированного участка тонкой кишки, б) введение болюса-трубки в дистальный участок тонкой кишки, в) сформированный энтероэнтероанастомоз на болюс-трубке;
Фиг.3 - сформированный энтероэнтероанастомоз тонкой кишки на болюс-трубке;
Фиг.4 - таблица 1 - результат изучения функции всасывания тонкого кишечника, пример №1;
Фиг.5 - таблица 2 - результаты использования модели энтероэнтероанастомоза при изучении функции всасывания в тонком кишечнике группы экспериментальных животных.
Сущность предлагаемого «Способа моделирования энтероэнтероанастомоза у мелких лабораторных животных» заключается в следующем.
Операцию по формированию модели энтероэнтероанастомоза на изолированном участке тонкой кишки проводят в стерильных условиях. В качестве экспериментальных животных использованы крысы. Эксперимент проведен в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Страсбург, 1986).
Экспериментальное исследование выполнено в лаборатории кафедры нормальной физиологии ГБОУ ВПО «Иркутский государственный медицинский университет» МЗ РФ при свободном доступе к пище и воде на рационе питания, соответствующем нормативам ГОСТа. При выполнении исследования выполнялись все биоэтические нормы работы с экспериментальными животными согласно приказа Министерства здравоохранения СССР от 12.08.1977 г. N755.
Масса подопытных крыс составила 220-250 г. Под общей анастезией (тиопентал натрия из расчета 20 мг/кг внутрибрюшинно) вскрывают брюшную полость разрезом 4 см по белой линии от мечевидного отростка. Отступив на 1 см проксимальнее от луковицы 12-перстной кишки, на передней поверхности дна желудка ближе к большой кривизне на участке, свободном от кровеносных сосудов, накладывают кисетный шов в виде круга диаметром 5 мм, захватывая только серозно-мышечную оболочку желудка. Рассекают стенку желудка в центре круга (см. приложение к описанию, фиг.1а).
В случае наличия содержимого в желудке отсасывают его шприцем. В сформированное отверстие желудка вводят полиэтиленовый катетер, соединенный со шприцем, наполненным изотоническим раствором хлорида натрия, продвигают катетер в начальную часть 12-перстной кишки и вводят 1,0 мл указанного раствора (см. приложение к описанию, фиг.1б). Извлекают катетер, при этом строго следят, чтобы раствор не поступал ретроградно в полость желудка. Катетер извлекают и в отверстие желудка вводят катетер-проводник длиной 20 см и диаметром 0,7 мм из полумягкого тефлона с шариком на конце (диаметр шарика 2 мм), слабо затягивают кисетный шов, осторожно продвигают катетер-проводник с шариком на конце по кишечнику ввинчивающими движениями (см. приложение к описанию, фиг.1в). Особо осторожно проводят катетер-проводник с шариком на конце через двенадцатиперстно-тощий изгиб. После прохождения указанного ранее изгиба продвигают катетер-проводник с шариком на конце на 5-7 см по тонкой кишке. Выбирают участок брыжейки тонкой кишки, свободный от кровеносных сосудов, поперечно пересекают тонкую кишку, обрабатывают асептическим раствором слизистую тонкой кишки в месте разреза. Дистальный конец тонкой кишки временно перевязывают лигатурой, из проксимального просвета тонкой кишки выводят катетер-проводник с шариком на конце и фиксируют на нем болюс-трубку длиной 10 мм и диаметром 4 мм, изготовленную, например, из плотного полиэтилена и вводят болюс-трубку в проксимальный просвет тонкой кишки. Затягивают кисетный шов на желудке. Выделяют участок тонкой кишки, равный примерно 20 см от дистально перевязанного просвета кишки, находят участок брыжейки тонкой кишки, свободный от кровеносных сосудов, и повторно поперечно пересекают тонкую кишку, выделяя изолированный участок тонкой кишки, у которого сохранен сосудисто-нервный пучок брыжейки, обрабатывают асептическим раствором слизистую кишечника в месте разреза. Другой конец болюс-трубки вводят в просвет дистального участка тонкой кишки (см. приложение к описанию, фиг.2а), и накладывают однорядные узловые серозно-мышечно-подслизистые швы с шагом 1,5 мм, которые восстанавливают целостность кишечника и герметизируют его полость (см. приложение к описанию, фиг.2б, фиг.3). Развязывают и ослабляют кисетный шов на желудке, вытягивают катетер-проводник с шариком на конце и болюсом-трубкой из просвета тонкой кишки через отверстие в желудке. Вводят в отверстие желудка полиэтиленовый катетер, надетый на шприц, продвигают в 12-перстную кишку, вводят 1 мл изотонического раствора хлорида натрия для проверки герметичности и состоятельности кишечного энтероэнтероанастомоза. Выводят катетер, обрабатывают слизистую желудка в области сформированного отверстия асептическим раствором и плотно завязывают кисетный шов на желудке. В просветы дистального и проксимального концов изолированного участка тонкой кишки вводят фистулы из фторопласта, на кишку накладывают кисетные швы и стягивают их вокруг фистулы. Дистальные концы фистул выводят наружу на 4 мм над поверхностью кожи, в которой предварительно делают отверстия, отступив по 1 см в стороны от белой линии живота.
Рану брюшной полости зашивают послойно. Послеоперационное ведение животного - обычное. Животное начинают поить через 1 сутки после операции, на 2 сутки осторожно промывают изолированный участок кишки изотоническим раствором хлорида натрия. С 3 дня начинают предварительную перфузию изолированного участка тонкой кишки. Для перфузии используют, например, раствор глюкозы или глутаминовой кислоты. Регулярная нагрузка изолированного участка кишки позволяет избежать атрофии этого участка тонкой кишки (3). В течение экстеримента (не менее 30 дней). Животное используют в опыте на 7-8 день после операции, то есть модель энтероэнтероанастомоза создана и возможно исследование различных функций тонкого кишечника (см. приложение к описанию, фиг.3).
Сущность предлагаемого «Способа моделирования энтероэнтероанастомоза у мелких лабораторных животных» поясняется примером моделирования энтнроэнтероанастомоза и использования модели для исследования функции всасывания кишечника.
Пример
Подопытная крыса, возраст 5 месяцев, вес 250 г. За сутки до операции животное было отсажено в отдельную клетку, в течение этих суток крыса была лишена пищи, за 12 часов до операции исключено потребление жидкости. Крыса была зафиксирована, внутрибрюшинно введен тиопентал натрия из расчета 20 мг/кг. Через 7 минут крыса была фиксирована на операционном столе. На передней поверхности живота выстрижена шерсть, операционное поле дважды обработано 5% спиртовым раствором йода. Сделан кожный разрез длиной 5 см вертикально от мечевидного отростка. Брюшная полость вскрыта разрезом длиной 4 см по белой линии живота вниз от мечевидного отростка. В рану извлечен дистальный отдел желудка с начальным отделом 12-перстной кишки. На 1 см проксимальнее от луковицы 12-перстной кишки, на передней поверхности желудка ближе к большой кривизне на участке, свободном от кровеносных сосудов, наложен кисетный шов в виде круга диаметром 5 мм, захватывая только серозно-мышечную оболочку желудка. Рассекли стенку желудка в центре круга, ограниченного кисетным швом. Содержимое желудка удалено шприцем, соединенным с полиэтиленовым катетером. В сформированное отверстие желудка введен полиэтиленовый катетер диаметром 2 мм, длиной 7 см, соединенный со шприцем, наполненным изотоническим раствором хлорида натрия. Катетер проведен в начальную часть 12-перстной кишки и через катетер введено 1,0 мл указанного раствора. Катетер извлечен и в отверстие желудка введен проводник-катетер длиной 20 см и диаметром 0,7 мм из тефлона с шариком на конце (диаметр шарика 2 мм). Слабо затянули кисетный шов, чтобы содержимое желудка не попало в брюшную полость. Катетер-проводник с шариком на конце продвинут по кишечнику ввинчивающими движениями в тонкую кишку. Выбран участок брыжейки тонкой кишки, свободный от кровеносных сосудов, и поперечно пересечена тонкая кишка. Слизистая тонкой кишки обработана в месте разреза антисептическим раствором. Дистальный конец тонкой кишки временно перевязан лигатурой. Из проксимального просвета тонкой кишки выведен катетер-проводник с шариком на конце и на нем зафиксирована болюс-трубка длиной 10 мм и диаметром 4 мм, изготовленная из плотного полиэтилена. Болюс-трубку ввели в проксимальный просвет тонкой кишки, плотно затянули кисетный шов на желудке. Был выделен участок тонкой кишки длиной около 20 см от дистально перевязанного просвета кишки, найден участок брыжейки кишки, свободный от кровеносных сосудов, и повторно поперечно пересечена тонкая кишка. Выделен изолированный участок тонкой кишки, у которого сохранен сосудисто-нервный пучок брыжейки, обработана слизистая кишечника в месте разреза асептическим раствором. Другой конец болюс-трубки введен в просвет дистального участка тонкой кишки и наложены однорядные узловые серозно-мышечно-подслизистые швы с шагом 1,5 мм на тонкую кишку, которые восстановили целостность кишечника и герметизировали его полость.
Ослабили кисетный шов на желудке, удалили катетер-проводник с шариком на конце и болюсом-трубкой из просвета тонкой кишки через отверстие в желудке. Затем в отверстие желудка введен полиэтиленовый катетер, соединенный со шприцем. Катетер продвинули в 12-перстную кишку и ввели 1 мл изотонического раствора хлорида натрия для проверки герметичности и состоятельности кишечного энтероэнтероанастомоза. Энтероэнтероанастомоз состоятелен и герметичен. Катетер выведен, слизистая желудка обработана асептическим раствором в области сформированного отверстия, и плотно завязан кисетный шов на желудке. В просветы проксимального и дистального концов изолированного участка тонкой кишки введены фистулы из фторопласта (длина фистулы 6 мм, внешний диаметр 4 мм, внутренний диаметр 2 мм, длина «ушек» для фиксации 3 мм), на кишку наложены кисетные швы и стянуты вокруг фистул. Изолированный участок тонкой кишки промыт изотоническим раствором хлорида натрия. Дистальные концы фистул выведены наружу на 4 мм над поверхностью кожи, в которой предварительно сделаны отверстия, отступив 1 см в стороны от белой линии живота. Рана брюшной полости послойно ушита. Модель энтероэнтероанастомоза тонкой кишки создана.
Созданная модель энтероэнтероанастомоза использована для исследования функции всасывания кишечника у данного животного. В 1-е сутки после операции крыса была лишена пищи и питья, состояние соответствовало тяжести перенесенной операции. На 2-е сутки крыса активна, состояние ближе к удовлетворительному, дана жидкость для питья. Изолированный участок тонкой кишки осторожно промыт изотоническим раствором хлорида натрия, получен кишечный секрет. Во время манипуляции животное достаточно спокойно в руках экспериментатора. На 3-й сутки состояние удовлетворительное, крыса активна, проведена пробная перфузия изолированного участка тонкой кишки раствором глюкозы 25 мМ в течение 15 минут. Дана пища. 4-6 сутки после операции - состояние без изменений, крыса активна, проводятся ежедневные пробные перфузии раствором 25 мМ глюкозы.
На 7 сутки сняты швы, крыса взята в эксперимент по изучению функции всасывания кишечника. В качестве субстрата была использована глюкоза концентрацией 40 мМ, так как содержание глюкозы в полости тонкой кишки в физиологических условиях не превышает 50 мМ (4). Перфузию изолированного участка кишки осуществляли с помощью перистальтического насоса "Infusens" (tipe 5188, Hungary) со скоростью 0,5 мл/мин. В дни, когда забор проб для биохимического исследования не производился, для поддержания функциональных характеристик и уменьшения атрофии изолированного участка тонкой кишки проводилась перфузия раствором глюкозы 25 мМ со скоростью 0,5 мл/мин.
Раствор глюкозы подогревали до 38°C с использованием теплообменника, подключенного к ультратермостату. Биохимическое определение концентрации глюкозы в исходном растворе и оттекающем перфузате проводили в 1 сутки опыта (7 сутки после операции), 10 сутки опыта (17 сутки после операции) и 30 сутки опыта (37 сутки после операции). Исследование функции всасывания тонкой кишки проводили в утренние часы в одно и то же время для устранения влияния циркадных ритмов на всасывание (3). После предварительной 15-минутной перфузии раствором глюкозы 40 мМ для достижения стационарного состояния, отбирали 4 пробы с интервалом 15 минут, т.е. исследовали динамику скорости всасывания глюкозы за 1 час опыта.
Определение концентрации глюкозы в исходном растворе и в оттекающем перфузате проводили гексокиназным методом (5). Скорость всасывания свободной глюкозы в тонкой кишке вычисляли по формуле, предложенной Л.В. Громовой и А.А. Грузковым (б):
j=Cвх × Vвх/15 - Cвых × Vвых/15,
где Cвх и Cвых - концентрация глюкозы в исходном и оттекающем перфузате (т.е. на входе и на выходе) (мМ);
Vвх и Vвых - объемы перфузионного раствора, поступающего в изолированную петлю и вытекающего из нее за 15-минутный интервал (мл).
Результаты проведенного исследования скорости всасывания глюкозы (мкмоль/мин) в тонком кишечнике у данной крысы представлены в таблице 1 (см. приложение к описанию, фиг.4). Скорость всасывания за 1 час опыта в мкмоль/мин составила в 1 сутки опыта 13,13(12,21-13,74), 10 сутки опыта 12,48(11,74-13,63), 30 сутки опыта - 12,48(12,23-12,52) в виде медианы и интерквартильного интервала. Скорость всасывания глюкозы при завершении эксперимента мало отличалась от данных, полученных в начале эксперимента, что говорит о жизнеспособности созданной модели. Эти результаты соответствуют данным, полученным другими авторами (3, 6).
Проведены хронические опыты по изучению процесса всасывания веществ на 13 белых крысах, оперированных по предлагаемому способу моделирования энтероэнтероанастомоза, условия проведенного исследования по изучению функции всасывания кишечника соответствовали вышеизложенному примеру. Эксперимент проведен в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных целей (Страсбург, 1986) и требованиями «Правил проведения работ с использованием лабораторных животных» (приложение к Приказу МЗ СССР от 12.08.1977, №755). В качестве субстрата была использована глюкоза концентрацией 40 мМ, так как содержание глюкозы в полости кишки в физиологических условиях не превышает 50 мМ (4). Предварительную перфузию изолированного участка кишки начинали на 3 сутки после операции, а опытную перфузию и забор проб для анализа проводили через 7-8 сутки после операции. В дни, когда забор проб для биохимического исследования не производился, для поддержания функциональных характеристик и уменьшения атрофии изолированного участка тонкой кишки, проводилась перфузия раствором глюкозы (25 мМ) с той же скоростью.
Результаты проведенного исследования скорости всасывания глюкозы (мкмоль/мин) в тонком кишечнике крыс представлены в следующей таблице №2 (см. приложение к описанию, фиг.5) в виде медианы и интерквартильного интервала.
Скорость всасывания глюкозы за час в 1, 10 и 30 сутки опыта по нашим данным составила 12,65(12,28-13,51), 13,03(12,31-13,49) и 12,57(12,07-13,48) мкмоль/мин. Эти результаты соответствуют данным, полученным другими авторами (3, 6). Незначительная разница наших результатов в абсолютных данных и данных цитируемых авторов находится в пределах допустимых ошибок. Отмечаем, что результаты скорости всасывания глюкозы на 30 сутки опыта, т.е. после операции на 37-38 сутки, практически не отличаются от результатов, полученных после 2-3 недель после операции. Эти данные однозначно указывают, что оперированные по нашему способу животные могут быть использованы в течение не менее одного месяца эксперимента и при этом полностью сохраняется жизнеспособность изолированного участка тонкой кишки, что позволяет применять предлагаемую модель энтероэнтероанастомоза для изучения функции всасывания кишечника при использовании других веществ.
Таким образом, предлагаемый «Способ моделирования энтероэнтероанастомоза у мелких лабораторных животных» по сравнению с другими известными технологиями позволил разработать более простой и эффективный способ, который обеспечивает сохранение нормального просвета тонкой кишки при формировании энтероэнтероанастомоза «конец в конец» у мелких лабораторных животных. Модель энтероэнтероанастомоза сохраняет свои свойства длительный срок и тем самым создает возможность исследования различных функций тонкого кишечника в эксперименте.
Источники информации
1. Лопухин Ю.М. Экспериментальная хирургия/Ю.М. Лопухин. -Москва: Медицина, 1971. - С.30-37, 60-64.
2. Уголев A.M. Методические приемы для изучения мембранного пищеварения и всасывания в тонкой кишке в условиях хронического эксперимента на крысах и некоторых других животных/Уголев A.M., Зарипов Б.З.//Физиологический журнал СССР. - 1979. - №12. -С.1850-1854.
3. Мембранный гидролиз и транспорт. Новые данные и гипотезы/A.M. Уголева [и др.]; под ред. A.M. Уголева. - Ленинград: Наука, 1986. -С.73-85, 139-159.
4. Diamond J.M. Evolutionary design of intestinal nutrient absorption: enough but not too much/Diamond J.M.//News Physiol. Sci. - 1991. - Vol.6 - P. 92-96.
5. Камышников B.C. Справочник по клинико-биохимической лабораторной диагностике/Камышников B.C. - Минск, 2000.- С.17-18.
6. Громова Л.В. Относительная роль различных механизмов всасывания глюкозы в тонкой кишке при физиологических условиях./ Громова Л.В., Груздков А.А.//Физиологический журнал им. И.М.Сеченова. - 1993. - №6. - С.65-72.
Способ моделирования энтероэнтероанастомоза у мелких лабораторных животных, включающий вскрытие брюшной полости, изоляцию отрезка тонкой кишки, формирование фистул на концах изолированного отрезка тонкой кишки и восстановление непрерывности пищеварительной трубки по типу «конец в конец» с использованием наполнителя просвета тонкой кишки, отличающийся тем, что при вскрытии брюшной полости выполняют на передней поверхности желудка кисетный шов в виде круга, в центре которого рассекают стенку желудка, через полость желудка в просвет тонкого кишечника вводят катетер-проводник с шариком на конце до места формирования энтероэнтероанастомоза, пересекают тонкую кишку с брыжейкой, после выделения изолированного участка тонкой кишки закрепляют на катетере-проводнике с шариком на конце болюс-трубку и формируют энтероэнтероанастомоз между проксимальным и дистальным концами тонкой кишки на болюсе-трубке, восстанавливают целостность кишечника и его герметичность накладыванием однорядных узловых серозно-мышечно-подслизистых швов, катетер-проводник с шариком на конце и болюс-трубку удаляют через отверстие в желудке, ограниченное кисетным швом, проверяют герметичность и состоятельность энтероэнтероанастомоза и на проксимальном и дистальном концах изолированного участка тонкой кишки закрепляют фистульные трубки.