Фосфорсодержащие фторированные производные 1,4-нафтохинона, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре
Иллюстрации
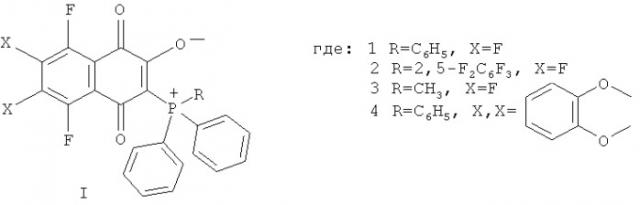
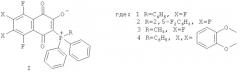
Показать всеИзобретение относится к новым фторированным производным 1,4-нафтохинона общей формулы (I)
обладающим цитотоксической активностью по отношению к раковым клеткам, которые могут найти применение в медицине. Предложены новые соединения с противораковой активностью для терапии злокачественных новообразований. 1 ил., 3 табл., 5 пр.
Реферат
Изобретение относится к области органической химии и молекулярной биологии, а именно к фторированным производным 1,4-нафтохинона, содержащим фосфор, общей формулы (I):
которые обладают цитотоксической активностью по отношению к раковым клеткам человека в культуре.
Клетки млекопитающих обычно используют обратимое фосфорилирование остатков тирозина в белках для передачи внеклеточного сигнала к внутриклеточным мишеням. Учитывая это, нарушение медиаторов передачи сигнала через фосфорилирование белков, а именно протеинкиназ и фосфатаз, связано с развитием большого числа заболеваний человека, включая раковые заболевания. Известно, что Cdc25A и Cd25B фосфатазы важны для контроля клеточного цикла и активируют циклин-зависимые киназы, которые играют важную роль в регуляции пролиферации клеток. Cdc25A и Cd25B фосфатазы человека обладают онкогенными свойствами и гиперэкспрессированы в различных раковых клетках человека. Учитывая это, они представляют интерес как мишени для антираковых препаратов [Boutros R., Dosier С., Ducommun В. Curr. Opin. Cell. Biol. 2006. V.18, P.185; Kristjansdottir K., Rudolf J.J. Chem. Biol., 2004. V.11. P.1043].
В зависимости от структуры, различные соединения, включая ингибиторы Cdc25 фосфатаз, могут быть полифункциональными и взаимодействовать не только с основной мишенью, но и с другими компонентами клеток, а также проявлять общую цитотоксичность, быть мутагенами, канцерогенами или проявлять защитно-антиокислительные свойства. Кроме того, они могут различаться по способности проникать в различные органы, ткани, клетки, клеточные органеллы (митохондрии, ядра). В этой связи совершенно очевидно, что одним из перспективных направлений развития терапии раковых заболеваний является создание новых соединений, проявляющих высокую активность при минимальных концентрациях в отношении основной мишени, но с низкой общей цито- и генотоксичностью. Еще одним преимуществом некоторых антираковых препаратов может быть их способность не только подавлять рост раковых клеток, но и параллельно служить антиоксидантами, подавляющими окислительный стресс, который, как считается, является одним из основных путей появления раковых клеток.
Среди большого числа различных исследованных соединений только некоторые производные нафтохинона [Eckstein J.W. Invest. New. Drugs. 2000. V.18, P.149; Pesttell K.Е., Ducruet A.P., Wipf P., et al. Oncogene., 2002. V.19. P.6607], и особенно нафтохинон NSC 95397 из National Cancer Institute library [Lazo J.S., Nemoto K., Pestell K.E. et al., Mol. Pharmacol., 2002. V.61. P.720] обладают способностью эффективно ингибировать Cdc25A фосфатазу.
Было показано, что пара-нафтохиноны, 7-аминохинолин-5,8-хинон и замещенные изохинолин-5,8-хиноны являются коровыми структурами для синтеза потенциальных ингибиторов Cdc25 фосфатаз; примером таких производных является соединение DA3003-1 [Lazo J.S., Nemoto K., Pestell K.E. et al., Mol. Pharmacol., 2002. V.61. Р.720; Wipf P., Joo В., Nguyen Т., Lazo J.S. Org. Biol. Chem., 2004, V.2. P.2173].
Известно, что производные хинона инактивируют Cdc25B фосфатазу либо по реакции Михаэля, либо за счет окисления каталитически важного остатка цистеина [Brisson M., Nguyen Т., Wipf P., et al, Mol. Pharmocol., 2005. V.68. P.1810-1820].
Известно, что некоторые замещенные производные хинолин-5,8-хинона по положениям C(2), C(3) и C(4) являются эффективными ингибиторами Cdc25B фосфатазы и роста раковых клеток [Cossy J., Belotti D., Brisson M., et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287].
Коровая структура пара-хинона входит в состав 14-ти широко используемых в клинике лекарственных препаратов и представляется фундаментальной для синтеза новых потенциальных ингибиторов ферментов, которые являются мишенями в антираковой терапии [Cossy J., Belotti D., Brisson M., et al. Bioorg. Med. Chem., 2006. V.14. P.6283-6287].
В последнее время был получен ряд фторированных производных 1,4-нафтохинона, содержащих аминокислотные фрагменты, общей формулы (II):
,
обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре (патент RU 2443678 C1, 27.02.2012).
Кроме того, описаны фторированные производные 1,4-нафтохинона общей формулы (III):
где: 1) R1=NHC(СН3)3, R2, R3=F; 2) R1=NHCH2CH2SCH3, R2, R3=F; 3) R1=N(CH2CH3)2, R2, R3=F; 4) R1=N(CH2CH2)2O, R2, R3=F; 5) R1=NHCH2CH2CH2CH3, R2, R3=F; 6) R1=NHC6H5, R2, R3=F; 7) R1=N(CH3)CH2CH2OH, R2, R3=F; 8) R1, R3=NHCH2CH2CH2CH3, R2=F; 9) R1=N(CH2CH2OH)2, R2, R3=F; 10) R1=NHC6H5, R2=СН3, R3=F; 11) R1=ОСН3, R2, R3=F; 12) R1=NH(СН2)2SS(СН2)2HN(2-пентафтор-1,4-нафтохинонил), R2, R3=F; 13) R1=NHC2H5, R2, R3=F; 14) R1=N+C5H5, R2=O-, R3=F; 15) R1=NHCH2CH2OH, R2, R3=F; 16) R1, R2=ОСН3, R3=F, обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре. Эти соединения получают взаимодействием гексафтор-1,4-нафтохинона или 2-метилпентафтор-1,4-нафтохинона (для соединения 10) с азот- и кислородцентрированными нуклеофилами (патент RU 2387635 C2, 27.04.2010).
Соединения с общими формулами (II) и (III) в меньшей степени подвержены реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса.
В литературе не описаны примеры нафтохинонов, содержащих атомы фосфора. В то же время такие соединения могут обладать другими активностями по сравнению с ранее описанными полифторированными нафтохинонами.
Ближайшим к заявляемым фосфорсодержащим фторированным производным 1,4-нафтохинона - прототипом, является тетрафторированный 2-(2-меркаптоэтанол)-3-метил-5,6,7,8-тетрафтор-1,4-нафтохинон (фторированный-Cpd 5), который обладает более высокой активностью в подавлении роста Hep3B клеток, чем исходный Cpd 5 (Ham W.H. et al., 2004, Bioorg. Med. Chem. Lett., 2004, V.14. P.4103-4105). Фторированный Cpd 5 был получен по реакции 2-метил-3,5,6,7,8-пентафтор-1,4-нафтохинона с 2-меркаптоэтанолом.
Недостатками известного фторированного Cpd 5 соединения является его высокая токсичность, поскольку он содержит атомы серы - тиоловые группы, которые легко окисляются (подвергаются окислительному стрессу) с образованием токсичных радикалов.
Технической задачей изобретения является создание фосфорсодержащих фторированных производных 1,4-нафтохинона, обладающих цитотоксической активностью по отношению к раковым клеткам человека в культуре, а также в меньшей степени подверженных реакциям с образованием токсичных для клеток радикальных производных в процессах окислительного стресса.
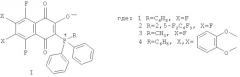
Поставленная задача достигается предлагаемыми фосфорсодержащими фторированными производными 1,4-нафтохинона общей формулы (I), где:
Предлагаемые соединения получают взаимодействием гексафтор-1,4-нафтохинона (для 1-3) с трифенилфосфаном (для 1), (2,5-дифторфенил)дифенилфосфаном (для 2), метилдифенидфосфаном (для 3), или хинона I (1) с пирокатехином (для 4) и характеризуют с помощью методов масс-спектроскопии высокого разрешения, спектров ЯМР 1Н и 19F.
Фосфор-содержащие нафтохиноны могут быть более перспективными соединениями для направленного подавления развития раковых клеток, синтезирующих в повышенных количествах онкогенные протеинкиназы и фосфатазы; они обладают заметными антиокислительными свойствами.
В таблице 1 представлены заявляемые фосфорсодержащие фторированные производные 1,4-нафтохинона и их структурные формулы. Значения масс молекулярных ионов представлены в таблице 2.
Изобретение иллюстрируется следующими примерами конкретного получения предлагаемых соединений.
Пример 1.
Получение 5,6,7,8-тетрафтор-1,4-диоксо-3-(трифенилфосфоний)-1,4-дигидро-2-нафтолята (1).
Смесь 0,048 г (0,180 ммоль) гексафтор-1,4-нафтохинона, 0,05 г (0,187 ммоль) трифенилфосфана и 0,75 мл метанола перемешивали 48 ч при комнатной температуре. Осадок отделяли на центрифуге, промывали метанолом (2×0,5 мл), сушили в вакууме (0,5 мм рт.ст.) и получали 0,048 г (53%) соединения 1. После кристаллизации сухого остатка из этанола получали еще 0,034 г продукта. Общий выход составил 0,082 г (90%), ярко-желтые кристаллы, разлагающиеся при нагревании без плавления.
Пример 2.
Получение 3-((2,5-дифторфенил)дифенилфосфоний)-5,6,7,8-тетрафтор-1,4-диоксо-1,4-дигидро-2-нафтолята (2).
Смесь 0,076 г (0,285 ммоль) гексафтор-1,4-нафтохинона, 0,085 г (0,285 ммоль) (2,5-дифторфенил)дифенилфосфана и 1,3 мл метанола перемешивали 48 ч при комнатной температуре. Осадок отделяли на центрифуге, промывали метанолом (2×0,2 мл) и сушили в вакууме (0,5 мм рт.ст.) и получали 0,096 г (62%) соединения 2, ярко-желтые кристаллы, разлагающиеся при нагревании без плавления.
Пример 3.
Получение 5,6,7,8-тетрафтор-3-(метилдифенилфосфоний)-1,4-диоксо-1,4-дигидро-2-нафтолята (3).
Смесь 0,100 г (0,376 ммоль) гексафтор-1,4-нафтохинона, 0,075 г (0,376 ммоль) дифенилметилфосфана и 1,5 мл метанола перемешивали 48 ч при комнатной температуре. Растворитель отгоняли, остаток кристаллизовали из этанола (1 мл) и очищали методом ТСХ (Sorbfil, хлороформ, RF 0.2). Получали 0,05 г (30%) соединения 3, ярко-желтые кристаллы, т.пл. 179°C.
Пример 4.
Получение 6,11-дифтор-7,10-диоксо-9-(трифенилфосфоний)-7,10-дигидробензо[b]дибензо[b,е][1,4]диоксин-8-олята (4).
Смесь 0.05 г (0.101 ммоль) бетаина 1, 0.011 г (0.101 ммоль) пирокатехина, 0.028 г (0.203 ммоль) карбоната калия и 1.5 мл ДМСО перемешивали 6 ч при комнатной температуре. Добавляли воду (3 мл), осадок отделяли на центрифуге, промывали водой и сушили на воздухе. Методом ТСХ (Sorbfil, хлороформ-хлористый метилен, 1:1; RF 0.2) выделили 0.048 г (83%) соединения 4, ярко-желтые кристаллы, разлагающиеся при нагревании без плавления.
Пример 5.
Проводили испытание влияния предлагаемых соединений на рост различных линий раковых клеток в культуре. Клетки аденокарциномы молочной железы человека MCF-7 выращивали в среде IMDM, клетки миеломы человека (линия RPMI 6228) выращивали с использованием среды RPMI 1640 с 40 мкг/мл гентамицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% CO2 в 96-луночных планшетах.
Для сравнения относительной активности всех соединений в одинаковых условиях их растворяли в ДМСО в высокой концентрации (10 мг/мл), а затем стоковый раствор разбавляли ДМСО для получения серии растворов с нужной концентрацией. При использовании клеток аденокарциномы молочной железы после формирования 50-70% монослоя в культуральную среду добавляли исследуемые препараты фосфорсодержащих фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема) и следили за ростом клеточной культуры в течение 3-х суток.
При использовании клеток линии миеломы человека, которая является суспензионной культурой, клетки рассевали в 96-луночный планшет в количестве 100 мкл на лунку, концентрация 2×105 клеток/мл; через 12-24 часа добавляли исследуемые препараты фосфорсодержащих фторированных производных 1,4-нафтохинона (объем добавляемых реагентов составлял 1/100 общего объема культуральной среды, количество ДМСО составляло 1% от конечного объема смеси в лунке).
Действие фосфорсодержащих фторированных производных 1,4-нафтохинона на клетки MCF-7 и RPMI 6228 в культуре и подавление их роста проводили с помощью теста, основанного на способности митохондриальных дегидрогеназ конвертировать водорастворимый 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2H-тетразолиум бромид (МТТ) в формазан (МТТ-тест), который кристаллизуется внутри клетки. Так как у нежизнеспособных клеток ферменты не функционируют и отсутствуют кофакторы этого превращения, они не окрашиваются МТТ. Образовавшийся осадок формазана в жизнеспособных клетках растворяли в изопропаноле и его количество определяли спектрофотометрически по поглощению на длине волны λ=560 нм.
В качестве положительного контроля использовали клетки, которые выращивали в отсутствие фосфорсодержащих фторированных производных 1,4-нафтохинона. Было установлено, что ДМСО в использованной концентрации (1%) заметного влияния на рост раковых клеток не оказывает. Кроме того, установлено, что исследуемые соединения не влияют на окраску клеток в МТТ-тесте, если они добавлены в лунки с клетками непосредственно перед проведением теста. Для оценки относительной активности всех предлагаемых фосфорсодержащих соединений в подавлении роста раковых клеток были исследованы зависимости количества живых клеток от концентрации этих соединений. В качестве примера на фиг.1 приведены данные ингибирования роста RPMI 6228 клеток для четырех исследованных соединений. Определение концентрации соединений (C50), при которой происходит подавление (ингибирование) роста клеток на половину (50%), проводили с помощью МТТ-теста. На фиг.1 приведены данные для соединения 1 (5,6,7,8-тетрафтор-1,4-диоксо-3-(трифенилфосфоний)-1,4-дигидро-2-нафтолят), соединения 2 (3-(2,5-дифторфенил)дифенилфосфоний)-5,6,7,8-тетрафтор-1,4-диоксо-1,4-дигидро-2-нафтолят), соединения 3 (5,6,7,8-тетрафтор-3-(метилдифенилфосфоний)-1,4-диоксо-1,4-дигидро-2-нафтолят) и соединения 4 (6,11-дифтор-7,10-диоксо-9-(трифенилфосфоний)-7,10-дигидробензо[b]дибензо[b,е][1,4]диоксин-8-олят). Количество живых клеток в контроле (инкубация клеток без соединений) принимали за 100%.
С помощью таких кривых определяли концентрацию соединения (C50), при которой происходит подавление (ингибирование) роста клеток наполовину. Данные по влиянию заявляемых соединений (ингибирование на 50%, C50) на рост раковых клеток миеломы человека (RPMI 6228) и аденокарциномы человека (MCF-7), а также контрольных клеток мышиных фибробластов линии LMTK после инкубации в течение 48 ч, которые приведены в табл.3.
Из таблицы 3 видно, что предлагаемые соединения подавляют рост раковых клеток миеломы (RPMI 6228) и аденокарциномы человека (MCF-7) в культуре при концентрациях 3,4-50,3 мкМ. Три фосфорсодержащих фторированных производных 1,4-нафтохинона (соединения 1-3) демонстрирует близкие значения C50 (3,4-7,7 мкМ) в случае двух типов раковых клеток (RPMI 6228 и MCF-7), в то время как соединение 4 ингибируют рост этих клеток в более высоких концентрациях (40-50,3 мкМ). Все соединения проявляют ингибирование клеток линии RPMI 6228 при меньших концентрациях (3,4-40,0 мкМ), чем MCF-7 (5,2-50,5 мкМ) клеток (табл.3).
Из табл.3 также видно, что подавление роста клеток на 50% с помощью соединений 1-4 происходит при концентрациях в 1,4-3,8 раз более низких, чем клеток фибробластов. Кроме того, эти соединения проявляют антиоксидантные свойства.
Таким образом, предлагаемые новые фосфорсодержащие фторированные производные 1,4-нафтохинона являются эффективными ингибиторами роста раковых клеток и являются потенциально перспективными для их использования в антираковой терапии.
| Таблица 1 | ||
| 1 | 5,6,7,8-Тетрафтор-1,4-диоксо-3-(трифенилфосфоний)-1,4-дигидро-2-нафтолят | |
| 2 | 3-((2,5-Дифторфенил)дифенилфосфоний)-5,6,7,8-тетрафтор-1,4-диоксо-1,4-дигидро-2-нафтолят | |
| 3 | 5,6,7,8-Тетрафтор-3-(метилдифенилфосфоний)-1,4-диоксо-1,4-дигидро-2-нафтолят | |
| 4 | 6,11-Дифтор-7,10-диоксо-9-(трифенилфосфоний)-7,10-дигидробензо[b]дибензо[b,e][1,4]диоксин-8-олят | |
| Таблица 2. | ||
| 1 | 5,6,7,8-Тетрафтор-1,4-диоксо-3-(трифенилфосфоний)-1,4-дигидро-2-нафтолят | Найдено [M]+ 506.0685. C28F4H15O3P. Вычислено M 506.0690. |
| 2 | 3-((2,5-Дифторфенил)дифенилфосфоний)-5,6,7,8-тетрафтор-1,4-диоксо-1,4-дигидро-2-нафтолят | Найдено [M]+ 542.0490. C28F6H13O3P. Вычислено M 542.0501. |
| 3 | 5,6,7,8-Тетрафтор-3-(метилдифенилфосфоний)-1,4-диоксо-1,4-дигидро-2-нафтолят | Найдено [M]+ 444.0535. C23F4H13O3P. Вычислено M 444.0533. |
| 4 | 6,11-Дифтор-7,10-диоксо-9-(трифенилфосфоний)-7,10-дигидробензо[b]-дибензо[b,е][1,4]-диоксин-8-олят | Найдено [M+H]+ 577.1310. C34F2H19O5P. Вычислено M+H 577.1011. |
| Таблица 3. | ||||
| Тип клеток Номер соединения | Величина С50, мкМ | Отношение С50 для LMTK и раковых клеток | ||
| RPMI 6228 | MCF-7 | LMTK | ||
| 1 | 3,4±0,3 | 5,2±0,5 | 12,8±1,0 | 2,5-3,8 |
| 2 | 3,7±0,3 | 7,9±0,7 | 12,9±1,1 | 1,6-3,5 |
| 3 | 4,8±0,4 | 7,7±0,6 | 11,0±1,0 | 1,4-2,3 |
| 4 | 40±3,5 | 50,3±5,0 | 80,0±7,3 | 1,6-2,0 |
Фосфорсодержащие фторированные производные 1,4-нафтохинона общей формулы (I): обладающие цитотоксической активностью по отношению к раковым клеткам человека в культуре.