Новые альдегиды и нитрилы, получаемые из изофорона, и их применение в парфюмерии
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I), которые могут найти применение в качестве душистого соединения или агента, маскирующего запах. В формуле (I) R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; Z обозначает CN или CHO; и имеется не более одной из пунктирных связей. При этом должны соблюдаться следующие условия: если Z обозначает СНО и имеется одна из пунктирных связей, R не обозначает атом водорода, и если присутствует пунктирная связь между углеродами Ca и Cb, R не обозначает группу =СН2. Изобретение относится также к способу получения соединения формулы (I), его применению в качестве душистого соединения или агента, маскирующего запах, и парфюмерной композиции. 5 н. и 5 з.п. ф-лы, 1 табл., 10 пр.
Реферат
Настоящее изобретение относится к новым альдегидам и нитрилам, получаемым из изофорона, обладающим особым ароматом, а также к применению этих соединений в парфюмерии.
Термин «парфюмерия» используется в данном описании не только для обозначения парфюмерии в традиционном понимании этого термина, но также для обозначения других областей, в которых запах продуктов имеет важное значение. Речь может идти о парфюмерных композициях в обычном понимании этого слова, таких как душистые основы или концентраты, одеколоны, туалетная вода, духи и аналогичные продукты; о композициях для местного нанесения - в частности, косметических композициях - таких как кремы для лица и тела, тальковые пудры, масла для волос, шампуни, лосьоны для волос, соли и масла для ванн, гели для душа и ванны, туалетные мыла, антиперспиранты и дезодоранты для тела, лосьоны и кремы для бритья, мыла, кремы, зубные пасты, ополаскиватели для полости рта, помады и аналогичные продукты; и о средствах для уборки дома, таких как смягчающие средства, детергенты, моющие средства, дезодоранты для помещений и аналогичные продукты.
Термины «душистое вещество», «ароматное», «пахучее» используются в описании как взаимозаменяемые в отношении любого органолептического соединения, стимулирующего приятные обонятельные ощущения.
Под выражением «маскировать» или «маскирующий» понимают снижение или устранение восприятия плохого запаха или плохого вкуса, генерируемого одной или несколькими молекулами, входящими в композицию продукта.
Многочисленные производные циклопентанового типа, в частности соединения, включающие скелет камфолена, или циклопентаноны, описаны в литературе в связи с их интересными ольфактивными свойствами. Например, в заявках на патент US 5073538, ЕР 0146859, US 4477683 и Bruns et al. (Bruns K.; Weber U.; Development in food science, 1998, 18 (F&F), 767-776) описаны производные 2,4,4-триметилциклопентана, некоторые из которых представляют интерес для использования в парфюмерной промышленности. Кроме того, в литературе описано очень мало соединений типа нитрилов или альдегидов, производных 2,4,4-триметилциклопентана (US 3931143, US 4477683 и Wheler O.H.; De Rodriguez E.G.; J.Org.Chem., 1964, 29(3), 718-721), и ни в одном из этих документов нет описания их ольфактивных свойств.
Вообще, в парфюмерной промышленности существует постоянная потребность в новых молекулах душистых веществ для того, чтобы расширить гамму нот, предлагаемых парфюмерам для создания их продукции. Кроме того, эта потребность возрастает по мере того, как парфюмерная промышленность сталкивается с ужесточением международных регламентов, а также с осознанием проблем окружающей среды и с ростом требований со стороны потребителей. Таким образом, цель настоящего изобретения заключается в том, чтобы предложить новые душистые и/или пахучие соединения.
Настоящее изобретение относится к новым альдегидам и нитрилам, получаемым из изофорона. Преимущество этих соединений заключается в том, что их получение надежно и недорого.
Так, настоящее изобретение относится к соединениям общей формулы (I), представленной ниже:
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2;
Z обозначает CN или CHO; и
имеется не более одной из пунктирных связей;
при условии, что:
если Z обозначает СНО и имеется одна из пунктирных связей, тогда R не обозначает атом водорода, и
если имеется пунктирная связь между углеродами Ca и Cb, тогда R не обозначает группу =СН2.
Под термином «С1-С6 алкил» в контексте настоящего изобретения подразумевают любой одновалентный радикал, являющийся производным от углеродной насыщенной цепи, линейной или разветвленной, содержащей 1-6 атомов углерода, в частности метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, трет-бутил, пентил и гексил. Предпочтительными алкилами являются метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, н-пентил.
Под термином «С2-С6 алкенил» в контексте настоящего изобретения подразумевают любой одновалентный радикал, являющийся производным углеродной цепи, линейной или разветвленной, содержащей 2-6 атомов углерода, включающей, по меньшей мере, одну двойную связь, в частности этенил, н-пропенил, изо-пропенил, н-бутенил, изо-бутенил, трет-бутенил, н-пентенил и н-гексенил. Предпочтительными алкенилами являются этенил, н-пропенил, изо-пропенил, н-бутенил, изо-бутенил, и н-пентенил.
Настоящее изобретение относится также к стереоизомерам формулы (I), в частности к диастереоизомерам формулы (I), а также к смесям этих изомеров в любых соотношениях.
В частности, настоящее изобретение относится к соединениям общей формулы (Ia):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2;
Z обозначает CN или CHO;
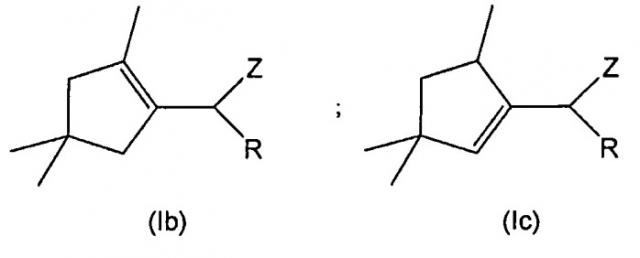
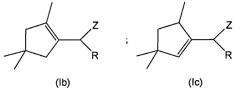
к соединениям общей формулы (Ib) и (Ic):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2;
Z обозначает группу CN или CHO; и
при условии, что, если Z обозначает СНО, тогда R не является атомом водорода;
к соединениям формулы (Ib) и (Ic), а также к соединениям общей формулы (Id):
в которой:
R обозначает атом водорода, С1-С6 алкил или С2-С6 алкенил;
Z обозначает CN или CHO; и
при условии, что, если Z обозначает СНО, тогда R не является атомом водорода.
Согласно первой форме осуществления настоящее изобретение относится к соединениям общей формулы (I'):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, алкил С1-С6 или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2; и имеется не более одной из пунктирных связей;
при условии, что, при наличии пунктирной связи между углеродами Са и Cb, R не является группой =СН2.
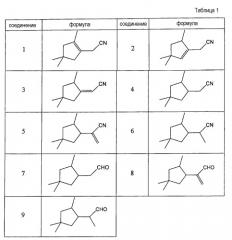
Особенно интересными соединениями формулы (I') являются соединения (1)-(6), представленные в таблице 1.
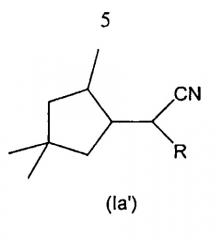
Первый вариант этого варианта осуществления относится к соединениям формулы (Ia'):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, С1-С6 алкил или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2.
Второй вариант относится к соединениям формулы (Ib'):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, С1-С6 алкил или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2.
Третий вариант этой формы осуществления относится к соединениям формулы (Ic'):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, С1-С6 алкил или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2.
Наконец, последний вариант этой формы осуществления относится к соединениям формулы (Id'):
в которой:
R обозначает атом водорода, С1-С6 алкил или С2-С6 алкенил; предпочтительно R обозначает атом водорода или С1-С6 алкил; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил или изо-пропил; еще более предпочтительно R обозначает атом водорода или метил.
Согласно второй форме осуществления настоящее изобретение относится также к соединениям общей формулы (I”):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, С1-С6 алкил или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2, и имеется не более одной из пунктирных связей;
при условии, что если имеется одна из пунктирных связей, тогда R не является атомом водорода, и
если имеется пунктирная связь между углеродами Са и Cb, тогда R не является группой =СН2.
Особенно интересными соединениями формулы (I”) являются соединения (7)-(9), представленные в таблице 1.
Первый вариант этой формы осуществления относится к соединениям формулы (Ia”):
в которой:
R обозначает атом водорода, С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает атом водорода, С1-С6 алкил или =СН2; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает атом водорода, метил или =СН2.
Второй вариант относится к соединениям формулы (Ib”):
в которой:
R обозначает С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает С1-С6 алкил или =СН2; более предпочтительно R обозначает метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает метил или =СН2.
Третий вариант этого варианта осуществления относится также к соединениям формулы (Ic”):
в которой:
R обозначает С1-С6 алкил, С2-С6 алкенил или =СН2; предпочтительно R обозначает С1-С6 алкил или =СН2; более предпочтительно R обозначает метил, этил, н-пропил, изо-пропил или =СН2; еще более предпочтительно R обозначает метил или =СН2.
Наконец, последний вариант этой формы осуществления относится к соединениям формулы (Id”):
в которой:
R обозначает С1-С6 алкил или С2-С6 алкенил; предпочтительно R обозначает С1-С6 алкил; более предпочтительно R обозначает метил, этил, н-пропил или изо-пропил; еще более предпочтительно R обозначает метил.
Более конкретно, изобретение относится к соединениям формулы (I), представленным в таблице 1.
Изобретение включает все энантиомеры и диастереоизомеры соединений формулы (I), индивидуальные или в форме смеси. Наличие в структуре соединений формулы (I) центров асимметрии приводит к существованию энантиомерных форм каждого из этих соединений. Изобретение включает соединения, представленные общей формулой (I), в форме смесей энантиомеров в изменяемых соотношениях, в частности рацемические смеси. Изобретение включает также соединения формулы (I) в форме только одного энантиомера. Получение смесей энантиомеров или оптически чистых форм осуществляют способами, известными специалисту, используя, например, оптически обогащенные или оптически чистые исходные продукты.
Преимущество соединений формулы (I) заключается в том, что способ их получения надежен и недорог. Так, соединения формулы (I) могут быть получены из изофорона.
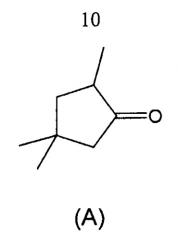
Настоящее изобретение относится также к способу получения соединения формулы (I), включающему стадию, заключающуюся во взаимодействии соединения формулы (А):
с диэтилфосфонодиалкилацетонитрилом формулы RCH(CN)PO(OC2H5)2, в которой R обозначает атом водорода, С1-С6 алкил или С2-С6 алкенил; предпочтительно R обозначает атом водорода или С1-С6 алкил; более предпочтительно R обозначает атом водорода, метил, этил, н-пропил или изо-пропил; еще более предпочтительно R обозначает атом водорода или метил; или с алкилцианоацетатом формулы NCCH2COOR', в которой R' обозначает С1-С4 алкил; предпочтительно R' обозначает метил.
На первой стадии получают эпоксид изофорона из изофорона путем эпоксидирования по Вейц-Шефферу. Перегруппировка эпоксида изофорона в кислой среде позволяет получить 2,4,4-триметилциклопентанон (А).
Согласно первому варианту осуществления соединения формулы (Ia') и (Id') получают согласно схеме 1:
При действии диэтилфосфоноалкилацетонитрила формулы RCH(CN)PO(OC2H5)2, в которой R имеет указанные выше значения, на циклопентанон формулы (А) получают соединения формулы (Id'). Эту реакцию преимущественно осуществляют в присутствии основания, такого как литийорганическое соединение, предпочтительно бутиллитий (BuLi), в аполярном растворителе, таком как тетрагидрофуран. Гидрирование соединений формулы (Id') позволяет получить соединения формулы (Ia'), в которой R не может обозначать =СН2. Гидрирование осуществляют в условиях, хорошо известных специалисту, например в автоклаве в атмосфере водорода в присутствии катализатора - 5%-ного палладия на угле.
Согласно второй форме осуществления соединения формулы (Ib') и (Ic'), а также соединения (5) и (6) получают, следуя схеме 2:
На первой стадии циклопентанон формулы (А) конденсируют с алкилцианоацетатом формулы NCCH2COOR', в которой R' обозначает С1-С4 алкил, предпочтительно метил, с образованием соединения формулы (В). Реакцию конденсации осуществляют, например, в присутствии уксусной кислоты (АсОН) и ацетата аммония (AcONH4) в апротонном аполярном растворителе, таком как циклогексан, при температуре кипения с обратным холодильником.
Затем согласно первому варианту соединение (В) направляют на декарбоксилирование, необязательно с последующим гидрированием и/или алкилированием с получением соединений формулы (Ia'), (Ib') или (Ic'). Реакцию декарбоксилирования осуществляют преимущественно в присутствии галогенида щелочного металла, такого как хлорид лития, в полярном растворителе, таком как N-метилпирролидон. Гидрирование осуществляют в условиях, хорошо известных специалисту, например в автоклаве в атмосфере водорода в присутствии катализатора - 5%-ного палладия на угле. Алкилирование может быть осуществлено с помощью алкилирующего агента, выбранного из алкилбромида, алкилиодида или алкилхлорида, и основания, такого как, например, диизопропиламид лития или трет-бутилат калия. Подходящим растворителем для этой реакции может служить аполярный растворитель, такой как тетрагидрофуран, или полярный апротонный растворитель, такой как диметилформамид.
Согласно второму варианту восстанавливают соединение формулы (В) с последующим дегидратированием и, необязательно, гидрированием и получают соединения (5) и (6). Восстановление преимущественно осуществляют с использованием гидрида, такого как NaBH4. Реакцию гидрирования осуществляют в условиях, хорошо известных специалисту, например в автоклаве в атмосфере водорода в присутствии катализатора - 5%-ного палладия на угле.
Как правило, соединения формулы (I”) получают восстановлением при умеренных условиях соответствующих нитрильных функциональных групп соединений формулы (I') до альдегидных функциональных групп. Это восстановление можно осуществить, например, в присутствии гидрида диизобутилалюминия (Dibal) в аполярном растворителе, таком как толуол.
В связи с их пахучими свойствами соединения формулы (I) находят разнообразное применение, частности, в парфюмерии и неограниченно в косметике, а также в качестве средств для уборки.
Таким образом, изобретение относится также к применению, по меньшей мере, одного соединения формулы (I) согласно изобретению в качестве душистого агента или соединения, в качестве агента, маскирующего запах, или в качестве агента, нейтрализующего запах, индивидуального или в форме смеси с одним или несколькими другими душистыми соединениями, известными специалисту, которые специалист сам подбирает в зависимости от желаемого эффекта. Дополнительным или дополнительными душистыми агентами могут быть соединения формулы (I) или другие душистые агенты, известные специалистам.
По этим же причинам изобретение относится также и к способу ароматизации базового продукта, включающему добавление соединения согласно изобретению к базовому продукту. Соединение согласно изобретению может быть добавлено в индивидуальном виде или в смеси с одним или несколькими другими душистыми соединениями, известными специалисту, которые специалист сам выбирает в зависимости от желаемого эффекта. Дополнительным или дополнительными душистыми агентами могут быть соединения формулы (I) или другие душистые средства, известные специалисту. Упомянутым базовым продуктом может быть, в частности, парфюмерная композиция, в частности парфюмерная основа или парфюмерный концентрат, одеколон, туалетная вода или духи; косметическая композиция, в частности крем для лица и для тела, тальковая пудра, масло для волос или для тела, шампунь, лосьон для волос, соль для ванны, масло для ванны, гель для душа, гель для ванны, мыло туалетное, антиперспирант для тела, дезодорант для тела, лосьоны, крем для бритья, мыло для бритья, крем, зубная паста, ополаскиватель для полости рта или помада; или средство для уборки дома, в частности смягчающее средство, детергент, моющее средство или дезодорант для помещений.
Изобретение относится также к композициям, включающим базовый продукт и эффективное количество одного или нескольких соединений формулы (I) согласно изобретению.
Речь может идти о душистой композиции как таковой или о композиции, в которой душистый агент используют для маскировки или нейтрализации определенных запахов.
Базовый продукт легко подбирается специалистом в зависимости от заданного состава и, следовательно, от заданного использования, в отношении которых обычные компоненты, такие как растворитель(и) и/или добавка(и), хорошо известны.
Эффективное количество соединений формулы (I) согласно изобретению, вводимое в композицию, зависит от природы композиции, достижения желаемого запаха и от природы других пахучих или нет соединений, необязательно присутствующих в композиции, и может быть легко определено специалистом, зная, что оно варьируется в широком интервале от 0,1 до 99 мас.%, более конкретно от 0,1 до 50 мас.%, в частности от 0,1 до 30 мас.%.
Соединения формулы (I) согласно изобретению могут быть использованы как таковые или могут быть введены или нанесены на инертный материал-носитель, или этот носитель может содержать другие активные ингредиенты конечной композиции. Могут быть использованы самые разные материалы-носители, включая, например, полярные растворители, масла, жировые вещества, тонко измельченные твердые продукты, циклодекстрины, мальтодекстрины, камедь, смолы и любой другой материал-носитель, известный для такого рода композиций.
Таким образом, изобретение относится также к применению соединений формулы (I) для приготовления душистой композиции или создания душистого продукта, предназначенных для областей применения, описанных выше, в частности, в парфюмерии, косметике, например для приготовления шампуней или мыл, и для создания средств для уборки дома, таких как смягчающие или моющие средства.
Изобретение относится, более конкретно, к парфюмерной композиции, в частности к парфюмерной основе или парфюмерному концентрату, одеколону, туалетной воде или духам, включающим, по меньшей мере, одно соединение формулы (I) или композицию, содержащую, по меньшей мере, одно соединение формулы (I).
В частности, изобретение относится также и к косметической композиции, например, такой как крем для лица и для тела, тальковая пудра, масло для волос или для тела, шампунь, лосьон для волос, соль для ванны, масло для ванны, гель для душа, гель для ванны, туалетное мыло, антиперспирант для тела, дезодорант для тела, лосьоны, крем для бритья, мыло для бритья, крем, зубная паста, ополаскиватель для полости рта, помада, включающей, по меньшей мере, одно соединение формулы (I) или, по меньшей мере, одну композицию, содержащую, по меньшей мере, одно соединение формулы (I). Другим объектом изобретения является способ косметической обработки или косметического ухода с профилактической или другой целью, использующий, по меньшей мере, одно соединение формулы (I) или, по меньшей мере, одну композицию, содержащую, по меньшей мере, одно соединение формулы (I).
Изобретение относится также к средству для уборки дома, в частности, смягчающему, детергентному, моющему средству, дезодоранту для помещений, включающему, по меньшей мере, одно соединение формулы (I).
Соединения согласно изобретению могут быть использованы, индивидуально или в комбинации, как таковые или могут быть введены или нанесены на инертный материал-носитель, или этот носитель может содержать другие активные ингредиенты в конечной композиции. Могут быть использованы самые разные материалы носителя, включая, например, полярные растворители, масла, жировые вещества, тонко измельченные твердые продукты, циклодекстрины, мальтодекстрины, камедь, смолы и любой другой материал-носитель, известный для такого рода композиций.
Следующие примеры лучше иллюстрируют различные способы получения новых соединений согласно изобретению, а также их применение и их интерес. Эти примеры представлены только с целью иллюстрации и не могут рассматриваться как ограничивающие объем изобретения.
Пример 1: Получение 2-(2,4,4-триметилциклопент-1-енил)ацетонитрила (1) и 2-(3,3,5-триметилциклопент-1-енил)ацетонитрила (2)
Помещают в сосуд циклопентанон А, 1,5 экв. метилцианоацетата, 1 экв. уксусной кислоты и 10 молярных % ацетата аммония в циклогексане. Реакционную среду кипятят с обратным холодильником для удаления образующейся воды с помощью аппарата типа Дина-Старка. После кипячения в течение ночи конверсия А достигает удовлетворительного значения (>90%) и тогда дают реакционной среде вернуться к комнатной температуре. Промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт В перегоняют при пониженном давлении.
Т кип.=80°С/0,3 Торра
Метил-2-циано-2-(2,4,4-триметилциклопентилиден)ацетат В помещают в сосуд с 2 экв. хлорида лития в смесь 98:2 NMP (N-метилпирролидона) и воды. Перемешивают при 150°С. После 3 часов реакционную среду охлаждают до комнатной температуры, затем выливают в 1% раствор HCl. Перемешивают несколько минут, затем экстрагируют два раза с помощью МТВЭ (метил-трет-бутиловый эфир). Объединенные органические слои промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт перегоняют при пониженном давлении. Получают смесь 70:30 2-(2,4,4-триметилциклопент-1-енил)ацетонитрила и 2-(3,3,5-триметилциклопент-1-енил)ацетонитрила.
Ткип.=78-82°С/6 Торр
Ольфактивное описание: аромат пряный с нотой тмина, древесный, цитрусовый, сильный
Мажорный изомер:
1Н-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,08 (с, 6Н), 1,63 (с, 3Н), 2,15 (с, 2Н), 2,25 (с, 2Н), 3,08 (с, 2Н).
13С-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,43, 19,82, 30,07, 30,19, 50,99, 53,84, 121,95, 136,53, 136,54.
МС [e/m (%)]: 149 (M+, 45), 135 (10), 134 (100), 109 (43), 108 (15), 107 (27), 94 (21), 93 (66), 91 (26), 79(22), 77(18), 67 (16), 41 (14), 39 (13).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,02-1,04 (м, 3H), 1,08 (с, 6H), 1,10-1,20 (м, 2H), 1,95-2,05 (м, 1H), 3,01 (с, 2H), 5,56 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 14,40, 18,22, 28,52, 36,70, 40,77, 48,92, 118,08, 134,15, 139,95.
MC [e/m (%)]: 149 (M+, 53), 148 (22), 135 (11), 134 (94), 122 (10), 120 (12), 109 (26), 108 (35), 107 (48), 106 (22), 94 (38), 93 (48), 92 (15), 91 (27), 83 (100), 80 (19), 79 (27), 77 (23), 69 (37), 67 (21), 66 (30), 65 (22), 56 (20), 55 (33), 54 (10), 53 (15), 51 (11), 43 (10), 41 (41), 39 (31).
ИК (пленка, см-1): 759w, 840w, 931w, 1070w, 1159w, 1241w, 1315w, 1364м, 1415м, 1446м, 2249м, 2837м, 2866м, 2954с.
Пример 2: Получение 2-(2,4,4-триметилциклопентилиден)ацетонитрила (3)
В инертной атмосфере помещают 1,1 экв. диэтилфосфоноацетонитрила в ТГФ (тетрагидрофуране). К этому продукту по каплям прибавляют при температуре около 10°С 1,1 экв. раствора бутиллития в гексане. Затем перемешивают один час при комнатной температуре и после этого добавляют по каплям при температуре около 10°С 1 экв. циклопентанона А. Реакционную среду перемешивают несколько часов при комнатной температуре, затем выливают в 10%-ный раствор HCl. Водный слой экстрагируют три раза с помощью МТВЭ. Объединенные органические слои промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт перегоняют при пониженном давлении. Получают смесь 75:25 транс и цис изомеров 2-(2,4,4-триметилциклопентилиден)ацетонитрила.
Ткип.=85°С/6 Торр
Ольфактивное описание: аромат свежий, цитрусовый с нотой плодов цитрусовых, зеленый, сильный
Мажорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,99 (с, 3H), 1,12 (с, 6H), 1,20-1,32 (м, 2H), 1,72-1,95 (м, 1H), 2,23-2,61 (м, 1H), 2,76-2,82 (м, 1H), 5,12 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,88, 28,01, 29,37, 37,84, 39,22, 48,59, 49,41, 91,17, 117,93, 178,84.
MC [e/m (%)]: 149 (M+, 47), 148 (21), 135 (11), 134 (90), 122 (11), 120 (12), 109 (22), 108 (34), 107 (42), 106 (18), 95 (10), 94 (35), 93 (49), 92 (15), 91 (22), 84 (10), 83 (100), 81 (15), 80 (19), 79 (26), 78 (10), 77 (20), 69 (33), 67 (19), 66 (29), 65 (21), 56 (22), 55 (35), 53 (15), 51 (11), 43 (10), 41 (40), 39 (30).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,89 (с, 3H), 1,14 (с, 6H), 1,20-1,32 (м, 2H), 1,72-1,95 (м, 1H), 2,23-2,61 (м, 1H), 2,76-2,82 (м, 1H), 5,24 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 19,93, 27,24, 28,88, 38,06, 38,58, 49,63, 50,18, 91,50, 117,93, 178,84.
MC [e/m (%)]: 149 (M+, 12), 135 (10), 134 (100), 109 (17), 107 (11), 94 (20), 93 (82), 91 (21), 79 (20), 77 (14), 41 (12).
ИК (пленка, см-1): 770w, 795м, 809с, 880w, 996w, 1268w, 1320w, 1369м, 1387м, 1420м, 1463с, 1637с, 2216с, 2870м, 2956с.
Пример 3: Получение 2-(2,4,4-триметилциклопентил)ацетонитрила (4)
Раствор, содержащий 1 эквивалент смеси соединений 1 и 2, полученной в примере 1, в толуоле и 5 мас.% 5%-ного палладия на угле помещают в автоклав, находящийся под давлением водорода 20 бар и при температуре 40°С. В конце реакции автоклав продувают азотом и раствор отфильтровывают через целит. Фильтрат концентрируют. Полученный сырой продукт в форме двух диастереоизомеров в соотношении 70:30 очищают перегонкой.
Т кип.=80°С/6 Торр
Ольфактивное описание: аромат зеленый, свежий с нотой цедры, сильный
Мажорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,92-1,08 (м, 3H), 1,04 (с, 6H), 1,15-1,42 (м, 2H), 1,60-1,87 (м, 3H), 2,23-2,44 (м, 3H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,82, 21,33, 31,54, 37,09, 39,94, 43,66, 47,86, 50,59, 119,42.
MC [e/m (%)]: 151 (M+, 0,3), 136 (39), 119 (20), 111 (21), 108 (16), 96 (13), 95 (100), 83 (67), 82 (26), 69 (30), 67 (18), 56 (11), 55 (25), 41 (28), 39 (14).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,92-1,08 (м, 3H), 1,04 (с, 6H), 1,15-1,42 (м, 2H), 1,60-1,87 (м, 3H), 2,23-2,44 (м, 3H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 16,16, 19,29, 30,43, 35,47, 37,09, 39,04, 46,71, 49,42, 120,36.
1H-ЯМР (200 МГц, CDCl3): (м.д.) 0,92-1,08 (м, 3H), 1,04 (с, 6H), 1,15-1,42 (м, 2H), 1,60-1,87 (м, 3H), 2,23-2,44 (м, 3H).
13C-ЯМР (50 МГц, CDCl3): (м.д.) 18,82, 21,33, 31,54, 37,09, 39,94, 43,66, 47,86, 50,59, 119,42.
MS [e/m (%)]: 151 (M+, 0,3), 136 (39), 119 (20), 111 (21), 108 (16), 96 (13), 95 (100), 83 (67), 82 (26), 69 (30), 67 (18), 56 (11), 55 (25), 41 (28), 39 (14).
1H-ЯМР (200 МГц, CDCl3): (м.д.) 0,92-1,08 (м, 3H), 1,04 (с, 6H), 1,15-1,42 (м, 2H), 1,60-1,87 (м, 3H), 2,23-2,44 (м, 3H). δ (м.д.) 16,16, 19,29, 30,43, 35,47, 37,09, 39,04, 46,71, 49,42, 120,36.
MC [e/m (%)]: 151 (M+, 0,2), 136 (25), 119 (13), 111 (29), 109 (10), 108 (20), 96 (27), 95 (100), 94 (11), 84 (16), 83 (69), 82 (31), 81 (11), 69 (52), 68 (10), 67 (20), 56 (24), 55 (29), 53 (11), 41 (34), 39 (17).
ИК (пленка, см-1): 931w, 1064w, 1316w, 1366м, 1379м, 14124, 1463м, 2246м, 2866м, 2930с, 2952с.
Пример 4: Получение 2-(2,4,4-триметилциклопентил)акрилонитрила (5)
1,1 экв. боргидрида натрия помещают в инертной атмосфере в этанол при температуре 10°С. К этой смеси добавляют по каплям метил-2-циано-2-(2,4,4-триметилциклопентилиден)ацетат В. Реакционную среду перемешивают в течение ночи при комнатной температуре, затем нейтрализуют ацетоном. Затем смесь выливают в холодный 10%-ный раствор HCl. Экстрагируют водный слой дважды с помощью МТВЭ. Объединенные органические фракции промывают раствором бикарбоната натрия, затем солевым раствором. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя получают 3-гидрокси-2-(2,4,4-триметилциклопентил)пропаннитрил в форме четырех диастереоизомеров в соотношении 11:13:23:53.
3-гидрокси-2-(2,4,4-триметилциклопентил)пропаннитрил помещают в инертной атмосфере в дихлорметан при температуре 10°С. К смеси добавляют 2,2 экв. DBU (диазабицикло[5.4.0]ундец-7-ена) и несколько кристаллов DMAP (4-диметиламинопиридина), затем по каплям добавляют 1,2 экв. трифторуксусного ангидрида. Реакционную среду перемешивают в течение ночи при комнатной температуре, затем выливают в воду. Водный слой экстрагируют один раз дихлорметаном. Объединенные органические фракции промывают водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт, полученный в форме двух диастереоизомеров в соотношении 70:30, очищают перегонкой при пониженном давлении.
Ткип.=35°С/0,3 Торр
Ольфактивное описание: аромат зеленый, фруктовый с нотой кожицы персика, меда.
Мажорный изомер:
1H-ЯМР (200 МГц, CDC13): δ (м.д.) 0,85 (д, J=7,2 Гц, 3H), 0,96-1,06 (м, 6H), 1,10-1,17 (м, 2H), 1,64-1,83 (м, 4H), 2,17-2,48 (м, 1H), 2,55-2,64 (м, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,94, 31,70, 40,84, 42,07, 46,98, 48,61, 49,20, 50,39, 203,41.
MC [e/m (%)]: 163 (M+, 1), 148 (21), 121 (10), 120 (12), 107 (10), 106 (40), 84 (100), 83 (15), 79 (21), 77 (13), 55 (16), 41 (21), 39 (13).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,85 (д, J=7,2 Гц, 3H), 0,96-1,06 (м, 6H), 1,10-1,17 (м, 2H), 1,64-1,83 (м, 4H), 2,17-2,48 (м, 1H), 2,55-2,64 (м, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 16,94, 30,64, 35,64, 36,46, 46,12, 48,51, 49,67, 50,65, 203,41.
MC [e/m (%)]: 163 (M+, 0,4), 148 (12), 106 (29), 84 (100), 79 (17), 77 (11), 69 (46), 55 (11), 41 (18), 39 (11).
ИК (пленка, см-1): 841w, 932с, 1078w, 1195w, 1294w, 1367м, 1378м, 1407w, 1461м, 1618м, 2222м, 2867м, 2953с.
Пример 5: Получение 2-(2,4,4-триметилциклопентил)пропаннитрила (6)
Раствор, содержащий 1 эквивалент 2-(2,4,4-триметилциклопентил)акрилонитрила 5 в толуоле и 5 мас.% 5%-ного палладия на угле, помещают в автоклав, находящийся под давлением водорода 20 бар и при температуре 40°С. В конце реакции автоклав продувают азотом и раствор отфильтровывают через целит. Фильтрат концентрируют. Сырой продукт, полученный в форме четырех диастереоизомеров в соотношении 8:18:22:52, очищают перегонкой.
Ткип.=46°С/0,7 Торр
Ольфактивное описание: аромат зеленый, резкий, с нотой полыни, древесный.
4 Перекрывающихся изомера:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,91-1,03 (м, 6H), 1,09-1,11 (м, 3H), 1,31-1,92 (м, 2H), 1,25-1,39 (м, 3H), 1,72-1,74 (м, 1H), 2,21-2,43 (м, 1H), 2,59-2,84 (м, 1H).
13C-ЯМР (50 МГц, CDCl3, мажорный изомер (52%)): δ (м.д.) 16,51, 20,91, 28,73, 30,88, 30,99, 35,95, 38,42, 46,23, 49,64, 50,78, 123,32.
MC [e/m (%)], изомер в количестве 52%: 165 (M+, 1), 150 (49), 133 (32), 111 (65), 109 (10), 96 (19), 95 (100), 83 (54), 81 (14), 69 (69), 67 (14), 56 (11), 55 (43), 53 (11), 41 (32), 39 (14).
MC [e/m (%)], изомер в количестве 22%: 165 (M+, 0,4), 150 (57), 133 (26), 111 (33), 96 (14), 95 (100), 83 (68), 81 (11), 69 (47), 67 (12), 55 (34), 41 (25), 39 (12).
MC [e/m (%)], изомер в количестве 18%: 165 (M+, 0,3), 150 (31), 133 (17), 122 (11), 111 (84), 110 (17), 109 (19), 96 (19), 95 (83), 94 (11), 84 (29), 83 (54), 82 (13), 81 (15), 69 (100), 67 (17), 56 (18), 55 (49), 53 (13), 41 (40), 39 (17).
MC [e/m (%)], изомер в количестве 8%: 165 (M+, 0,1), 150 (29), 133 (19), 111 (87), 110 (16), 109 (18), 96 (15), 95 (83), 94 (14), 84 (32), 83 (56), 82 (13), 81 (17), 69 (100), 67 (15), 56 (15), 55 (49), 53 (11), 41 (38), 39 (16).
ИК (пленка, см-1): 979w, 1103w, 1197w, 1319w, 1366м, 1381м, 1461м, 2238м, 2867м, 2952с.
Пример 6: Получение 2-(2,4,4-триметилциклопентил)ацетальдегида (7)
2-(2,4,4-триметилциклопентил)ацетонитрил 4 помещают в инертной атмосфере в толуол при температуре 10°С. К этой смеси добавляют по каплям 1,2 экв. Dibal-Н (гидрида диизобутилалюминия). Реакционную среду перемешивают несколько часов при комнатной температуре, затем выливают в смесь 20:40:40 уксусной кислоты, воды и льда. Водный слой экстрагируют один раз толуолом. Объединенные органические слои промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт, полученный в форме двух диастереоизомеров в соотношении 70:30, очищают перегонкой при пониженном давлении.
Ткип.=50°С/0,3 Торр
Ольфактивное описание: аромат ярко-выраженный зеленый, цитрусовый, пряный, с нотой тмина, очень сильный.
Мажорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,05 (2д, J=7,0 Гц и J=6,8 Гц, 6H), 1,57-1,64 (м, 2H), 1,94-1,98 (м, 1H), 2,28-2,35 (м, 1H), 2,52-2,71 (м, 2H), 7,14-7,28 (м, 5H), 9,65 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 10,26, 17,71, 33,71, 33,91, 35,43, 51,88, 126,27, 128,71 (2C), 128,81 (2C), 142,49, 205,95.
MC [e/m (%)]: 154 (M+, 2), 110 (35), 95 (100), 69 (21), 55 (17), 41 (17).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,89 (2д, J=7,0 Гц и J=6,8 Гц, 6H), 1,57-1,64 (м, 2H), 1,94-1,98 (м, 1H), 2,28-2,35 (м, 1H), 2,52-2,71 (м, 2H), 7,14-7,28 (м, 5H), 9,64 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 8,57, 15,78, 32,59, 34,02, 36,97, 50,93, 126,27, 128,71 (2C), 128,81 (2C), 142,49, 205,95.
MC [e/m (%)]: 154 (M+, 0,5), 110 (36), 109 (13), 95 (100), 83 (11), 69 (33), 55 (21), 41 (22).
ИК (пленка, см-1): 698с, 747м, 1454м, 1496м, 1603w, 1721с, 2704w, 2860м, 2933м, 2963м, 3026м, 3062.
Пример 7: Получение 2-(2,4,4-триметилциклопентил)акрилальдегида (8)
2-(2,4,4-триметилциклопентил)акрилонитрил 5 помещают в инертной атмосфере в толуол при температуре 10°С. К этому продукту добавляют по каплям 1,2 экв. Dibal-Н (гидрида диизобутилалюминия). Реакционную среду перемешивают несколько часов при комнатной температуре, затем выливают в смесь 20:40:40 уксусной кислоты, воды и льда. Водный слой экстрагируют один раз толуолом. Объединенные органические слои промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт, полученный в форме двух диастереоизомеров в соотношении 70:30, перегоняют при пониженном давлении.
Ткип.=40°С/0,3 Торр
Ольфактивное описание: аромат зеленый, цитрусовый, древесный, сильный.
Мажорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,88 (д, J=6,4 Гц, 3H), 1,05 (2с, 6H), 1,22-1,34 (м, 2H), 1,60-1,87 (м, 2H), 2,04-2,17 (м, 1H), 2,57-2,67 (м, 1H), 6,01 и 6,28 (2с, 2H), 9,56 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,61, 31,78, 37,28, 39,56, 45,53, 49,06, 50,60, 133,39, 153,26, 195,50.
MC [e/m (%)]: 166 (M+, 35), 151 (89), 137 (30), 133 (43), 124 (17), 123 (60), 110 (26), 109 (100), 108 (21), 107 (21), 105 (20), 96 (12), 95 (88), 93 (25), 91 (24), 84 (29), 83 (39), 82 (11), 81 (58), 79 (32), 77 (22), 70 (12), 69 (57), 68 (11), 67 (39), 65 (11), 56 (10), 55 (42), 53 (27), 43 (16), 41 (58), 39 (31).
Минорный изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,59 (д, J=7,2 Гц, 3H), 1,05 (2с, 6H), 1,22-1,34 (м, 2H), 1,60-1,87 (м, 2H), 2,04-2,17 (м, 1H), 2,57-2,67 (м, 1H), 6,07 и 6,20 (2с, 2H), 9,56 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,13, 31,54, 34,56, 37,28, 40,47, 43,24, 49,74, 134,33, 151,82, 195,50.
MC [e/m (%)]: 166 (M+, 25), 151 (66), 137 (27), 133 (29), 124 (14), 123 (44), 110 (20), 109 (100), 108 (18), 107 (17), 105 (14), 95 (68), 93 (20), 91 (22), 84 (72), 83 (39), 82 (10), 81 (57), 79 (29), 70 (11), 69 (86), 67 (32), 65 (10), 56 (12), 55 (39), 53 (23), 43 (13), 41 (57), 39 (29).
ИК (пленка, см-1): 895w, 937м, 1190w, 1242w, 1364w, 1376w, 1459м, 1623w, 1693с, 2696w, 2865м, 2952м.
Пример 8: Получение 2-(2,4,4-триметилциклопентил)пропанальдегида (9)
2-(2,4,4-триметилциклопентил)пропаннитрил 6 помещают в инертной атмосфере в толуол при температуре 10°С. К этому продукту добавляют по каплям 1,2 экв. Dibal (гидрид диизобутилалюминия). Реакционную среду перемешивают несколько часов при комнатной температуре, затем выливают в смесь 20:40:40 уксусной кислоты, воды и льда. Водный слой экстрагируют один раз толуолом. Объединенные органические слои промывают раствором бикарбоната натрия, затем соленой водой. После высушивания над сульфатом магния, фильтрации через бумагу и выпаривания растворителя сырой продукт, полученный в форме трех диастереоизомеров, определенных методом CPG, в соотношении 73:16:11, перегоняют при пониженном давлении.
Ткип.=40°С/0,4 Торр
Ольфактивное описание: аромат древесный, сухой, зеленый, цитрусовый, свежий.
3 Перекрывающихся изомера:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,95-1,03 (c перекрытые, 6H), 1,07-1,11 (д перекрытые, 3H), 1,17-1,32 (м, 2H), 1,40-1,50 (м, 1H), 1,62-1,71 (м, 1H), 1,81-2,05 и 2,20-2,23 (2м, 2H), 2,35-2,48 (м, IH), 9,64 и 9,70 (2с, 1H).
13C-ЯМР (50 МГц, CDCl3, изомер в количестве 73%): δ (м.д.) 9,43, 19,34, 31,21, 31,40, 37,0, 37,40, 45,90, 47,10, 48,65, 50,46, 205,88.