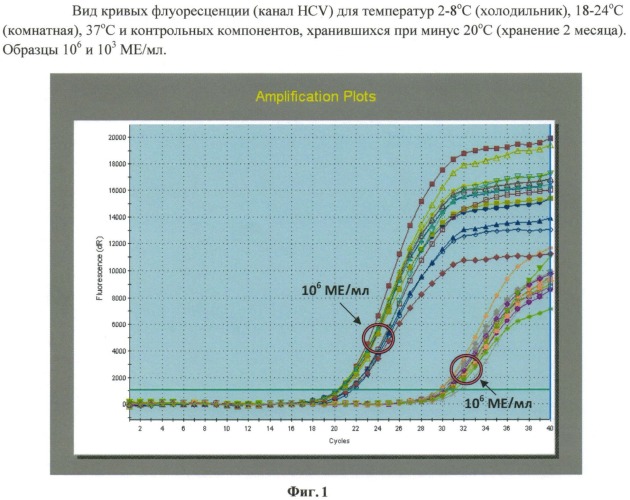
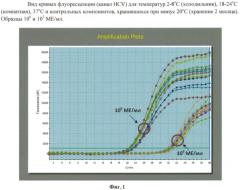
Сухая смесь для приготовления реакционной смеси для амплификации нуклеиновой кислоты и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии и биотехнологии и касается сухой смеси для амплификации нуклеиновой кислоты и способа ее получения. Охарактеризованная смесь содержит термостабильную ДНК-полимеразу, обратную транскриптазу, первый стабилизатор, выбранный из группы, включающей моносахариды, дисахариды, полиспирты и второй стабилизатор, выбранный из группы, включающей полисахариды, альбумины, поливинилпирролидон. При осуществлении способа получения сухой смеси готовят водный раствор, содержащий указанные выше вещества, и лиофилизируют его. Полученный продукт может храниться до 1 года при температуре выше 0°С с сохранением активностей обратной транскриптазы и ДНК-полимеразы. Представленные изобретения могут быть использованы для амплификации как одновременно ДНК и РНК, так и по отдельности. 2 н. и 24 з.п. ф-лы, 13 ил., 7 табл., 4 пр.
Реферат
Область техники
Настоящее изобретение относится к области молекулярной биологии и биотехнологии, в частности к способу получения сухой смеси для амплификации нуклеиновой кислоты, содержащей обратную транскриптазу и термостабильную ДНК-полимеразу, и может быть использовано в различных областях техники, в которых применяется анализ, основанный на методе полимеразной цепной реакции.
Уровень техники
Метод полимеразной цепной реакции (ПЦР) широко используется в различных областях техники. ПЦР позволяет увеличивать количество специфической нуклеотидной последовательности в миллионы раз. В основе ПЦР лежит способность фермента ДНК-полимеразы, используя в качестве затравки синтетические одноцепочечные олигонуклеотиды (праймеры), ограничивающие амплифицируемый фрагмент с двух сторон, синтезировать из нуклеотидтрифосфатов комплементарную цепь. Благодаря простоте и специфичности метод ПЦР широко используется в научно-исследовательских целях, в пищевой промышленности, в сельском хозяйстве, в медицине, в частности для диагностики различных заболеваний и выявления возбудителей инфекций.
Основными компонентами реакционной смеси для проведения ПЦР являются термостабильный фермент, осуществляющий синтез комплементарной цепи, нуклеотидтрифосфаты, ионы Mg2+, матрица и специфичные праймеры, способные отжигаться на комплементарной последовательности матрицы. Одной из главных сложностей при хранении реагентов для амплификации является сохранение активности ферментов в течение длительного времени. Ферменты обычно хранят в глицериновом растворе при температуре ниже минус 20°С. Оттаивание и нагревание ферментов при транспортировке и приготовлении реакционной смеси может привести к снижению и потере их ферментативной активности. Увеличить срок хранения биологически активных веществ, в частности ферментов, можно посредством высушивания.
Одним из способов сохранения биологически активных веществ, в частности ферментов, является лиофилизация. Лиофилизация (лиофильная сушка, сублимационная сушка) представляет собой процесс удаления воды из замороженного материала при низком атмосферном давлении. В водном растворе ферменты окружены гидратной оболочкой, образованной молекулами воды, связанными с поверхностью белка водородными связями. Такая водная оболочка стабилизирует фермент и обеспечивает поддержание его активности. Стабилизация пространственной структуры происходит за счет того, что молекулы воды фиксируют взаимное расположение отдельных белковых групп, препятствуя их непосредственным взаимодействиям и образованию межмолекулярных связей в макромолекуле. В процессе сушки может происходить изменение трехмерной структуры белка, что приводит к нарушению его активности.
Для предотвращения изменения структуры белка в процессе лиофилизации используют стабилизаторы и криопротекторы. В качестве стабилизаторов для сохранения активности белков и ферментов известно использование таких соединений, как маннитол и лактоза (ЕР 0431882 А2), пентоза и некоторые дисахариды (US 4,451,569), сахароза, мальтоза и трегалоза (Carpenter et al., Stabilization of phosphofructokinase during air-drying with sugars and sugar/transition metal mixtures. Cryobiology 24: 455-464 (1987)). Однако эффективность, приемлемость и преимущества использования тех или иных соединений в качестве добавок для лиофилизации существенно зависят от структуры биологически активного материала, который необходимо стабилизировать.
Для стабилизации ПЦР-смесей, содержащих ДНК-полимеразу, известно использование FICOLL, сорбитола или сахарозы (US 6153412 и US 5861251), целлобиозы, позволяющей поддерживать активность при температуре до 55°C (WO 2010133628 (A1)), сочетания дисахарида и карбопола-940 (ЕР 1498492 (В1)). Также известна сухая смесь реагентов для полимеразной цепной реакции, содержащая ДНК-полимеразу и стабилизатор, в качестве которого использованы 0,16% D-глюкозы, 1,6% инулина, 8% D-маннитола. При этом для проведения ПЦР-анализа сухую смесь реагентов растворяют буферным раствором, в состав которого входят ионы магния, а затем добавляют специфичные праймеры и анализируемую ДНК (патент РФ №2259401).
Другим способом стабилизации Taq-полимеразы является добавление в реакционную смесь перед лиофилизацией стабилизирующего вещества, в качестве которого используют казеин или БСА, и второй стабилизирующей молекулы, в качестве которой используют аптамер. Заявленная сухая смесь сохраняет активностьЮ, достаточную для проведения ПЦР при ее восстановлении после хранения в течение одной недели при комнатной температуре (ЕР 2202302 (A1)).
Также из предшествующего уровня техники известен способ получения стабилизированной композиции, которая может быть использована для амплификации молекул РНК методом NASBA. Лиофилизированная смесь содержит обратную транскриптазу, РНК-полимеразу, и криопротектор, в качестве которого заявлены трегалоза и поливинилпирролидон (ЕР 0726310 (В1)).
Амплификацию молекул РНК с использованием ДНК-полимеразы проводят в две стадии: на первой стадии за счет обратной транскрипции получают кДНК, на второй стадии синтезированную кДНК амплифицируют с помощью ПЦР и детектируют либо в режиме реального времени, либо после окончания реакции амплификации. Совмещение обратной транскрипции и ПЦР в одной пробирке позволяет снизить риск контаминации, а также ускорить и упростить анализ за счет уменьшения количества манипуляций. В то же время требуется подбор условий и состава реакционной смеси для обеспечения и поддержания РНК-зависимой ДНК-полимеразной и ДНК-зависимой ДНК-полимеразной активностей ферментов.
На сегодняшний день существует необходимость предоставления способа получения стабильных сухих смесей для амплификации нуклеиновых кислот, содержащих обратную транскриптазу и термостабильную ДНК-полимеразу, характеризующихся возможностью длительного хранения при температуре выше 0°С.
Раскрытие изобретения
Технической задачей, решаемой авторами настоящего изобретения, является предоставление способа получения стабильной сухой смеси, предназначенной для амплификации нуклеиновых кислот, а именно смеси, содержащей по крайней мере два фермента, представляющих собой термостабильную ДНК-полимеразу и обратную транскриптазу. Технический результат достигается благодаря лиофилизации водного раствора для амплификации нуклеиновой кислоты с использованием как минимум двух стабилизаторов. Заявленный способ позволяет получать гомогенную и в то же время легкорастворимую смесь. Полученные заявленным способом смеси имеют длительный срок хранения при температуре выше 0°С и обладают высокой стабильностью. Настоящее изобретение также упрощает проведение анализа, основанного на исследовании нуклеиновых кислот, и дает возможность варьирования состава смеси в зависимости от целей исследования.
Целью настоящего изобретения является предоставление способа получения сухой смеси для амплификации нуклеиновой кислоты, включающего следующие стадии:
- приготовление водного раствора для амплификации нуклеиновой кислоты, содержащего по крайней мере два фермента, представляющих собой ДНК-полимеразу и обратную транскриптазу, и как минимум два стабилизатора,
- лиофилизацию указанного водного раствора.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор реакционной смеси для амплификации нуклеиновой кислоты содержит термостабильную ДНК-полимеразу и обратную транскриптазу.
Также целью настоящего изобретения является предоставление способа, в котором термостабильная ДНК-полимераза представляет собой Taq-полимеразу из Thermus aquaticus.
Также целью настоящего изобретения является предоставление способа, в котором термостабильная ДНК-полимераза представляет собой hot-start ДНК-полимеразу.
Также целью настоящего изобретения является предоставление способа, в котором обратная транскриптаза представляет собой обратную транскриптазу вируса лейкемии мышей (M-MLV обратную транскриптазу).
Также целью настоящего изобретения является предоставление способа, в котором водный раствор содержит праймеры и олигонуклеотидный зонд для детекции, содержащий флуоресцентную метку.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор содержит буферные компоненты и нуклеотидтрифосфаты.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор содержит буферные компоненты, ионы магния и нуклеотидтрифостфаты
Также целью настоящего изобретения является предоставление способа, в котором водный раствор содержит ионы магния, буферные компоненты, нуклеотидтрифосфаты, праймеры и олигонуклеотидный зонд для детекции.
Также целью настоящего изобретения является предоставление способа, в котором праймеры и олигонуклеотидный зонд для детекции представляют собой праймеры и олигонуклеотидный зонд для выявления вируса гепатита С.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор для амплификации нуклеиновой кислоты представляет собой раствор для осуществления реакции обратной транскрипции, совмещенной с полимеразной цепной реакцией.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор для амплификации нуклеиновой кислоты представляет собой раствор для осуществления реакции обратной транскрипции, совмещенной с полимеразной цепной реакцией в реальном времени.
Также целью настоящего изобретения является предоставление способа, в котором водный раствор для осуществления реакции обратной транскрипции, совмещенной с мультиплексной полимеразной цепной реакцией.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизаторов используют соединения, выбранные из группы, включающей углеводы, полиспирты, полимеры, белки, аминокислоты или их различные комбинации.
Также целью настоящего изобретения является предоставление способа, в котором углевод представляет собой полисахарид, дисахарид или моносахарид.
Также целью настоящего изобретения является предоставление способа, в котором дисахарид представляет собой трегалозу или сахарозу.
Также целью настоящего изобретения является предоставление способа, в котором полимер представляет собой декстран.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизаторов используют углевод и полимер.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизаторов используют дисахарид и декстран.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизаторов используют трегалозу и декстран.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизатора используют 1-25% трегалозу.
Также целью настоящего изобретения является предоставление способа, в котором в качестве стабилизатора используют 0,1-10% декстран с молекулярной массой 50000-200000 Да.
Также целью настоящего изобретения является предоставление способа, в котором лиофилизация включает стадии замораживания, первичной и вторичной сушки.
Также целью настоящего изобретения является предоставление способа, в котором лиофилизацию указанного водного раствора осуществляют в пробирках, стрипах или плашках.
Также целью настоящего изобретения является предоставление сухой смеси для амплификации нуклеиновой кислоты, содержащей по крайней мере два фермента, представляющих собой ДНК-полимеразу и обратную транскриптазу, и как минимум два стабилизатора, полученной по любому из вышеописанных способов.
Осуществление изобретения
Настоящее изобретение предоставляет способ получения сухой смеси для амплификации нуклеиновой кислоты, которая содержит по крайней мере два фермента, представляющих собой ДНК-полимеразу и обратную транскриптазу. Для получения сухой смеси готовят водный раствор, содержащий ДНК-полимеразу и обратную транскриптазу, указанный водный раствор может дополнительно содержать один или несколько компонентов реакционной смеси. Полученный водный раствор может быть обработан с целью удаления воды, в частности с помощью метода лиофилизации. Полученная после удаления воды реакционная смесь может быть названа согласно настоящему изобретению «сухая смесь». Сухая смесь согласно настоящему изобретению может быть названа «лиофилизированная смесь», если она получена методом лиофилизации.
Согласно настоящему изобретению водный раствор для амплификации нуклеиновой кислоты представляет собой раствор, который может содержать один или несколько компонентов, необходимых для проведения реакции амплификации. Перечень компонентов реакционной смеси, которые могут присутствовать в водном растворе, включает ферменты, буферные компоненты, ионы магния, нуклеотидтрифосфаты, олигонуклеоитидные праймеры, олигонуклеотидный зонд для детекции или краситель, ДНК- или РНК-матрицу, но не ограничивается перечисленными компонентами. В зависимости от целей и применения состав смеси для амплификации может варьировать.
Реакционная смесь (водный раствор для амплификации нуклеиновой кислоты) может быть полной, если она содержит все реагенты, необходимые для проведения реакции, и неполной, если она содержит только часть необходимых реагентов. Для специалиста в данной области техники очевидно, что для проведения реакции амплификации сухая смесь может быть восстановлена раствором, содержащим недостающие реагенты, кроме того, недостающие реагенты могут быть добавлены в восстановленную смесь как по отдельности, так и вместе, непосредственно перед началом реакции амплификации.
Водный раствор может содержать дополнительные компоненты реакционной смеси, необходимые для мониторинга накопления реакции амплификации, например, олигонуклеотидные зонды для детекции или интеркалирующие красители, такие как бромистый этидий или SYBR Green.
Согласно настоящему изобретению под реакцией амплификации нуклеиновой кислоты подразумевается любая реакция комплементарного синтеза молекулы нуклеиновой кислоты, в том числе синтез молекулы кДНК с использованием в качестве матрицы РНК и последующая амплификация синтезированных молекул кДНК методом ПЦР или ПЦР в реальном времени. Предлагаемый способ может быть использован для получения сухих смесей, которые предназначены для проведения совмещенной обратной транскрипции и различных модификаций ПЦР, в частности ПЦР с «горячим стартом» (hot-start PCR), мультиплексной ПЦР (multiplex PCR), гнездовой ("вложенная", nested PCR,) количественной ПЦР (Q-PCR), лигазной цепной реакции (ЛЦР, LCR - ligase chain reaction), ПЦР в режиме реального времени (Real-Time PCR), а также методов, основанных на ПЦР, в частности секвенирования. Настоящее изобретение не ограничено какой-либо конкретной модификацией полимеразной цепной реакции. Предлагаемые способы могут быть использованы для получения сухих смесей, предназначенных для проведения различных вариантов ПЦР.
Согласно настоящему изобретению фраза «амплификация нуклеиновой кислоты» может означать специфичную реакцию амплификации для выявления нуклеиновой кислоты-мишени. Предлагаемая сухая смесь предназначена как для амплификации дезоксирибонуклеиновой кислоты (ДНК), так и рибонуклеиновой кислоты (РНК). Понятие нуклеиновой кислоты, согласно настоящему изобретению, не ограничено каким-либо образом.
Согласно настоящему изобретению водный раствор и полученная из него сухая смесь для амплификации нуклеиновой кислоты может содержать нуклеиновую кислоту, которая может быть использована в качестве матрицы для контроля прохождения реакции амплификации. Реакционная смесь может содержать молекулу дезоксирибонуклеиновой кислоты или рибонуклеиновой кислоты. При этом в качестве матрицы для контроля прохождения реакции амплификации могут быть использованы как полногеномные последовательности, так и фрагменты нуклеиновых кислот. Также в качестве контроля могут быть использованы фаги, плазмиды и векторы, в частности РНК-фаг и ДНК-плазмида, содержащие амплифицируемые последовательности.
Настоящее изобретение предоставляет способ получения сухой смеси для амплификации нуклеиновой кислоты, получаемой из водного раствора, который содержит по крайней мере два фермента, участвующих в реакции амплификации, в частности термостабильную ДНК-полимеразу и обратную транскриптазу или фермент/ферменты, обладающие РНК-зависимой ДНК-полимеразной активностью и ДНК-зависимой ДНК-полимеразной активностью, позволяющей проводить реакцию ПЦР.
Предлагаемый способ позволяет получить смесь для амплификации нуклеиновой кислоты, которая содержит фермент, обладающий ДНК-зависимой-ДНК-полимеразной активностью, и согласно настоящему изобретению может быть назван «ДНК-полимераза». ДНК-полимераза представляет собой фермент, обладающий способностью инициировать и катализировать синтез на 3'-конце праймера в направлении к 5'-концу ДНК-матрицы. Предпочтительно использование термостабильных ферментов, которые сохраняют активность в течение длительной инкубации при высокой температуре. Согласно настоящему изобретению, могут быть использованы термостабильные ДНК-полимеразы, полученные из термофильных бактерий, например, таких как Thermus aquaticus (Taq-полимераза), Thermus thermophiles (Tth), Thermus flavis (Tfl), Thermus caldophilus (Tea), Thermotoga maritime (Tma), Thermotoga neapolitana (Tne), Pyrococcus furiosus (Pfu), Pyrococcus woesei (Pwo), Thermococcus litoralis (Tli, известная также как Vent®), Pyrococcus species GB-D (DEEPVENT®), Thermococcus kodakaraensis (Kod). Перечень термостабильных полимераз, которые могут быть использованы согласно настоящему изобретению, не ограничен каким-либо образом.
Согласно настоящему изобретению могут быть использованы как ферменты дикого типа, так и различные мутантные и модифицированные варианты, и их сочетания. Примеры некоторых модифицированных Taq-полимераз описаны в Европейских патентах ЕР 1091002 (В2), ЕР 0902035 (В1), ЕР 0892058 (В1), ЕР 0823479 (В1).
Кроме того, известно, что ДНК-полимеразы помимо основной ДНК-зависимой ДНК-полимеразной активности, могут обладать 5'-3'-экзонуклеазной активностью и 3'-5'-экзонуклеазной (корректирующей) активностью. Например, Taq-полимераза из Thermus aquaticus имеет два домена, С-концевая часть белка обеспечивает полимеразную активность, а N-концевая часть белка отвечает за экзонуклеазную активность. Настоящее изобретение предоставляет способ получения сухой смеси для амплификации нуклеиновой кислоты, в которой обеспечивается поддержание как минимум двух активностей фермента, а именно 5'-3'-полимеразной и 5'-3'-экзонуклеазной. Наличие у ДНК-полимеразы 5'-3'-экзонуклеазной активности позволяет осуществлять детекцию амплификации в реальном времени с использованием гибридизационно-флуоресцентных зондов типа TaqMan.
Термин «hot-start ДНК-полимераза» (или «обратимо инактивированная ДНК-полимераза») относится к ДНК-полимеразе, которая модифицирована таким образом, чтобы предотвратить неспецифический синтез при низких температурах до начала амплификации.
Согласно настоящему изобретению могут быть использованы термостабильные ДНК-полимеразы, инактивированные за счет химической модификации, в результате которой наблюдается полная или практически полная потеря активности фермента при низких температурах. В качестве примеров модифицирующих реагентов известны формальдегид (ЕР 0962526 (В1)), ангидрид дикарбоновой кислоты (патент РФ №2174556), полиэтиленгликоль и пропиленгликоль (патентная заявка ЕР 2075331 (А2)). Для восстановления ферментативной активности химически модифицированной ДНК-полимеразы перед реакцией амплификации проводят инкубацию реакционной смеси при повышенной температуре (так называемая ПЦР с «горячим стартом» - hot start PCR).
Также согласно настоящему изобретению в качестве модификации, предотвращающей неспецифическую амплификацию, могут быть использованы антитела, которые способны связываться с ДНК-полимеразой, образуя комплекс антитело-полимераза (ЕР 0592035 (В1)). Перед проведением реакции амплификации антитела могут быть необратимо инактивированы путем прогревания реакционной смеси при температуре выше 80°С.
В качестве агентов, предотвращающих неспецифический синтез при низких температурах, также известно использование аптамеров, которые представляют собой олигонуклеотиды, обладающие высокой степенью аффинности к полимеразе и способные связываться в растворе с ДНК-полимеразой таким образом, чтобы блокировать ее полимеразную активность. Примеры таких олигонуклеотидных лигандов описаны в заявке WO 1996041010.
Согласно настоящему изобретению получаемая сухая смесь для амплификации нуклеиновой кислоты, кроме ДНК-полимеразы, содержит второй фермент, представляющий собой обратную транскриптазу. Термин «обратная транскриптаза» («транскриптаза» или «ревертаза») относится к ферментам, которые представляют собой РНК-зависимые ДНК-полимеразы и способны осуществлять синтез цепи ДНК на РНК-матрице. Примерами таких ферментов могут быть ретровирусные обратные транскриптазы, такие как обратная транскриптаза вируса лейкемии мышей Молони (М-MLV обратная транскриптаза (Moloney Murine Leukemia Virus)) и обратная транскриптаза вируса миелобластоза птиц (AMV-обратная транскриптаза (Avian Myeloblastosis Virus)), а также Mint-ревертаза, используемая для синтеза полноразмерных библиотек кДНК и клонирования 5'-концов кДНК (5'-RACE). Перечень обратных транскриптаз, которые могут быть использованы согласно настоящему изобретению, не ограничен каким-либо образом.
Ретровирусные обратные транскриптазы (MMLV и AMV), кроме РНК-зависимой ДНК-полимеразной активности, имеют еще ДНК-зависимую ДНК-полимеразную активность и активность РНКазы Н (RNase H activity). Согласно настоящему изобретению, в состав смеси для амплификации нуклеиновой кислоты может входить как транскриптаза дикого типа, обладающая активностью РНКазы Н, так и транскриптаза со сниженной активностью РНКазы Н, например, описанная Gerard и соавт. (Gerard, G.F., et al., FOCUS 11(4):60 (1989); Gerard, G.F, et al, FOCUS 14(3):91 (1992)).
Согласно настоящему изобретению обратная транскриптаза может быть модифицирована за счет введения нуклеотидных замен в последовательность, кодирующую указанную обратную транскриптазу. Примеры таких модификаций, повышающих термостабильность и точность M-MLV обратной транскриптазы, а также снижающих терминальную дезоксинуклеотидил-трансферазную активность, описаны в заявке ЕР 2325303 (A3). В качестве обратной транскриптазы согласно настоящему изобретению может быть использована, например, обратная транскриптаза с увеличенным временем полужизни (Svarovskaia ES et al. Retroviral mutation rates and reverse transcriptase fidelity. Front Biosci. 2003 Jan 1; 8:d117-34), обратная транскриптаза с повышенной точностью транскрипции (Arezi, В. and Hogrefe H. Novel mutations in Moloney Murine Leukemia Virus reverse transcriptase increase thermostability through tighter binding to template-primer. Nucleic Acids Res. 2009 February; 37(2): 473-481). Перечень обратных транскриптаз, которые могут быть использованы согласно настоящему изобретению, не ограничен каким-либо образом.
Известно, что активность Taq-полимеразы может ингибироваться в присутствии обратной транскриптазы, причем это ингибирование вызвано непосредственным взаимодействием обратной транскриптазы с полимеразой (Sellner et al. Reverse transcriptase inhibits Taq polymerase activity. Nucleic Acids Research, Vol.20, №7, 1487-1490). Настоящее изобретение позволяет не только обеспечить стабилизацию ферментов во время лиофилизации, но и сохранить активности полимеразы и обратной транскриптазы, достаточные для прохождения реакций обратной транскрипции и амплификации в одной пробирке.
Согласно настоящему изобретению водный раствор для амплификации нуклеиновой кислоты содержит по крайней мере два фермента, один из которых имеет РНК-зависимую ДНК-полимеразную активность, второй фермент имеет ДНК-зависимую ДНК-полимеразную активность и является термостабильным, в частности, водный раствор и, соответственно, получаемая из него сухая смесь может содержать комбинацию двух ферментов обратной транскриптазы и термостабильной ДНК-полимеразы.
Предлагаемый в настоящем изобретении способ получения сухой смеси для амплификации нуклеиновой кислоты обеспечивает стабильность ферментов в процессах лиофилизации, хранения и транспортировки, замешивания реагентов и непосредственно прохождения реакции амплификации.
Согласно настоящему изобретению водный раствор может содержать различные концентрации термостабильной ДНК-полимеразы и обратной транскриптазы, концентрации и соотношение ферментов могут варьировать и зависят от типа используемых ферментов. Для ферментов, описанных в примерах настоящего изобретения, соотношение единиц активности ферментов может лежать в пределах от 1 (ДНК-полимераза) : 0,2 (обратная транскриптаза) до 1 (ДНК-полимераза) : 10 (обратная транскриптаза), в частности, соотношение единиц активности может быть равным примерно 1 (Taq-полимеразы) : 4 (MMLV). Для обеспечения поддержания активностей обоих ферментов в «полной» реакционной смеси (конечный объем смеси после восстановления и добавления матрицы 50 мкл) могут быть использованы 5 ед. Taq-полимеразы и 20 ед. обратной транскриптазы.
Согласно настоящему изобретению в качестве нуклеотидтрифосфатов водный раствор и сухая смесь для амплификации нуклеиновой кислоты могут содержать дезоксинуклеотидтрифосфаты (dNTPs - dATP, dTTP, dGTP, dCTP, dUTP), рибонуклеотидфосфаты (ATP, GTP, CTP, UTP), дидезоксинуклеотидтрифосфаты (ddNTPs - ddATP, ddTTP, ddGTP, ddCTP), а также их комбинации. Концентрация нуклеотидтрифосфатов в реакционной смеси для амплификации может варьировать, оптимальная концентрация дезоксинуклеотидтрифосфатов составляет по 50-500 мМ каждого dNTP. Кроме того, согласно настоящему изобретению нуклеотидтрифосфаты могут содержать радиоактивную или флуоресцентную метку.
Термин «буферные компоненты» согласно настоящему изобретению означает компоненты реакционной смеси, которые обеспечивают необходимые условия реакции для прохождения реакции обратной транскрипции и амплификации, в частности, поддерживают рН, ионную силу раствора, стабилизируют ферменты. Кроме того, буферный раствор может содержать различные добавки. В качестве примеров буферных компонентов могут быть упомянуты буфер Tris-HCl, ЭДТА, различные соли (KCl, (NH4)2SO4, K2PO4), дитиотриетол, ДМСО, ДМФА, глицерин, бетаин, меркаптоэтанол, неионные детергенты (Tween, Triton), желатин, и др. Перечень буферных компонентов, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом.
Необходимым компонентом реакционной смеси для работы полимеразы являются ионы Mg2+. Обычно в качестве источника ионов Mg2+ используют MgCl2 и/или MgSO4, которые согласно настоящему изобретению могут содержаться в водном растворе для амплификации нуклеиновой кислоты перед проведением лиофилизации, либо быть добавленными при восстановлении сухой смеси непосредственно перед постановкой реакции амплификации.
Для специалиста в данной области техники, очевидно, что состав водного раствора зависит от типа проводимой реакции амплификации нуклеиновой кислоты, перечень буферных компонентов, а также их оптимальное сочетание могут быть подобраны экспериментальным путем.
Термин «праймер» согласно настоящему изобретению относится к олигонуклеотиду, который может служить в качестве затравки для инициации синтеза нуклеиновой кислоты. Праймер может представлять собой одноцепочечный олигодезоксирибонуклеотид. Типы используемых праймеров зависят от предполагаемого применения и не ограничены каким-либо образом. Например, для осуществления реакции обратной транскрипции обычно используют случайные гексонуклеотиды (random) или олиго(dT)15-20-праймеры (для синтеза первой цепи с 3' конца поли(А)+ мРНК), также могут быть использованы олигонуклеотиды, специфичные к определенной мишени (для диагностических целей). Для проведения реакции амплификации ДНК обычно используют специфичные праймеры, комплементарные определенной последовательности ДНК-мишени. Длина праймеров может варьировать, но обычно составляет 6-50 нуклеотидов. Термин «специфичные праймеры» обозначает олигонуклеотиды, которые будут гибридизоваться и позволят детектировать амплификацию нуклеиновой кислоты-мишени (последовательности-мишени) вне зависимости от вариаций последовательности, расположенной между участками, к которым подобраны специфичные праймеры.
Кроме того, согласно настоящему изобретению праймеры могут содержать дополнительные элементы, способствующие обнаружению или предотвращению неспецифической амплификации. Праймеры могут содержать флуоресцентную метку на 5'-конце, как, например, праймеры-зонды "скорпионы" (Scorpions).
Согласно настоящему изобретению водный раствор и получаемая из него сухая смесь для амплификации нуклеиновой кислоты могут содержать один или несколько праймеров, в частности, могут быть использованы несколько пар праймеров для амплификации разных фрагментов с целью проведения мультиплексной ПЦР.
Водный раствор и получаемая сухая смесь для амплификации нуклеиновой кислоты, согласно настоящему изобретению, могут дополнительно содержать олигонуклеотидный зонд для детекции. Термин «олигонуклеотидный зонд для детекции» («зонд») означает олигонуклеотидную последовательность, которая может быть использована для мониторинга накопления продукта в процессе амплификации. В качестве примеров зондов, согласно настоящему изобретению, могут быть упомянуты олигонуклеотидные зонды, комплементарные участку ампликона и меченые флуоресцентными красителями (гибридизационно-флуоресцентная детекция). Частными примерами таких зондов могут служить зонды TaqMan® (Европейский патент ЕР 0919565 (В1)), «молекулярные маяки» (Molecular Beacons®, патент US 5118801 (А)), зонды с резонансным переносом энергии (FRET-технология, патенты ЕР 0912760 (В1), ЕР 1033411 (В1), US 7160998), "амплифлюр" (Amplifluor®, Европейский патент ЕР 0912597). Перечень зондов, которые могут быть использованы согласно настоящему изобретению, не ограничен каким-либо образом.
Одним из вариантов настоящего изобретения является способ получения сухой смеси для амплификации нуклеиновой кислоты, в которой присутствует олигонуклеотидный зонд для детекции, содержащий флуоресцентную метку. Термин «олигонуклеотидный зонд для детекции, содержащий флуоресцентную метку», означает олигонуклеотидную последовательность, которая способна гибридизоваться с участком последовательности-мишени (полностью или частично комплементарна) и содержит флуоресцентную метку на 5'- и/или 3'-конце или внутри последовательности. В качестве флуоресцентной метки могут быть использованы такие светоиспускающие соединения, как, например, флуоресцин и его производные карбоксифлуоресцеин (FAM), гексахлорфлуоресцеин (HEX), тетрахлорфлуоресцеин (ТЕТ) и дихлордиметилфлуоресцеин (JOE), родамин и его производные 5(6)-карбокси-Х-родамин (ROX), 6-карбоксиродамин (R6G), тетраметилродамин (TAMRA), цианиновые красители, например, тетраметилиндокарбоцианин (Су3), дибензоиндокарбоцианин (Су3.5), тетраметилиндодикарбоцианин (Су5), бензоиндодикарбоцианин (Су5.5). Перечень флуорофоров и красителей, которые могут быть использованы в качестве флуоресцентной метки в настоящем изобретении, не ограничен каким-либо образом.
Согласно настоящему изобретению, зонд может представлять собой олигонуклеотид, к которому присоединены молекула флуорофора и молекула гасителя флуоресценции. В зависимости от расположения флуоресцентной метки, гаситель может располагаться либо на противоположном конце зонда, либо внутри олигонуклеотдиной цепи. Гаситель флуоресценции подбирается таким образом, чтобы его спектр поглощения лежал в области длин волн спектра испускания флуорофора. В качестве гасителя флуоресценции могут быть использованы, например, гасители BHQ (black hole quenchers) производства компании Biosearch Technologies, США (патент США US 7,019,129) или гасители RTQ (real-time quenchers) производства компании «Синтол» (Россия).
Согласно настоящему изобретению при использовании флуоресцентно меченных зондов или праймеров, а также интеркалирующих красителей детекция амплификации может осуществляться как во время, так и после прохождения реакции амплификации.
Для мониторинга прохождения реакции амплификации в реальном времени с использованием TaqMan зондов ДНК-полимераза должна обладать 5'-3'-экзонуклеазной активностью. 5'-3'-экзонуклеазная активность ДНК-полимеразы обеспечивает разрушение зонда, при условии, что зонд гибридизован с выявляемой последовательностью-мишенью. Разрушение зонда приводит к разделению молекул флуорофора и гасителя и испусканию флуоресценции, уровень которой может регистрироваться в ходе реакции. Предлагаемый в настоящем изобретении способ получения сухой смеси позволяет сохранять 5'-3'-экзонуклеазную активность термостабильной ДНК-полимеразы на уровне, достаточном для обеспечения возможности детекции амплификации в реальном времени.
Согласно настоящему изобретению детекция амплификации может проводиться по окончании амплификации, например, с помощью электрофореза или анализа кривых плавления (Ririe et al. Product differentiation by analysis of DNA melting curves during the polymerase chain reaction", Anal Biochem. 1997 245 (2): 154-60; Lyon, E. 2001. Mutation detection using fluorescent hybridization probes and melting curve analysis. Expert. Rev. Mol. Diagn. 1:92-101), в частности с помощью HMR-анализа (Carl Т. et al. High-Resolution Genotyping by Amplicon Melting Analysis Using LCGreen. Clinical Chemistry, June 2003 vol.49 no.6 853-860; Cameron et al. Amplicon Melting Analysis with Labeled Primers: A Closed-Tube Method for Differentiating Homozygotes and Heterozygotes. Clinical Chemistry March 2003 vol.49 no.3 396-406).
В зависимости от типа используемых красителей для детекции и количества амплифицируемых мишеней сухая смесь может предназначаться для осуществления реакции обратной транскрипции, совмещенной с полимеразной цепной реакцией, реакции обратной транскрипции, совмещенной с полимеразной цепной реакцией в реальном времени, реакции обратной транскрипции, совмещенной с мультиплексной полимеразной цепной реакцией, и др.
Одним из вариантов настоящего изобретения является способ получения смеси для амплификации нуклеиновой кислоты, которая содержит праймер и олигонуклеотидный зонд для детекции вируса гепатита. Термин «вирус гепатита» согласно настоящему изобретению относится к вирусам, способным вызывать специфическое поражение печени, называемое гепатитом. Известно, что вирусы, вызывающие гепатит, относятся к разным таксономическим группам и имеют разные биологические свойства (http://www.hv-info.ru/info/statyi/pechen-diagnostika/156-2011-08-11-09-05-03.html). Гепатит может быть вызван как РНК-, так и ДНК-содержащим вирусом. Частными примерами РНК-содержащих вирусов, вызывающих гепатит, являются вирус гепатита С, вирус гепатита А, вирус гепатита E, вирус гепатита D, вирус гепатита G и другие. Перечень вирусов, праймеры и олигонуклеотидные зонды для выявления которых могут быть использованы согласно настоящему изобретению, не ограничен каким-либо образом.
Одним из вариантов настоящего изобретения является способ получения сухой смеси для амплификации нуклеиновой кислоты, содержащей все компоненты, необходимые для проведения реакции, за исключением матрицы. Матрица может быть добавлена к сухой смеси вместе с восстанавливающим раствором. Уменьшение количества манипуляций при подготовке проб и постановке анализа снижает риск контаминации и упрощает его проведение.
Настоящее изобретение предоставляет способ получения сухой смеси для амплификации нуклеиновой кислоты путем лиофилизации водного раствора. Термин «лиофилизация» (лиофильная сушка, лиофильное высушивание) означает процесс высушивания водных растворов (смесей) различных веществ в замороженном состоянии под вакуумом. Вода удаляется из замороженных объектов путем сублимации льда, т.е. превращения его в пар, минуя жидкую фазу. Согласно настоящему изобретению лиофилизация может быть проведена с использованием лиофильной установки (лиофилизатора), при этом способ получения сухой смеси для амплификации нуклеиновой кислоты может включать стадии замораживания, первичной сушки и вторичной сушки.
Замораживание водного раствора для амплификации нуклеиновой кислоты можно проводить путем понижения температуры до температуры в диапазоне от минус 190°С до минус 20°С, предпочтительно до минус 40°С, и выдерживания водного раствора при указанной температуре в течение времени, достаточного