Композиция на основе дигидрокверцетина, включенного в фосфолипидные наночастицы
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лечебно-профилактической композиции на основе дигидрокверцетина. Лечебно-профилактическая композиция на основе дигидрокверцетина в форме наночастиц размером, включающая фосфатидилхолин растительного происхождения, мальтозу и дигидрокверцетин при определенном соотношении компонентов. Вышеописанная композиция обладает повышенной фармакологической активностью, низкой токсичностью, способна выдерживать длительное хранение. 3 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к профилактической медицине и касается лечебно-профилактической композиции на основе дигидрокверцетина, включенного в фосфолипидные наночастицы, состоящей из наночастиц диаметром 8-30 нм на основе растительных фосфолипидов, с включенным в них антиоксидантом дигидрокверцетином.
В настоящее время известно, что с помощью лечебно-профилактических препаратов можно (1) организовать сбалансированное питание и поддерживать необходимый жизненный тонус организма (нутрицевтики) и (2) предупреждать развитие различных патологий в организме, мягко корректировать уже имеющиеся нарушения (парафармацевтики). Применение лечебно-профилактических препаратов способствует не только оздоровлению общества и продлению жизни человека, но и играет важную роль в профилактике ряда заболеваний, таких как сердечно-сосудистые, желудочно-кишечные, обменные (ожирение), онкологические. Лечебно-профилактические препараты позволяют значительно сократить прием лекарственных препаратов, особенно дорогостоящих.
С позиции патологии клеточных и субклеточных процессов, развитие многих заболеваний имеет общие патогенетические звенья, даже в тех случаях, когда клинические проявления их не однотипны. Известно, что нарушения в структуре цитоплазматических и внутриклеточных биомембран могут быть общими патогенетическими элементами многих болезненных процессов [1]. Все это обуславливает универсальность и эффективность лекарственных препаратов, направленных на репарацию поврежденных клеточных мембран, в первую очередь, препаратов на основе фосфолипидов - универсальных компонентов мембран всех типов клеток. В настоящее время такие препараты на основе «эссенциальных» фосфолипидов известны и широко применяются (Фосфоглив, Эсенциале, Липостабил, Мослецитин).
Использование фосфолипидов для получения лекарственных и лечебно-профилактических композиций является важной и актуальной задачей. Учитывая уникальность строения фосфолипидных молекул и их важнейшую роль в функционировании клетки и организма в целом, фосфолипиды представляют собой «эссенциальную» субстанцию, обладающую фармакологическими свойствами, на основе которой могут быть разработаны и введены в медицинскую практику высокоэффективные натуральные лечебно-профилактические препараты [2, 3].
Благодаря фармакологическим свойствам дигидрокверцетина, препараты на его основе способны нормализовать работу разных клеток организма, предупреждать образование тромбов в сосудах, снижать уровень холестерина в крови, служить регулятором обмена жиров в организме, оказывать антиаллергическое, противовоспалительное, радиозащитное и сосудорасширяющее действие; укреплять стенки кровеносных сосудов, предотвращать развитие болезней сердца и печени. В топ-20 БАД по объему аптечных продаж в России в 2011 г. на 8 месте стоит «Капилар» производителя ДИОД ОАО, содержащий дигидрокверцитин.
Выбор дигидрокверцетина для разработки композиции обусловлен, с одной стороны, широким спектром биологического действия и эффективностью, а с другой, - плохой растворимостью в воде и низкой биодоступностью.
Выходом из подобной ситуации является применение систем для транспорта биологически активных соединений в организме. Использование наносистем для транспорта таких соединений открывает возможности не только увеличить биодоступность последних, но и обеспечить пролонгирование циркуляции биологически активного соединения в кровотоке, за счет чего повышается поступление препарата в органы, ткани и клетки.
Наиболее распространенными наноносителями в настоящее время являются липосомы на основе фосфолипидов. Десятки новых липосомальных препаратов представлены на фармацевтическом рынке, еще большее их количество находится на разных стадиях клинических испытаний. Основное преимущество липосомальной транспортной наносистемы заключается в том, что липосомы за счет своей структурной организации способны осуществлять транспорт как гидрофильных, так и гидрофобных лекарственных субстанций. Диаметр частиц фосфолипидных липосомальных препаратов, как правило, составляет 100-400 нм, а форма выпуска - наноэмульсия, реже - лиофилизированный порошок. Следует отметить, что, несмотря на перечисленный ряд преимуществ, размер частиц большинства из существующих на рынке липосомальных лекарств способствует их опсонизации (взаимодействие с белками-опсонинами, ускоряющими поглощение фагоцитами) и выведению из циркуляции ретикуло-эндотелиальной системой. Так, показано, что снижение размера липосом в 8 раз продлевает их циркуляцию в кровотоке почти в 40 раз [4].
Фосфолипидные наночастицы, благодаря своей химической структуре, способны служить переносчиками как для растворимых, так и для нерастворимых в биологических жидкостях (гидрофобных) лекарственных препаратов. Встраивание лекарственных соединений в липидную матрицу наночастиц позволяет получить новые наноформы лекарственных препаратов с высокой эффективностью, биодоступностью и сниженными побочными действиями.
Высокая общая площадь поверхности, в сочетании с наноразмерами, создает оптимальные условия для взаимодействия таких частиц с клеткой. Кроме того, наноразмер создает уникальную возможность внедрения частиц в области щелевых межклеточных контактов, ширина которых в некоторых участках может составлять 30-50 нм. Близкие размеры, наряду с общим характером поверхности, фосфолипидных наночастиц и липопротеинов создают также оптимальные условия для их взаимодействия друг с другом. При этом фосфолипидные частицы, несущие биологически активное вещество, включаются в систему липопротеинов плазмы крови, с участием липид-транспортных белков, в результате чего молекулы липофильного лекарства вместе с фосфолипидами могут транспортироваться к частицам липопротеинов.
Из существующего уровня техники известны диспергируемые стабилизированные фосфолипидом микрочастицы, представляющие собой быстродиспергируемую твердую дозированную форму, состоящую из нерастворимого в воде соединения в виде наномерных или микромерных твердых частиц, поверхность которых стабилизирована поверхностными модификаторами, например фосфолипидом, при этом частицы диспергированы в создающей объем матрице (патент РФ 2233654). Размер получаемых частиц составляет 0,66-10,6 мкм (660-10000 нм).
Известен также способ получения субмикронных частиц водонерастворимого или плохо растворимого органического фармацевтически активного соединения, включающий стадии растворения этого соединения в смешиваемом с водой первом растворителе, смешивания этого раствора со вторым растворителем, в который может быть добавлен фосфатидилхолин, и гомогенизации, или гомогенизации в противотоке полученной предсуспензии или воздействия на нее ультразвуком (патент РФ 2272616). Размер получаемых частиц составляет 0,1-2,46 мкм (100-2500 нм). В Европейском патенте EP 0556394 A1 описан способ получения лиофилизированного препарата для доставки лекарственных субстанций, на основе рафинированного соевого масла и рафинированного яичного фосфатидилхолина. Препарат легко растворяется в воде с образованием частиц с размером 10-100 нм и представляет собой жировую эмульсию.
Задачей настоящего изобретения является разработка технологии получения водорастворимой композиции на основе дигидрокверцетина, включенного в фосфолипидные наночастицы со средним диаметром липосомально-мицеллярных частиц до 30 нм, обладающей повышенной биологической активностью, низкой токсичностью и способной выдерживать длительное хранение.
Необходимый технический результат изобретения достигается за счет повышения растворимости дигидрокверцетина, встроенного в фосфолипидные частицы в сравнении со свободным дигидрокверцетином.
В соответствии с изобретением описывается композиция в виде фосфолипидных наночастиц размером до 30 нм, включающая фосфатидилхолин, мальтозу и дигидрокверцетин при следующем соотношении компонентов, % мас.:
| Фосфатидилхолин | 20-43 |
| Мальтоз | 55-78 |
| Дигидрокверцетин | 2-8 |
Описывается также способ получения композиции в форме наночастиц размером до 30 нм, включающей 20-43% мас. фосфатидилхолина, 55-78% мас., мальтозы, 2-8% мас., биологически активного соединения, заключающийся в том, что фосфолипид и дигидрокверцетин (гидрофобное лекарственное средство) растворяют в этаноле, отгоняют этанол, добавляют воду, суспензируют, добавляют мальтозу и полученную суспензию подвергают нескольким циклам гомогенизации под высоким давлением 800-1500 бар при температуре 40-50°C с последующей лиофилизацией.
Количество циклов гомогенизации составляет, как правило, 7-10 циклов, и рН раствора находится в пределах 6,0-7,5.
Используемый фосфатидилхолин является основным компонентом высокоочищенного растительного соевого фосфолипида, содержание фосфатидилхолина, в котором не менее 78-95% масс. Другие фосфолипидные компоненты могут содержаться в количествах, не превышающих допустимые (лизофосфатидилхолина до 4% масс, следовые количества других фосфолипидов).
В качестве вспомогательных фармакологически приемлемых веществ композиция содержит криопротектор - мальтозу для возможности получения лиофилизата, способного после растворения в физиологическом растворе или воде полностью восстанавливать свою структуру (в частности, размер частиц).
Материалы и методы
В работе использовались следующие материалы:
1. Соевый фосфолипид марки Липоид S 100 фирмы Липоид, Германия.
2. Мальтозы моногидрат фирмы MERCK, Германия.
3. Дигидрокверцетин («Лавитол (дигидрокверцетин)»)
4. Вода для инъекций (по ФС №42-4587-95).
Изобретение иллюстрируется следующими примерами.
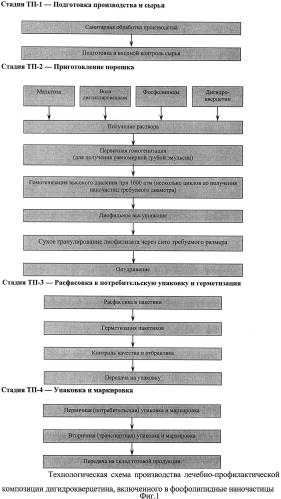
Пример 1. Технологические этапы получения
Получение первичной (грубой) эмульсии. Навески соевого фосфолипида (фосфатидилхолина) и Дигидрокверцетина добавляют к водному раствору мальтозы, гомогенизируют методом роторно-статорной гомогенизации в течение 5-10 мин при температуре 40-55°C и скоростях вращения ротора - 20000-30000 об/мин до получения однородной первичной дисперсии.
Микрофлюидизация концентрированной дисперсии. Гомогенизацию проводят с помощью микрофлюидайзера Microfluidizer Processor, MHO EN-30K (США). Первичную дисперсию, полученную на предыдущей стадии, пропускают через микрофлюидайзер под давлением 1500-2000 бар ±10%. Температуру дисперсии поддерживают в пределах 40-65°C. Процесс микрофлюидизации проводят в течение 3-7 циклов до достижения величины светопропускания рабочего раствора >40% (контролируют по светопропусканию при 660 нм в кювете с длиной оптического пути 1 см).
Фильтрация фосфолипидной эмульсии. Процесс фильтрации осуществляется в тангенциальном потоке. Фильтруемая жидкость при фильтрации в тангенциальном потоке из накопительной емкости с помощью насоса подается в корпус фильтра и с большой скоростью двигается вдоль мембран. Часть жидкости проходит сквозь поры внутрь мембран. Вся чистая и отфильтрованная жидкость собирается изо всех мембран и откачивается насосом. Насос, откачивающий отфильтрованную жидкость, периодически переключается на несколько секунд в реверсивное направление, создавая гидроудар в мембране. За счет этого частицы, осевшие на поверхности мембраны, слетают с нее и увлекаются потоком загрязненной жидкости.
Розлив в поддоны. Розлив препарата осуществляется вручную в асептических условиях.
Лиофильная сушка. Продукт замораживают до -40°C, затем полки нагревают до +10°C. При вакууме 150 миллиТор продукт сублимируют в течение 30 часов. Затем температуру полок повышают до +50°C и досушивают препарат при вакууме 50 миллиТор в течение 8-10 часов.
В качестве упаковки для готовых лечебно-профилактических изделий выбраны пакетики «саше».
Технологическая схема приведена на фиг.1.
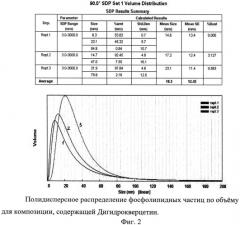
Пример 2. Размер частиц
Для определения размера фосфолипидных наночастиц использовали метод фотонной корреляционной спектроскопии на приборе Beckman N5 Submicron Particle Size Analyzer (Beckman Coulter, США) с использованием Contin-программ.
Протокол определения размера частиц
Содержимое пакетика «саше» растворяли в 10 мл дистиллированной воды; из полученного раствора отбирали 20 мкл и переносили в кювету, содержащую 3 мл дистиллированной воды. Устанавливали кювету в прибор и измеряли интенсивность рассеяния света при угле рассеивания 90°. Температура термостатирующей ячейки 25°C, время для уравновешивания температуры в кювете - 3 мин.
Полученные данные распределения по размерам частиц для обеих композиций представлены на фиг.2.
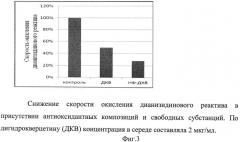
Пример 3. Сравнение антиоксидантной активности лечебно-профилактической композиции
Сравнение антиоксидантной активности разработанной композиции определяли спектрофотометрически по измерению скорости окисления дианизидинового реактива пероксидазой по возрастанию поглощения при 460 нм (ε=30 мМ-1 м-1). Реакцию проводили в присутствии рибофлавина для инициации окисления по радикальному пути.
Дигидрокверцетин и его фосфолипидный аналог добавляли в среду инкубации перед добавлением перекиси водорода, запускающей процесс окисления. Скорость окисления в отсутствии антиоксидантов принимали за 100%. Введение в среду инкубации антиоксидантов снижает скорость окисления дианизидинового реактива. Результаты представлены на фиг.3.
Пример 4. Антигипоксическое действие дигидрокверцетина
Антигипоксическое действие антиоксидантов изучали на модели острой гипоксии [5, 6]: животное в замкнутом пространстве поглощает кислород, уменьшая его содержание в камере. Вследствие возникающего дефицита кислорода возникает т.н. гипоксическая гипоксия. При этом определяют устойчивость к дефициту кислорода (продолжительности жизни в условиях гипоксии) на фоне приема исследуемых композиций.
Тест проводили следующим образом: исследуемую композицию и свободную субстанцию вводили per os белым нелинейным мышам ежедневно в течение 15 дней (20 мг/кг по дигидрокверцетину). Затем животных помещали в плотно закрытую банку. С помощью секундомера фиксировали продолжительность жизни. Контролем служили интактные животные. В качестве параметров, характеризующих антигипоксическое действие, были определены активность каталазы, уровень диеновых конъюгатов и гидроперекисей липидов в гомогенатах головного мозга после гибели у животного [7, 8, 9]. Результаты антигипоксического действия дигидрокверцетина (ДГК) и его фосфолипидной композиции (НФ-ДГК) представлены в таблице 1.
| Таблица 1 | ||||
| Эффективность дигидрокверцетина и его фосфолипидной композиции в тесте «баночной гипоксии» | ||||
| Группы животных | Продолжительность жизни, мин | Малоновый диальдегид, нмоль/мг белка | Каталаза, мкмоль H2O2/мг мин | Гидроперекиси липидов, ед. опт.пл. при 480 нм |
| Интактные | - | 2.77±0.32 | 9.59±0.63 | 0.11±0.01 |
| Контроль | 35.6±2.2 | 4.58±0.62 | 3.36±0.52 | 0.45±0.02 |
| ДГК субстанция | 49.7±1.8* | 3.26±0.52* | 5.20±0.81* | 0.31±0.03* |
| НФ-ДГК | 62,3±2.0** | 2.95±0.40** | 6.88±0.38** | 0.23±0.02** |
| * - достоверные отличия от контроля, P<0.05** - достоверные отличия от группы, получавшей свободную субстанцию, P<0.05 |
Как видно из данных, при применении исследуемой лечебно-профилактической композиции существенно увеличивалось время жизни мышей (почти в 2 раза), при этом повышение уровней малонового диальдегида и гидроперекисей липидов в ткани мозга, а также снижение каталазной активности ткани мозга было достоверно меньше, чем в группе контроля. Это свидетельствует об увеличении резервной антиокислительной активности мозга.
Перечень чертежей, использованных в описании
Фиг.1. Технологическая схема производства дигидрокверцетина, включенного в фосфолипидные наночастцы.
Фиг.2. Полидисперсное распределение фосфолипидных частиц по объему для композиции, содержащей Дигидрокверцетин.
Фиг.3. Снижение скорости окисления дианизидинового реактива в присутствии антиоксидантных композиций и свободных субстанций.
Литература
1. Платова О.М. Фосфоглив: Механизм действия и применение в клинике//ГУ НИИ биомедицинской химии РАМН, 2005-318 с.
2. Кочеткова, А.А. и др. Современная теория позитивного питания и функциональные продукты // Пищевая промышленность. - 1999. - №4. - С.7-10.
3. Колеснов А.Ю. Биохимические системы в оценке качества продуктов питания. М.: Пищевая промышленность, - 2000.
4. Drummond DD, Meyer О, Hong К, Kirpotin DB, Papahadjopoulos D: Optimizing liposomes for delivery of chemotherapeutic agents to solid tumors. Pharmacol. Rev. 51, 691-743 (1999).
5. Руководство по физиологии. Экологическая физиология человека. Адаптация человека к экстремальным условиям среды. Под ред., О.Г. Газенко. М., «Наука», 1979, с.333-336.
6. Руководство к практическим занятиям по патологической физиологи. Под ред. О.М. Павленко. М., «Медицина», 1974, с.174-175.
7. Tyson С.А., Luman K.D., Stephens RJ Age-related differences in G-SH-shuttle enzymes in NO2- or O3-exposed rat lungs - Arch. O3. Env. Health, 1982, Vol.37., No 3, p.167-176.
8. Методы исследований в профпатологии. Под ред. О.Г. Архиповой. М., 1988, с.156-158.
9. Современные методы в биохимии. Под ред. В.Н. Ореховича. М., «Медицина», 1977, с.62-64.
Лечебно-профилактическая композиция на основе дигидрокверцетина в форме наночастиц размером 8-30 нм, включающая фосфатидилхолин растительного происхождения 78-95%-ный, мальтозу и дигидрокверцетин при следующем соотношении компонентов, мас.%:
| фосфатидилхолин | 20-43 |
| мальтоза | 57-78 |
| дигидрокверцетин | 2-8 |