Способ диагностики аллергических реакций
Иллюстрации
Показать всеГруппа изобретений относится к способу обнаружения множественных цитокинов из отдельно взятых клеток и предназначено для создания набора иммунологических характеристик заболеваний. Для воплощения изобретения предусматривается наличие суспензии живых мононуклеарных клеток периферической крови индивида, нанесенной на пластичный планшет, который содержит по меньшей мере одну микролунку в матрице микролунок. При этом по меньшей мере одна микролунка в указанной матрице микролунок содержит одну клетку в объеме менее одного нанолитра. Матрицу микролунок приводят в контакт с субстратом, причем субстрат предварительно обрабатывают по меньшей мере двумя средствами для обнаружения и каждое средство для обнаружения связывается с секретированным цитокином указанной клетки. Измеряют уровень каждого указанного секретированного цитокина на указанном субстрате, при этом уровень соответствует количеству указанного секретированного цитокина указанной единичной клетки. Определяют скорость секреции каждого указанного секретированного цитокина из указанной клетки, определяя, таким образом, характеристики указанных секретированных цитокинов. Измеряют динамическое изменение указанных характеристик секретированных цитокинов. Использование группы изобретений обеспечивает создание иммунологических характеристик заболеваний. 2 н. и 39 з.п. ф-лы, 4 табл., 21 ил., 4 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет документа UUSN 61/120033, поданного 4 декабря 2008 года, который включен в настоящее описание в качестве ссылки в полном объеме.
ДЕКЛАРАЦИЯ ОТНОСИТЕЛЬНО ФИНАНСИРОВАНИЯ ИССЛЕДОВАНИЯ ФЕДЕРАЛЬНЫМ БЮДЖЕТОМ
Настоящее изобретение частично финансировалось правительством США, грант номер 5U19AI050864-07, выданный Национальным Институтом Здравоохранения. Правительство имеет определенные права на настоящее изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к способам обнаружения множественных цитокинов и взаимосвязанных поверхностно-экспрессируемых иммунофенотипических биомаркеров отдельно взятых клеток для создания иммунологических характеристик заболеваний.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Хорошо известно, что отдельные клетки, даже те, которые визуально идентичны, отличаются друг от друга множеством характеристик, таких как вариабельность экспрессии отдельного гена, концентрация особо важного метаболита или иона или характером ответа на приложенное раздражение. Живые клетки обладают очень низким количеством копий многих компонентов, включая дезоксирибонуклеиновую кислоту (ДНК) и важные регуляторные молекулы. Как случайные события, присущие биохимическому процессу экспрессии гена (собственный шум), так и изменения в других клеточных компонентах (внешний шум) вносят вклад по существу в общую изменчивость клеток. Типы клеток, мутации и изменения - все это вносит вклад в разнообразие клеток организма.
Однако при большинстве клинических или клеточных исследований проводится анализ клеток в большом объеме, с использованием сыворотки или культуральной среды для выращивания клеток. Эти исследования часто усредняют информацию о всей клеточной популяции и не дают подробной информации, которая является особо важной для оценки состояния биологической системы, например: 1) экспрессируются ли два или более гена совместно в одной и той же клетке или они экспрессируются в различных субпопуляциях клеток; 2) является ли небольшое увеличение экспрессии, измеренной в матрице, результатом небольшого, равномерного увеличения во всех клетках или большого увеличения в подмножестве клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В системе нано- или суб-наноразмерных исследований, способы изобретения предоставляют количественные измерения как комбинации, так и распределения скоростей секреции для множества (например, 2, 4, 5, 6, 8, 10, 20) секретируемых продуктов, например, цитокинов, высвобождаемых одновременно из разных жизнеспособных клеток. Способы предоставляют ответы на множество вопросов в одной системе исследования, включая: "кто" (фенотип или линия дифференцировки подробно исследуемой клетки), "что" (идентификация секретируемого продукта, например, цитокин, антитело, хемокин или фактор роста), "как часто" (частота встречаемости респондеров в популяции клеток), и "как много" (величина секреции, например, уровень количества каждого секретируемого продукта). Способы могут использоваться для обнаружения характера любой секреторной клетки, например, иммунной клетки, такой как T-клетка или B-клетка, но также могут использоваться для других секреторных клеток, таких как клетки, которые секретируют гормоны или ферменты. Характер секреции отдельной жизнеспособной клетки соответствует ее фенотипу или линии дифференцировки (например, определяемому визуально или при анализе) для получения характера секреции клетки. Характер секреции дает ценную информацию для диагностики заболевания или мониторинга ответов при терапевтическом вмешательстве.
Например, изобретение относится к способу диагностики иммунологического заболевания у больного, например, инфекционного заболевания, аутоиммунного заболевания или аллергии. В некоторых вариантах осуществления, исследуют единичные клетки (или несколько клеток) для обнаружения характера иммунного ответа человека, например, аллергического ответа. Сгруппированные количественные (многомерные) наборы данных, полученные способами по изобретению, используются для распознавания ответов клеток различных доноров на различные стимулы. Способы, описанные в настоящей заявке, также можно использовать для клинического мониторинга вакцин, терапевтических биологических лекарственных препаратов, хронических инфекций, аутоиммунных заболеваний и т.д.
В одном из аспектов, отличительным признаком изобретения является способ определения иммунных характеристик больного, например, характеристик секретируемых цитокинов. Способ предусматривает наличие суспензии клеток (например, живых клеток) больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку (причем каждая микролунка составляет менее 100×100×100 мкм3, например, 50×50×50 мкм3) в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок имеет субнанолитровый объем для единичной клетки. В одном из аспектов, клетками являются клетки цельной крови. В другом аспекте, клетками являются мононуклеарные клетки периферической крови (PBMC). Матрицу микролунок приводят в контакт с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения (например, средством для обнаружения цитокина), и при этом средство для обнаружения связывается с секретируемым продуктом (например, цитокином) клетки. В одном из аспектов, в способе используют по меньшей мере два средства для обнаружения по меньшей мере три средства для обнаружения, или по меньшей мере четыре средства для обнаружения. Уровень средства для обнаружения на субстрате измеряют, при этом уровень соответствует количеству секретируемого продукта единичной клетки, определяя посредством этого иммунные характеристики. Необязательно, средство для обнаружения выявляет панель секретируемых продуктов T-клетки. В другом аспекте, средство для обнаружения выявляет панель секретируемых продуктов T-хелпера 2 (Th2).
В одном из аспектов, скорость секреции определяют для каждого секретируемого продукта. В другом аспекте, определяют фенотип клетки. Необязательно, секретируемые продукты соответствуют поверхностно-экспрессируемым маркерам на клетках, которые различают линии дифференцировки.
Способ определения характеристики отдельной жизнеспособной клетки осуществляют с использованием следующих стадий: получения суспензии клеток больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок содержит единичную клетку в субнанолитровом объеме; приведение в контакт матрицы микролунок с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения, и при этом средство для обнаружения связывается с продуктом, секретируемым указанной клеткой для получения печатной микроматрицы; визуализации печатной матрицы для получения набора данных; фильтрования набора данных для идентификации локализаций на указанной матрице, состоящей из единичной клетки; и сравнение локализации с уровнями секретируемых продуктов, обнаруженными из локализаций единичных клеток, определяя посредством этого указанную иммунную характеристику отдельной жизнеспособной клетки. Необязательно, способ предусматривает идентификацию фенотипа или линии дифференцировки единственной клетки, а затем сравнение фенотипа или линии дифференцировки с уровнем секретируемых продуктов в точно установленной локализации.
В некоторых вариантах осуществления, характеристика представляет собой общий T-клеточный профиль, Th1-профиль, Th2-профиль, Th9-профиль, Th17-профиль или профиль другой секреторной клетки. Например, субстрат содержит соответствующие пары антител или множество антител для обнаружения интересующих цитокинов. Различные панели антител, используемые в качестве образцов, обнаруживающих пулы цитокинов, свидетельствуют об асимметричности ответа Th и специфичных ответов Th2 и Th1. Например, общая T-клеточная панель выявляет следующие цитокины IL-4/IL-10/IL-17/IFNγ. Увеличение одного или более цитокинов среди секретируемых продуктов подробно исследованной клетки свидетельствует о ее характеристике. Th2-панель содержит средства для обнаружения IL-4/IL-5/IL-9. Панель для обнаружения характеристик цитотоксического T-лимфоцита (CTL) или Th1 включает средства для обнаружения, которые выявляют IFNγ/MIP-1β/TNFα/перфорин/IL-2, где MIP и/или перфорин свидетельствуют об асимметричности в сторону CTL фенотипа, а IL-2 свидетельствуют об асимметричности в сторону Th1-фенотипа. Панель, содержащая средства для обнаружения, которые выявляют IFNγ/IL-10/IL-17/IL-22, подходит для оценки образцов слизистой оболочки, например, для определения иммунной характеристики клеток желудочно-кишечного тракта (в качестве средства для оценки заболевания/расстройства или предрасположенности к нему). Обнаружение изотипа антитела подходит для оценки аллергических реакций или предрасположенных к аллергии людей. Например, были разработаны панели средств для обнаружения для обнаружения следующих панелей антител (IgG1/IgA/IgE/IgG4 и IgG1/IgA/IgG3/IgM). Обнаружение увеличения изотипа антитела IgE свидетельствует об аллергической реакции к стимулирующему аллергену.
Характерный Th-пул содержит средства, которые выявляют интерлейкин-17 (IL-17), IL-10, IL-4, интерферон-γ (IFN-γ), IL-1b, IL-2, IL-6, IL-7, IL-8, IL-12, IL-21, IL-22, IL-23, макрофагальный воспалительный белок (MIP) 1b, MIP1a и/или Интерферон-индуцируемый белок (IP)-10. Характерный (Th2-пул) выявляет IL-4, IL-5, IL-13 и/или IL-9. В другом аспекте, клетки визуализируют на поверхностно-экспрессируемые маркеры (например, CD3, CD4, CD8, CD14, CD19, CD20, CD25, CD27, CD38, CD138, CD95, CD154, CD127). Эти маркеры согласуются с цитокиновыми характеристиками для каждой клетки, что отличает способы, описанные в настоящей заявке, от описанных ранее способов захвата.
В качестве альтернативы или в дополнение, в способе можно использовать средство для обнаружения идентифицирующего антитела, например, IgE, IgG1, IgG4, IgGA, IgG2, IgG3, IgM, IgA1 и/или IgA2. Предпочтительным средством для обнаружения цитокина является антитело, например, поликлональное или моноклональное антитело для цитокина. В качестве альтернативы, средством для обнаружения цитокина является аптамер.
В целом, используют любую биологическую ткань с цитокин-продуцирующими клетками. В некоторых вариантах осуществления, используют мононуклеарные клетки периферической крови (PBMC). При необходимости, клетки стимулируют перед помещением на пластичном планшете. Например, клетки стимулируют предполагаемым или известным аллергеном. В качестве альтернативы, клетки стимулируют пептидами, белками или исходными патогенами инфекционных агентов.
В некоторых вариантах осуществления, аллергеном является пищевой продукт. Например, пищевой продукт представляет собой молоко, яйцо, арахис, лесной орех, рыбу, моллюск, сою, пшеницу, яичные продукты, бобовые или морепродукты. В некоторых вариантах осуществления, аллергеном является лекарственный препарат, например, амоксициллин, пенициллин, сульфаниламидный препарат, барбитурат, противосудорожное средство, инсулин или йод. В некоторых вариантах осуществления, аллергеном является пыль, пыльца, перхоть домашних животных, латекс или хлор, или ядовитое вещество, связанное с укусом насекомого, например, укусом жала осы, огненного муравья или пчелы. В некоторых вариантах осуществления, аллергеном является биологическое терапевтическое средство, например, Г-КСФ (фильгастрим) и ГМ-КСФ (сарграмостим), EPO (эритропоэтин), РИТУКСАН® (ритуксимаб), ГЕРЦЕПТИН® (трастузумаб), гормон роста человека, БЕТАСЕРОН® (интерферон бета-1b), АВОНЕКС®, (интерферон-бета-1a или ЭНБРЕЛ® (этанерцепт).
В еще одном аспекте, отличительным признаком изобретения является способ оценки чувствительности к аллергену у больного. Способ предусматривает наличие суспензии клеток больного, нанесенной на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок, при этом по меньшей мере одна микролунка в матрице микролунок имеет единичную клетку. Предпочтительно, клетки приводят в контакт с тестируемым аллергеном. Матрицу микролунок приводят в контакт с субстратом, при этом субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения, указывающим на чувствительность к аллергену. Вслед за этим, средство для обнаружения выявляют, например, измеряют уровень средства для обнаружения. Уровень средства для обнаружения коррелирует с уровнем секретируемого продукта, например, цитокина или антитела, оценивая посредством этого чувствительность аллергена. В одном из примеров, средство для обнаружения идентифицирует цитокин, например, увеличение уровня цитокина Th2, например, IL-4, по сравнению с уровнем цитокина Th1, IFNγ, свидетельствует о том, что больной страдает аллергией или существует риск развития аллергии к указанному аллергену. В еще одном примере, средство для обнаружения выявляет изотип антитела, причем увеличение изотипа IgE по сравнению с другими изотипами, такими как IgG (в частности, IgG4, IgM или IgA), свидетельствует об аллергической реакции на стимулирующий аллерген и аллергии или предрасположенности к ней больного, клетка которого была получена.
В другом аспекте, отличительным признаком изобретения является способ определения набора цитокиновых характеристик больного, служащего признаком аутоиммунного заболевания или инфекционного заболевания. Сначала получают суспензию клеток больного, нанесенную на пластичный планшет, содержащий по меньшей мере одну микролунку в матрице микролунок. В одном из аспектов по меньшей мере одна микролунка в матрице микролунок имеет единичную клетку. Затем матрицу микролунок приводят в контакт с субстратом. В одном из аспектов, субстрат предварительно обрабатывают по меньшей мере одним средством для обнаружения цитокина. В завершении, выявляют средство для обнаружения цитокина и определяют набор цитокиновых характеристик, служащий признаком аутоиммунного заболевания или инфекционного заболевания. Набор цитокиновых характеристик, являющийся эталоном и служащий признаком аутоиммунного заболевания или инфекционного заболевания, имеет повышение уровня IFNγ или IL-2 по сравнению с нормальным уровнем указанного IFNγ или IL-2.
Иллюстративные аутоиммунные заболевания включают артрит (включая ревматоидный артрит), рассеянный склероз, иммуно-опосредованный сахарный диабет или сахарный диабет 1 типа, воспалительное заболевание кишечника, системную красную волчанку, псориаз, склеродермию и аутоиммунные заболевания щитовидной железы. Примеры инфекционных заболеваний включают, например, африканский трипаносомоз, холеру, криптоспоридиоз, лихорадку денге, гепатит A, гепатит B, гепатит C, ВИЧ/СПИД, грипп, малярию, японский энцефалит, малярию, корь, менингит, онхоцеркоз ("речную слепоту"), пневмонию, ротавирус, шистосомоз, шигеллез, острый фарингит, туберкулез, брюшной тиф и желтую лихорадку.
Еще в одном аспекте, изобретение относится к набору, который включает субстрат, пластичный планшет, выполненный с возможностью приема субстрата и обеспечения водонепроницаемого уплотнения между пластичным планшетом и субстратом, и инструкции для использования адаптируемой подложки и субстрата для идентификации видов, которые могут ассоциировать. Набор предпочтительно имеет множество микролунок и выполнен с возможностью приема субстрата и обеспечения водонепроницаемого уплотнения между пластичным планшетом и субстратом. Набор предпочтительно включает инструкции для использования пластичного планшета и субстрата для идентификации видов, которые могут ассоциировать.
Как использовано в настоящем описании, термин "ассоциировать" относится к взаимодействиям, таким как связывание, адсорбция, ионное притяжение или некоторые другие типы взаимодействия между двумя видами. В некоторых примерах, виды, которые ассоциируют, предпочтительно связываются друг с другом с константой ассоциации, равной по меньшей мере приблизительно 109 M-1 или более. Виды, которые связываются друг с другом с такими константами ассоциации, предусматривают легкое распознавание между видами, которые ассоциируют, и видами, которые не ассоциируют.
В соответствии с некоторыми примерами, пластичный планшет используют в способах и наборах, описанных в настоящей заявке. Как использовано в настоящем описании, "пластичный планшет" относится к устройству, которое может изгибаться, смещаться или деформироваться по меньшей мере в одном измерении при помещении в контакт с субстратом. Например, в некоторых конфигурациях пластичный планшет может включать материал, например, эластомерный материал, который в случае, если пластичный планшет приводят в контакт с субстратом, между пластичным планшетом и субстратом может быть образовано по существу водонепроницаемое уплотнение для замедления или для предотвращения выхода или утечки любой текучей среды в пластичном планшете.
Пластичный планшет изготавливают с помощью мягкой литографии и реплицирующего формования, и он состоит из биологически совместимого материала, который является нетоксичным и газопроницаемым. Пластичный планшет или субстрат, или они оба, содержат один или более материалов, выбранных из группы, состоящей из стекла, пластмассы, полистирола, поликарбоната, поли(диметилсилоксана), нитроцеллюлозы, поли(винилиденфторида) и металла. Металлом является один или более из золота, палладиума, платины, серебра, стали или их сплавов и смесей. В некоторых вариантах осуществления, субстратом является стеклянный планшет, пластмассовый планшет или шарик, и пластичные планшеты содержат матрицу микролунок. Пластичный планшет вдавливают в субстрат для образования герметичного, но обратимого уплотнения с субстратом. Матрица микролунок включает блок лунок, где лунка имеет диаметр, равный приблизительно 50 мкм, и глубину, равную приблизительно 50 мкм, при этом лунки разделены приблизительно на 50 мкм, или лунка имеет диаметр, равный приблизительно 100 мкм, и глубину, равную приблизительно 100 мкм, при этом лунки разделены приблизительно на 100 мкм. Размеры лунок подбирают таким образом, чтобы удерживать приблизительно 1 нанолитр или менее текучей среды. Иллюстративные способы для получения пластичных планшетов более подробно описаны в патенте США № 6180239 и патенте США № 6776094, полное раскрытие каждого из которых включено в настоящее описании в качестве ссылки в полном объеме.
Точное количество лунок или камер в пластичном планшете может изменяться. В некоторых примерах, пластичный планшет включает единственную большую микролунку, где могут быть скринированы единичные виды. Например, пластичный планшет включает единственный тип клетки, катализатор или другие выбранные виды, подлежащие скринингу. В конфигурациях, где пластичный планшет выполнен в виде матрицы, количество отдельных микролунок может изменяться от приблизительно 1, 4, 8, 24, 48, 96, 384, 1024, 2048, 5096 или более или любого значения между данными иллюстративными значениями.
Гравировальный планшет включает множество лунок, при этом каждая из лунок имеет менее чем 100 микрометров в диаметре и содержит единичную клетку. Предпочтительно, количество клеток составляет менее чем 5 клеток. Гравировальный планшет имеет соответствующий газопроницаемый состав. Планшет имеет модуль упругости (Модуль Юнга) в диапазоне, составляющем 200-2000 килопаскаль (кПа). Композиция планшета предпочтительно представляет собой поли(диметилсилоксан). Лунки планшета содержат по меньшей мере одну клетку. Данная клетка является иммунной клеткой, продуцирующей антитела клеткой, клеткой гибридомы, T-клеткой или другой клеткой из крови или ткани. Функция или характер секреции клетки или клеток неизвестны. Необязательно, клетка продуцирует рекомбинантный секретируемый полипептид.
В еще одном аспекте, изобретение относится к испытательному устройству, содержащему пластичный планшет, содержащий по меньшей мере одну микролунку, которая образует матрицу микролунок, которая приводит в контакт субстрат с одним или более средствами обнаружения цитокина, описанными в настоящей заявке, способом, обеспечивающим водонепроницаемое уплотнение между пластичным планшетом и субстратом. Устройство помещает один вид, в большинстве случаев клетку по меньшей мере в одну лунку матрицы микролунок. Размеры микролунок пластичного планшета подбирают и располагают таким образом, чтобы удерживать приблизительно один нанолитр или меньше объема текучей среды.
Если не определено иное, все технические и научные термины, использованные в настоящем описании, имеют такое же смысловое значение, которое обычно подразумевается рядовыми специалистами в области, к которой относится настоящее изобретение. Несмотря на то что при практическом применении или тестировании настоящего изобретения могут быть использованы способы и материалы, аналогичные или эквивалентные тем, что описаны в настоящей заявке, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, приведенные в настоящем описании, включены в качестве ссылки в полном объеме. В случае конфликта, настоящее описание, включая определения, будет иметь решающее значение. В дополнение, материалы, способы и примеры являются исключительно иллюстративными и не предназначены для ограничения.
Другие признаки и преимущества изобретения станут понятными из следующего подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
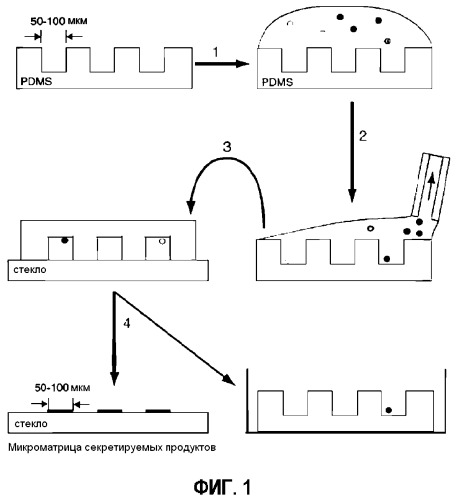
Фигура 1 представляет собой схематическое изображение процедуры микрогравирования. (1) Суспензию клеток наносят на матрицу микролунок, изготовленную с помощью мягкой литографии. (2) Клеткам предоставляют возможность осаждения в лунки, а затем избыточную среду удаляют с помощью аспирации. (3) Матрицу приводят в контакт с твердой подложкой, предварительно обработанной захватывающим антителом, слегка сдавливают и инкубируют в течение 1-2 ч. (4) Микролунки удаляют с твердой подложки и помещают обратно в среду. Стеклянный планшет обрабатывают идентифицирующими антителами.
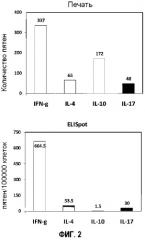
Фигура 2 представляет собой группу столбиковых диаграмм, демонстрирующих частоту встречаемости цитокин-секретирующих клеток, измеренную с помощью микрогравирования и иммуноферментного спот-анализа.
Фигура 3 представляет собой группу микрофотографий, иллюстрирующих квадриплексные наборы цитокиновых характеристик для CD4+ T-клеток, сформированные с помощью микрогравирования.
Фигура 4 представляет собой группу микрофотографий, показывающих квадриплексные наборы цитокиновых характеристик Th2 для CD4+ T-клеток, сформированных с помощью микрогравирования.
Фигура 5 представляет собой группу гистограмм, демонстрирующих квадриплексные цитокиновые исследования для PBMC человека, стимулированных (a) анти-CD3/анти-CD28, (b) фитогемагглютинином и (c) митогеном фитолакки. Данные показывают количество пятен, обнаруженных с помощью микрогравирования спустя 24 ч, 48 ч, и 72 ч стимулирования.
Фигура 6 показывает группу графиков, демонстрирующих количественное выражение секреции цитокинов отдельно взятых клеток. (A) Схематическое изображение конфигурации одной микролунки, содержащей единичную клетку, в процессе микрогравирования. (B) Графическое изображение рассчитанного количества анализируемого материала, накопленного в среде (o) и на поверхности стекла (•) в процессе микрогравирования, когда клетка секретирует с постоянной скоростью, составляющей 10 молекул/с. (C, D) Продуцирование IL-6 PBMC человека после стимулирования LPS в течение 3, 6 или 12 ч. (C) Гистограмма распределения скоростей секреции IL-6, измеренных с помощью микрогравирования после каждого стимулирования. (D) уровень мРНК IL-6, измеренный с помощью количественной ПЦР. (E) Гистограммы распределения скоростей секреции IL-6, измеренных с помощью микрогравирования, от двух доноров после стимулирования LPS, PHA и PWM. Значение n, показанное на (C) и (E), представляет собой нормированное общее количество клеток под каждой кривой.
Фигура 7 представляет собой пару графиков, демонстрирующих экспериментальный анализ измерений с использованием микрогравирования единственного анализируемого вещества. (A) Измерение IL-6, секретируемого отдельными PBMC человека. Клетки стимулировали на протяжении 48 ч. LPS (10 мкг/мл) и PWM (5 мкг/мл). Коробчатая диаграмма относительной интенсивности флуоресценции захваченного IL-6, как функции времени инкубирования. Минимальное количество событий, включенных в каждый короб, составляло 35. Сплошная линия была выстроена в соответствии с линейной регрессией средних значений. Статистические значения определяли с помощью двухстороннего критерия Стьюдента. (B) Измерение секреции антител из клеток HYB 099-01 гибридомы мышей (Анти-овальбумин, Statens Serum Institute). Секретируемый IgG захватывали с помощью смеси двух козлиных антимышиных IgG (от Zymed и Southern Biotech, по 50 мкг/мл каждого) и обнаруживали с помощью овальбумина Alexa 555 (Invitrogen, 2 мкг/мл). Количества живых клеток в микролунках определяли с помощью окрашивания Кальцеином фиолетовым AM (Invitrogen) после микрогравирования. Средние значения сигналов графически изображали как функцию чисел клеток, представленных в каждой лунке, для трех различных периодов инкубирования (15, 30, и 45 мин). Сплошные линии выстраивали с помощью линейной регрессии.
Фигура 8 представляет собой линейный график, который показывает рассчитанное количество захваченного анализируемого материала, как функцию скорости секреции и аффинности для захватывающих антител (KD). Сплошная линия представляет общее количество секретируемого анализируемого материала как функцию времени. θo представляет собой расчетную плотность центров связывания на стекле. Данные расчеты предполагают, что захватывающие антитела с низкой аффинностью (KD=10 нМ) могут преуменьшать скорости секреции приблизительно в два раза.
Фигура 9 представляет собой микроснимок стандартного контрольного планшета (A) и калибровочную кривую образца (B), использованную для вычисления скорости секреции клеток. Группу разведенных, флуоресцентно меченых идентифицирующих антител наносили в виде пятен на стекле (1 мкл/пятно) в указанных концентрациях, и среднюю интенсивность флуоресценции каждого пятна наносили на график для создания калибровочной кривой (сплошная линия).
Фигура 10 представляет собой микрофотографию и серию диаграмм, демонстрирующих квадриплексный анализ цитокинов из отдельно взятых клеток. PBMC человека стимулировали PMA/иономицином в течение 6 ч. (A) Характерные изображения отдельных клеток в микролунках сравнивали с микроснимками из соответствующей микроматрицы цитокинов (расположенных в рядах). Первая колонка показывает составные микроснимки микролунок (фазовый контраст) и клеток (Кальцеин AM). Оставшиеся четыре колонки представляют собой микроснимки, полученные из сравнения локализации на печатной микроматрице для каждого из четырех цитокинов (IL-17, синий; IFNγ, зеленый; IL-2, желтый; TNFα, красный). Оранжевые прямоугольники за пределами изображений указывают на позитивные пятна в каждом ряду (MFI > фон + 3σ). (B) Гистограммы скоростей секреции для каждого цитокина, упорядоченных в соответствии с комбинациями продуцированных цитокинов. Цвета присвоены в соответствии с (A). Вложенные ряды квадратов в каждой гистограмме показывают комбинацию цитокинов, продуцированных клетками, представленными на графике. Значения n на каждой гистограмме представляют собой нормированное общее количество цитокин-продуцирующих клеток на 100000 клеток. Гистограммы построили на данных из трех независимых экспериментов.
Фигура 11 представляет собой микрофотографию, показывающую характерные изображения редко встречающихся функциональных клеток в групповом обнаружении. Первая колонка показывает составные микроснимки микролунок (фазовый контраст) и клеток (Кальцеин AM). Оставшиеся четыре колонки представляют собой микроснимки, полученные из сравнения локализации на печатной микроматрице для каждого из четырех цитокинов (IL-17, синий; IFNγ, зеленый; IL-2, желтый; TNFα, красный). Оранжевый прямоугольник за пределами изображения обозначает позитивные пятна в каждом ряду (MFI > фон + 3 SD).
Фигура 12 представляет собой пару гистограмм, показывающих скорости секреции, измеренные для CD4 и CD8 T-клеток, продуцирующих (A) IFNγ или (B) IL-2. n представляет собой количество рядов клеток после микрогравирования, несущих обозначенные маркеры поверхности (p=0,055 для IFNγ, p=0,94 для IL-2).
Фигура 13 представляет собой группу графиков, демонстрирующих корреляцию совместно секретируемых цитокинов. (A) Двумерные графики рассеяния скоростей секреции для пары цитокинов из двойных продуцентов IFNγ/IL-2, IFNγ/TNFα и IL-2/TNFα. Цвет каждой оси показывает тип цитокина в данном измерении (IFNγ, зеленый; IL-2, желтый; TNFα, красный). Каждая точка изображает одну клетку, где значения x и y представляют собой скорости секреции для пары цитокинов; r представляет собой коэффициент корреляции, а р представляет собой вероятность отсутствия корреляции. (B) Двумерные графики каждой пары цитокинов для тройных продуцентов IFNγ/IL-2/TNFα. (C) Графики рассеяния скоростей для CD4 (синий) и CD8 (красный) IFNγ/IL-2 (верхняя панель) и IFNγ/TNFα (нижняя панель) T-клеток. Число n представляет собой общее количество пятен на графиках.
Фигура 14 представляет собой иллюстрацию механизма амплификации по типу катящегося кольца. Идентифицирующее антитело конъюгируют с олигонуклеотидом. Кольцо ДНК скрещивают с комплементарной последовательностью в олигонуклеотиде и амплифицируют посредством полимеразной цепной реакции (ПЦР). В заключение, амплифицированную последовательность ДНК метят in situ с помощью гибридизации с флуоресцетномечеными олигонуклеотидами.
Фигура 15 представляет собой иллюстрацию схемы обнаружения множественных цитокинов с использованием амплификации по типу катящегося кольца (RCA). Каждый тип идентифицирующего антитела связан с уникальной олигонуклеотидной последовательностью. Четыре кольца ДНК с комплементарной последовательностью праймеров используют для амплификации праймеров. Четыре репортерные последовательности метят различными флуорофорами для гибридизации длинных цепей ДНК.
Фигура 16 представляет собой изображение, показывающее схему последовательной маркировки на основании RCA для обнаружения множественных цитокинов. После процесса RCA, как показано выше, для обнаружения соответствующих последовательностей в систему добавляют первый набор репортерных последовательностей с флуоресцентной маркировкой. После сканирования планшеты обрабатывают либо ферментом для специфичного расщепления двойной нити ДНК или химическим реагентом для расщепления линкера между репортерной последовательностью и флуорофором. После данного процесса амплифицированные последовательности для первого пула цитокинов деактивируют. Затем к системе применяют второй пул репортерных последовательностей с флуорофором для обнаружения еще одного пула цитокинов. Весь процесс обнаружения может быть повторен несколько раз.
Фигура 17 представляет собой группу иллюстраций, иллюстрирующих проблему существующей в настоящее время аллергической пробы.
Фигура 18 представляет собой группу иллюстраций и графиков, демонстрирующих осуществление способа микрогравирования, описанного в настоящей заявке.
Фигура 19 представляет собой группу иллюстраций, составляющих характеристику аллергического ответа.
Фигура 20 представляет собой схематическое изображение, рисующее анализ микроматричных данных.
Фигура 21 представляет собой блок-схему, демонстрирующую составление иммунной характеристики на основании типа клетки, величины секреции и частоты встречаемости респондеров.
Рядовым специалистам в данной области, получающим пользу от данного раскрытия, должно быть понятно, что примеры, показанные на Фигурах, нарисованы необязательно в масштабе. Некоторыми признаки или компоненты могли быть увеличены, уменьшены или деформированы для облегчения лучшего понимания иллюстративных аспектов и примеров, раскрытых в настоящем описании. В дополнение, использование затемнения, рисунков, пунктиров и тому подобное на Фигурах не предназначено для предположения или обозначения какого-либо особого материала или ориентации, если иное не ясно из контекста.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способам мультиплексного захвата цитокинов. Изобретение также предусматривает сравнение цитокинов с поверхностно-экспрессируемыми маркерами на клетках, которые различают линии дифференцировки, и количественное определение скоростей секреции для повышения размерности данных. Области контакта идентифицируют с помощью дифференциальной маркировки.
Более конкретно, изобретение предоставляет измерение частоты встречаемости клеток-респондеров, сопровождающих поликлональные митогены/аллергены (например, митоген фитолакки (PWM) и фитогемагглютинин (PHA)), а также TCR-специфичную активацию (например, анти-CD3/CD28). Скорости секреции количественно определяют исходя из собранных данных. Такие дополнительные данные предусматривают возможность оценки как частоты встречаемости, так и величины (распределения) ответов. Такой дополнительный параметр важен для улучшения анализа цитокинового ответа. Как описано ниже, специфичный пример включает измерение секреции IL-6 (маркера раннего воспалительного ответа) PBMC у двух различных доноров после стимулирования PWM, PHA и т.д. Как описано ниже, частота встречаемости клеток-респондеров варьирует, но не совпадает с величиной ответов. Статистические проверки показывают, что распределения являются уникальными. Такие многомерные данные улучшают качество иммунного мониторинга заболеваний (например, аллергии, инфекционных, аутоиммунных и т.д.). Данные измерения осуществляют более чем для одного цитокина (по меньшей мере для четырех) на клетку.
Как описано ниже, поверхностно-экспрессируемые фенотипические маркеры (например, CD4 и CD8) сравнивают с отдельными измерениями, дополнительно усовершенствуя анализ данных для идентификации уникальных подмножеств с помощью визуализации цитометрии и соответствующего высвобождения цитокина. Скорости секреции для различных цитокинов привязывают к единичным клеткам. Способы, описанные в настоящей заявке, предусматривают сгруппированные количественные (многомерные) наборы данных, причем данные показывают, что такие измерения используют для распознавания ответов клеток от различных доноров на различные стимулы. Варианты применения изобретения включают аллергические пробы, клинический мониторинг вакцин, терапевтические биологические лекарственные препараты, непрерывные инфекции, аутоиммунные заболевания и т.д.
Изобретение относится к способам и композициям для тестирования чувствительности людей к одному или более аллергенам с помощью исследования уровней цитокинов, которые являются характеристикой аллергической реакции. Аллергия представляет собой один тип гиперчувствительности иммунной системы, причиной которой является контактирование с окружающими веществами, известными как аллергены. Аллергия представляет собой всемирное эпидемическое заболевание. Аллергический иммунный ответ требует сенсибилизации и развития специфичного иммунного ответа по отношению к аллергену. В процессе сенсибилизации к аллергену, активация аллерген-специфичных CD4+ Th2-клеток приводит к продуцированию цитокинов Th2 (таких как IL-4 и IL-13), которые являются ответственными за возникновение переключения класса на IgE в B-клетках, образование слизи и активацию эндотелиальных клеток для Th2-клеток и миграцию эозинофилов в ткани. IgE повышает чувствительность тучных клеток и базофилов посредством связывания с высокоаффинным рецептором для IgE (FcεRI), экспрессируемого на их поверхности. При перекрестном связывании комплексов IgE-FcεRI посредством аллергена тучные клетки и базофилы дегранулируют, высвобождают вазоактивные амины (в первую очередь гистамин), липидные медиаторы (простагландины и цистеиниловые лейкотриены), цитоки