Способ моделирования генерализованного амилоидоза у животных
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной нефрологии, и может быть использовано для моделирования генерализованного амилоидоза у животных для изучения патогенеза, профилактики и лечения амилоидоза. Способ включает введение сирийским хомякам нативной овечьей плазмы подкожно через день из расчета 0,025 мл/г массы тела. Введение осуществляют в течение 30 дней эксперимента. Способ, являясь легко воспроизводимым, обеспечивает сокращение сроков моделирования указанной патологии за счет большей антигенности выбранного белкового препарата для данного вида животных. При этом способ позволяет успешно изучать функциональное состояние системы почек, минерального обмена и других показателей организма животных. 1 пр., 2 табл., 4 ил.
Реферат
Данное изобретение относится к медицине, экспериментальной патологии и может быть использовано для моделирования экспериментального амилоидоза у животных, изучения патогенеза, профилактики и лечения амилоидоза, особенно при исследовании функционального состояния почек.
Амилоидоз (амилоидная дистрофия) - нарушение белкового обмена, сопровождающееся образованием и отложением в тканях специфического белково-полисахаридного комплекса - амилоида.
Развитие амилоидоза связано с извращением белково-синтетической функции ретикуло-эндотелиальной системы, накоплением в плазме крови аномальных белков, служащих аутоантигенами. В результате взаимодействия антигена с антителом происходит осаждение грубодисперсных белков, участвующих в образовании амилоида. Откладываясь в тканях (например, в стенках сосудов, железистых и т.п.), амилоид вытесняет функционально специализированные элементы органа.
Амилоид является сложным гликопротеидом, в котором фибриллярные и глобулярные белки тесно связаны с полисахаридами. Амилоид состоит из полипептидных цепей, что определяет двойное лучепреломление при окраске конго красным, свойственное амилоиду. Кроме фибриллярного белка, в состав амилоида входит другой белок - так называемый Р-компонент, который одинаков при всех формах амилоидоза.
Установлено, что амилоид содержит альбумины, глобулины, фибриноген, фибрин; среди плазменных белков преобладает γ-глобулин (Dammacco F. Amyloidosis: clinical picture, immunological and biomolecular features, treatment prospects // Ann. Ital. Med. Int. -1991. - Jan-Mar. - 6 (1 Pt 2). - P.107-116.
Однако механизмы формирования амилоидных отложений и нарушения функций органов при этом изучены крайне слабо.
Известен классический способ моделирования экспериментального амилоидоза (Грицман А.Ю. Некоторые вопросы экспериментальной терапии амилоидоза и резорбции амилоида // Автореф. дисс. на соиск. уч. ст. канд. мед. наук. М., 1974), заключающийся во введении белым мышам через день по 0,5 мл 5% казеината натрия подкожно в течение 60 дней. Недостатком его является то, что приготовление раствора казеината связано с определенными сложностями, такими как поиск чистого казеина, необходимость растворения его точной навески в кипящем 0,25% растворе гидроокиси натрия, фильтрование, стерилизация, хранение. Готовый раствор казеината натрия имеет щелочную реакцию, высокое содержание натрия, что резко ограничивает применение данной модели при исследовании функционального состояния почек, системы кровообращения, минерального обмена и других показателей, связанных с влиянием натрия и его определением.
Также известен способ моделирования экспериментального амилоидоза у животных (патент РФ на изобретение №2269825, Заалишвили Т.В., Козырев К.М., зарегистрированный 20.02.2009 г., заявка №2004127649/14 от 15.09.2004 г., МПК' G09B 23/28), заключающийся во введении белым мышам через день по 1 мл нативного яичного альбумина подкожно в течение 30 дней эксперимента.
Недостатком способа является то, что белые мыши являются мелкими животными, что значительно усложняет исследование функционального состояния различных систем экспериментальных животных. Учитывая то, что у белых мышей объем получаемой крови после декапитации не превышает 1,0 мл, затрудняется ее использование для нужд биохимических и патофизиологических исследований. Также затруднено исследование функционального состояния почек из-за малых физиологических объемов и анатомических размеров, а также сложность и длительность воспроизведения модели амилоидоза.
За прототип взят способ моделирования экспериментального амилоидоза у животных (патент РФ на изобретение №2347279, Пухова И.У., Козырев К.М., Брин В.Б., зарегистрированный 20.02.2009 г. заявка №2007135901/14 от 27.09.2007 г., МПК' G09B 23/28), заключающийся во введении сирийским хомякам нативной свиной плазмы через день подкожно из расчета 0,025 мл/г массы тела в течение 60 дней эксперимента.
Недостатком прототипа является то, что в эксперименте используется свиная плазма, обладающая меньшей антигенностью и вводимая в течение 60 дней.
Заявляемое изобретение направлено на решение задачи, заключающейся в разработке способа моделирования генерализованного амилоидоза у животных.
Решение этой задачи обеспечивает расширение возможностей моделирования генерализованного амилоидоза у животных, особенно при исследовании функционального состояния системы почек, минерального обмена и других показателей экспериментальных животных.
Предлагаемый способ отличается от прототипа тем, что для моделирования генерализованного амилоидоза используется нативная овечья плазма (обладающая большими антигенными свойствами) из расчета 0,025 мл/г массы тела в течение 30 дней эксперимента с целью получения и возможности изучения патогенеза, профилактики и лечения амилоидоза, особенно при исследовании функционального состояния почек. Введение нативной овечьей плазмы приводит к развитию системного вторичного амилоидоза с преимущественным поражением почек, селезенки, печени и миокарда в течение 30 дней эксперимента.
Поставленная задача достигается тем, что способ моделирования генерализованного амилоидоза у животных включает введение сирийским хомякам белкового препарата подкожно через день из расчета 0,025 мл/г массы тела и отличается тем, что в качестве белкового препарата сирийским хомякам вводят нативную овечью плазму в течение 30 дней эксперимента.
Заявленный способ является эффективным, экономически выгодным и легко воспроизводимым.
По имеющимся у автора сведениям совокупность существенных признаков, характеризующих сущность заявляемого изобретения, не известна, что позволяет сделать вывод о соответствии изобретения критерию «новизна».
Экспериментальным животным (сирийские хомяки-самцы массой тела 100-120 г) в качестве белкового препарата вводят нативную овечью плазму (белки которой обладают наибольшей антигенностью) через день из расчета 0,025 мл/г массы тела в течение 30 дней эксперимента, что обеспечивает расширение возможностей моделирования генерализованного амилоидоза у животных, благодаря более быстрому развитию патологии, особенно при исследовании функционального состояния почек, системы кровообращения, минерального обмена и других показателей экспериментальных животных, что позволяет сделать вывод о соответствии критерию «изобретательский уровень».
Совокупность существенных признаков, характеризующих сущность изобретения, в принципе может быть многократно использована в медицине с получением результата, заключающегося в эффективном и быстро воспроизводимом способе моделирования генерализованного амилоидоза у животных, что позволяет сделать вывод о соответствии изобретения критерию «промышленная применимость».
Данный способ осуществляется следующим образом.
Для получения генерализованного амилоидоза в качестве экспериментальных животных выбраны половозрелые сирийские хомяки-самцы массой 100-120 г.
Для моделирования генерализованного амилоидоза экспериментальным животным проводятся подкожные инъекции нативной овечьей плазмы через день из расчета 0,025 мл/г массы тела в течение 30 дней. Нативная овечья плазма получается из крови овец, забиваемых на бойне. Кровь из сонной артерии собирается в стерильный сосуд с предварительным добавлением гепарина из расчета 5000 Ед./л крови. Сосуд накрывается стерильной полиэтиленовой крышкой. Стабилизированная кровь разливается в центрифужные пробирки и центрифугируется при скорости 2500 оборотов в минуту в течение 15 мин. Далее полученная плазма собирается с помощью стерильного шприца емкостью 20 мл и разливается в пластиковые пробирки и замораживается при температуре -10°C. Перед проведением инъекций плазма размораживается при температуре 30°C.
У контрольных и опытных животных исследуется 6-часовой спонтанный диурез. Клубочковая фильтрация определяется по клиренсу эндогенного креатинина, рассчитывается канальцевая рабсорбция воды. Содержание натрия и калия в моче определяется методом пламенной фотометрии, содержание кальция - спектрофотометрически. Основные процессы мочеобразования и экскреция электролитов определяются по истечении 15 и 30 дней эксперимента.
По истечении времени эксперимента (1 мес) животные забиваются под наркозом. Морфологическому исследованию на предмет выявления амилоидоза (окраска гематоксилином и эозином, конго-красным) подвергаются внутренние органы. Образцы тканей фиксируются в 10% нейтральном формалине с последующим приготовлением парафиновых срезов толщиной 5-6 микрон. Срезы окрашиваются гематоксилином и эозином, Конго красным. Изучение срезов проводится в проходящем свете при помощи микроскопа Микмед-1 под увеличением х 80, х 200, х 400. Сущность заявляемого способа подтверждается функционально и морфологически.
Исследования показали, что в условиях спонтанного диуреза на фоне подкожного введения нативной овечьей плазмы отмечается увеличение диуреза через 1 месяц (табл. 1). Увеличение диуреза обусловлено снижением канальцевой реабсорбции воды.
| Таблица 1 | |||||
| Изменения объема спонтанного диуреза и основных процессов мочеобразования при формировании амилоидной нефропатии | |||||
| Условия опыта | Статистич. показатель | Процессы мочеобразования | Содержание белка мг/мл | ||
| Диурез мл/час/100 | СКФ м/час/100 | Реабсорбция% | |||
| Фон | М±m | 0,15±0,007 | 21,89±1,065 | 99,32±0,026 | 0,89±0,096 |
| 1 мес. эксперимента | М±m | 0,21±0,007 | 22,0±0,905 | 99,03±0,031 | 1,79±0,046 |
Экскреция калия и кальция под влиянием амилоидогена в условиях спонтанного 6-часового диуреза повышается на протяжении эксперимента более чем в 1,5 раза (табл.2).
| Таблица 2 | ||||
| Изменения экскреции электролитов с мочой при формировании амилоидной нефропатии | ||||
| Условия опыта | Статистич. показатель | Электролитовыделительная функция | ||
| Экскреция Na | Экскреция К | Экскреция Са | ||
| Фон | М±m | 11,18±0,389 | 6,76±0,394 | 0,55±0,043 |
| 1 мес эксперимента | М±m | 10,82±0,805 | 11,67±0,492 | 0,99±0,093 |
Под влиянием введения нативной овечьей плазмы отмечалось прогрессивное увеличение протеинурии в 2 раза на 30 день эксперимента (табл. 1).
Морфологически отмечалось:
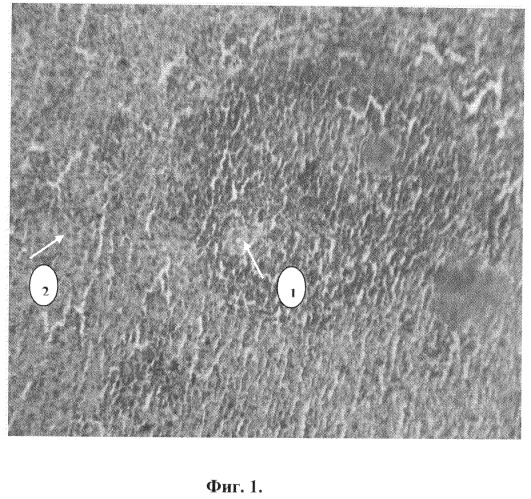
Фиг.1. Плазматическое пропитывание стенок центральных артерий лимфоидных фолликулов, периваскулярный отек (1), переходящий на межклеточные пространства с накоплением конгофильных субстанций (2).
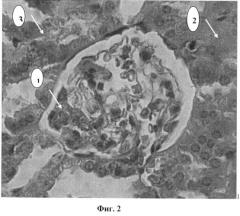
Фиг.2. Конгофилия сосудистого клубочка (1), базальных мембран канальцев (2) и стромально-сосудистых структур почки (3). Окраска Конго красным.
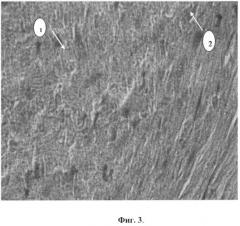
Фиг.3. Набухание кардиомиоцитов, очаговое исчезновение поперечной исчерченности (1) и очаговая конгофилия отдельных групп кардиомиоцитов (2).
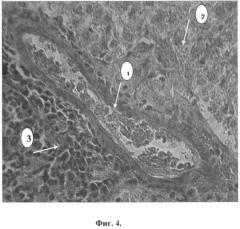
Фиг.4. Конгофилия сосудистой стенки (1), мелкокапельная жировая дистрофия и некроз гепатоцитов (2), периваскулярный лимфогистиоцитарный инфильтрат (3).
Пример
Проведены серии опытов из 2-х групп:
1-я группа (10 сирийских хомяков-самцов) - контрольная,
2-я группа (10 сирийских хомяков-самцов) - амилоидная - животным проводились подкожные инъекции нативной овечьей плазмой через день из расчета 0,025 мл/г массы тела сирийских хомяков-самцов в течение 30 дней.
Морфологическому исследованию на предмет выявления амилоидоза (окраска конго-красным) подвергнуты внутренние органы, кровеносные сосуды.
В результате проведенных исследований получены морфологические доказательства эффективности применения нативной овечьей плазмы для моделирования экспериментального амилоидоза у сирийских хомяков-самцов.
Гистологически у 2-й группы животных в почках (фиг.2) при окраске срезов Конго-красным отмечалась очаговая конгофилия микроциркуляторного русла, сосудов и стромальных структур коркового и мозгового слоев почки, гиперемия, плазматическое пропитывание и периваскулярный отек, наиболее выраженный в корковом слое. Гипертрофия отдельных клубочков со сдавлением набухшими капиллярами мальпигиева тельца капсулы Шумлянского-Боумена. Таким образом, морфологически документируются начальные проявления модели системного амилоидоза, полученного путем подкожного введения нативной овечьей плазмы в течение 30 дней.
Исходя из полученных результатов исследования обосновывается использование нативной овечьей плазмы для моделирования амилоидоза у сирийских хомяков.
Подводя итог, следует отметить, что подкожное введение сирийским хомякам нативной овечьей плазмы является эффективным способом моделирования экспериментального амилоидоза.
Способ моделирования генерализованного амилоидоза у животных, включающий введение сирийским хомякам белкового препарата подкожно через день из расчета 0,025 мл/г массы тела, отличающийся тем, что в качестве белкового препарата сирийским хомякам вводят нативную овечью плазму в течение 30 дней эксперимента.