Фармацевтически приемлемые соли тимодепрессина и способ их получения
Иллюстрации
Показать всеИзобретение относится к фармацевтически приемлемым кристаллическим или аморфным солям D-изоглутамил-D-триптофана, способам их получения, фармацевтическим композициям, которые их содержат, и их применению для получения фармацевтических композиций для лечения различных состояний и/или заболеваний. В частности, данное изобретение относится к калиевой соли D-изоглутамил-D-триптофана (1:1) и магниевой соли D-изоглутамил-D-триптофана (2:1). 20 н. и 2 з.п. ф-лы, 15 ил., 13 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым кристаллическим и аморфным фармацевтически приемлемым солям D-изоглутамил-D-триптофана. В частности, данное изобретение касается калиевой соли D-изоглутамил-D-триптофана (1:1), литиевой соли D-изоглутамил-D-триптофана (1:1), кальциевой соли D-изоглутамил-D-триптофана (2:1), магниевой соли D-изоглутамил-D-триптофана (2:1) и органических аммонийных солей D-изоглутамил-D-триптофана (1:1), свойства которых улучшены по сравнению с аморфным D-изоглутамил-D-триптофаном, кристаллическим D-изоглутамил-D-триптофаном и динатриевой солью D-изоглутамил-D-триптофана. Данное изобретение также относится к способам получения таких новых солей D-изоглутамил-D-триптофана.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
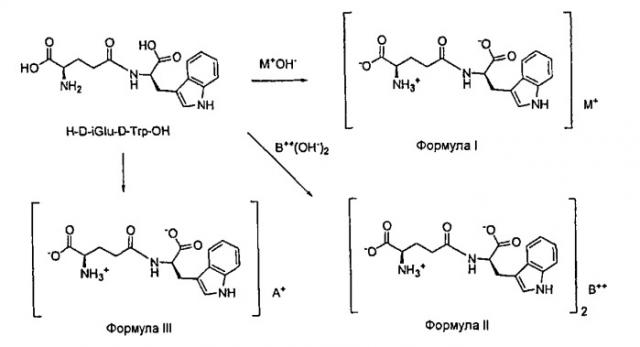
Соединение D-изоглутамил-D-триптофан (также известное как H-D-iGlu-D-Trp-OH или тимодепрессин) представляет собой синтетический геморегуляторный дипептид следующей формулы:
Тимодепрессин представляет собой свободную двухосновную кислоту, которой присвоен регистрационный номер® согласно Chemical Abstracts Service (CAS) 186087-26-3. Патент США 5736519 раскрывает H-D-iGlu-D-Trp-OH и способ его получения, в ходе которого соединение очищают ионообменной хроматографией. Соединение является иммунодепрессантом и выборочно ингибирует пролиферацию гемопоэтических клеток-прекурсоров и стимулирует апоптоз гранулоцитов и апоптоз лимфоцитов (Sapuntsova, S.G., et al. (May 2002), Bulletin of Experimental Biology and Medicine, 133(5), 488-490).
Тимодепрессин в настоящее время продается в России в виде динатриевой соли D-изоглутамил-D-триптофана в виде жидкого препарата для инъекций и в форме для интраназального применения для лечения псориаза и атопического дерматита. Твердая форма динатриевой соли D-изоглутамил-D-триптофана представляет собой аморфный порошок, который является гигроскопичным и очень сложным в обращении. Молекулярная формула динатриевой соли D-изоглутамил-D-триптофана C16H17N3Na2O5. Ее химическая структура представлена ниже:
и описана в Kashirin, D.М., et al. (2000), Pharmaceutical Chemistry Journal, 34(11), 619-622.
При проведении исследований авторы изобретения установили, что лиофилизированная динатриевая соль D-изоглутамил-D-триптофана является чрезвычайно гигроскопичной, в течение нескольких минут превращается в гель на воздухе и является сложной в обращении.
Порошкообразная или аморфная форма соединения, предназначенного для фармацевтического применения, может приводить к производственным проблемам, связанным с насыпной плотностью, гигроскопичностью и переменным содержанием воды, которое не может быть отрегулировано сушкой в вакууме. D-изоглутамил-D-триптофан представляет собой дипептид, и сушка аморфной формы при повышенной температуре, например, 80-100°C, в вакууме не рекомендуется. Таким образом, существуют серьезные трудности, с которыми сталкиваются в ходе способа очистки динатриевой соли D-изоглутамил-D-триптофана и получения чистой динатриевой соли в производственных масштабах. Более того, не существует опубликованной методики ее получения.
Мононатриевая соль D-изоглутамил-D-триптофана идентифицирована Chemical Abstracts Services (CAS) и приведена в реестрах CAS REGISTRYSM под регистрационным номером CAS® 863988-88-9. Однако, нет никаких ссылок, где упоминалось бы вещество, и, следовательно, отсутствуют опубликованные данные относительно его идентичности, физических и/или химических свойств, характеристик или способа его получения. Лиофилизированный порошок мононатриевой и динатриевой соли пептидных лекарственных препаратов не может обеспечить контролируемого диапазона насыпной плотности порошка для рецептуры. Он может требовать значительных инвестиций в технологию диспергирования лиофилизированного материала.
Таким образом, существует необходимость в разработке альтернативных кристаллических фармацевтически приемлемых солей D-изоглутамил-D-триптофана. Такие кристаллические соли в целом могут быть очищены более простыми способами по сравнению с аморфной формой и могут обладать другими предпочтительными свойствами, например, с точки зрения их специфической кристаллической формы, и/или их характеристик растворимости, и/или отсутствия гигроскопичности, и/или их характеристик стабильности, в том числе свойств их термической стабильности, и/или их способности подвергаться окислительному разложению.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Задача настоящего изобретения состояла в разработке ряда новых стабильных, фармацевтически приемлемых солей тимодепрессина, пригодных для получения фармацевтических препаратов.
Не все соли D-изоглутамил-D-триптофана являются химически стабильными (например, аморфная динатриевая соль). Однако, авторы изобретения получили новые стабильные металлические и органические аммонийные соли D-изоглутамил-D-триптофана (H-D-i-Glu-D-Trp-OH), которые являются предметом настоящего изобретения.
В одном аспекте по настоящему изобретению предлагаются новые соли D-изоглутамил-D-триптофана. Такие новые формы соли представляют собой соединения формулы I:
где M выбирают от группы, состоящей из лития и калия;
формулы II:
где B выбирают от группы, состоящей из магния и кальция; и формулы III:
где A выбирают из группы, состоящей из трет-бутиламмония, трис(гидроксиметил)метиламмония и метил-(2,3,4,5,6-пентагидроксигексил)аммония.
Конкретно, в новых солях формулы I катион лития или калия заменяет один атом водорода в карбоксильном фрагменте соединения D-изоглутамил-D-триптофана. Авторы изобретения установили, что новые соли формулы I по настоящему изобретению, где M представляет собой калий (т.е. монокалиевая соль D-изоглутамил-D-триптофана), могут существовать в различных формах, в частности, в аморфной или в некристаллической форме, а также в кристаллической форме. Авторы изобретения также установили, что новые соли формулы I по настоящему изобретению, где M представляет собой литий (т.е. монолитиевая соль D-изоглутамил-D-триптофана), могут существовать в различных формах, в частности, в аморфной или некристаллической форме, а также в кристаллической форме. Таким образом, данное изобретение касается монолитиевых и монокалиевых солей D-изоглутамил-D-триптофана в любой из их форм.
В другом аспекте настоящего изобретения предлагаются новые литиевые соли и калиевые соли D-изоглутамил-D-триптофана, соединения формулы I.
В еще одном аспекте настоящего изобретения предлагается кристаллическая калиевая соль D-изоглутамил-D-триптофана, соединение формулы I.
В еще одном аспекте настоящего изобретения предлагается кристаллическая литиевая соль D-изоглутамил-D-триптофана, соединения формулы I.
Данное изобретение также касается кристаллической формы магниевой соли D-изоглутамил-D-триптофана и полукристаллической формы кальциевой соли D-изоглутамил-D-триптофана, где катион кальция или магния заменяет один атом водорода в карбоксильном фрагменте соединения D-изоглутамил-D-триптофана. Кальциевая или магниевая соль D-изоглутамил-D-триптофана образуется в соотношении 2:1, как иллюстрируется формулой II.
Авторы изобретения установили, что магниевая соль по настоящему изобретению (т.е. магниевая соль тимодепрессина [1:2]) существует в кристаллической форме, в то время как кальциевая соль по настоящему изобретению (т.е. кальциевая соль тимодепрессина [1:2]) является полукристаллической с процентом кристалличности, не превышающим примерно 67%.
В другом аспекте настоящего изобретения предлагается новая кристаллическая магниевая соль D-изоглутамил-D-триптофана, соединение формулы II.
В еще одном аспекте настоящего изобретения предлагается кальциевая соль D-изоглутамил-D-триптофана, соединение формулы II.
Данное изобретение также касается органических солей амина формулы III, где A выбирают из группы, состоящей из трет-бутиламмония, трис(гидроксиметил)метиламмония и метил-(2,3,4,5,6-пентагидроксигексил)-аммония. Авторы изобретения установили, что такие соли формулы III являются аморфными.
В другом аспекте настоящего изобретения предлагается новая трет-бутиламмонийная, трис(гидроксиметил)метиламмонийная, метил-(2,3,4,5,6-пентагидроксигексил)-аммонийная соль D-изоглутамил-D-триптофана, соединение формулы III.
В еще одном аспекте настоящего изобретения предлагается способ получения солей формул I, II и III из дипептида D-изоглутамил-D-триптофана.
В еще одном аспекте настоящего изобретения предлагается способ получения указанных солей D-изоглутамил-D-триптофана (соединение формулы I и II) в результате солевого обмена D-изоглутамил-D-триптофана аммонийной соли (1:1).
В более ранней патентной заявке, поданной в Канаде 28 ноября 2006 г., заявитель раскрывает способы получения D-изоглутамил-D-триптофана и его моноаммонийной соли, новой стабильной кристаллической формы D-изоглутамил-D-триптофана и его моноаммонийной соли. D-изоглутамил-D-триптофан и его моноаммонийная соль, используемая в настоящем изобретении, могут быть получены при помощи способа, описанного в вышеуказанной патентной заявке.
В другом аспекте настоящего изобретения предлагается фармацевтическая композиция, в состав которой входит любая из новых солей, описанных выше, и как минимум один фармацевтически приемлемый носитель.
Фармацевтическая композиция может быть получена путем объединения любой из новых солей, описанных выше, и как минимум одного фармацевтически приемлемого носителя. В другом аспекте настоящего изобретения предлагается способ создания фармацевтической композиции, в состав которой входит любая из новых солей, описанных выше, и как минимум один фармацевтически приемлемый носитель.
В другом аспекте настоящего изобретения предлагается применение любой из новых солей, описанных в данном изобретении, с получением лекарственного средства для лечения псориаза у субъекта, нуждающегося в таком лечении.
Другой признак кристаллических солей по настоящему изобретению состоит в том, что они могут также использоваться в качестве промежуточных соединений в получении некристаллической соли для того, чтобы обеспечить выделение некристаллической соли с уровнем чистоты и однородностью, которые подходят для препарата, соответствующего строгим фармацевтическим требованиям и спецификациям. Примерами данных солей являются литиевая соль, натриевая, калиевая и аммонийная соли. Методы перекристаллизации в общем удаляют примеси в ходе способа, в то время как очистка аморфной субстанции пептидного лекарственного средства требует препаративной обращенно-фазовой жидкостной хроматографии с высоким давлением, которая является не экономичной.
Другие и дополнительные преимущества и признаки настоящего изобретения будут очевидны специалистам в данной отрасли из следующего подробного описания, которое сопровождается соответствующими фигурами.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На приложенных фигурах:
На Фиг.1А представлена порошковая рентгенограмма (XRPD) калиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.1В представлен инфракрасный спектр с преобразованием Фурье (FTIR) кристаллической калиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.1C представлен спектр FTIR аморфной калиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.2A представлена XRPD образца литиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.2B представлен спектр FTIR кристаллической литиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.2C представлен спектр FTIR аморфной литиевой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.3A представлен XRPD магниевой соли D-изоглутамил-D-триптофана (1:2).
На Фиг.3B представлен спектр FTIR магниевой соли D-изоглутамил-D-триптофана (1:2).
Фиг.4A представлен XRPD кальциевой соли D-изоглутамил-D-триптофана (1:2).
На Фиг.4В представлен XRPD кальциевой соли D-изоглутамил-D-триптофана (1:2).
На Фиг.4C представлен спектр FTIR кальциевой соли D-изоглутамил-D-триптофана (1:2), полученный с использованием материала с фиг.4A.
На Фиг.5 показан график идентификации состава дипептида, D-изоглутамил-D-триптофана при различных показателях pH.
На Фиг.6 показан спектр FTIR аморфной соли трет-бутиламина и D-изоглутамил-D-триптофана (1:1).
На Фиг.7 представлен спектр FTIR аморфной моно-трис(гидроксиметил)аминометановой соли D-изоглутамил-D-триптофана (1:1).
На Фиг.8 представлен спектр FTIR аморфной моно-N-метил-D-глюкаминовой соли D-изоглутамил-D-триптофана (1:1).
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ИЗОБРЕТЕНИЯ
Как было указанно выше, данное изобретение касается новых металлических солей D-изоглутамил-D-триптофана и органических солей амина D-изоглутамил-D-триптофана.
В данном изобретении D-изоглутамил-D-триптофан является свободной двухосновной кислотой
Химия аминокислот или простых дипептидов осложнена тем фактом, что группа -NH2 представляет собой основание и группа -CO2H представляет собой кислоту. Таким образом, в водном растворе ион H+ перемещается от одного конца молекулы к другому с образованием цвиттер-иона:
Цвиттер-ионы одновременно электрически заряжены и электрически нейтральны. Они содержат позитивные и негативные заряды, но суммарный заряд на молекуле равен нулю. Хотя образование соли не связано с какой-либо теорией, аминокислотный фрагмент iGlu H-D-iGlu-D-Trp-OH существует в виде цвиттер-иона, и, таким образом, присутствует только одна группа -CO2H, которая остается доступной для образования соли, если только 1 экв. одновалентного гидроксида металла, 0,5 экв. двухвалентного гидроксида металла B(OH)2 или один эквивалент органического амина используется для коррекции pH до нейтральных значений. Примерами одновалентных гидроксидов металлов являются гидроксид натрия, гидроксид лития и гидроксид калия. Примерами двухвалентных гидроксидов металлов являются гидроксид кальция и гидроксид магния.
Если соль одновалентного металла и H-D-iGlu-D-Trp-OH формулы I изображается в формате, показанном выше, только одна группа CO2H может связаться с одним ионом одновалентного металла с образованием соли формулы I. Примерами таких одноосновных солей по настоящему изобретению являются калиевая и литиевая соли (1:1). Примерами двухвалентных металлических солей по настоящему изобретению являются магниевая и кальциевая соли. Примерами органических солей амина по настоящему изобретению являются соли трет-бутиламмония, трис(гидроксиметил)метиламмония и метил-(2,3,4,5,6-пентагидроксигексил)аммония.
Хотя в предшествующем уровне техники свободно используется термин «тимодепрессин» для обозначения как свободного двухосновного D-изоглутамил-D-триптофана, так и его динатриевой соли, в пределах контекста настоящего изобретения, тимодепрессин представляет собой свободную двухосновную кислоту D-изоглутамил-D-триптофана с молекулярной формулой C16H19N3O5, а динатриевая соль представляет собой соединение с молекулярной формулой C16H17N3Na2O5. Они представляют собой два различных химических вещества с различными физико-химическими свойствами.
В данном изобретении монолитиевая или монокалиевая соль образуется заменой одного атома водорода карбоксильной группы ионом металла, лития или калия, со структурой, показанной в формуле I выше. Конкретные структуры показаны ниже:
Литиевая соль формулы I
Калиевая соль формулы I
В данном изобретении магниевая или кальциевая соль образуется заменой одного атома водорода карбоксильной группы ионом металла, магния или кальция, со структурой, показанной в формуле II выше. Термин “кальциевая соль D-изоглутамил-D-триптофана (2:1)” в данном описании относится к Ca(D-изоглутамил-D-триптофан)2. Подобным образом, термин “магниевая соль D-изоглутамил-D-триптофана (2:1)” относится здесь к Mg(D-изоглутамил-D-триптофан)2. Конкретные структуры показаны ниже:
Кальциевая соль формулы II
Магниевая соль формулы II
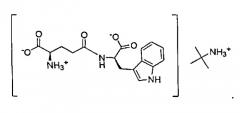
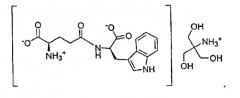
В данном изобретении органические соли амина относятся к солям пептида и органического амина. Например, трет-бутиламин, N-метил-D-глюкамин и трометамин представляют собой органические амины. Органическая соль амина по настоящему изобретению образована заменой одного атома водорода карбоксильной группы органическим амином со структурой, показанной в формуле III выше. Например, органическая соль амина, образованная из трет-бутиламина и D-изоглутамил-D-триптофана, в данном описании обозначает соль D-изоглутамил-D-триптофана трет-бутиламмония (1:1). Конкретная структура показана ниже:
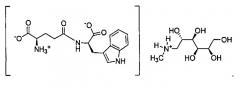
Органическая соль амина по настоящему изобретению, образованная из N-метил-D-глюкамина и D-изоглутамил-D-триптофана, в данном описании обозначает соль D-изоглутамил-D-триптофана метил-(2,3,4,5,6-пентагидроксигексил)аммония (1:1). Конкретная структура показана ниже:
Органическая соль амина по настоящему изобретению, образованная из трометамина и D-изоглутамил-D-триптофана, в данном описании обозначает соль D-изоглутамил-D-триптофана трис(гидроксиметил)метиламмония (1:1). Конкретная структура показана ниже:
Фармацевтически приемлемая соль лекарственной субстанции является химически стабильной и может использоваться в фармацевтической композиции. В отличие от простых ароматических углеводородов, тимодепрессин представляет собой дипептид с несколькими функциональными группами. Дипептид D-изоглутамил-D-триптофан содержит альфа-аминогруппу, две карбоксильные группы и индольный азот в пределах одной молекулы. Идеальная соль должна быть такой, для которой значение pH раствора близко к 7 или находится в диапазоне слабоосновных значений pH. В ходе исследования авторы изобретения с целью разработки новой соли, свободной от недостатков динатриевой соли D-изоглутамил-D-триптофана, использовали графическое определение состава (фиг.5) для того, чтобы определить соли с идеальным pH раствора и растворимостью, приемлемые для фармацевтических препаратов. Фиг.5 представляет собой график идентификации состава, H-D-iGlu-D-Trp-ОН в интервале pH от 0 до 12 с использованием экспериментально определенных значений pKa. На фиг.5, LH2 = H-D-iGlu-D-Trp-OH, LH = соль монокарбоновой кислоты, L = соль дикарбоновой кислоты и LH3 = кислотно-аддитивная соль H-D-iGlu-D-Trp-OH. На оси X показано значение pH раствора, в то время как на оси Y показано количество форм, присутствующих при конкретном значении pH. Исходя из практического опыта авторов изобретения, они используют 6 мл воды на грамм H-D-iGlu-D-Trp-OH для целей выделения, что соответствует концентрации раствора 0,5 М.
Согласно графическому определению состава, показанному на фиг.5, pH для формы двухосновной кислоты составляет от приблизительно 2,7 до приблизительно 3 в растворе. pH раствора для металлической соли формулы I, где M представляет собой калий или литий; двухосновной соли формулы II, где В представляет собой кальций или магний, составляет приблизительно 7.
Другие соли, например, соли формулы IV
где M является таким, как определено выше, соли формулы V
где B является таким, как определено выше, и соли формулы VI
где A является таким, как определено выше, представляют собой новые соли.
Динатриевая соль (формула IV, где M = Na) является менее стабильной химической формой в качестве твердого вещества. Она чрезвычайно гигроскопична, и ее очень трудно отвешивать при исследовании рецептур. В растворе, в соответствии с графическим определением состава (фиг.5), pH превышает 9,0, и значение pH раствора должно быть доведено до значений от приблизительно 7,0 до приблизительно 7,4 при изготовлении препарата.
Как указано выше, авторы изобретения установили, что калиевая соль формулы I может существовать в аморфной или некристаллической форме, а также в кристаллической форме, в зависимости от условий, при которых она была получена, как описано более подробно ниже. Данное изобретение касается монокалиевой соли тимодепрессина в любой из ее форм.
В одном из вариантов настоящего изобретения предлагается калиевая соль формулы I в аморфной форме.
В другом варианте настоящего изобретения предлагается калиевая соль формулы I в кристаллической форме.
В другом варианте настоящего изобретения кристаллическая калиевая соль формулы I охарактеризована порошковой рентгенограммой, полученной при λ=1,542 Å с применением источника излучения Cu Kα, которая содержит пики в области следующих значений 2θ - 9,91, 14,84, 15,81, 18,97, 19,76, 24,04, 24,36, 24,82, 25,48, 27,49, 27,94, 28,42, 30,82, 31,28, 31,69, 32,17, 34,35, 35,81 и 36,96°.
В другом варианте настоящего изобретения кристаллическая калиевая соль формулы I характеризуется порошковой рентгенограммой, в существенной мере сходной с показанной на фиг.1А.
Как указано выше, авторы изобретения определили, что литиевая соль формулы I может существовать в аморфной или некристаллической форме, а также в кристаллической форме, в зависимости от условий, при которых она была получена, как описано более подробно ниже. Данное изобретение касается монолитиевой соли тимодепрессина в любой из ее форм.
В одном варианте настоящего изобретения предлагается литиевая соль формулы I в аморфной форме.
В другом варианте настоящего изобретения предлагается литиевая соль формулы I в кристаллической форме.
В другом варианте настоящего изобретения кристаллическая литиевая соль формулы I охарактеризована порошковой рентгенограммой, полученной при λ=1,542 Å с применением источника излучения Cu Kα, которая содержит пики в области следующих значений 2θ - 13,57, 15,53, 18,71, 20,11, 23,34, 24,1, 25,09, 27,31, 27,72, 28,39, 29,31, 30,19, 31,21, 32,06, 33,05, 33,62 и 37,41°.
В другом варианте настоящего изобретения кристаллическая литиевая соль формулы I характеризуется порошковой рентгенограммой, в существенной мере сходной с показанной на фиг.2А.
Как указано выше, авторы изобретения установили, что магниевая соль формулы II существует в кристаллической форме.
В другом варианте настоящего изобретения предлагается магниевая соль формулы II в кристаллической форме.
В другом варианте настоящего изобретения кристаллическая магниевая соль формулы II, которая охарактеризована порошковой рентгенограммой, полученной при λ=1,542 Å с применением источника излучения Cu Kα, которая содержит пики в области следующих значений 2θ - 12,2, 13,74, 14,84, 16,16, 17,96, 18,52, 18,94, 19,49, 21,05, 21,56, 22,56, 23,36, 24,12, 26,27, 27,65, 28,42, 29,14, 30,55, 31,77, 32,62, 33,26, 35,05, 36,34, 37,22 и 38,05°.
В другом варианте настоящего изобретения кристаллическая магниевая соль формулы II характеризуется порошковой рентгенограммой, в существенной мере сходной с показанной на фиг.3A.
Процент кристалличности тимодепрессина кальция или кальциевой соли формулы II по настоящему изобретению находится на уровне ниже приблизительно 67%, более предпочтительно - ниже приблизительно 50%, и наиболее предпочтительно - ниже приблизительно 25%.
В другом варианте настоящего изобретения предлагается кальциевая соль формулы II со степенью кристалличности ниже приблизительно 67%.
Общая кристалличность, измеренная методом порошкового рентгеноструктурного анализа, обеспечивает дополнительную полезную информацию для фармацевтических материалов, которые содержат какой-либо аморфный материал, образованный в ходе процедуры синтеза. Она также является ценным показателем с точки зрения контроля долгосрочных изменений в кристаллических материалах. Не будучи связанным с какими-либо конструктивными и композиционными особенностями, показатель "процент кристалличности" может быть подходящим индикатором стабильности конкретного материала как функции времени. Способ определения процента кристалличности соединения по настоящему изобретению описан в примере ниже. Характерные образцы XRPD кальциевой соли D-изоглутамил-D-триптофана показаны на фиг.4A и 4B.
В другом варианте настоящего изобретения предлагается соль трет-бутиламмония формулы III, как показано ниже:
В другом варианте настоящего изобретения предлагается соль трис(гидроксиметил)метиламмония формулы III, как показано ниже:
В другом варианте настоящего изобретения предлагается соль метил-(2,3,4,5,6-пентагидроксигексил)аммония формулы III, как показано ниже:
В другом варианте настоящего изобретения предлагается способ получения литиевой или калиевой соли формулы I, который включает (а) взаимодействие D-изоглутамил-D-триптофана в воде с гидроксидом лития или калия; (b) концентрирование раствора до образования масла и добавление изопропанола при перемешивании для осаждения соли; отделение полученного осадка; сушку продукта в вакууме с получением металлической соли формулы I, где М представляет собой литий или калий.
В другом варианте настоящего изобретения предлагается способ получения натриевой соли формулы IV, который включает (а) взаимодействие D-изоглутамил-D-триптофана в воде с гидроксидом натрия; (b) концентрирование раствора до образования масла и добавление изопропанола при перемешивании для осаждения соли; отделение полученного осадка; сушку продукта в вакууме с получением металлической соли формулы IV, где M представляет собой натрий.
В частности, соль карбоксилата металла формулы I образуется при взаимодействии смеси H-D-iGlu-D-Trp-OH с гидроксидом металла в количестве менее чем приблизительно 1 экв., например, гидроксидом калия или гидроксидом лития, и коррекцией pH при помощи того же гидроксида металла до приблизительно 7,0. Выпаривание растворителя дает масло, которое обрабатывают изопропанолом для осаждения твердой соли. Соль выделяют обычными средствами и сушат в вакууме с получением продукта формулы I.
В другом варианте настоящего изобретения предлагается способ получения кальциевой соли формулы II, который включает (a) взаимодействие D-изоглутамил-D-триптофана в воде с гидроксидом кальция; (b) концентрирование при перемешивании для осаждения соли; отделение полученного осадка и сушку продукта в вакууме с получением металлической соли формулы II, где В представляет собой кальций.
В частности, кальциевую соль получают смешиванием дипептида H-D-iGlu-D-Trp-OH с гидроксидом кальция, предпочтительно приблизительно 0,48-0,49 экв. гидроксида кальция на 1 экв. H-D-iGlu-D-Trp-OH, при температуре ледяной бани при перемешивании в течение нескольких часов, предпочтительно от приблизительно 2,5 до приблизительно 4 часов, с получением раствора. Предпочтительное количество воды составляет приблизительно 12,5 мл воды на 1 грамм H-D-iGlu-D-Trp-OH. pH раствора доводили до приблизительно 6 при помощи насыщенного раствора Ca(OH)2, и нерастворимые частицы отфильтровывали. Фильтрат упаривали до уровня от приблизительно 14 до приблизительно 16% от начального объема. При перемешивании в течение периода от приблизительно 14 до приблизительно 18 часов при комнатной температуре образуется твердое вещество, которое отфильтровывали. Кальциевую соль сушили в вакууме.
В другом варианте настоящего изобретения предлагается способ получения магниевой соли формулы II, который включает (a) взаимодействие D-изоглутамил-D-триптофана с этоксидом магния в изопропаноле; (b) концентрирование раствора с получением твердого вещества; смешивание раствора с водой; отфильтровывание нерастворимых частиц; разбавление фильтрата водой при перемешивании для осаждения соли; отделение полученного осадка и сушку в вакууме соли формулы II, где B представляет собой магний.
В частности, магниевую соль получают добавлением H-D-iGlu-D-Trp-OH к смеси этоксида магния в изопропаноле при температуре ледяной бани, предпочтительно используют приблизительно 0,48-0,49 экв. этоксида магния на 1 экв. H-D-iGlu-D-Trp-OH. Смесь перемешивают в течение периода от приблизительно 3 до приблизительно 10 часов, предпочтительно от приблизительно 4 до приблизительно 5 часов. pH раствора проверяли, отбирая образец и смешивая его с несколькими каплями воды. Добавляли дополнительное количество этоксида магния, предпочтительно, от приблизительно 0,1 до приблизительно 0,12 экв. этоксида магния, и перемешивали в течение периода от приблизительно 10 до приблизительно 18 часов, предпочтительно, в течение периода от приблизительно 14 до приблизительно 16 часов. pH раствора проверяли, отбирая образец и смешивая его с несколькими каплями воды, pH составлял приблизительно 7,0. Раствор упаривали при пониженном давлении с получением твердого вещества, которое растворяется в воде. Нерастворимые частицы отфильтровывали, и фильтрат упаривали с получением твердого вещества. Твердое вещество перемешивали с водой для образования суспензии, и далее перемешивали в течение периода от приблизительно 3 до приблизительно 6 часов с образованием осадка. Соль магния отфильтровывали и сушили в вакууме.
В другом варианте настоящего изобретения предлагается способ получения органической соли амина формулы III, который включает (a) взаимодействие D-изоглутамил-D-триптофана с органическим амином в воде, где органический амин представляет собой трет-бутиламин, или N-метилглюкамин, или трометамин; и (b) концентрирование раствора, совместное испарение с изопропанолом; добавление ацетона для осаждения соли; отделение полученного осадка и сушку продукта в вакууме с получением органической аммонийной соли формулы III, где A представляет собой трет-бутиламмоний или трис(гидроксиметил)метиламмоний или метил-(2,3,4,5,6-пентагидроксигексил)аммоний.
В частности, соединение формулы III, где противоион представляет собой органический амин, получали смешиванием органического амина с H-D-iGlu-D-Trp-OH в воде при температуре окружающей среды, перемешивая смесь в течение периода времени от приблизительно 12 до приблизительно 18 часов. Растворитель упаривали совместно с изопропанолом и упаривали в вакууме с получением твердого вещества, которое перемешивали с ацетоном и фильтровали. Примеры органических аминов выбраны из группы, состоящей из трис(гидроксиметил)аминометана, N-метилглюкамина и трет-бутиламина.
В другом варианте настоящего изобретения предлагается способ солевого обмена для получения соли D-изоглутамил-D-триптофана, который включает (a) взаимодействие аммонийной соли, представленной формулой VII,
в водном растворе с приблизительно 1 экв. гидроксида металла, представленным MOH, где M представляет собой калий или литий; и (b) выпаривание растворителя с получением твердого вещества, которое перемешивают с водой и изопропанолом с получением соединения формулы I, где М представляет собой калий или литий.
В другом варианте настоящего изобретения предлагается способ солевого обмена для получения соли D-изоглутамил-D-триптофана, который включает (a) взаимодействие аммонийной соли, представленной формулой VII, в водном растворе с приблизительно 0,5 экв. гидроксида металла B(OH)2, где B представляет собой кальций или магний; (b) выпаривание растворителя с получением твердого вещества, которое перемешивают с водой и изопропанолом с получением соединения формулы II, где В представляет собой кальций или магний.
Соединение формулы I может быть получено солевым обменом. Стабильная аммонийная соль H-D-iGlu-D-Trp-OH используется в качестве исходного материала. Ниже представлен характерный способ получения соединения формулы I. Раствор H-D-iGlu-D-Trp-OH, аммонийной соли (1:1) перемешивают с гидроксидом металла в воде и перемешивают в течение периода от приблизительно 15 минут до приблизительно 2 часов, предпочтительно, в течение периода от приблизительно 15 минут до приблизительно 45 минут. Растворитель удаляют выпариванием и оставшуюся жидкость перемешивают с изопропанолом с получением осадка. Гидроксид металла выбирают из группы, состоящей из гидроксида лития и гидроксида калия. Порошковые рентгенограммы D-изоглутамил-D-триптофана калиевой соли (1:1) и D-изоглутамил-D-триптофана литиевой соли (1:1) показывают, что они представляют собой кристаллические вещества.
Если раствор H-D-iGlu-D-Trp-OH, аммонийной соли (1:1) смешивают с гидроксидом металла в воде, с последующим перемешиванием в течение периода от приблизительно 15 минут до приблизительно 2 часов, предпочтительно, в течение периода времени от приблизительно 15 минут до приблизительно 45 минут, а затем высушивают лиофильной сушкой, материал, полученный таким образом, является аморфным. Аморфные формы натриевых, калиевых или литиевых солей H-D-iGlu-D-Trp-OH могут быть получены данным способом.
Соединение формулы II может быть получено в результате обмена аммонийной соли с гидроксидом кальция или гидроксидом магния. Например, суспензию H-D-iGlu-D-Trp-OH и металлический гидроксид в воде, например, гидроксид кальция или гидроксид магния, нагревают до приблизительно 50-65°C в течение периода от приблизительно 1 до приблизительно 4 часов. Растворитель удаляют выпариванием. Оставшуюся жидкость перемешивают с изопропанолом для осаждения H-D-iGlu-D-Trp-OH металлической соли (2:1). Если металл представляет собой магний, полученная металлическая соль H-D-iGlu-D-Trp-OH магния (2:1) является кристаллической, что подтверждается порошковой рентгенограммой. Если металл представляет собой кальций, выделенный H-D-iGlu-D-Trp-OH кальций (2:1) является полукристаллическим веществом, со степенью кристалличности менее чем приблизительно 67%.
14N-ЯМР представляет собой полезную методику характеристики моноаммонийной соли тимодепрессина. Металлические соли формулы I и II, полученные указанным выше способом, в существенной мере свободны от аммонийной соли, о чем свидетельствует отсутствие сигнала NH4 + по данным 14N-ЯМР.
Авторы изобретения использовали графический метод определения состава (фиг.5) для того, чтобы вычислить диапазон pH для солевых форм дипептида H-D-iGlu-D-Trp-OH. Как показано на фиг.5, соль формулы I, или II, или III преобладает при значениях pH от приблизительно 6 до приблизительно 8 и делает их идеальными кандидатами для применения препарата или введения в фармацевтические композиции. Она является особенно подходящей для жидких препаратов, сублингвальных таблеток, назальных капель и спреев.
ПРИМЕНЕНИЕ И ВВЕДЕНИЕ
Калиевые, литиевые, кальциевые, магниевые соли D-изоглутамил-D-триптофана и органические соли амина и D-изоглутамил-D-триптофана по настоящему изобретению могут быть включены в фармацевтические композиции для введения субъекту в терапевтически активном количестве и в биологически совместимой форме, пригодной для введения in vivo, т.е. в форме пептидов для введения, в которой терапевтический эффект превосходит любые токсические эффекты.
В соответствии с методом графического определения состава, как показано на фиг.5, преобладающими формами при нейтральных значениях pH являются монокарбоксилатная форма тимодепрессина, то есть мононатриевая соль дипептида D-изоглутамил-D-триптофана, если противоион представляет собой натрий. Динатриевая соль D-изоглутамил-D-триптофана является чрезвычайно гигроскопичной, и ее очень сложно отмеривать.
Аморфная или кристаллическая форма солей по настоящему изобретению представляют собой идеальные кандидатуры для замены динатриевой соли при изготовлении различных препаратов, пригодных для лечения таких же состояний и/или заболеваний, для лечения которых применяют тимодепрессин, например, псориаза. Введение новых кристаллических и аморфных солей по настоящему изобретению, как описано в данном описании, может быть осуществлено любым из общепринятых способов введения терапевтических лекарственных средств с систе