Мутантный микроорганизм, продуцирующий янтарную кислоту, способ его получения и способ получения янтарной кислоты (варианты).
Иллюстрации
Показать всеГруппа изобретений относится к продуцирующему янтарную кислоту мутантному микроорганизму, который способен использовать одновременно сахарозу и глицерин в качестве источников углерода. Мутантный микроорганизм получают путем ослабления механизма опосредуемой сахарозой катаболитной репрессии глицерина путем удаления гена, кодирующего фруктозофосфотрансферазу, или путем введения гена, кодирующего глицеролкиназу. Мутантный микроорганизм выбирают из группы, состоящей из Mannheimia sp., Actinobacillus sp. и Anaerobiospirillum sp. Предложены также способ получения мутантного микроорганизма и варианты способа получения янтарной кислоты с использованием указанного микроорганизма. Группа изобретений обеспечивает получение янтарной кислоты с высоким выходом 1,54 моль/моль. 4 н. и 7 з.п. ф-лы, 4 ил., 2 табл., 5 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к продуцирующему янтарную кислоту мутантному микроорганизму, который способен использовать одновременно сахарозу и глицерин в качестве источника углерода. В частности, настоящее изобретение относится к продуцирующему янтарную кислоту мутантному микроорганизму, который способен использовать одновременно сахарозу и глицерин для продукции янтарной кислоты, мутантный организм, получаемый путем ослабления механизма опосредуемой сахарозой катаболитной репрессии глицерина в продуцирующем янтарную кислоту микроорганизме.
Уровень техники
Янтарная кислота представляет собой дикарбоновую кислоту, включающую четыре атома углерода, которая может быть применена в различных отраслях промышленности. Янтарная кислота может быть применена в качестве предшественника важных для промышленности химических продуктов, включая адипиновую кислоту, 1,4-бутандиол, этилендиаминдисукцинат, итаконовую кислоту, γ-бутиролактон, γ-аминомасляную кислоту и тетрагидрофуран, и размер мирового рынка янтарной кислоты, включая ее предшественников, оценивают, примерно, в 15 миллиардов долларов (McKinlay et al., Appl. Microbiol. Biotechnol., 76:727, 2007). Как результат возникшего в последнее время интереса к экологически устойчивому развитию и в связи с уменьшением запасов нефти и связанному с этим колебанием цен, на протяжении последних десятилетий во всем мире проводятся исследования в области производства янтарной кислоты на биологической основе (McKinlay et al., Appl. Microbiol. Biotechnol. 76:727, 2007; Song et al., Enzyme Microbial Technol., 39:352, 2006; Jantama et al, Biotechnol. Bioeng., 99:1140, 2008). Однако любой из типов штаммов, разработанных к настоящему времени, не позволяет достичь максимальной продуктивности и выхода янтарной кислоты, при этом сведя к минимуму образование побочных продуктов. Если получали высокую продуктивность, то эффективность была низкой, и, наоборот, если эффективность была высокой, то продуктивность - низкой. Кроме того, если продуктивность была высокой, то также происходило образование большого количества побочных продуктов. Таким образом, идеальный штамм, способный увеличить продуктивность и выход, продуцируя только янтарную кислоту, до сих пор не разработан (Jantama et ah, Biotechnol. Bioeng., 99:1140, 2008).
Цена сахарозы составляет примерно 1/4 от цены на глюкозу, которую обычно применяют при получении янтарной кислоты с помощью микробиологической ферментации. Кроме того, при быстром росте всемирного производства биодизельного топлива, в качестве побочного продукта образуется глицерин, и, таким образом, его цена падает из-за превышения предложения над спросом и нужен подходящий способ для переработки глицерина. Соответственно, цена глицерина очень низка и продолжает снижаться (Miller-Klein Associates, Oct. 2006).
Между тем, большинство микроорганизмов предпочтительно используют предпочтительные источники углерода из смесей различных источников углерода. Для достижения этого, большинство микроорганизмов обладают механизмом катаболитной репрессии, который ингибирует использование непредпочтительных источников углерода, если доступны предпочтительные источники углерода (Gorke et ah, Nature Reviews, 6:613, 2008). Что касается предпочтительного использования источников углерода, регулируемого с помощью механизма катаболитной репрессии, то хорошо известно, что E. coli демонстрирует диауксический рост в присутствии как глюкозы, так и лактозы, о чем было сообщено в работе Monod et al. в 1942. В этой работе, глюкоза представляла собой предпочтительный источник углерода, и, таким образом, E. coli продемонстрировала кривую диауксического роста, на которой было видно, что непредпочтительный источник углерода, лактоза, начинал потребляться после короткой лаг-фазы, после того, как глюкоза была полностью потреблена. Кроме того, из-за этого механизма катаболитной репрессии, для общих штаммов Mannheimia сильно затруднена одновременная утилизация сахарозы и глицерина. Тем не менее, использование глицерина в качестве источника углерода имеет много преимуществ. Глицерин сильно восстановлен, и если его применяют в качестве источника углерода, то количество образовавшихся восстановительных эквивалентов (NADH, NADPH, FADH2 и т.п.) увеличивается в два раза по сравнению с сахарами, такими как глюкоза, ксилоза и сахароза, при образовании промежуточного продукта фосфоенолпирувата (PEP). Таким образом, глицерин представляет собой перспективный источник углерода для производства химических соединений с восстанавливающими свойствами (Yazdani et ah, Curr. Opin. Biotechnol., 18:213, 2007). Однако во многих случаях, скорость роста клеток при применении глицерина в анаэробных условиях медленнее скорости роста при применении других сахаров, и, таким образом, применение глицерина в качестве единственного источника углерода выгодно с точки зрения восстановительной способности, но имеет ограничение в увеличении продуктивности требуемого биологического продукта, поскольку он демонстрирует медленный темп роста.
Для преодоления этого ограничения, если скорость утилизации глицерина может быть увеличена при утилизации сахаров, таких как сахароза, скорость утилизации которой выше, чем скорость утилизации глицерина и которая позволяет обеспечить рост клеток до более высокого уровня и с более высокой скоростью, то клетки могут быть выращены с высокой скоростью, поскольку они используют преимущество высокой восстановительной способности глицерина, и, таким образом, могут эффективно продуцировать соединения-восстановители, в особенности, янтарную кислоту.
Соответственно, авторы настоящего изобретения предприняли значительные усилия для разработки способа производства высокоочищенной янтарной кислоты с высокой эффективностью, используя одновременно недорогие сахарозу и глицерин, и в результате обнаружили, что при культивировании продуцирующего янтарную кислоту мутантного микроорганизма, полученного путем удаления гена, кодирующего фруктозофосфотрансферазу, из продуцирующего янтарную кислоту микроорганизма, или введения гена, кодирующего глицеролкиназу, в микроорганизм, механизм катаболитной репрессии в мутантном микроорганизме ослабевает, таким образом, что мутантный микроорганизм может продуцировать янтарную кислоту, используя одновременно сахарозу и глицерин, минимизировать образование побочных продуктов, и продуцирует гомо-янтарную кислоту с высокой эффективностью и с очень высокой продуктивностью, которые не могут быть достигнуты при применении традиционных способов, завершая тем самым настоящее изобретение.
Раскрытие изобретения
Техническая задача
Цель настоящего изобретения заключается в получении мутантного микроорганизма, в котором механизм катаболитной репрессии ослаблен, так что микроорганизм способен использовать одновременно сахарозу и глицерин для максимального увеличения выхода продуцируемой янтарной кислоты, таким образом, чтобы приблизиться к теоретическому уровню, в то же время образование побочных продуктов сведено к минимуму, чтобы таким путем производить гомо-янтарную кислоту.
Другая цель настоящего изобретения заключается в обеспечении способа продукции гомо-янтарной кислоты в указанном мутантном микроорганизме, используя сахарозу и глицерин в качестве источника углерода в анаэробных условиях без образования побочных продуктов.
Техническое решение
Для достижения указанных целей, настоящее изобретение обеспечивает мутантный микроорганизм, который способен использовать одновременно сахарозу и глицерин для продукции янтарной кислоты, мутантный микроорганизм, получаемый путем ослабления механизма опосредуемой сахарозой катаболитной репрессии глицерина в продуцирующем янтарную кислоту микроорганизме.
Настоящее изобретение также обеспечивает способ получения мутантного микроорганизма, который способен использовать сахарозу и глицерин для продукции янтарной кислоты, способ, включающий ослабление механизма опосредуемой сахарозой катаболитной репрессии глицерина в продуцирующем янтарную кислоту микроорганизме.
Настоящее изобретение также обеспечивает способ получения янтарной кислоты, способ, включающий следующие стадии: культивирование вышеуказанного продуцирующего янтарную кислоту мутантного микроорганизма в анаэробных условиях; и извлечение янтарной кислоты из культурального бульона.
Краткое описание чертежей
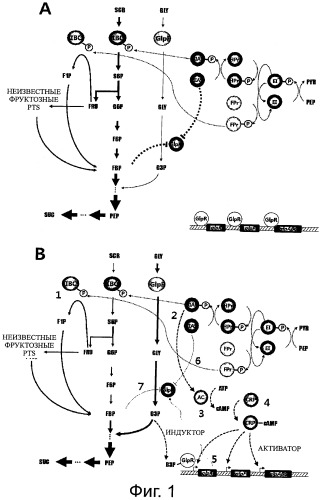
На фиг.1 схематически изображены метаболические пути сахарозы и глицерина и механизм катаболитной репрессии в штамме Mannheimia. Конкретнее, фиг.1A показывает общие метаболические пути сахарозы и глицерина и механизм катаболитной репрессии между ними, и фиг.1B показывает части фигуры 1A, которые могут быть метаболически сконструированы для того, чтобы ослабить механизм катаболитной репрессии (GLY, глицерин; G3P, глицерол-3-фосфат; SCR, сахароза; G6P, глюкозо-6-фосфат; FRU, фруктоза; F1P, фруктозо-1-фосфат; FBP, фруктозо-1,6-бисфосфат; PEP, фосфоенолпируват; SUC, янтарная кислота; PYR, пировиноградная кислота; IIBCF, фруктозная единица PTS IIBC; IIBCS, сахарозная единица PTS IIBC; EI, фермент I; Hpr, гистидиновый белок; IIA, фермент IIA в PTS; Fpr, бифункциональный фруктозо-специфичный белок IIA/HPr; AC, аденилатциклаза; cAMP, циклическая AMP; CRP, белок-рецептор с AMP).
Фиг.2 представляет собой серию графиков, показывающих рост клеток и продукцию метаболитов, полученных при культивировании с подпиткой M. succiniciproducens PALK (фиг.2A), М. succiniciproducens PALFK (фиг.2B) и M. succiniciproducens PALKG (фиг. 2C).
Фиг.3 представляет собой график, показывающий рост клеток и продукцию метаболитов, полученных при культивировании с подпиткой штамма M. succiniciproducens PALFK, который инокулируют в увеличивающемся количестве.
Фиг.4A представляет собой схему, показывающую способ культивирования MCRB, в котором сплошной линией обозначен поток жидкостей (среда, содержащая клетки среда, содержащая метаболиты среда и т.п.), и пунктирной линией обозначен поток газа (углекислый газ). Фиг.4B представляет собой график, показывающий рост клеток и продукцию метаболитов, полученных в культуре штамма M. succiniciproducens PALFK, при применении способа культивирования MCRB.
Лучший способ осуществления изобретения
Если не указано иное, то все технические и научные термины, примененные в этом документе, имеют тот же смысл, как его обычно понимает специалист в той области техники, к которой относится изобретение. Обычно, номенклатура, примененная в этом документе, хорошо известна и ее обычно применяют в этой области техники.
В одном из аспектов, настоящее изобретение направлено на мутантный микроорганизм, который способен использовать одновременно сахарозу и глицерин для продукции янтарной кислоты, мутантный микроорганизм, получаемый путем ослабления механизма опосредуемой сахарозой катаболитной репрессии глицерина в продуцирующем янтарную кислоту микроорганизме.
Как применен в этом документе, термин «механизм катаболитной репрессии» относится к механизму, который подавляет использование микроорганизмом непредпочтительного источника углерода в присутствии предпочтительного источника углерода, при культивировании микроорганизма в среде, в которой присутствуют различные источники углерода (Gorke et al, Nature Reviews, 6:613, 2008).
В штамме Mannheimia, который представляет собой продуцирующий янтарную кислоту штамм, сахароза и глицерин не могут быть одновременно применены для производства янтарной кислоты из-за механизма катаболитной репрессии.
Обычно, если сахароза и глицерин присутствуют одновременно, то глицерин потребляется после сахарозы, которая представляет собой предпочтительный для потребления источник углерода. Также, Mannheimia предпочитает сахарозу глюкозе, так что он быстрее метаболизирует сахарозу, если сахароза и глицерин присутствуют одновременно.
Настоящее изобретение ставит своей целью искусственно ослабить этот механизм катаболитной репрессии.
Механизм катаболитной репрессии может быть грубо подразделен на два процесса: репрессия транскрипции и аллостерическая репрессия (Deutscher et al, Microbiol. Mol. Biol. Rev., 70:939, 2006; Gorke et al, Nature reviews, 6:613, 2008; Pettigrew et al, J. Bacteriol., 178:2846, 1996; Zwaig et al, J. Bacterid., 102:753, 1970). Что касается репрессии транскрипции, то регулятор GlpR подавляет транскрипцию генов, вовлеченных во внутриклеточный транспорт и утилизацию глицерина. Как применено в этом документе, термин «аллостерическая репрессия» относится к снижению активности глицеролкиназы, в результате связывания фруктозо-1,6-бисфосфата (FBP) или EIIA с глицеролкиназой, которая играет ключевую роль в метаболизме глицерина. В среде, в которой сахароза и глицерин присутствуют одновременно, репрессия транскрипции под действием регулятора GlpR и аллостерическая репрессия под действием FBP и EIIA происходит одновременно, так что метаболизм глицерина обычно бывает подавлен. Стратегия, способная ослабить этот механизм катаболитной репрессии, позволяет избежать репрессии транскрипции, вызываемой GlpR, и аллостерической репрессии, вызываемой FBP и EIIA.
На фиг.1 схематически изображены метаболические пути сахарозы и глицерина и механизм катаболитной репрессии в штамме Mannheimia. Конкретнее, фиг.1A показывает общие метаболические пути сахарозы и глицерина и механизм катаболитной репрессии между ними, и фиг.1B показывает части фигуры 1A, которые могут быть метаболически сконструированы для того, чтобы ослабить механизм катаболитной репрессии. На фигуре 1 сплошными линиями со стрелками показаны метаболические пути сахарозы и глицерина, и их толщина указывает на относительную метаболическую скорость. Тонкими пунктирными линиями со стрелками показан процесс, в котором фосфорильную группу непрерывно переносят от PEP на единицу PTS IIBC, и толстыми пунктирные линиями со стрелками схематически показаны различные пути, способные индуцировать экспрессию оперона glp, включая путь, начинающийся от фосфорилированного IIA, путь, начинающийся от аденилатциклазы (AC), путь, начинающийся от CRP-cAMP, путь, начинающийся от G3P-GlpR, и т.п. толстыми пунктирные линии, имеющие на конце T-форму, указывают на относительную степень аллостерической репрессии, вызываемой нефосфорилированным IIA и/или фруктозо-1,6-бисфосфатом (FBP) и приложенной к глицеролкиназе (GlpK), которая играет ключевую роль в опероне glp.
Как показано на фигуре 1A, механизм опосредуемой сахарозой катаболитной репрессии глицерина грубо подразделен на репрессию транскрипции под действием GlpR или ему подобного, и на аллостерическую репрессию под действием FBP и EIIA. Как показано на фигуре 1B, способы преодоления этой репрессии включают способ преодоления репрессии транскрипции путем включения продукции различных активаторов, способ ослабления опосредуемой GlpK аллостерической репрессии путем снижения концентрации FBP или IIA и им подобных.
В одном из вариантов раскрывается способ, в котором IIBCF удаляют из части 1 фигуры 1B, так что концентрация фосфорилированного IIA относительно увеличивается для индукции экспрессии AC, и, таким образом, продуцируется гораздо больше сАМР для увеличения продукции CRP-cAMP, тем самым, индуцируя экспрессию оперона glp.G3P, образованный в реакции, катализируемой таким образом дополнительно экспрессированной GlpK, отсоединяет транскрипционный репрессор GlpR от мест связывания ДНК в регулоне glp (glpABC, glpF, glpK и т.п.) и облегчает транскрипцию генов регулона glp. В этот момент, концентрация нефосфорилированного IIA поддерживается на относительно низком уровне, и метаболизм сахарозы в целом снижается из-за удаления IIBCF, так что концентрация FBP относительно снижается, тем самым, ослабляя аллостерическую репрессию. Одновременное действие этих двух факторов приводит к росту в метаболизме глицерина.
В одном из вариантов раскрывается способ, в котором концентрация фосфорилированного IIA в части 2 фигуры 1B возрастает для индукции экспрессии АС, и, таким образом, продуцируется гораздо больше сАМР для увеличения продукции CRP-cAMP, индуцируя тем самым экспрессию оперона glp.G3P, продуцируемый таким образом дополнительно экспрессированной GlpK, отсоединяет транскрипционный репрессор GlpR от мест связывания ДНК в регулоне glp, облегчая транскрипцию генов регулона glp, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором сверхэкспрессию AC в части 3 фиг.1B индуцируют так, что продуцируется гораздо больше сАМР для увеличения продукции CRP-cAMP, тем самым, индуцируя экспрессию оперона glp.G3P, производимый таким образом дополнительно экспрессированной GlpK, отсоединяет транскрипционный рецептор GlpR от мест связывания ДНК в регулоне glp, облегчая транскрипцию генов регулона glp, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором сверхэкспрессию CRP в части 4 фиг.1B и сверхэкспрессию AC в части 3 фиг.1B индуцируют одновременно, так что продукция CRP-cAMP увеличивается, тем самым, индуцируя экспрессию оперона glp.G3P, производимый GlpK таким образом экспрессируется дополнительно отсоединяет транскрипционный рецептор GlpR от мест связывания ДНК регулона glp, облегчая транскрипцию генов регулона glp, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором сверхэкспрессию CRP в части 4 фигуры 1B индуцируют, так что продукция CRP-cAMP увеличивается, тем самым, индуцируя экспрессию оперона glp.G3P, производимый таким образом экспрессированной GlpK, дополнительно отсоединяет транскрипционный рецептор GlpR от мест связывания ДНК регулона glp, облегчая транскрипцию генов регулона glp, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором индуцируют сверхэкспрессию GlpK в части 5 фигуры 1B, так что продукция G3P увеличивается. Это приводит к отсоединению транскрипционного рецептора GlpR от мест связывания ДНК регулона glp, облегчая транскрипцию генов регулона glp, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором все гены в регулоне glp сверхэкспрессируют или различные комбинации некоторых генов сверхэкспрессируют, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором промотор сверхэкспрессии, не имеющий сайта, с которым может связаться GlpR, вводят в сайт промотора для экспрессии каждой транскрипционной единица регулона glp на хромосоме в части 5 фигуры 1B, так что репрессия с помощью GlpR фундаментально блокируется и регулон glp сверхэкспрессируется, что приводит к увеличению метаболизма глицерина.
В одном из вариантов раскрывается способ, в котором GlpR удаляют, так что репрессия экспрессии регулона glp ослабевает, что приводит к увеличению метаболизма глицерина. В качестве еще одного примера, существует способ, в котором концентрацию IIA и/или FBP в частях 6 и 7 фигуры 1B снижают, так что степень аллостерической репрессии под действием GlpK снижается, что приводит к увеличению метаболизма глицерина.
Помимо перечисленных выше способов, возможны комбинации описанных выше способов и способов, вытекающих из них, например, способ, в котором глицеролкиназу, полученную из гетерологичного штамма, разрабатывают так, чтобы она была менее подвержена аллостерической репрессии, или глицеролкиназу, претерпевающую аллостерическую репрессию, сверхэкспрессируют, что приводит к увеличению метаболизма глицерина. Кроме того, существует способ, в котором механизм катаболитной репрессии ослабляют, так что метаболизм глицерин может быть активирован.
При этом янтарная кислота представляет собой типичный пример соединения-восстановителя и представляет собой C4-соединение, которое содержит две карбоксильные группы и для которого PEP (фосфоенолпируват) служит в качестве интермедиата-предшественника. Также, продуцирующие янтарную кислоту микроорганизмы относятся к микроорганизмам, которые продуцируют большие количества янтарной кислоты, по сравнению с другими метаболитами, и могут быть применены в промышленном масштабе для получения янтарной кислоты путем ферментации. Типичные продуцирующие янтарную кислоту микроорганизмы включают бактерии рубца. Известные бактерии рубца включают Actinobacillus sp., Anaerobicspirillum sp. и Mannheimia sp. (включая Basfia sp. Когда Basfia sp. был первоначально выделен, он был назван «Mannheimia», его назвали «Basfia sp.», и последовательность 16S rRNA на 99,8% идентична последовательности Mannheimia sp. Таким образом, в настоящем изобретении Basfia sp. также называют «Mannheimia sp.» / Scholten et al, WO 2009/024294 A1; Kuhnert et al, Int. J. Syst. Evol. Microbiol., 60:44). На основании частичной генетической информации (16s rRNA), ферментного анализа и результатах ферментации различных бактерий рубца, о которых до настоящего времени было известно, что они продуцируют янтарную кислоту, было установлено, что основной путь биосинтеза для продукции янтарной кислоты из источника углерода у этих бактерии рубца практически идентичен пути биосинтеза для продукции янтарной кислоты в Mannheimia sp., которая представляет собой разновидность бактерий рубца. В особенности, все бактерии рубца, вовлеченные в продукцию янтарной кислоты, превращают C3-соединения (фосфоенолпируват и пируват) в C4-соединение (оксалоацетат и малат), используя CO2-фиксирующий фермент, и превращают C4-соединения в фумарат, таким образом, продуцируя янтарную кислоту (Zeikus et al, Appl Microbiol Biotechnol, 51:545, 1999; Lee et al, Appl Environ. Microbiol, 72:1939, 2006). Другими словами, все бактерии рубца, включая Mannheimia sp., имеют одинаковый путь биосинтеза янтарной кислоты, и специалистам в этой области техники понятно, что генетическая мутация настоящего изобретения может быть применена к продуцирующим янтарную кислоту штаммам бактерий, полученным из рубца, кроме того, к M. succiniciproducens, приведенной в примерах настоящего изобретения.
В настоящем изобретении, продуцирующий янтарную кислоту микроорганизм может представлять собой бактерию рубца. Бактерия рубца может быть выбрана из группы, состоящей из Mannheimia sp., Actinobacillus sp. и Anaerobiospirillum sp.
В настоящем изобретении, штамм Mannheimia sp. может представлять собой Mannheimia succiniciproducens PALK (КСТС10973 BP).
В настоящем изобретении, ослабление механизма катаболитной репрессии может быть выполнено путем удаления гена, кодирующего фруктозофосфотрансферазу, и мутантный микроорганизм может представлять собой Mannheimia succiniciproducens PALFK (KCTC11694BP).
В настоящем изобретении ослабление механизма катаболитной репрессии может быть выполнено путем введения гена, кодирующего глицеролкиназу, и продуцирующий янтарную кислоту мутантный микроорганизм может представлять собой Mannheimia succiniciproducens PALFK (KCTC11694BP).
В настоящем изобретении, продуцирующий янтарную кислоту мутантный микроорганизм, который продуцирует янтарную кислоту с максимальным выходом, не образуя других органических кислот, конструируют путем генно-инженерной модификации бактерии рубца, представляющей собой продуцирующий янтарную кислоту микроорганизм.
В одном из примеров настоящего изобретения, M. succiniciproducens PALFK (KCTC11694BP), способную метаболизировать одновременно сахарозу и глицерин, конструируют путем удаления гена, кодирующего фруктозофосфотрансферазу (fruA), из геномной ДНК Mannheimia succiniciproducens PALK (KCTC10973BP). Сконструированный штамм продуцирует янтарную кислоту с высоким выходом и продуктивностью и не образует побочные продукты.
В настоящем изобретении, делецию каждого из генов выполняют путем инактивации представляющего интерес гена, используя способ гомологичной рекомбинации. Однако любой способ генной инженерии может быть применен без особых ограничений в настоящем изобретении, при условии, что можно изменить или устранить интересующий ген, так чтобы фермент, кодируемый представляющим интерес геном, не образовывался.
В настоящем изобретении, культивирование продуцирующего янтарную кислоту мутантного микроорганизма и извлечение янтарной кислоты может быть выполнено с помощью любого из способов, известных в общепринятых способах ферментации.
В настоящем изобретении, M. succiniciproducens PALFK (KCTC11694 BP) и традиционный мутантный штамм (M. succiniciproducens PALK (KCTC10973BP)) сравнивали друг с другом в отношении выхода янтарной кислоты, образования побочных продуктов и способности метаболизировать источники углерода. M. succiniciproducens PALK (KCTC10973BP) представляет собой мутантный микроорганизм, полученный путем делеции гена, кодирующего лактатдегидрогеназу (IdhA), гена, кодирующего фосфотранацетилазу (pta), и гена, кодирующего ацетаткиназу (аскА), из генома штамма Mannheimia sp. и представляет собой родительский штамм мутантного микроорганизма M. succiniciproducens PALFK (KCTC11694BP) изобретения, в котором ген, кодирующий фруктозофосфотрансферазу (fruA), не удален.
В продуцирующем янтарную кислоту мутантном микроорганизме М. succiniciproducens PALFK (KCTC11694BP) в соответствии с настоящим изобретением, образование побочных продуктов, включая молочную кислоту, пировиноградную кислоту, уксусную кислоту и муравьиную кислоту, сведены к минимуму, а выход продукции янтарной кислоты увеличен и приближается к теоретическому выходу (1,71-1,86 моль/моль), по сравнению с теми же параметрами в продуцирующем янтарную кислоту мутантном штамме M. succiniciproducens PALFK (KCTC10973BP), показывая, что он представляет собой отличный штамм для получения янтарной кислоты.
В другом аспекте, настоящее изобретение направлено на способ получения мутантного микроорганизма, который способен использовать сахарозу и глицерин для продукции янтарной кислоты, способ, включающий ослабление механизма опосредуемой сахарозой катаболитной репрессии глицерина в продуцирующем янтарную кислоту микроорганизме.
В другом примере настоящего изобретения, M. succiniciproducens PALKG (KCTC11693BP), способный метаболизировать одновременно сахарозу и глицерин, конструируют путем введения кодирующего глицеролкиназу гена E. coli в геномную ДНК Mannheimia succiniciproducens PALK (KCTC10973BP). Сконструированный штамм продуцирует янтарную кислоту с высокой продуктивностью и выходом без образования побочных продуктов.
Продуцирующий янтарную кислоту микроорганизм М. succiniciproducens PALKG (KCTC11693BP) также сравнивали описанным выше способом.
Еще в одном аспекте, настоящее изобретение обеспечивает также способ получения янтарной кислоты, способ, включающий следующие стадии: культивирование вышеуказанного продуцирующего янтарную кислоту мутантного микроорганизма в анаэробных условиях; и извлечение янтарной кислоты из культурального бульона.
В настоящем изобретении, культивирование может быть проведено в среде, содержащей как сахарозу, так и глицерин, и количество органических кислот, образующихся в качестве побочных продуктов, может быть равно 1% (по масс.) или менее в расчете на количество продуцированной янтарной кислоты.
В еще одном аспекте, настоящее изобретение также направлено на способ получения янтарной кислоты с увеличенной продуктивностью, способ, включающий следующие стадии: (a) культивирование в анаэробных условиях или мутантного микроорганизма, который продуцирует янтарную кислоту с высоким выходом, при незначительном образовании побочных продуктов или их отсутствии, или мутантного микроорганизма, полученного путем ослабления механизма опосредуемой сахарозой катаболитной репрессии глицерина, так чтобы иметь возможность использовать одновременно сахарозу и глицерин; (b) концентрирование клеток микроорганизма в культуральном бульоне до высокой концентрации; (c) культивирование высококонцентрированных клеток; и (d) извлечение янтарной кислоты из культурального бульона.
В настоящем изобретении, стадия (b) концентрирования клеток в культуральном бульоне до высокой концентрации может быть выполнена способом посева, осуществляемого путем инокуляции продуцирующего штамма в высокой концентрации или способом с применением мембранного биореактора с рециркулирующими клетками (MCRB) (называемый в этом документе «способ MCRB»).
В соответствии со способом получения янтарной кислоты с применением мутантного микроорганизм изобретения, который может утилизовать одновременно сахарозу и глицерин для продукции янтарной кислоты, янтарная кислота может быть продуцирована без побочных продуктов со сверхвысоким выходом, приближающимся к теоретическому выходу. Хотя, цена сахарозы составляет 1/4 от цены глюкозы, обычно при получении янтарной кислоты с помощью микробиологической ферментации применяют глюкозу. Кроме того, при быстром росте всемирного производства биодизельного топлива, в качестве побочного продукта производится глицерин, и его цена, таким образом, снижается из-за избыточного предложения и необходим подходящий способ переработки глицерина. Соответственно, цена глицерина очень низка и продолжает снижаться (Miller-Klein Associates, Oct. 2006). Особая ценность способа получения янтарной кислоты в соответствии с настоящим изобретением заключается в том, что с его помощью возможно экономически эффективно производить янтарную кислоту путем микробиологической ферментации, а с помощью химического синтеза, требующего огромных затрат на сырье, производить янтарную кислоту со сверхвысоким выходом, приближающимся к теоретическому выходу, и производить янтарную кислоту со сверхвысокой чистотой, так что затраты на выделение и очистку могут быть минимизированы.
Применение штамма PALFK в соответствии с настоящим изобретением позволяет производить гомо-янтарную кислоту без образования побочных продуктов и с очень высоким выходом, приближающемся к теоретическому выходу (от 1,71 до 1,86 моль/моль). Три фактора, включающие продуктивность, выход и отношение побочные продукты/янтарная кислота, представляют собой основные ключевые факторы применимости этого способа получения янтарной кислоты для промышленного производства. В особенности, продуктивность, связанная с начальной стоимостью капитала и энергетическими затратами, и выход представляют собой меру эффективного использования сырья и связаны со стоимостью сырья, которая составляет значительную часть стоимости био-процесса, а отношение побочные продукты/янтарная кислота связаны с затратами на разделение и очистку, которые составляют половину или более от общей стоимости биопроцесса.
Таким образом, в одном из примеров настоящего изобретения, используя штамм PALFK, выход делают максимальным и отношение побочные продукты/янтарная кислота делают минимальным, при этом два из трех вышеуказанных ключевых факторов (выход и отношение побочные продукты/янтарная кислота) совершенствуют до наивысших достижимых уровней. Кроме того, значительные усилия были предприняты для того, чтобы найти способ улучшения продуктивности, и в результате было установлено, что способ посева и способ MCRB увеличивают концентрацию клеток в культуральном бульоне и улучшают продуктивность янтарной кислоты, по меньшей мере, в 2 раза и в 10 раз, соответственно, по сравнению с родительским штаммом.
ПРИМЕРЫ
В дальнейшем в этом документе, настоящее изобретение будет описано подробно с отсылкой к примерам. Специалисту в этой области техники понятно, что эти примеры приведены только для иллюстративных целей и не должны быть истолкованы как ограничивающие объем настоящего изобретения.
В особенности, следующие примеры иллюстрируют только специфический вектор и Mannheimia sp., которая представляет собой продуцирующий янтарную кислоту микроорганизм в качестве клетки-хозяина для удаления генов в соответствии с настоящим изобретением. Однако специалисту в этой области техники понятно, что применение других типов продуцирующих янтарную кислоту микроорганизмов также может обеспечить мутантные микроорганизмы, которые продуцируют высокоочищенную янтарную кислоту.
Пример 1: Конструирование вектора с делецией fruA (pSacHR06fruA)
Для удаления гена fruA (гена, кодирующего фруктозофосфотрансферазу), из генома продуцирующего янтарную кислоту микроорганизма путем гомологичной рекомбинации, вектор для обмена генов конструируют следующим способом. Во-первых, проводят PCR, используя в качестве матрицы геномную ДНК M. succiniciproducens MBEL55E (KCTC0769BP) и каждую пару праймеров с последовательностями SEQ ID NOS: 1 и 2, пару праймеров с последовательностями SEQ ID NOS: 3 и 4 и пару праймеров с последовательностями SEQ ID NOS: 5 и 6, и получая, таким образом, фрагменты PCR, содержащие левый гомологичный участок fruA (HL), ген устойчивости к хлорамфениколу (Cm) и правый гомологичный участок fruA t (HR), соответственно.
Затем, проводят перекрывающуюся PCR, используя вышеуказанные три фрагмента PCR в качестве матрицы и праймеры с последовательностями SEQ ID NOS: 1 и 6, полученный фрагмент ДНК расщепляют с помощью SacI и PstI и встраивают в вектор pSacHR06, конструируя, таким способом, вектор pSacHR06fruA.
SEQ ID NO:1:5'-ATCGCGGATCCGGTGGAAACCCTCGGTTTATT
SEQ ID NO:2:5'-AATCTGCTCTGATGCGCAGCTAAAACCTGGTGCAATA
SEQ ID NO:3:5'-CCAGGTTTTAGCTGCGCATCAGAGCAGATTGTACTGAGAG
SEQ ID NO:4:5'-AATTACACTTGAAACCCTGATTCTGTGGATAACCGTATTAC
SEQ ID NO:5:5'-ATCCACAGAATCAGGGTTTCAAGTGTAATTGGCGGAG
SEQ ID NO:6:5'-TCGACGCGTCGACTTCATCTAACCCCAACGCTTG
Пример 2: Конструирование штамма M. succiniciproducens PALFK
Мутантный штамм конструируют путем удаления fruA из генома M. succiniciproducens PALK (KCTC10973BP), используя вектор pSacHR06fruA для удаления гена fruA, сконструированного в примере 1.
В частности, М. succiniciproducens PALK (KCTC10973BP) высевают на чашки с твердой средой BHI (сердечно-мозговая вытяжка) и культивируют при 39°C в течение 36-ти часов. Сформировавшуюся колонию инокулируют в 10 мл жидкой среды BHI и растят в течение 12-ти часов. Бульон с достаточно выросшей культурой клеток инокулируют в 100 мл жидкой среды BHI в концентрации 1% и растят в стационарном инкубаторе при 39°C.
После того как примерно через 4-5 часов OD600 культурального бульона достигнет значения, равного примерно 0,3-0,5, его поддерживают при 0-4°C в течение 20 минут, так чтобы клетки больше не росли. Затем, для сбора клеток, культуральный бульон центрифугируют при 4°C при 4500 rpm в течение 15-ти минут. Затем, клетки ресуспендируют в 200 мл 10%-ного раствора глицерина при 4°C и центрифугируют в описанных выше условиях. Это ресуспендирование и центрифугирование проводят суммарно три раза, каждый раз при этом уменьшая объем 10%-ного раствора глицерина на 1/2. Полученные клетки ресуспендируют в таком же объеме 10%-ного раствора глицерина, разливают по порциям и хранят при -80°C.
Суспензию концентрата клеток, полученную как описано выше, смешивают с вектором с генной делецией pSacHR06fruA, сконструированным в примере 1, и проводят электропорацию при 2,5 кВ, 25 мкФ и 200 Ом для трансформации M. succiniciproducens вектором PALK (KCTC10973BP). Подвергнутые электропорации клетки добавляют к BHI жидкой среде и инкубируют в стационарном инкубаторе при 39°C в течение 1-го часа. Затем, культуральный бульон высевают на чашки с твердой средой BHI, содержащей 6,8 мкг/мл антибиотика хлорамфеникола и инкубируют в стационарном инкубаторе при 39°C в течение 48-ми часов или дольше. Для того чтобы отобрать колонию, в которой прошел двойной кроссинговер, сформировавшиеся колонии высевают на чашки с твердой средой BHI, содержащей хлорамфеникол (6,8 мкг/мл) и 100 г/л сахарозы, и растят в течение 24-х часов, после чего сформировавшиеся колонии высевают на чашки снова, на ту же среду.
Мутантный штамм, сформировавшийся в среде, растят в содержащей антибиотик жидкой среде BHI, и геномную ДНК изолируют из культивируемого штамма способом, описанным в работе Rochelle et al. (Rochelle et al, FEMS Microbiol Lett., 100:59, 1992). PCR проводят, применяя изолированную геномную ДНК мутантного штамма в качестве матрицы, и PCR-продукт подвергали электрофоретическому разделению для подтверждения того, что ген fruA действительно был удален из геномной ДНК. Действительно ли ген fruA был удален, подтверждали, дважды проводя PCR следующим образом. Во-первых, PCR проводят, применяя геномную ДНК мутантного штамма в качестве матрицы и каждую пару праймеров с последовательностями SEQ ID NOS: 7 и 8 и пару праймеров с последовательностями SEQ ID NOS: 9 и 10. Для подтверждения делеции fruA, PCR-фрагменты, полученные из двух PCR, подвергают электрофоретическому разделению по их размерам. В результате, сконструировали М. succiniciproducens PALFK (KCTC11694BP) и депонировали его под регистрационным номером KCTC11694BP в Корейской коллекции типовых культур, Корейского научно-исследовательского института биологических наук и биотехнологии.
SEQ ID NO:7:5'-CTATGATTTGGTCGGGCGTTT
SEQ ID NO:8:5'-TGAATGGCAGAAATTCGAAA
SEQ ID NO:9:5'-TGATCTTCCGTCACAGGTAT
SEQ ID NO:10:5”TTGACCGCACTTTGCACATC
Пример 3: Конструирование вектора pME18glpK22 и конструирование штамма M. succiniciproducens PALKG с введенным в него вектором
Для получения ДНК, которая содержит ген Е. coli, кодирующий глицеролкиназу (glpK22), проводят PCR, применяя геномную ДНК Escherichia coli K-12 MG1655 (ATCC 47076; Американская коллекция типовых культур, Manassas, VA, США) и каждую пару праймеров с послед