Лекарственное средство на основе дииндолилметана и его применение для лечения гриппа и респираторных вирусных инфекций
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой лекарственно средство для лечения гриппа и респираторных вирусных инфекций, содержащее 3,3-дииндолилметан, рыбий жир типа А и полисорбат 80 при соотношении компонентов, мас.%: 3,3-дииндолилметан 9-20, рыбий жир типа А 1-10, полисорбат 80 - остальное. Изобретение также касается применения такого лекарственного средства для лечения гриппа и респираторных вирусных инфекций. 2 н. и 1 з.п. ф-лы, 2 ил., 7 табл., 8 пр.
Реферат
Изобретение относится к области медицины, а именно к фармакологии, и может быть использовано для лечения гриппа и респираторных вирусных инфекций.
Возрастающая роль инфекционных вирусных заболеваний в структуре общей заболеваемости населения, появление новых опасных вирусов со всей очевидностью показали, что здравоохранение столкнулось с проблемой недостатка противовирусных препаратов для лечения тяжелых форм вирусных инфекций. Разработка противовирусных препаратов в последние годы стала одним из актуальных направлений современной фармакологии. Кризис этих исследований с особенной очевидностью проявился в 2003 году, когда практическое здравоохранение многих стран оказалось лицом к лицу с беспрецедентной смертностью больных от атипичной пневмонии, вызванной коронавирусом SARS. Фактически, для лечения этой тяжелой и практически фатальной инфекции Всемирной Организацией Здравоохранения (ВОЗ) был рекомендован только один и довольно проблемный препарат - Рибавирин (Smith СВ. et al. (1980) Lack of effect of oral ribavirin in naturally occurring influenza A virus (H1N1) infection, J. Infect. Dis.,141, 548-554; Knight V., Gilbert B.E. (1987) Ribavirin aerosol treatment of influenza, Infect. Dis. Clin. North Am., 1, 441-457). Единственный ингибитор синтеза РНК- содержащих вирусов -Рибавирин, несомненно, большое достижение современной фармакотерапии, однако клиницистам хорошо известны серьезные побочные эффекты при использовании этого препарата. Разработка препаратов против РНК-содержащих вирусов оставалась за пределами пристального внимания как крупных производителей и разработчиков лекарственных препаратов, так и ВОЗ. Однако отстраненность от проблемы лечения SARS, геморрагической лихорадки Эболы, Денге и гриппа стоила жизни многим больным в самых разных странах мира. Реальная смертность от «птичьего» гриппа A(H5N1) в странах Юго-Восточной Азии вновь продемонстрировала бессилие современной медицины. Развившаяся в 2009 году пандемия гриппа A(HlNl)pdm 2009 резко обострила проблему доступности и эффективности лекарственных препаратов для лечения этой тяжелой инфекции. Массовая заболеваемость и относительно высокая смертность повысили спрос на отечественные, доступные населению, недорогие и эффективные препараты для профилактики и лечения гриппа.
ВОЗ для лечения и профилактики гриппа рекомендовано применение препаратов этиотропного действия. Сейчас в мире используются два поколения таких препаратов. Первое поколение представлено хорошо известными Римантадином и применяемым в Европе и США сходным с ним Амантадином. К препаратам второго поколения относятся селективные ингибиторы вирусной нейраминидазы - Реленза (Занамивир) и Тамифлю (Осельтамивир). Кроме них в России широко используется и ряд других препаратов - Арбидол, Циклоферон, Ингавирин, Кагоцел, интерфероны и другие препараты, относящиеся к категории иммуномодуляторов (Логинова СЛ., Борисевич СВ., Лыков М.В. и др. (2009). Изучение эффективности Ингавирина in vitro в отношении «мексиканского» пандемического подтипа H1N1 вируса гриппа А, штаммы A/Cflifornia/04/2009 и A/California/07/2009, Антибиотики и Химиотер., 54, 15-17). Однако уже в период применения препарата Тамифлю для лечения тяжелых случаев «птичьего» гриппа у людей в 2006 году и позднее пандемического гриппа в 2009 году, препарат был серьезно скомпрометирован как в отношении клинической эффективности, так и по широкому спектру побочных эффектов, а позднее - быстрым распространением генетических признаков резистентности штаммов вируса к Тамифлю. Кроме того, практика применения ингибиторов нейраминидазы в лечении гриппа показала, что высокая эффективность этой группы препаратов ограничена назначением их на ранней стадии инфекции, при использовании данных препаратов через 2 суток от начала заболевания резко снижается их эффективность.
Таким образом, анализируя основные препараты для лечения гриппа необходимо отметить, что все они не лишены недостатков и главные из них - это развитие резистентности, необходимость раннего применения препаратов, токсичность и развитие побочных эффектов, отсутствие препаратов для лечения тяжелых форм гриппозной инфекции.
Острые респираторные вирусные инфекции (ОРВИ) и грипп, относящиеся к социально значимым инфекциям, остаются практически неконтролируемыми заболеваниями из-за высокой изменчивости антигенной структуры, вирулентности циркулирующих вирусов и появления новых высокопатогенных возбудителей (SARS, вирусы «птичьего» гриппа A(H5N1), пандемический вирус гриппа A(HlNl)pdm2009) Прямую угрозу для жизни ребенка представляют ОРВИ, сопровождающиеся поражением гортани (аденовирусы, парагриппозные вирусы, герпесвирусы, респираторно-синцитиальный вирус). Однако для многих из этих инфекций не существует этиотропных средств профилактики и лечения, так как имеющиеся в клинической практике этиотропные противовирусные средства (Римантадин, Тамифлю, Рибавирин) не лишены недостатков, к основным из которых можно отнести развитие резистентности, токсичность, развитие побочных эффектов, ограниченный спектр действия и другие.
Кроме того, и для многих респираторных вирусов вообще отсутствуют этиотропные средства для лечения и профилактики. Это относится к таким широко распространенным вирусным инфекциям, как респираторно-синцитиальная вирусная инфекция, парагрипп, аденовирусная инфекция и ряд других. Вместе с тем, данные инфекции широко распространены и вызывают нередко тяжелые заболевания как среди взрослых, так и среди детей, что остро ставит вопрос о создании новых препаратов для обеспечения оптимального ассортимента лекарственных средств лечения этих инфекций.
Как было показано в последние годы, многие вирусы, в том числе и вирусы гриппа H1N1 и H5N1, существенно вмешиваются в механизмы регулировки апоптоза клеток хозяина (Galluzzi L. et al. (2008) Viral control of mitochondrial apoptosis, PLoS Pathog., 4(5), el000018). Как правило, вирусы, ингибирующие апоптоз, вмешиваются в ранние стадии процесса апоптоза, например ингибируя белок р53, имитируя антиапоптотический фактор Вс1-2 или вмешиваясь в сигнальный каскад «рецепторов смерти» (Marzo I, Brenner С, Zamzami N, Jurgensmeier JM, Susin SA, et al. (1998). Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis, Science, 281, 2027-2031; Gougeon ML (2003) Apoptosis as an HIV strategy to escape immune attack, Nat Rev Immunol, 3, 392-404). Однако, хотя в отношении вирусов получены убедительные доказательства того, что они препятствуют апоптозу зараженных ими макрофагов (Мок СК, Lee DC, Cheung CY, Peiris M, Lau AS (2007). Differential onset of apoptosis in influenza A virus H5N1- and H1N1-infected human blood macrophages, J Gen Virol, 88, 275-1280), механизм этого остается недостаточно исследованным. В то же время, известно, что длительная секреция инфицированными вирусом макрофагами провоспалительных цитокинов может в свою очередь вызывать апоптоз Т-лимфоцитов, тем самым подавляя иммунный ответ на вирус, а также вызывать апоптоз клеток окружающих тканей, усугубляя их повреждение (Uiprasertkul MP, Kitphati R, Puthavathana P. et al. (2007). Apoptosis and pathogenesis of avian influenza A (H5N1) virus in humans, Emerg Infect Dis, 13, 708-712). Кроме того, инфицированные макрофаги при этом синтезируют значительное количество активных форм кислорода, повреждающих окружающие ткани (Peterhans Е. (1997). Oxidants and antioxidants in viral diseases: disease mechanisms and metabolic regulation, JNutr., 127(5), 962-965).
Альтернативной возможностью воздействия на патогенез вирусной инфекции является подавление секреции провоспалительных цитокинов, которая считается одним из главных факторов, ведущих к тяжелым повреждениям органов и тканей при ряде вирусных инфекций. В особенности это касается таких серьезных и тяжелых инфекций, которые вызываются вирусами гриппа H5N1 и атипичной пневмонии (Korteweg С, Gu J. (2008). Pathology, molecular biology, and pathogenesis of avian influenza A (H5N1) infection in humans. Am J Pathol., 172(5), 1155-1170).
По-видимому, подавление апоптоза инфицированных макрофагов и гиперсекрецию провоспалительных цитокинов можно считать одними из важнейших патогенетических механизмов, которые обеспечивают развитие гриппозной инфекции в организме. Принимая во внимание данные о вовлеченности этих механизмов в инфекционный процесс при гриппе, можно предположить, что восстановление способности макрофагов к апоптозу и подавление чрезмерной секреции провоспалительных цитокинов должно приводить к ускорению элиминации вируса гриппа и уменьшению степени повреждения тканей.
В литературе представлено множество доказательств того, что 3,3-дииндолилметан (ДИМ) коммитирует клетки к апоптозу, протекающему с участием митохондриального и, возможно, других механизмов (например, Savino J.A., Evans J.F., Rabinowitz D., Auborn K.J., Carter Т.Н. (2006) Multiple, disparate roles for calcium signaling in apoptosis of human prostate and cervical cancer cells exposed to diindolylmethane, Mo I Cancer Ther., 5(3), 556-563).
Для лечения острых инфекционных процессов особенно важна скорость доставки лекарственного средства в очаг воспаления. Такая лекарственная форма была разработана для 3,3-дииндолилметана (RU 2419426 С1, опуб. 27.05.2011) и представляет собой ДИМ, растворенный в смеси рыбьего жира и полисорбата и расфасованный в твердые желатиновые капсулы. Содержание рыбьего жира, при котором удается достичь растворения ДИМ и повышения его биодоступности при пероральном приеме, составляет 10-20% от общей массы содержимого капсулы.
Состав раствора для наполнения капсул разработан с использованием рыбьего жира формулы «Омега-3», который улучшил растворение субстанции. Выбранное соотношение компонентов («Омега-3» к общей массе раствора составляет от 10 до 20%) обеспечивало стабильность как раствора, так и препарата в течение выбранного срока. Состав препарата по патенту RU 2419426 представлен в таблице 1. Спецификация используемого рыбьего жира формулы «Омега-3» приведена в таблице 2.
| Таблица 1 | |||
| Состав на одну капсулу | 1 | 2 | 3 |
| Дииндолилметан | 50 мг | 100 мг | 150 мг |
| Омега-3 (Рыбий жир) | 100 мг | 100 мг | 100 мг |
| Вспомогательные вещества | |||
| Полисорбат 80 (ЕР 2007) | 400 мг | 350 мг | 500 мг |
| Масса содержимого капсулы | 550 мг | 550 мг | 750 мг |
| Таблица 2 | ||
| Омега-3 | ||
| Наименование показателей | Метод | Требования |
| Внешний вид | Органолептический метод | Прозрачная желтоватая жидкость с рыбным запахом |
| Растворимость | ГФХИ | Практически нерастворим в воде |
| Относительная плотность | Ареометр | 0,915-0,930 г/см3 |
| Кислотное число | Евр.ф. | Не более 2,0 мгКОН/г |
| Перекисное число | Евр.ф. | Не более 5,0 ммоль акт.кисл./кг |
| Токкоферол (Витамин А) | Евр.ф | До 20 ppm |
| Сумма Омега-3: | ГЖХ | 60,0-100,0% |
| Полиненасыщенные жирные кислоты | ||
| тимнодоновая (эйкозопантаеновая) кислота (ЕРА) | ГЖХ | 33-44% |
| цервоновая (докозагексаеновая) кислота (DHA) | ГЖХ | 22-30% |
Применение рецептуры, описанной в патенте RU 2419426, для лечения гриппозной инфекции выявило побочный эффект в виде тяжелой формы диареи, которая вынуждала прекратить дальнейший прием препарата. По нашему предположению этот побочный эффект обусловлен высоким содержанием рыбьего жира, стимулирующего перистальтику кишечника. Таким образом, описанная рецептура не может быть использована для лечения острой гриппозной инфекции, тем более что для достижения устойчивых клинических эффектов требуются большие дозы ДИМ, достигающие 0,5 г и больше.
Задачей настоящего изобретения является расширение арсенала средств для лечения острых респираторных заболеваний и гриппозной инфекции путем разработки перорального лекарственного средства на основе 3,3-дииндолилметана (ДИМ) для лечения этих заболеваний.
Технический результат изобретения заключается в обеспечении возможности лечения острых респираторных заболеваний и гриппозной инфекции с использованием ДИМ.
Технический результат достигается лекарственным средством для лечения гриппа и респираторных вирусных инфекций, содержащим 3,3-дииндолилметан, рыбий жир типа A и вспомогательное вещество полисорбат 80 при соотношении компонентов, мас.%:
| 3,3-дииндолилметан | 9-20 |
| рыбий жир типа A | 1-10 |
| полисорбат 80 | остальное |
Для решения указанной задачи в первую очередь необходимо было снизить содержание рыбьего жира в препарате дииндолилметана, но при этом не изменить растворимость ДИМ в лекарственной форме и сохранить высокую биодоступность активного вещества.
Технический результат достигается также применением вышеуказанного лекарственного средства для лечения гриппа и респираторных вирусных инфекций предпочтительно путем введения его в количестве от 1 до 10 мг на один кг массы пациента.
Авторы предположили, что данная задача может быть решена использованием рыбьего жира типа А, характеризующегося низким содержанием непредельных жирных кислот (Пример 1).
Изучение противовирусной активности различных лекарственных форм дииндолилметана проводили на модели анализа протективных свойств препаратов у лабораторных животных (белых мышей) при экспериментальной смертельной гриппозной инфекции. Заданные условия экспериментальных исследований позволяют осуществлять жесткий выбор препаратов, обеспечивающих высокий процент выживания животных при заражении многократными смертельными дозами вируса. Фактически, в естественных условиях человек никогда не заражается абсолютно смертельной дозой вируса. В течение инкубационного периода и 1 фазы развития процесса в организме человека происходит репликация вируса, и главным условием развития осложненной и опасной для жизни инфекции является подавление вирусом защитных механизмов. На животной модели при заражении смертельной дозой вируса эти механизмы подавляются сразу, что позволяет тестировать препараты, действующие на ключевые процессы репродукции вируса и защиты.
Материалы и методы.
Вирусы. Вирус гриппа A/Aichi/2/68 (H3N2) был получен из коллекции вирусов НИИ гриппа РАМН и пассирован в аллантоисной полости 10-12-дневных куриных эмбрионов в течение 48 часов при 36°С.
Животные. Белых беспородных мышей (самки) массой 14-16 г получали из питомника «Рапполово» (Ленинградская обл.) и содержали на стандартном рационе в регламентированных условиях вивария НИИ гриппа РАМН. Подбор животных в группы опыта проводили методом случайной выборки. До начала испытаний животные находились под наблюдением 2 недели.
Экспериментальная гриппозная инфекция. Перед экспериментом 5 мышей были заражены вируссодержащей аллантоисной жидкостью. На 3 сутки после заражения их легкие были изолированы, гомогенизированы в 10-кратном объеме стерильного физиологического раствора, после чего инфекционная активность вируса в гомогенате была определена в отдельном эксперименте при помощи титрования по летальности на животных. Титр вируса рассчитывали по методу Рида и Менча (Am.J.Hyg., 1938, 27:493-497).
Исследуемые препараты вводили животным перорально исходя из концентрации 150 мг/кг веса в объеме 0,2 мл. Препараты вводили по лечебно-профилактической схеме: за 24 часа и 1 час до заражения и через 24, 48 и 72 часа после заражения. В качестве плацебо контрольной группе животных вводили физиологический фосфатный буфер. В качестве референс-препарата использовали Ремантадин в концентрации 50 мг/кг веса. Ремантадин вводили животным внутрибрюшинно в объеме 0,2 мл по той же схеме, что и исследуемые препараты. В качестве отрицательного контроля использовали интактных животных, которые содержались в тех же условиях, что и опытные группы.
Вирус вводили животным интраназально под легким эфирным наркозом в дозе 1 и 10 LD50. В каждую группу наблюдения брали по 13 мышей. На 3 день после заражения 3 животных из каждой группы умерщвляли, вскрывали и изолировали легкие для выделения вируса. Легкие хранили при -20°С до постановки соответствующих экспериментов.
Наблюдение за оставшимися животными осуществляли в течение 14 дней, т.е. срока, в течение которого при экспериментальном гриппе отмечается смертность животных. Ежедневно фиксировали смертность животных в контрольных и опытных группах. На основании полученных показателей смертности в каждой группе рассчитывали процент смертности (М, отношение числа павших за 14 дней животных к общему числу зараженных животных в группе), индекс защиты (IP, отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе) и среднюю продолжительность жизни животных (DL) из расчета 14 дней наблюдения в соответствии со следующими формулами:
| DL=(Σ N D)/Nt, | где N - количество животных, проживших D дней, |
| Nt - общее число животных в группе; | |
| M=M/Nt, | где М - число животных в группе, павших в |
| течение 14 дней после аражения; | |
| IР=((Мс-Ме)/Мс)×100%, | где Мс и Me - смертность в процентах в |
| контрольной и опытной группах соответственно. |
Животных, выживших к 15 дню после инфицирования, вскрывали и исследовали макроскопически их легкие. Визуально оценивали площадь хронических очагов постгриппозной пневмонии, остающихся в легочной ткани мышей по прошествии острой стадии гриппозной инфекции в течение всей жизни животного. Площадь очагов поражения выражали в процентах от общей площади поверхности легких.
Титрование вируса в легочной ткани. Для определения инфекционного титра вируса гриппа в легочной ткани животных легкие мышей, извлеченные на 3 сутки после инфицирования, гомогенизировали в десятикратном объеме стерильного физиологического фосфатного буфера и готовили из гомогенатов серию десятикратных разведений на том же буфере. Для титрования вируса использовали фрагменты переживающих хорионаллантоисных оболочек (ХАО) куриных эмбрионов.
Исследования проводили по модифицированному методу Fazekas de St.Growts [Hyng J., 1958, С.151]. Фрагменты ХАО готовили из хорионаллантоисной оболочки 10-12-дневных куриных эмбрионов после предварительной их стерилизации этанолом и удаления эмбриона вместе с желточным мешком. Кусочки ХАО размером (20×25) мм размещали в лунки полистирольных панелей, содержащие по 0,2 мл поддерживающей среды, и добавляли по 0,2 мл соответствующего разведения легочного гомогената. Планшеты покрывали стеклом, выдерживали 48 ч при температуре 37°С, удаляли фрагменты ХАО и вносили по 0,4 мл 1%-ной суспензии куриных эритроцитов в физиологическом растворе.
Уровень репродукции вируса в лунках панели оценивали по реакции гемагглютинации (РГА) эритроцитов. За титр вируса принимали величину, противоположную десятичному логарифму наибольшего разведения вируса, способного вызвать положительную реакцию гемагглютинации, и выражали в логарифмах минимальной 50% дозы вируса (lg ИД50).
Изобретение поясняется следующими чертежами.
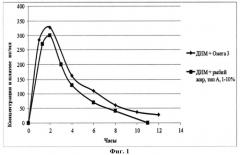
На фиг.1 приведен график зависимости концентрации дииндолилметана в плазме волонтеров от времени после приема 100 мг предложенного средства.
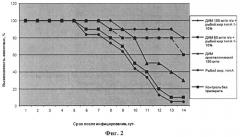
На фиг.2 приведены графики зависимости выживаемости белых мышей от времени при их инфицировании летальной гриппозной пневмонией при введении: (1) - предложенного средства ДИМ 150 мг/кг п/о+рыбий жир тип А 1%; (2) - предложенного средства ДИМ 600 мг/кг п/о+рыбий жир тип А 10%; (3) - только ДИМ кристаллический 150 мг/кг; (4) - только рыбий жир, тип А; (5) - контроль без препарата. Изобретение иллюстрируется следующими примерами.
Пример 1
Состав рыбьего жира, использованного для получения лекарственной формы.
В таблице 3 приведена спецификация рыбьего жира, использованного для получения предложенной лекарственной формы.
| Таблица 3 | ||
| Рыбий жир, тип А (ЕР) | ||
| Наименование показателей | Метод | Требования |
| Внешний вид | Органолептический метод | Прозрачная желтоватая жидкость с рыбным запахом |
| Растворимость | ГФ XII | Практически нерастворим в воде |
| Относительная плотность | Ареометр | 0,917-0,930 г/ см3 |
| Кислотное число | Евр.ф. 2.5.1 | Не более 2,0 мгКОН/г |
| Перекисное число | Евр.ф. 01/2008:0428 | Не более 10,0 ммоль акт.кисл./кг |
| Витамин А | Евр.ф | 600-2500 ME |
| Витамин D3 | Евр.ф | 60-250 ME |
| Состав жирных кислот: | ||
| Миристиновая кислота | ГЖХ | 2,0-6,0% |
| Пальмитиновая кислота | ГЖХ | 7,0-14,0% |
| Пальмитоолеиновая кислота | ГЖХ | 4,5-11,5% |
| Олеиновая кислота | ГЖХ | 12,0-21,0% |
| Полиненасыщенные жирные кислоты | ||
| Линолеиновая кислота | ГЖХ | 1,5-3,0% |
| α-линолеиновая кислота | ГЖХ | 0-2,0% |
| Тимнодоновая (экозопантаеновая) кислота (ЕРА) | ГЖХ | 7,0-16,0% |
| Цервоновая (докозагексаеновая) кислота (DHA) | ГЖХ | 6,0-18,0% |
Пример 2
Составы препарата.
В таблице 4 приведены составы препарата на одну капсулу.
| Таблица 4 | ||
| Состав на одну капсулу | ||
| Дииндолилметан | 50 мг | 100 мг |
| Рыбий жир, тип А | 10 мг-55 мг | 10 мг-55 мг |
| Вспомогательные вещества | ||
| Полисорбат 80 (ЕР 2007) | до 550 мг | до 550 мг |
| Масса содержимого капсулы | 550 мг | 550 мг |
Пример 3
Концентрация дииндолилметана в плазме волонтеров после приема 100 мг препарата.
Во всех клинических исследованиях проводилось сравнение фармакокинетики разработанного препарата DIM на основе рыбьего жира типа А в концентрации 1-10%, препарата DIM на основе Омега 3 и кристаллического DIM в равных дозировках. Во всех исследуемых группах волонтеров установлено, что оба препарата имеют сравнимую биодоступность. Максимальная концентрация DIM в крови наблюдалась через два часа после приема препаратов и достигала примерно 300 нг/мл. Прием кристаллического DIM в этой же дозировке не позволял обнаружить его в этом диапазоне концентраций в плазме пациентов (Фиг.1).
Пример 4
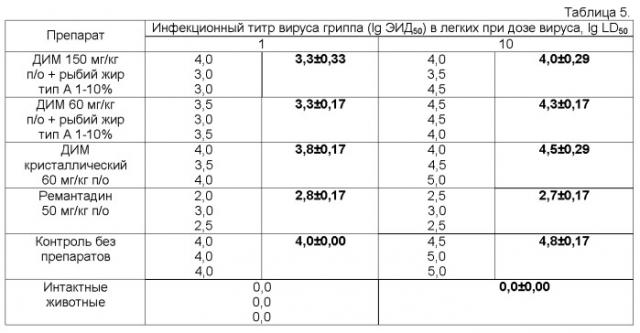
Влияние химиопрепаратов на содержание инфекционного вируса в легочной ткани белых мышей на 3 сутки после инфицирования представлено в таблице 5.
*жирным шрифтом выделены средние значения в каждой группе животных.
В ходе опыта не было отмечено токсических эффектов препаратов в использованных концентрациях в виде дозозависимой неспецифической смертности на ранних сроках эксперимента (1-2 сутки).
Как видно из представленных результатов, заражение животных вирусом гриппа вызывало репликацию инфекционного агента в легких независимо от заражающей дозы до уровня 4-5 lg ЭИД50/0,2 мл. Применение ремантадина в дозе 50 мг/кг веса животных снижало этот показатель на 1-3 порядка в зависимости от использованной дозы вируса.
Использование препаратов на основе ДИМ и рыбьего жира типа А в концентрации 1-10% существенно не влияло на инфекционные титры вируса в легких.
В ходе эксперимента не было отмечено неспецифической смертности в контрольной группе интактных животных. Клинические признаки заболевания были типичными для гриппозной инфекции и включали затрудненное дыхание, атаксию, тремор, а также снижение потребления корма и воды.
Пример 5
Смертность в ходе патологического процесса при экспериментальной летальной гриппозной инфекции у белых мышей, вызванной вирусом гриппа A/Aichi/2/68 (H3N2) в условиях применения химиопрепаратов, представлена в таблице 6.
| Таблица 6 | ||||||||||||||||
| Препарат | Доза вируса LD50 | Смертность животных на инфицирования сроках после (дни) | Средняя продолжительность жизни (дни) | Индекс защиты, % | ||||||||||||
| 1 | 2 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15* | ||||
| ДИМ 150 мг/кг п/о + рыбий жир тип А 1-10% | 1 | 0/10 | 15,0 | 100 | ||||||||||||
| 10 | 1 | 1 | 2/10 | 14,2 | 78 | |||||||||||
| ДИМ 60 мг/кг п/о + рыбий жир тип А 1-10% | 1 | 0/10 | 15 | 100 | ||||||||||||
| 10 | 1 | 1 | 2 | 4/10 | 13,5 | 56 | ||||||||||
| Ремантадин | 1 | 1 | 1/10 | 14,4 | 80 | |||||||||||
| 10 | 1 | 1 | 2/10 | 13,9 | 78 | |||||||||||
| Контроль без препаратов | 1 | 1 | 2 | 1 | 1 | 5/10 | 12,1 | - | ||||||||
| 10 | 1 | 1 | 1 | 2 | 1 | 2 | 1 | 9/10 | 10,9 | - |
* - общая смертность (пало/заражено)
Как следует из представленных в таблице 6 данных, вирус гриппа вызывал летальную инфекцию у белых мышей, сопровождающуюся гибелью животных, начиная с 6-9 суток после инфицирования в зависимости от дозы вируса. Такой показатель, как продолжительность жизни животных, был связан с использованной дозой вируса обратной зависимостью. Ремантадин, использованный в опыте как референс-препарат, оказывал при этой инфекции существенное протективное действие, что проявлялось снижением смертности в опытных группах по сравнению с контролем (индекс защиты 78-80%) и увеличением продолжительности жизни (на 2,7 - 3,0 суток в зависимости от дозы вируса). Полученные данные, таким образом, согласуются с ранее полученными результатами экспериментов in vitro, свидетельствующих о чувствительности использованного штамма вируса к ремантадину.
При анализе динамики показателей патологического процесса в условиях применения химиопрепаратов было показано, что они также проявляют способность к продлению срока жизни животных и снижению специфической смертности в группах опыта. Так, максимальная доза разработанного препарата при пероральном введении приводит к 100%-ной защите животных от летальной гриппозной пневмонии. При этом по совокупности показателей препарат ДИМ оказался сравнимым по эффективности с ремантадином, несмотря на отсутствие у него прямой противовирусной активности.
Пример 6
Протективное действие разработанных препаратов при летальной гриппозной пневмонии у белых мышей. Доза вируса 10 LD50.
При анализе динамики показателей патологического процесса в условиях применения разработанного препарата было показано, что он также влияет на продление срока жизни животных и снижение специфической смертности в группах. Так, пероральное введение максимальной дозы разработанного препарата приводит к 100%-ной защите животных от летальной гриппозной пневмонии.
Для наглядности протективное действие препаратов при наибольшей из использованных доз вируса (10 LD50) представлено на Фиг.2. Следует отметить, что ДИМ в кристаллическом виде практически не оказывал влияние на выживание инфицированных животных, что очевидно обусловлено его низкой биодоступностью. Результаты выживаемости животных, получавших только рыбий жир, были сравнимы с контрольной группой, не получавшей никакого лечения.
Пример 7
Результаты оценки площади очагов хронического поражения легких при использовании химиопрепаратов представлены в таблице 7.
| Таблица 7 | ||
| Препарат | Площадь очагов хронической пневмонии (% от общей площади поверхности легких) при дозе вируса, LD50 | |
| Доза вируса -1 LD50 | Доза вируса -10 LD50 | |
| ДИМ 150 мг/кг п/о + рыбий жир тип А 1-10% | 26±±8,2 | 35±11,4 |
| ДИМ 60 мг/кг п/о + рыбий жир тип А 1-10% | 4±3,2 | 50±2,8 |
| Ремантадин | 31±11,8 | 27±6,8 |
| Контроль без препаратов | 39±8,2 | 72±9,0 |
Как видно из Таблицы 7, гриппозная инфекция приводила к появлению в легких животных стойких очагов хронического воспаления, площадь которых у выживших к 15-м суткам эксперимента напрямую зависела от использованной дозы вируса. Применение ремантадина снижало этот показатель для каждой из инфицирующих доз, наиболее достоверно это было выражено при дозе вируса 10 LD50. Использование разработанного препарата также существенно влияло на этот показатель.
Пример 8
Изучение эффективности разработанного препарата в лечении острых респираторных вирусных инфекций у людей.
В исследование включались пациенты, отвечающие следующим критериям,
Критерии включения:
- лабораторно подтвержденный диагноз ОРВИ средней степени тяжести, вызванной вирусами гриппа, парагриппа, аденовирусом, респираторно-синцитиальным вирусом;
- наличие симптомов общей инфекционной интоксикации;
- наличие симптомов поражения верхних дыхательных путей (ринит, фарингит, ларингит, трахеит);
- длительность заболевания не более 48 часов;
- возраст больных от 18 до 50 лет;
- отсутствие осложнений заболевания ОРВИ;
Критерии не включения:
- повышенная чувствительность в анамнезе к препаратам, используемым в качестве стандартной терапии, или к компонентам препарата Инфемин;
- положительные данные анализа крови на ВИЧ, сифилис, гепатиты В и С;
- тяжелые аллергические реакции в анамнезе;
- беременность или кормление грудью;
- существующие в настоящем или прошлом психические заболевания, настоящая алкогольная или наркотическая зависимость;
- аутоиммунные заболевания;
- тяжелые соматические заболевания (хронические заболевания сердечно-сосудистой системы, нейроэндокринной системы, печени, почек);
- необходимость стационарного лечения ОРВИ;
- участие в клиническом исследовании в течение последних 30 дней;
- отказ использовать методы барьерной контрацепции на протяжении исследования;
- прием противовирусных и/или иммуномодулирующих препаратов с момента начала заболевания ОРВИ.
Было проведено открытое, рандомизированное сравнительное клиническое исследование в 2-х параллельных группах. В исследовании было предусмотрено 3 периода: скрининговое обследование - до 1 дня, период лечения - 6 дней, период последующего наблюдения - 6 дней. Пациенты наблюдались амбулаторно. Всего 56 пациентов, отвечающих критериям включения/невключения, были рандомизированы в 2 группы по 28 пациентов в каждой. Исследуемый препарат назначается пациентам первой группы в дозе 400-800 мг/сут (2-4 капсулы с дозировкой 100 мг дииндолилметана 2 раза в сутки) в течение 6 дней, кроме того, они получали стандартную симптоматическую терапию. Пациенты второй группы получали только стандартную симптоматическую терапию. В исследовании оценка состояния пациентов проводилась пятикратно на протяжении 12 дней.
Средняя длительность заболевания в контрольной группе составила 7,0±1,5 дня, а в экспериментальной - 5,5±1,5 дня. Различие статистически значимо (р=0,0004, критерий Стьюдента). Кроме того, к концу курса лечения (на 6-й день терапии), в экспериментальной группе у 24 пациентов, произошло повышение уровня индуцированной выработки гамма-интерферона лимфоцитами, а в контрольной - только у 9 пациентов (р=0,0002, критерий χ2). Число осложнений также было ниже на фоне приема препарата - у 2 пациентов, тогда как в контрольной группе - у 8 человек (р=0,0403, критерий χ2). Не было выявлено статистически значимых отличий в эффективности препарата в подгруппах с инфекцией, вызванной различными вирусами, что указывает на универсальность лечебного эффекта при данной группе заболеваний. В результате проведенных исследований можно сделать следующие выводы.
1. Проведено тестирование протективных свойств препаратов ДИМ на основе рыбьего жира типа А с концентрацией 1-10% для лечения и профилактики вирусных инфекций у лабораторных животных (белых мышей) при экспериментальной гриппозной инфекции.
2. Будучи применен перорально по лечебно-профилактической схеме, препарат ДИМ на основе рыбьего жира типа А с концентрацией 1-10% не оказывал влияния на репликацию вируса гриппа в легких инфицированных животных.
3. Показано, что использование препаратов ДИМ на основе рыбьего жира типа А с концентрацией 1-10% препятствует развитию хронических последствий гриппозной инфекции, снижая площадь очагов хронической постгриппозной пневмонии у животных.
4. Показана высокая протективная активность препаратов ДИМ на основе рыбьего жира типа А с концентрацией 1-10% при пероральном введении мышам. Эта активность проявляется в снижении смертности мышей в опытных группах по сравнению с контролем (индекс защиты, в зависимости от дозы препарата, 80-100% и 22-78% при инфицирующей дозе 1 и 10 LD50 соответственно), а также увеличении средней продолжительности жизни (на 2,5-2,9 и 1,4-3,3 суток при дозе вируса 1 и 10 LD50 соответственно). Таким образом, активность этого препарата при пероральном введении оказывается сопоставима или превосходит активность препарата сравнения - ремантадина.
5. Показано, что использование препаратов ДИМ на основе рыбьего жира типа А с концентрацией 1-10% препятствует развитию хронических последствий гриппозной инфекции, существенно снижая площадь очагов хронической постгриппозной пневмонии у животных.
1. Лекарственное средство для лечения гриппа и респираторных вирусных инфекций, содержащее 3,3-дииндолилметан, рыбий жир типа A и полисорбат 80 при соотношении компонентов, мас.%:
| 3,3-дииндолилметан | 9-20 |
| рыбий жир типа A | 1-10 |
| полисорбат 80 | остальное |
2. Применение лекарственного средства по п. 1 для лечения гриппа и респираторных вирусных инфекций.
3. Применение по п. 2, при котором средство вводят в количестве от 1 до 10 мг 3,3-дииндолилметана на один кг массы пациента.