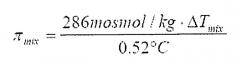Порошковые белковые композиции и способы их получения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается способа получения высушенной распылением стабильной порошковой композиции, содержащей антитело или его антигенсвязывающий фрагмент; фармацевтического препарата, содержащего эффективное количество высушенной распылением стабильной порошковой композиции, содержащей антитело или его антигенсвязывающий фрагмент, полученной указанным способом; высушенной распылением стабильной порошковой композиции, полученной указанным способом, содержащей антитело или его антигенсвязывающий фрагмент и эксципиент, где композиция содержит 6% или менее остаточной влаги и антитело или его антигенсвязывающий фрагмент выбрано из группы, состоящей из МАК 195F, АВТ-325, АВТ-308 или АВТ-147. Группа изобретений обеспечивает в качестве технического результата получение высушенной распылением порошковой композиции с повышенной стабильностью. 11 н. и 33 з.п. ф-лы, 11 ил., 14 табл.
Реферат
Родственные заявки
По данной заявке испрашивается приоритет по предварительной патентной заявке США номер 61/021298, поданной 15 января 2008 г., полное содержание которой включено в данный документ посредством ссылки.
Уровень техники изобретения
Основным принципом фармацевтических белковых препаратов является то, что должна быть преодолена определенная нестабильность. Пути деградации белков можно разделить на два типа, включающих химическую нестабильность и физическую нестабильность. Химическая нестабильность приводит к изменению белка за счет образования связей или расщепления. Примеры проблем, связанных с химической нестабильностью, включают дезамидирование, рацемизацию, гидролиз, окисление, бета-элиминирование и дисульфидный обмен. Физическая нестабильность, с другой стороны, не приводит к ковалентным изменениям в белках. Скорее, она связана с изменениями в структуре высшего порядка (вторичная и выше) белков. К ним относятся денатурация, адсорбция на поверхности, агрегация и преципитация. Manning et al., Pharm. Res. 6, 903 (1989).
После открытия структуры ДНК Уотсоном и Криком (1953) и последующего завершения проекта секвенирования человеческого генома интерес к химии белка рос быстрыми темпами. Отношения между генами и их белковыми продуктами при заболеваниях, в тканях и при развитии вызывали особый интерес. Next generation pharmaceutical, выпуск 6 (GDS publishing Ltd., 2006). За прошедшие десятилетия количество фармацевтических препаратов на основе белков увеличивалось очень быстро. В настоящее время некоторые белки или пептиды можно выделять или синтезировать, модифицировать и доставлять для ослабления или исцеления определенных нарушений и заболеваний. Основным способом применения фармацевтических препаратов на основе белков по-прежнему является внутривенное введение жидких препаратов, однако протестированы и применяются также и другие способы.
Было предпринято много усилий для перевода белковых растворов в твердые формы. Порошковые композиции имеют много преимуществ, например, большие количества белка можно хранить или транспортировать, так как они занимают меньше места и имеют меньший вес, и при этом расходуется энергии меньше, чем требуется для охлаждения жидких препаратов во время хранения и доставки. Порошковые композиции также легче использовать в новых способах доставки, таких как ингаляция (Tzannis et al., международная публикация № WO 2005067898) или безыгольная инъекция (Burkoth, The Drug Delivery Companies Report 76-78 (2001)). Для получения порошков из водных растворов белков используют различные методы, среди них распылительная сушка, распылительная сублимационная сушка, сублимационная сушка или осаждение из сверхкритических жидкостей, либо (частично) органических растворов. Winters et al., Journal of Pharm. Sci. 85(6): 586-594 (1996). В отличие от сублимационной сушки, которая является очень дорогой и трудоемкой процедурой, распылительная сушка является эффективным, действенным способом получения нагруженных белком сухих веществ, которые предоставляют возможности для разработки новых форм доставки биофармацевтических препаратов, таких как ингаляция. Maa et al., Pharm. Res. 16(2): 249-254 (1999).
При распылительной сушке чистого белкового раствора существует риск возникновения частичной инактивации, которая автоматически приводит к снижению качества фармацевтических препаратов. Инактивация, например, может быть вызвана процессом, связанным с физическим стрессом из-за высоких температур, напряжения сдвига и больших поверхностей раздела фаз (жидкость/газ), такая как денатурация или агрегация, либо химическими реакциями, например, гидролизом или окислением.
Сущность изобретения
Настоящее изобретение относится к способам распылительной сушки белковых препаратов, содержащих белок и эксципиент. В частности, способы и композиции по изобретению основаны на методе распылительной сушки, в котором раствор, содержащий интересующий белок и эксципиент, сушат распылением.
Препарат по изобретению обладает многими преимуществами по сравнению со стандартными растворами и лиофилизированными препаратами. В частности, способы распылительной сушки по изобретению сводят к минимуму связанную с процессом деградацию и повышают стабильность белков при температуре окружающей среды (например, по сравнению с сублимированными композициями). Кроме того, высушенные распылением препараты также легче перевозить, и они пригодны для производства высококонцентрированных препаратов, улучшая биодоступность белка, и разработки препаратов с локальным высвобождением (например, с доставкой в легкие) и замедленным высвобождением (например, липосомные и покрытые PLGA (поли(D,L-лактид-ко-гликолид) микросферы).
Способы и композиции по изобретению можно использовать для получения стабильной порошковой композиции или препарата, содержащих любой интересующий белок и эксципиент. В одном аспекте способы и композиции по изобретению используют для антител и их фрагментов, включая те, которые применяют in vivo и in vitro. В дополнительном варианте осуществления фрагмент антитела представляет собой фрагмент иммуноглобулина G (IgG).
Кроме того, многостадийные способы очистки и концентрирования, необходимые для получения белковых и пептидных препаратов, часто являются причиной вариабельности композиций, такой, что точный состав препарата может варьировать от партии к партии. Федеральное законодательство требует, чтобы композиции лекарственных средств были в высшей степени унифицированными по своему составу, независимо от места производства и номера партии. Способы по изобретению можно использовать для создания порошковых препаратов белков, к которым добавляют эксципиенты в точных количествах, что позволяет создавать белковые препараты с точными концентрациями эксципиентов.
В одном аспекте изобретение относится к способу получения порошкового белка или пептида, который включает распылительную сушку раствора, содержащего более чем примерно 50 мг/мл белка или пептида и по меньшей мере один эксципиент, так что получается порошковый белок или пептид. В некоторых вариантах осуществления раствор содержит более чем примерно 100 мг/мл белка или пептида. Белок может также представлять собой связывающий белок с двойным вариабельным связывающим доменом (DVD).
В некоторых вариантах осуществления способ включает получение порошкового антитела, которое включает распылительную сушку раствора, содержащего более чем примерно 50 мг/мл антитела или его антигенсвязывающего фрагмента и по меньшей мере один эксципиент, так что получается порошковое антитело. В некоторых вариантах осуществления раствор содержит более чем примерно 100 мг/мл антитела или его антигенсвязывающего фрагмента. Антитело или его антигенсвязывающий фрагмент может представлять собой иммуноглобулин G (IgG), например, MAK 195F, адалимумаб, ABT-325, ABT-308 или ABT-147. В некоторых вариантах осуществления порошок стабилен при температуре и влажности окружающей среды в течение по меньшей мере трех месяцев и/или стабилен при 40°C в течение по меньшей мере трех месяцев.
Эксципиент может включать, например, трегалозу, сахарозу, сорбит, полиэтиленгликоль, по меньшей мере одну аминокислоту, гистидин, аланин, аргинин, глицин или их смесь. В некоторых вариантах осуществления раствор имеет соотношение эксципиент:белок от примерно 0,27:1,0 до примерно 2,8:1,0; от примерно 0,27:1,0 до примерно 1,4:1,0; от примерно 0,27:1,0 до примерно 0,7:1,0 или соотношение примерно 0,7:1,0. В некоторых вариантах осуществления раствор содержит от примерно 20 до примерно 30 мМ эксципиента или примерно 25 мМ эксципиента.
В некоторых вариантах осуществления способ включает распылительную сушку с температурой входящего воздуха (Tin) от примерно 100°C до примерно 180°C, и температурой воздуха на выходе (Tout) от примерно 60°C до примерно 110°C. В некоторых вариантах осуществления способ включает распылительную сушку с Tin примерно 130°C и Tout примерно 80°C. Способ может включать, например, распыление раствора с образованием капель раствора, высушивание капель газом с образованием порошка и извлечение порошка из газа. Способ может включать распыление раствора при помощи распылителя с нагнетательным соплом и/или отделение и извлечение порошкового антитела из газа при помощи циклонного сепаратора.
Способ может также включать помещение порошкового антитела в фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель может быть приемлемым для парентерального, перорального, энтерального и/или местного введения. Фармацевтически приемлемый носитель может включать жидкость, такую как вода.
В другом аспекте изобретение направлено на создание фармацевтического препарата, который содержит эффективное количество антитела или его антигенсвязывающего фрагмента, полученного любым из способов, описанных в данном документе. В еще одном аспекте изобретение направлено на создание фармацевтического препарата, который содержит эффективное количество белка или пептида, полученного любым из способов, описанных в данном документе.
В еще одном аспекте изобретение относится к стабильной порошковой композиции, содержащей белок или пептид и эксципиент, где композиция содержит менее чем примерно 6% остаточной влаги, в некоторых вариантах осуществления - менее чем примерно 4% или 3% остаточной влаги. Белок или пептид может включать антитело или его антигенсвязывающий фрагмент, например, антитело IgG или его антигенсвязывающий фрагмент, такое как, например, MAK 195F, адалимумаб, ABT-325, ABT-308 или ABT-147. Белок может также представлять собой связывающий белок с двойным вариабельным связывающим доменом (DVD).
В некоторых вариантах осуществления порошковая композиция стабильна при температуре и влажности окружающей среды в течение по меньшей мере трех месяцев и/или примерно при 40°C в течение по меньшей мере трех месяцев. В некоторых вариантах осуществления белок или пептид, или антитело, или его антигенсвязывающий фрагмент сохраняет свою биологическую активность.
Эксципиент может включать трегалозу, сахарозу, сорбит, полиэтиленгликоль, по меньшей мере одну аминокислоту, гистидин, аланин, аргинин, глицин или их смесь. Композиция может иметь массовое соотношение эксципиента (например, трегалозы и/или сахарозы) и антитела или его антигенсвязывающего фрагмента от примерно 0,27:1,0 до примерно 2,8:1,0, от примерно 0,27:1,0 до примерно 1,4:1,0, от примерно 0,27:1,0 до примерно 0,7:1,0 или примерно 0,7:1,0. Композиция может иметь массовое соотношение эксципиента (например, сорбита) и антитела или его антигенсвязывающего фрагмента от примерно 0,27:1,0 до примерно 2,8:1,0, от примерно 0,27:1,0 до примерно 1,4:1,0, от примерно 0,27:1,0 до примерно 0,7:1,0 или примерно 0,7:1,0, или примерно 0,35:1.
В еще одном аспекте изобретение относится к способу производства фармацевтической композиции, который включает смешивание эффективного количества стабильной порошковой композиции по изобретению с фармацевтически приемлемым носителем, например, жидкостью, такой как вода. В некоторых вариантах осуществления фармацевтическая композиция адаптирована для парентерального, перорального, энтерального или местного введения. Способ может дополнительно включать обработку стабильной порошковой композиции при температуре значительно выше температуры окружающей среды (например, экструзия расплава) без существенного влияния на стабильность порошковой композиции.
В некоторых вариантах осуществления способ включает покрытие порошковой композиции, например, полимером, таким как PLGA, для получения фармацевтической композиции с замедленным высвобождением или отсроченным высвобождением. Дополнительно или альтернативно, способ может включать покрытие энтеросолюбильным покрытием. В некоторых вариантах осуществления активность белка, пептида, антитела или его антигенсвязывающего фрагмента защищена эксципиентом от преципитации, денатурации или окисления органическими растворителями, например, PEG 400, этанолом, DMSO, NMP или ледяной уксусной кислотой.
В настоящее время почти все компании используют замороженные нерасфасованные композиции лекарственных средств и сталкиваются с такими проблемами, как воспроизводимость условий замораживания и оттаивания, непредвиденная кристаллизация эксципиентов в составе нерасфасованной субстанции лекарственного средства, сдвиг pH буферного раствора в процессе замораживания, а также длительный период задержки в связи с оттаиванием, например, 2-литрового контейнера при температурах примерно 37°C. Использование высушенных распылением сыпучих композиций лекарственных средств поможет избежать указанных проблем. Кроме того, высушенные распылением сыпучие композиции лекарственных средств очень удобны для обработки в процессе составления конечной композиции лекарственного средства и делают возможным производство в широком диапазоне концентраций. В дополнение к этому, высушенные распылением композиции лекарственных средств, к которым только добавляют воду, могут заменять классическое составление препаратов и, вследствие этого, снижают риск при производстве лекарственного средства и в то же время способствуют увеличению производственной мощности. Кроме того, полноразмерные/полные антитела могут быть менее подвержены физической деградации по сравнению с фрагментами моноклонального антитела (мАТ) (mAb). Вдобавок, как правило, существует небольшое, или полностью отсутствует, увеличение физической или химической деградации с увеличением концентрации белка вплоть до 100 мг/мл. Поскольку более концентрированные растворы повышают эффективность процесса, использование концентраций белка 100 мг/мл будет полезно.
Краткое описание чертежей
Эти и другие особенности и преимущества способов и композиций, раскрытых в данном документе, будут более понятны со ссылкой на следующее подробное описание в сочетании с прилагаемыми чертежами, где:
на фигуре 1 представлена распылительная сушилка Büchi B-191, используемая в примерах;
на фигуре 2 представлен выход и Tg различных смесей сорбит-MAK;
на фигуре 3 представлена агрегация, кристалличность и содержание воды для различных смесей сорбит-MAK;
на фигуре 4 представлены изображения сканирующей электронной микроскопии (SEM) смесей сорбит-MAK 3000x (a) 25 мМ, (b) 100 мМ;
на фигуре 5 представлен выход и Tg различных смесей трегалоза-MAK;
на фигуре 6 представлена агрегация, кристалличность и содержание воды для различных смесей трегалоза-MAK;
на фигуре 7 представлены изображения SEM смесей трегалозы (3000x) (a) 10 мМ трегалоза, (b) 100 мМ трегалоза и (c) высушенная распылением чистая трегалоза;
на фигуре 8 представлен выход и Tg различных смесей сахароза-MAK;
на фигуре 9 представлена агрегация, кристалличность и содержание воды для различных смесей сахароза-MAK;
на фигуре 10 представлены данные эксклюзионной хроматографии (SEC) о физической стабильности для высушенных распылением препаратов MAK 195F: (A) влияние сорбита, трегалозы и сахарозы, и (B) влияние концентрации стабилизатора на степень агрегации белка; и
на фигуре 11 представлено влияние обработки и хранения в течение 3 месяцев (A) на физическую стабильность и (B) на химическую стабильность для высушенных распылением высококонцентрированных MAK 195F, адалимумаба и ABT-325 в 200 мМ растворах трегалозы.
Подробное описание изобретения
I. Определения
Для того чтобы сделать настоящее изобретение более понятным, сначала дается определение некоторым терминам.
Термин «кислый компонент», используемый в данном документе, означает вещество, включая раствор, имеющее кислый pH, то есть менее чем 7,0. Примеры кислых компонентов включают фосфорную кислоту, соляную кислоту, уксусную кислоту, лимонную кислоту, щавелевую кислоту, янтарную кислоту, винную кислоту, молочную кислоту, яблочную кислоту, гликолевую кислоту и фумаровую кислоту.
Термин «антиоксидант», используемый в данном документе, должен означать вещество, которое ингибирует окисление или действует как синергист антиоксиданта, и, таким образом, используется для предотвращения порчи препаратов вследствие окислительного процесса. Такие соединения включают в качестве примера и без ограничений альфа-токоферол (витамин E), аскорбиновую кислоту, аскорбилпальмитат, лимонную кислоту, бутилированный гидроксианизол, бутилированный гидрокситолуол, эдетовую кислоту (ЭДТА, эдетат) и ее соли, гидрофосфористую кислоту, яблочную кислоту, монотиоглицерин, пропионовую кислоту, пропилгаллат, метионин, аскорбат натрия, цитрат натрия, сульфид натрия, сульфит натрия, бисульфит натрия, метабисульфит натрия и другие, известные рядовому специалисту в данной области.
Если в данном документе не указано иное, термины «композиция» и «препарат» используются взаимозаменяемо.
Термин «эксципиент» означает вещество, которое можно добавлять к препарату для обеспечения необходимой консистенции, например, для изменения объемных свойств, для улучшения стабильности и/или регулирования осмоляльности. Примеры наиболее часто используемых эксципиентов включают, но не ограничиваются ими, стабилизаторы, сахара, полиолы, аминокислоты, поверхностно-активные вещества, хелатообразующие вещества и полимеры.
Термин «лекарственное средство», используемый в данном документе со ссылкой на композицию, например, водный препарат, представляет собой препарат, полезный для лечения заболевания или нарушения.
Термин «белок» должен включать последовательность аминокислот, в которой длина цепи является достаточной для образования более высоких уровней вторичной и/или третичной и/или четвертичной структуры. Это отличает его от «пептидов» или других низкомолекулярных молекул, которые не обладают такой структурой. Примеры белков, предусмотренных в рамках определения, используемого в данном документе, включают терапевтические белки. «Терапевтически активный белок» или «терапевтический белок» означает белок, который можно использовать для терапевтических целей, то есть для лечения нарушения у субъекта. Следует отметить, что в то время как терапевтические белки можно использовать в лечебных целях, изобретение не ограничивается только таким использованием, поскольку белки можно также использовать для исследований in vitro. В предпочтительном варианте осуществления терапевтический белок представляет собой слитый белок, либо антитело или его антигенсвязывающий фрагмент. В одном варианте осуществления способы и композиции по изобретению включают по меньшей мере два различных белка, которые определяют как два белка, имеющих различные аминокислотные последовательности. Дополнительные отличающиеся белки не включают продукты распада белка.
Термин «порошковый белок» означает композицию, содержащую белок, которую получают методами распылительной сушки по изобретению. «Порошковое антитело» означает композицию, содержащую антитело или его антигенсвязывающий фрагмент, которую получают методами распылительной сушки по изобретению.
Термин «фармацевтический препарат» означает препарат, находящийся в такой форме, которая позволяет биологической активности активных ингредиентов сохранять эффективность, и, вследствие этого, его можно вводить субъекту для терапевтического применения.
Термин «раствор» означает смесь по меньшей мере одного эксципиента или белка, или пептида с жидкостью. Раствор может включать растворенные молекулы белка, коллоидные растворенные молекулы белка, дисперсные агрегаты белка или кристаллы, или осадки, или суспензии в жидкости, либо их сочетания.
«Стабильная» композиция представляет собой композицию, в которой, например, находящийся в ней белок в основном сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность при обработке и/или при хранении. В данной области применяются различные аналитические методы для измерения стабильности белка, и их обзор приведен, например, в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993). В одном варианте осуществления стабильность белка определяют по процентному содержанию мономера белка в растворе, с малым процентным содержанием деградированного (например, фрагментированного) и/или агрегированного белка. Например, водная композиция, содержащая стабильный белок, может содержать по меньшей мере 95% мономера белка. Альтернативно водная композиция по изобретению может содержать не более 5% агрегатов и/или деградированного белка.
Термин «стабилизатор» означает эксципиент, который улучшает или иным образом повышает стабильность. Стабилизаторы включают, но не ограничиваются ими, α-липоевую кислоту, α-токоферол, аскорбилпальмитат, бензиловый спирт, бисульфиты, бор, бутилированный гидроксианизол (BHA), бутилированный гидрокситолуол (BHT), аскорбиновую кислоту и ее сложные эфиры, каротиноиды, цитрат кальция, ацетил-L-карнитин, хелатообразующие вещества, хондроитин, хондроитинсульфат, лимонную кислоту, коэнзим Q-10, ЭДТА (этилендиаминтетрауксусную кислоту, эдетата динатрий), эриторбовую кислоту, фумаровую кислоту, алкилгаллаты, глюкозамин (хитозан, гиалуронат натрия), яблочную кислоту, метабисульфит, пропилгаллат, бисульфит натрия, метабисульфит натрия, сульфит натрия, сульфит калия, винную кислоту, тиосульфаты, тиоглицерин, токоферол и его сложные эфиры, например, токоферола ацетат, токоферола сукцинат, токотриенал, d-α-токоферола ацетат, витамин C и его сложные эфиры, витамин Е и его сложные эфиры, например, витамина Е ацетат, а также их сочетания.
Термин «модификатор тоничности», используемый в данном документе, должен означать соединение или соединения, которые можно использовать для регулирования тоничности жидкого препарата. Подходящие модификаторы тоничности включают глицерин, лактозу, маннит, декстрозу, хлорид натрия, сульфат магния, хлорид магния, сульфат натрия, сорбит, трегалозу, сахарозу, рафинозу, мальтозу и другие, известные рядовому специалисту в данной области. В одном варианте осуществления тоничность жидкого препарата приближена к тоничности крови или плазмы.
Термин «антитело», используемый в данном документе, включает целые антитела и их любой антигенсвязывающий фрагмент (то есть «антигенсвязывающую часть») или одиночные цепи. «Антитело» означает гликопротеин, как правило, включающий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, связанные между собой дисульфидными связями, или его антигенсвязывающий фрагмент. Термин «антитело» также включает его выделенные существующие в природе варианты. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно обозначенной в данном документе VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно обозначенной в данном документе VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL можно дополнительно подразделять на области гипервариабельности, называемые определяющими комплементарность областями (CDR), перемежающиеся с областями, которые являются более консервативными и называются каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Термин «антигенсвязывающий фрагмент» антитела (или просто «фрагмент антитела»), используемый в данном документе, означает один или несколько фрагментов антитела, которые сохраняют способность специфически связываться с антигеном (например, TNFα, IL-12, IL-13). Антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, предусмотренных в рамках термина «антигенсвязывающий фрагмент» антитела, включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, бивалентный фрагмент, включающий Fab-фрагменты, связанные дисульфидным мостом в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546), который состоит из домена VH или VL, и (vi) выделенную определяющую комплементарность область (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединять, используя рекомбинантные методы, при помощи синтетического линкера, который дает им возможность находиться в составе одной белковой цепи, в которой области VL и VH образуют пары, формируя моновалентные молекулы (известные как одноцепочечные Fv (scFv), смотри, например, Bird et al. (1988) Science 242: 423-426, и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также должны быть предусмотрены в рамках термина «антигенсвязывающий фрагмент» антитела. Такие фрагменты антитела получают общепринятыми методами, известными квалифицированным специалистам в данной области, и данные фрагменты подвергают скринингу на полезность таким же образом, как и интактные антитела. В одном варианте осуществления изобретения фрагмент антитела выбирают из группы, состоящей из Fab, Fd, Fd', одноцепочечного Fv (scFv), scFvа и доменного антитела (dAb).
Более того, антитело или его антигенсвязывающий фрагмент может являться частью большей по размеру молекулы иммуноадгезина, образованной ковалентной или нековалентной ассоциацией антитела или фрагмента антитела с одним или несколькими другими белками или пептидами. Эти другие белки или пептиды могут иметь функциональные группы, которые позволяют очищать антитела или их антигенсвязывающие фрагменты или дают им возможность связываться друг с другом или другими молекулами. Так, примеры таких молекул иммуноадгезинов включают использование активной зоны стрептавидина для создания тетрамерных молекул одноцепочечного вариабельного фрагмента (scFv) (Kipriyanov et al. (1995) Human Antibodies and Hybridomas 6: 93-301) и использование остатка цистеина, маркерного пептида и C-концевого полигистидинового маркера для создания бивалентных и биотинилированных молекул scFv (Kipriyanov et al. (1994) Mol. Immunol. 31: 1047-1058). Фрагменты антител, такие как Fab- и F(ab')2-фрагменты, можно получать из целых антител общепринятыми методами, такими как расщепление папаином или пепсином, соответственно, целых антител. Кроме того, антитела, фрагменты антител и молекулы иммуноадгезинов можно получать при помощи стандартных методов рекомбинантной ДНК.
Два домена антитела являются «комплементарными», когда они принадлежат к семействам структур, которые образуют родственные пары или группы, или происходят из таких семейств и сохраняют эту особенность. Например, VH-домен и VL-домен антитела являются комплементарными, два VH-домена не являются комплементарными и два VL-домена не являются комплементарными. Комплементарные домены можно найти в других членах суперсемейства иммуноглобулинов, например, Vα и Vβ (или гамма и дельта) домены T-клеточного рецептора.
Термин «домен» означает свернутую белковую структуру, которая сохраняет свою третичную структуру независимо от остального белка. Как правило, домены отвечают за отдельные функциональные свойства белков, и во многих случаях могут добавляться, удаляться или переноситься на другие белки без утраты функции остальной части белка и/или домена. Под единичным вариабельным доменом антитела понимают свернутый полипептидный домен, содержащий последовательности, характерные для вариабельных доменов антитела. Вследствие этого, он включает вариабельные домены полного антитела и модифицированные вариабельные домены, например, в которых одна или две петли заменены последовательностями, которые не характерны для вариабельных доменов антитела, или вариабельные домены антитела, которые были укорочены или содержат N- или C-концевые дополнительные фрагменты, а также свернутые фрагменты вариабельных доменов, которые сохраняют, по меньшей мере частично, активность и специфичность связывания полноразмерного домена.
Вариабельные домены по изобретению можно комбинировать для образования группы доменов, например, можно комбинировать комплементарные домены, например, VL-домены комбинируют с VH-доменами. Некомплементарные домены также можно комбинировать. Домены можно комбинировать множеством способов, включая соединение доменов ковалентным и нековалентным образом.
«dAb» или «доменное антитело» означает полипептид одного вариабельного домена антитела (VH или VL), который специфически связывает антиген.
Термин «антигенсвязывающая область» или «антигенсвязывающий центр», используемый в данном документе, означает часть(ти) молекулы антитела или его антигенсвязывающего фрагмента, которая содержит аминокислотные остатки, взаимодействующие с антигеном, и придает антителу его специфичность и/или аффинность для антигена.
Термин «эпитоп» должен означать ту часть любой молекулы, которая способна узнаваться и связываться антителом в одной или нескольких антигенсвязывающих областях антитела. В контексте настоящего изобретения, под первым и вторым «эпитопами» понимают эпитопы, которые не являются одинаковыми и не связываются одним моноспецифическим антителом или его антигенсвязывающим фрагментом.
Словосочетание «рекомбинантное антитело» означает антитела, которые получают, экспрессируют, создают или выделяют рекомбинантными методами, такие как антитела, экспрессируемые при помощи рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина, антитела, выделенные из комбинаторной библиотеки антител, антитела, выделенные из животного (например, мыши), которое является трансгенным по генам иммуноглобулина человека (смотри, например, Taylor et al. (1992) Nucl. Acids Res. 20: 6287-6295), или антитела, полученные, экспрессированные, созданные или выделенные любыми другими способами, включающими сплайсинг конкретных последовательностей генов иммуноглобулинов (таких как последовательности генов иммуноглобулинов человека) с другими последовательностями ДНК. Примеры рекомбинантных антител включают химерные, CDR-привитые и гуманизированные антитела.
Термин «человеческое антитело» означает антитела, имеющие вариабельные и константные области, соответствующие или происходящие из последовательностей иммуноглобулинов зародышевой линии человека, как описано, например, в Kabat et al. (смотри Kabat, et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако человеческие антитела по изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, внесенные в результате случайного или сайт-специфического мутагенеза in vitro или в результате соматической мутации in vivo), например, последовательности CDR и, в частности, CDR3.
Рекомбинантные человеческие антитела по изобретению имеют вариабельные области и могут также включать константные области, происходящие из последовательностей иммуноглобулинов зародышевой линии человека (смотри Kabat et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242). Однако в некоторых вариантах осуществления такие рекомбинантные человеческие антитела подвергают мутагенезу in vitro (или, если используют животное, трансгенное по последовательностям Ig человека, то соматическому мутагенезу in vivo), и, таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, несмотря на то, что происходят от и родственны последовательностям VH и VL зародышевой линии человека, могут не существовать естественным образом в репертуаре антител зародышевой линии человека in vivo. Однако в некоторых вариантах осуществления такие рекомбинантные антитела являются результатом избирательного мутагенеза или обратной мутации, или и того и другого.
Термин «обратная мутация» означает процесс, при котором некоторые или все из аминокислот человеческого антитела, подвергшихся соматической мутации, заменены соответствующими остатками зародышевой линии из гомологичной последовательности антитела зародышевой линии. Последовательности тяжелой и легкой цепей человеческого антитела по изобретению отдельно выравнивают с последовательностями зародышевой линии в базе данных VBASE для выявления последовательностей с наибольшей гомологией. Отличия, имеющиеся в человеческом антителе по изобретению, устраняют возвратом к последовательности зародышевой линии путем мутирования нуклеотидов на определенных позициях, кодирующих такую отличающуюся аминокислоту(ты). Роль каждой аминокислоты, идентифицированной таким образом в качестве кандидата для обратной мутации, должна быть исследована на ее прямую или опосредованную роль в связывании антигена, и любая аминокислота, которая, как установлено после мутации, влияет на любую желательную характеристику человеческого антитела, не должна быть включена в конечное человеческое антитело. Чтобы свести к минимуму число аминокислот, подвергающихся обратной мутации, те аминокислотные позиции, которые, как было установлено, отличаются от ближайшей последовательности зародышевой линии, но идентичны соответствующим аминокислотам во второй последовательности зародышевой линии, можно оставлять, при условии, что вторая последовательность зародышевой линии идентична и коллинеарна с последовательностью человеческого антитела по изобретению по меньшей мере по 10, предпочтительно по 12 аминокислотам, с обеих сторон от интересующей аминокислоты. Обратная мутация может иметь место на любом этапе оптимизации антитела.
Термин «химерное антитело» означает антитела, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из одного вида, а последовательности константных областей из другого вида, например, антитела, имеющие вариабельные области тяжелой и легкой цепей мыши, соединенные с константными областями человека.
Термин «CDR-привитое антитело» означает антитела, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из одного вида, но в которых последовательности одной или нескольких CDR-областей VH и/или VL заменены последовательностями CDR из другого вида, например, антитела, имеющие вариабельные области тяжелой и легкой цепей мыши, в которых одна или более мышиных CDR (например, CDR3) заменены последовательностями CDR человека.
Термин «гуманизированное антитело» означает антитела, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из видов, отличных от человека (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL была изменена, чтобы стать более «человеческой», то есть более сходной с вариабельными последовательностями зародышевой линии человека. Один тип гуманизированного антитела представляет собой CDR-привитое антитело, в котором последовательности CDR человека вводят в последовательности VH и VL, отличные от человеческих, для замены соответствующих последовательностей CDR, отличных от человеческих.
Различные аспекты изобретения описаны более подробно в следующих подразделах.
II. Способы по изобретению
Способы по настоящему изобретению и полученные композиции по настоящему изобретению обладают множеством преимуществ для доставки и/или распространения лекарственной субстанции, например, препараты являются более легкими и стабильными при температуре окружающей среды. Существуют также преимущества для составления и