Способы лечения легочных нарушений составами липосомального амикацина
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к пульмонологии, и может быть использовано для лечения легочного нарушения у больного. Для этого пациенту вводят эффективную дозу распыленного состава липосомального амикацина от 100 до 2500 мг ежедневно в течение цикла лечения, который включает период введения от 15 до 75 дней и последующий период отмены в течение от 15 до 75 дней. При этом цикл лечения повторяется, по меньшей мере, дважды. Изобретение обеспечивает улучшение функции легких, которое поддерживается в течение, по меньшей мере, 15 дней после окончания лечения, и увеличение объема форсированного выдоха в одну секунду (FEV1). 27 з.п. ф-лы, 16 табл., 11 ил., 3 пр.
Реферат
По настоящей заявке испрашивается предварительный приоритет заявки США No. 12/250412, поданной 13 октября 2008 г., содержание которой включено тем самым в качестве ссылки в полном объеме.
Известный уровень техники
Кистозный фиброз (CF), также называемый муковисцидозом, представляет собой аутосомное, рецессивное, наследственное заболевание экзокринных желез. Оно поражает легкие, потовые железы и пищеварительную систему, вызывая хронические нарушения дыхательной и пищеварительной систем. Оно вызывается в результате мутаций белка трансмембранного регулятора проводимости кистозного фиброза (CFTR). Это наиболее обычное летальное, аутосомное, рецессивное заболевание среди белой расы.
Первой манифестацией CF иногда является мекониевая непроходимость кишечника у 16% младенцев, у которых развивается CF. Другие симптомы CF проявляются в период раннего детства. Оба легких и поджелудочная железа продуцируют аномально вязкую слизь. Эта слизь начинает наращиваться и начинает забивать проходы в поджелудочную железу и легкие. Легочные проблемы начинаются с постоянного присутствия густой, вязкой слизи и представляют собой одно из наиболее серьезных осложнений CF. Слизь в легких может становиться ростовой средой для бактерий, приводя к хроническим респираторным инфекциям и конечному постоянному повреждению легочной ткани. В течение конечной стадии CF больной испытывает повышенный застой в грудной клетке, непереносимость активности, повышенные хрипы и усиленный кашель, выделения от которого часто содержит мокроту, смешанную с кровью (кровохарканье), обусловленную кровотечением из легочных артерий бронхиол. Хронический кашель и кашель со стреляющими звуками обычен у людей с CF. Эти густые секреты также вызывают обструкцию поджелудочной железы, препятствуя поступлению в кишечник пищеварительных ферментов, способствующих перевариванию и всасыванию пищи. Учащенный стул с неприятным запахом часто является ранним признаком CF наряду с жирными маслами, которые видны в стуле. Это может нарушать рост и питание в целом, если подходящее лечение для поддержки пищеварения не используется в ранний период жизни. Так как легочная функция ухудшается, у больных CF может развиваться легочная гипертензия, хронический бронхит и хроническая дилатация бронхиол (бронхоэктазия). Весьма обычным является абсцесс легких. Смерть обычно наступает от тяжелой инфекции, пневмонии или сердечной недостаточности.
Кистозный фиброз является исключительно наследуемым, так как оба родителя должны нести рецессивные гены, чтобы ребенок приобрел заболевание. На генетическом уровне кистозный фиброз наиболее часто является результатом делеции в рамке трех пар оснований в ДНК. Кистозный фиброз возникает в результате продукции аномальной формы белка, называемого трансмембранным регулятором проводимости кистозного фиброза (CFTR). CFTR участвует в транспорте хлоридных ионов через эпителиальные клетки, найденные в легком и кишечном тракте. У больных CF CFTR работает неадекватно, вызывая аккумуляцию ионов в эпителиальных клетках. Так как вода следует за ионами в результате осмотического процесса, это ведет к истощению воды и вязкой слизи на поверхности альвеол. Наиболее общей аномалией белка CFTR является мутация, обозначаемая как ∆F508, которая характеризуется делецией 3 п.о. в последовательности пар оснований ДНК с локализацией в хромосоме 7q31.1-31.2, которая кодирует аминокислоту фенилаланин.
В дополнение к легочным инфекциям большинство людей с CF также страдают от проблем с пищеварением, особенно перевариванием жиров. Это ведет к нарушению всасывания и трудностям в прибавлении и поддержании массы, что в свою очередь влияет на здоровье в целом. Это обусловлено аномально вязкой слизью, которая блокирует высвобождение пищеварительных ферментов из поджелудочной железы. Недостаточность поджелудочной железы лечат дополнительными ферментами. Обычно необходимы смешиваемые с водой формы жирорастворимых витаминов A, D, E и K, так как пониженное всасывание жиров может вести к дефициту этих витаминов.
Больные CF также характеризуются повышенной заболеваемостью сахарным диабетом из-за блокады поджелудочной железы. Хроническая блокада вызывает с течением времени деградацию островков Лангерганса и снижение продукции инсулина, являющееся причиной гипергликемии. Существует также доказательство того, что больные CF становятся более устойчивыми к продуцируемому инсулину, что может инициироваться инфекциями или лечением кортикостероидами. Диабет у больных CF обычно обозначается как CFRD, диабет, связанный с кистозным фиброзом. Обычная диета для диабетиков не возможна и, следовательно, дозы инсулина вместо этого подгоняют к типичной высококалорийной/высокожировой диете CF.
У многих больных CF происходит расширение до некоторой степени кончиков их пальцев, известное как «барабанные палочки». Состояние влияет на пальцы рук и ног и ведет к округлению и увеличению кончиков пальцев. Это может также наблюдаться у людей с COPD или тяжелым заболеванием сердца. Так как люди с CF склонны к плохому всасыванию питательных веществ, остеопороз может возникнуть раннем периоде полового созревания из-за низкой плотности костей. Для людей с CF важно регулярно проходить сканирования с помощью измерения поглощения рентгеновских лучей двух разных энергий (DEXA) для измерения плотности костей и начала лечения, если это необходимо. При ранней диагностике лечение может помочь предотвратить более серьезные осложнения.
Некоторые больные CF характеризуются потерей слуха в результате побочного эффекта длительного использования лекарств группы -мицин/-мицин, таких как тобрамицин, который используют для борьбы с легочными инфекциями. Хотя этот побочный эффект хорошо известен и понятен, эти конкретные антибиотики крайне ценны для лечения больных CF, и часто потеря слуха может рассматриваться как необходимый компромисс для сохранения жизни и здоровья. CF возникает в первую очередь у индивидуумов, происходящих из центральной и западной Европы. В Соединенных Штатах медиана возраста наступления смерти повысилась с возраста 8,4 лет в 1969 г. до возраста 14,3 лет в 1998 г. Средний возраст наступления смерти повысился с 14 лет в 1969 г. до возраста 32, 4 года в 2003 г. (Фонд кистозного фиброза). Основным вкладом в существенное увеличение ожидаемой продолжительности жизни является усовершенствованное лечение антибиотиками хронических инфекций дыхательных путей у индивидуумов с CF (Goss and Rosenfeld 2004), а также улучшенное питание и более ранняя диагностика.
Главным фактором здоровья дыхательных путей у индивидуумов с CF является восприимчивость к хроническому инфицированию Pseudomonas aeruginosa. Скорость инфицирования P. aeruginosa повышается с возрастом и в возрасте 18 лет 80% индивидуумов с CF в США являются инфицированными. Трудности лечения этой инфекции являются мультифакторными, включая слабое проникновение антибиотиков в места инфицирования, включая мукозные пробки, инактивацию антибиотиков мокротой при CF, рост бактерий в биопленке, изменения фенотипа, включая превращение в мукоидную форму P. Aeruginosa, и появление множественной устойчивости к лекарствам (Chmiel and Davis 2003; Gibson, Burns et al. 2003). Краеугольным камнем лечения легких является оптимизация лечения P. Aeruginosa, так как инфицирование этим патогеном связано с плохим клиническим исходом (Doring, Conway et al. 2000; Chmiel and Davis 2003; Gibson, Burns et al. 2003; Gibson, Emerson et al. 2003).
Один из современных подходов к управлению хроническим инфицированием P. Aeruginosa у человека с CF включает использование супрессорной терапии с помощью ингалируемого тобрамицина (TOBI®). Ингалируемый тобрамицин, 300 мг, вводимый дважды в день с циклами по 28 дней с последующим 28-дневным перерывом приема лекарства, как показано, снижает количество колоний P. Aeruginosa, повышает предсказанный % FEV1, снижает госпитализации и снижает использование антибиотиков (Ramsey, Pepe et al. 1999). Тем не менее, больные должны получать дозу два раза в день при приблизительно 15-20 минутных периодов ингаляции на дозу.
Ежедневная физиотерапия грудной клетки и лечение вдыханием аэрозоля весьма обычно предписывается больным CF. Обычная физиотерапия включает ручное выстукивание (поколачивание) грудной клетки, способы и устройства избыточного давления или возможное использование устройства, такого как ThAIRapy Vest или внутрилегочный перкуссивный вентилятор (IPV) для достижения того же эффекта: высвобождения вязкой слизи. Обычно даваемые аэрозольные медицинские препараты включают альбутерол, ипратропия бромид и пульмозим для высвобождения секретов и снижения воспаления. Обнаружено, что те больные CF, которые переходили с одного на другое, были более здоровыми; в последующем в некоторых больницах использовали распыленный 6%-10% солевой раствор у тех больных CF, которые не имели астмы, для высвобождения секретов. Для борьбы с инфекциями иногда дают ингалируемые аминогликозидные антибиотики. Используется ряд фармакологических агентов, которые помогают в выведении слизи. N-ацетилцистеин, который солюбилизирует мукозный гликопротеин, однако, не был одобрен как высокоэффективный. Рекомбинантная ДНКаза человека снижает вязкость мокроты путем разрушения концентрированного количества ДНК в мокроте больных CF. Лечение ДНКазой выгодно для увеличения проходимости дыхательных путей при кратковременном использовании и также продлевает интервал между эпизодами легочных обострений.
Больные CF обычно госпитализируются до некоторой степени регулярно, часто каждые 6 месяцев в зависимости от тяжести случая. Больные часто получают внутривенные антибиотики через катетеры линии PICC, центральной линии или Port-a-Caths.
Кистозный фиброз может также приводить к бронхоэктазии. Бронхоэктазия представляет собой аномальное растяжение и расширение дыхательных путей, обусловленное блокадой слизью. Когда организм не способен избавиться от слизи, слизь становится прилипшей и аккумулируется в дыхательных путях. Блокада и сопровождаемая инфекция вызывают воспаление, ведущее к ослаблению и расширению путей. Ослабленные пути могут покрываться рубцами и деформироваться, что позволяет слизи и бактериям аккумулироваться в большей степени, приводя к циклированию инфекции и блокаде дыхательных путей. Бронхоэктазия представляет собой заболевание, которое вызывает локализованное необратимое расширение части бронхиального дерева. Вовлеченные бронхи расширяются, воспаляются и легко сминаются, приводя к обструкции проходимости дыхательных путей и нарушению выведения секретов. Бронхоэктазия связана с широким спектром нарушений, но она обычно возникает в результате некротизирующих бактериальных инфекций, таких как инфекции, вызываемые штаммами Staphylococcus или Klebsiella, или Bordatella pertussis.
Бронхоэктазия является одним из хронических обструктивных заболеваний легких (COPD) и она может осложняться эмфиземой и бронхитом. Заболевание обычно неверно диагностируется как астма или пневмония. Бронхоэктазия может развиваться в любом возрасте, наиболее часто начинается в детстве, но симптомы могут быть не очевидными еще долгое время. Бронхоэктазия может возникать как часть врожденного дефекта, такого как первичная цилиарная дискинезия или кистозный фиброз. Приблизительно 50% всех случаев бронхоэктазии в США возникает из-за кистозного фиброза. Она может также развиваться после рождения как результат травмы или других заболеваний, таких как туберкулез, пневмония и грипп.
Расширение бронхиальных стенок ведет к обструкции проходимости дыхательных путей и нарушенному выведению секретов, потому что расширенные области препятствуют нормальному давлению воздуха в бронхиолах, вызывая застой мокроты в расширенных областях вместо того, чтобы выталкивать ее вверх. Застойная мокрота создает среду, ведущую к росту инфекционных патогенов, и эти области легких становятся, таким образом, очень чувствительными к инфекции. Чем больше инфекций испытывают легкие, тем больше становятся поврежденными легочная ткань и альвеолы. Когда это случается, бронхиолы становятся более неэластичными и расширенными, что создает бесконечный деструктивный цикл этого заболевания.
Существует три типа бронхоэктазии, варьирующих по степени тяжести. Веретенообразная (цилиндрическая) бронхоэктазия (наиболее обычный тип) относится к умеренно воспаленным бронхам, которые теряют способность сужаться дистально. При варикозной бронхоэктазии бронхиальные стенки выглядят четкообразными, так как области расширения перемежаются областями констрикции. Мешковидная (кистозная) бронхоэктазия характеризуется тяжелым необратимым вздутием периферических бронхов с или без уровней воздуха-жидкости. Заметен хронический продуктивный кашель, возникающий у до 90% больных бронхоэктазией. Мокрота продуцируется ежедневно у 76% больных.
В дополнение к CF другие генетические причины или факторы, вносящие вклад в бронхоэктазию, включают синдром Картагенера, синдром Юнга, недостаточность альфа-1-антитрипсина и варианты первичного иммунодефицита. Приобретенная бронхоэктазия возникает более часто, причем одной из наиболее значимых причин является туберкулез. Особенно типичной причиной заболевания у детей является синдром приобретенного иммунодефицита, возникающий в результате действия вируса иммунодефицита человека. Другие причины бронхоэктазии включают инфекции дыхательных путей, обструкции, вдыхание и аспирация аммиака и других токсических газов, легочная аспирация, алкоголизм, употребление героина и аллергии. Курение сигарет тоже может вносить вклад в бронхоэктазию.
Диагноз бронхоэктазии основывается на изучении истории болезни и характерных паттернов данных КТ сканирования с высоким разрешением. Такие паттерны включают аномалии «дерева с почками» и кисты с определимыми границами. Бронхоэктазия может также диагностироваться без подтверждения КТ сканированием, если в истории болезни ясно обнаруживаются частые инфекции дыхательных путей, а также есть подтверждение лежащей в основе проблемы с помощью анализа крови и культивирования образцов мокроты.
Симптомы включают кашель (ухудшающийся при переходе в горизонтальное положение), одышку, аномальные звуки в грудной клетке, слабость, потерю массы и утомляемость. При инфекциях слизь может быть обесцвеченной, с неприятным запахом и может содержать кровь. Тяжесть симптомов широко варьируется от больного к больному и время от времени, до бессимптомного больного.
Целью лечения бронхоэктазии является контролирование инфекций и бронхиальной секреции, снятие обструкции дыхательных путей и предотвращение осложнений. Это включает продолжительное использование антибиотиков для предотвращения пагубных инфекций, а также удаление аккумулировавшейся жидкости с помощью постурального дренажа и физиотерапии грудной клетки. Может быть также использовано хирургическое вмешательство для лечения локальной бронхоэктазии, с удалением обструктивных участков, которые могут вызвать прогрессию заболевания.
Ингаляционная стероидная терапия, которой стойко придерживаются для возможности снижения продукции мокроты и снижения констрикции дыхательных путей, в течение периода времени должна предотвращать прогрессию бронхоэктазии. Одним из обычно используемых вариантов лечения является беклометазона дипропионат, также используемый при лечении астмы. Использование ингаляторов, таких как альбутерол (сальбутамол), флутиказон (фловент/фликсотид) и ипратропий (атровент), может способствовать снижению вероятности инфицирования путем очистки дыхательных путей и снижения воспаления.
Ингаляционный сухой порошок маннита под названием бронхитол одобрен FDA для использования у больных кистозным фиброзом с бронхоэктазией. Исходное показание для орфанного лекарства, одобренное в феврале 2005 г., позволяло его использование для лечения бронхоэктазии. Исходное одобрение основывалось на результатах фазы 2 клинических испытаний, продемонстрировавшей, что продукт является безопасным, хорошо переносимым и эффективным для стимуляции гидратирования/удаления слизи, тем самым улучшая качество жизни у больных с хроническими обструктивными заболеваниями легких, такими как бронхоэктазия. Продолжали развиваться длительные исследования до 2007 г. с гарантией безопасности и эффективности лечения.
Больным бронхоэктазией часто дают антибиотики для борьбы с инфекцией и бронходилататоры для открытия путей. Иногда антибиотики предписываются в течение длительного периода для предотвращения возвратных инфекций, особенно у людей, которые страдают кистозным фиброзом. Существуют также способы физиотерапии для помощи в удалении слизи. Трансплантация легких также является альтернативой в тяжелых случаях. Летальный исход не является обычным, но может возникать из-за массивной геморрагии. Если легочные инфекции подвергаются лечению немедленно, существует меньшая вероятность развития бронхоэктазии.
Пневмония представляет собой заболевание легких и дыхательной системы, при котором альвеолы (микроскопические заполненные воздухом мешочки легкого, ответственные за поглощение кислорода из атмосферы) воспаляются и заполняются жидкостью. Пневмония может возникать в результате различных причин, включая инфицирование бактериями, вирусами, грибами или паразитами и химическое или физическое повреждение легких. Типичные симптомы, связанные с пневмонией, включают кашель, боль в грудной клетке, лихорадку и затрудненность дыхания. Диагностические средства включают рентген и исследование мокроты.
Следовательно, существует потребность в лекарствах для лечения легочных нарушений, включая CF, легочные инфекции, COPD, бронхоэктазию и другие. Кроме того, существует потребность в улучшении легочной функции у больных, имеющих такие нарушения.
Краткое изложение сущности изобретения
Настоящее изобретение частично относится к способу лечения легочного нарушения у больного, включающему введение больному эффективной дозы распыленного состава липосомального амикацина в течение, по меньшей мере, одного цикла лечения, где:
цикл лечения включает период введения от 15 до 75 дней, с последующим периодом отмены в течение от 15 до 75 дней;
и эффективная доза включает от 100 до 2500 мг амикацина ежедневно в течение периода введения.
В некоторых вариантах осуществления цикл лечения с введением больному повторяется, по меньшей мере, дважды. В некоторых вариантах осуществления период введения составляет от 15 до 35 дней или от 20 до 35 дней. В других вариантах осуществления период введения составляет 28 дней. В некоторых вариантах осуществления период отмены составляет от 15 до 35 дней или от 20 до 35 дней. В других вариантах осуществления период отмены составляет 28 дней. В еще одних вариантах осуществления период отмены составляет от 25 до 75 дней, от 35 до 75 дней или от 45 до 75 дней. В других вариантах осуществления период отмены составляет приблизительно 56 дней.
В некоторых вариантах осуществления период введения составляет приблизительно 28 дней, и период отмены составляет приблизительно 28 дней, тогда как в других вариантах осуществления период введения составляет приблизительно 28 дней и период отмены составляет приблизительно 56 дней.
В некоторых вариантах осуществления эффективная доза включает от 250 до 1500 мг амикацина, от 250 до 1000 мг амикацина или от приблизительно 280 до приблизительно 560 мг амикацина. В других вариантах осуществления эффективная доза составляет приблизительно 280 или приблизительно 560 мг амикацина.
В некоторых вариантах осуществления легочное нарушение выбрано из группы, состоящей из хронической обструктивной болезни легких, бронхоэктазии, легочной инфекции, кистозного фиброза, недостаточности фермента альфа-1-антитрипсина и их сочетания. В других вариантах осуществления состояние легких представляет собой бактериальную инфекцию легких, такую как инфицирование P. aeruginosa. В некоторых вариантах осуществления состояние легких представляет собой бронхоэктазию.
В некоторых вариантах осуществления больной имеет Cmax амикацина в сыворотке менее приблизительно 10 мкг/мл в течение периода введения. В других вариантах осуществления больной имеет Cmax амикацина в мокроте, по меньшей мере, 1000 мкг на грамм мокроты либо в течение введения, либо в течение, по меньшей мере, 15 дней после введения.
В некоторых вариантах осуществления больной характеризуется снижением log10 КОЕ бактериальной инфекции в легких, по меньшей мере, на 0,5 в течение, по меньшей мере, 15 дней после окончания периода введения. В других вариантах осуществления снижение log10 КОЕ составляет, по меньшей мере, 1,0.
В некоторых вариантах осуществления больной испытывает улучшение функции легких в течение, по меньшей мере, 15 дней после окончания периода введения. Например, больной может испытывать увеличение FEV1, рост насыщения крови кислородом или оба эффекта. В некоторых вариантах осуществления больной имеет FEV1, который повысился, по меньшей мере, на 5% над FEV1 до цикла лечения. В других вариантах осуществления FEV1 повышается на от 5 до 50%. В других вариантах осуществления FEV1 повышается на от 25 до 500 мл над FEV1 до цикла лечения. В некоторых вариантах осуществления насыщение крови кислородом повышается, по меньшей мере, на 1% над насыщением кислородом до цикла лечения.
В некоторых вариантах осуществления длительность времени до обострения легочного заболевания составляет, по меньшей мере, 20 дней от последнего дня введения. В других вариантах осуществления длительность времени до избавляющего лечения составляет, по меньшей мере, 25 дней от последнего дня введения.
В некоторых вариантах осуществления состав липосомального амикацина включает липид, выбранный из группы, состоящей из фосфатидилхолина яйца (EPC), фосфатидилглицерина яйца (EPG), фосфатидилинозитола яйца (EPI), фосфатидилсерина яйца (EPS), фосфатидилэтаноламина (EPE), фосфатидной кислоты (EPA), фосфатидилхолина сои (SPC), фосфатидилглицерина сои (SPG), фосфатидилсерина сои (SPS), фосфатидилинозитола сои (SPI), фосфатидилэтаноламина сои (SPE), фосфатидной кислоты сои (SPA), гидрогенизированного фосфатидилхолина яйца (HEPC), гидрогенизированного фосфатидилглицерина яйца (HEPG), гидрогенизированного фосфатидилинозитола яйца (HEPI), гидрогенизированного фосфатидилсерина яйца (HEPS), гидрогенизированного фосфатидилэтаноламина (HEPE), гидрогенизированной фосфатидной кислоты (HEPA), гидрогенизированного фосфатидилхолина сои (HSPC), гидрогенизированного фосфатидилглицерина сои (HSPG), гидрогенизированного фосфатидилсерина сои (HSPS), гидрогенизированного фосфатидилинозитола сои (HSPI), гидрогенизированного фосфатидилэтаноламина сои (HSPE), гидрогенизированной фосфатидной кислоты сои (HSPA), дипальмитоилфосфатидилхолина (DPPC), димиристоилфосфатидилхолина (DMPC), димиристоилфосфатидилглицерина (DMPG), дипальмитоилфосфатидилглицерина (DPPG), дистеароилфосфатидилхолина (DSPC), дистеароилфосфатидилглицерина (DSPG), диолеилфосфатидилэтаноламина (DOPE), пальмитоилстеароилфосфатидилхолина (PSPC), пальмитоилстеароилфосфатидилглицерина (PSPG), моноолеоилфосфатидилэтаноламина (MOPE), холестерина, эргостерина, ланостерина, токоферола, аммонийных солей жирных кислот, аммонийных солей фосфолипидов, аммонийных солей глицеридов, миристиламина, пальмитиламина, лауриламина, стеариламина, дилауроилэтилфосфохолина (DLEP), димиристоилэтилфосфохолина (DMEP), дипальмитоилэтилфосфохолина (DPEP) и дистеароилэтилфосфохолина (DSEP), N-(2,3-ди-(9-(Z)-октадеценилокси))-проп-l-ил-N,N,N-триметиламмония хлорида (DOTMA), 1,2-бис(олеоилокси)-3-(триметиламмонио)пропана (DOTAP), фосфатидилглицеринов (PGs), фосфатидных кислот (PAs), фосфатидилинозитолов (PIs), фосфатидилсеринов (PSs), дистеароилфосфатидилглицерина (DSPG), димиристоилфосфатидиловой кислоты (DMPA), дипальмитоилфосфатидиловой кислоты (DPPA), дистеароилфосфатидиловой кислоты (DSPA), димиристоилфосфатидилинозитола (DMPI), дипальмитоилфосфатидилинозитола (DPPI), дистеароилфосфатидилинозитола (DSPI), димиристоилфосфатидилсерина (DMPS), дипальмитоилфосфатидилсерина (DPPS), дистеароилфосфатидилсерина (DSPS) и их смесей. В других вариантах осуществления состав липосомального амикацина включает фосфолипид и стерин, такой как DPPC и холестерин. В других вариантах осуществления состав липосомального амикацина включает DPPC и холестерин в отношении приблизительно 2 к 1 по массе. В некоторых вариантах осуществления состав липосомального амикацина обладает отношением липида к лекарству от приблизительно 0,5 до приблизительно 1,0, от приблизительно 0,5 до 0,7 или приблизительно 0,6 по массе.
Краткое описание фигур
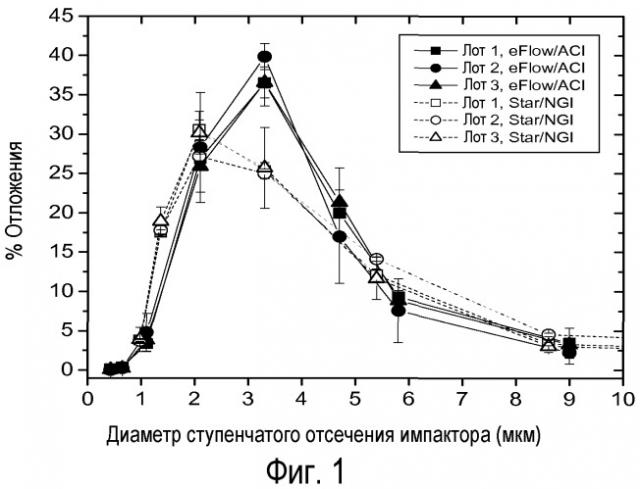
На фигуре 1 изображено распределение масс распыленных частиц липосомального амикацина, собранных ступенчато импактором, в виде функции ограничения диаметра. Использовали три лота липосомального амикацина из подписи к таблице 15 (обозначенные как 1, 2 и 3) с небулайзером eFlow и системой ACI (закрашенные символы) или с небулайзером LDC Star и системой NGI (незакрашенные символы).
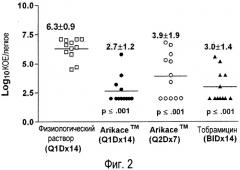
На фигуре 2 изображено снижение Log10КОЕ/легкие у крыс после ингаляции липосомального амикацина 75 мг/мл или тобрамицина. Символы представляют собой Log10КОЕ/легкие у каждой крысы через 18 дней после капельного введения PA3064 в агаровых шариках и через 3 дня после последней сессии ингаляции физиологического раствора или одного из указанных выше антибиотиков. Величины 2,0 Log10 КОЕ представляют собой нижний предел метода определения бактерий в легком. Отрезки представляют собой среднее в каждой группе. Результаты по средним и стандартным отклонениям и двустороннему t-критерию рассчитывали с использованием программы Excel от Microsoft.
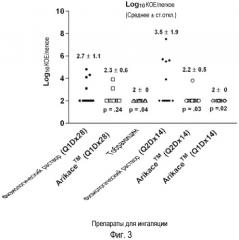
На фигуре 3 изображено снижение Log10КОЕ/легкие у крыс после ингаляции липосомального амикацина и тобрамицина в течение 28 дней. Эквивалентные дозы указанных выше антибиотиков давали с помощью ингаляционной терапии, но по различным схемам. Тобрамицин давали два раза в день ежедневно суммарно в течение 104 мин в день в течение 28 дней. Липосомальный амикацин давали один раз в день в течение 80 мин в течение 28 дней (Q1Dx28), также как и физиологический раствор. Липосомальный амикацин давали также один раз в день в течение 160 мин каждый следующий день в течение 28 дней (Q2Dx14), также как и физиологический раствор или один раз в день в течение 160 мин 14 последовательных дней (Q1DX14), затем объективно наблюдали до тех пор, пока крыс не подвергали эвтаназии. Символы представляют собой Log10КОЕ/легкие у каждой крысы через 35 дней после капельного введения P. aeruginosa 3064 в агаровых шариках. Средние и стандартные отклонения, а также двусторонний t-критерий рассчитывали с использованием программы Excel от Microsoft.
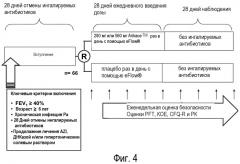
На фигуре 4 изображены схемы исследования для исследования 4, где больные получали липосомальный амикацин ежедневно в течение 28 дней с последующим мониторингом в течение 28-дневного периода после последнего дня введения.
На фигуре 5 изображен график, показывающий процентное увеличение насыщения кислородом над исходной линией у больных детей, получающих дозу 280 мг амикацина по сравнению с плацебо.
На фигуре 6 изображен график, показывающий насыщение кислородом у больных детей, получающих дозу 560 мг амикацина по сравнению с плацебо.
На фигуре 7a изображен график изменения функции легких с возрастом по измерению FEV1 в группе с плацебо. Данные по плацебо для вариантов как для 280, так и для 560 мг амикацина, объединяли и разделяли по возрасту. Также данные для Arikace™ для вариантов 280 и 560 мг амикацина объединяли и разделяли по возрасту.
На фигуре 7b изображено изменение функции легких с возрастом у больных, получавших ингалируемый липосомальный амикацин.
На фигуре 8 изображен график, сравнивающий изменение FEV1 (измеренный в мл) у групп с 560 мг и 280 мг амикацина и группы плацебо.
На фигуре 9 изображен график изменения FEV1 в виде процента по отношению к исходной линии у групп с 560 мг амикацина, 280 мг амикацина и плацебо.
На фигуре 10 изображен график изменения Log КОЕ у всех больных.
На фигуре 11 изображен график изменения Log КОЕ для мукоидных штаммов.
Подробное описание изобретения
I. Определения
Для удобства перед дальнейшим описанием настоящего изобретения в настоящем разделе собраны определенные термины, применяемые в описании, примерах и прилагаемой формуле изобретения. Эти описания должны быть прочитаны в свете оставшейся части раскрытия и быть понятны специалисту в данной области техники. Если не указано иначе, все методические и научные термины, используемые в настоящем описании, имеют то же самое значение, что и обычно понимаемое специалистом в данной области техники.
Термин «легочное нарушение» относится к любому заболеванию, недомоганию или другому болезненному состоянию, относящемуся к дыхательным путям индивидуума, особенно к легким индивидуума. Обычно патологическое состояние легких ведет к затрудненности дыхания.
Термин «лечение» известен в данной области техники и относится к лечению, а также к облегчению, по меньшей мере, одного симптома любого состояния или заболевания.
Термин «профилактическое» или «терапевтическое» лечение известен в данной области техники и относится к введению реципиенту одной или более надлежащих композиций. Если она вводится перед клинической манифестацией нежелательного состояния (например, заболевания или другого нежелательного состояния животного-реципиента), то лечение является профилактическим, т.е. оно предохраняет реципиента от развития нежелательного состояния, тогда как, если она вводится после манифестации нежелательного состояния, то лечение является терапевтическим (т.е. оно предназначено для снижения, облегчения или удержания нежелательного состояния или его побочных эффектов).
Термины «терапевтически эффективная доза» и «терапевтически эффективное количество» относятся к количеству соединения, которое ведет к предотвращению или облегчению симптомов у больного или желаемому биологическому исходу, например, улучшению клинических признаков, отставленному наступлению заболевания, сниженным уровням бактерий и т.д.
Термин «FEV1» хорошо известен в данной области техники как критерий функции легких и обозначает объем форсированного выдоха в одну секунду. Величины FEV1, используемые в настоящем описании, измеряются в мл, а также в виде процентного изменения от исходного уровня, например, изменения от величин до начала лечения.
«Больной», «индивидуум» или «реципиент», подвергаемые лечению с помощью представленного способа, могут обозначать либо человека, либо животного, не являющегося человеком.
Термин «млекопитающее» хорошо известен в данной области техники и примеры млекопитающих включают человека, приматов, коров, свиней, собак, кошек и грызунов (например, мышей и крыс).
Термин «биологически доступный» известен в данной области техники и относится к форме данного изобретения, которая принимает во внимание, что вводимое количество или его часть должна всасываться, включаться или другим образом быть физиологически доступной для того индивидуума или больного, которому оно вводится.
Термин «фармацевтически приемлемые соли» известен в данной области техники и относится к относительно нетоксичным, аддитивным солям соединений с неорганическими и органическими кислотами, включая, например, соли, содержащиеся в композициях настоящего изобретения.
Термин «фармацевтически приемлемый носитель» известен в данной области техники и относится к фармацевтически приемлемому веществу, композиции или наполнителю, такому как жидкий или твердый наполнитель, разбавитель, формообразующий агент, растворитель или инкапсулирующее вещество, вовлеченные в перенос или транспортировку любой данной композиции или ее компонента из одного органа или части тела к другому органу или части тела. Каждый носитель должен быть «приемлемым» в смысле быть совместимым с данной композицией и ее компонентами и не приносить вреда больному. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) солод; (6) желатин; (7) тальк; (8) наполнители, такие как масло какао и парафины суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, манит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) забуферивающие агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический физиологический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) растворы фосфатного буфера; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах.
II. Липосомальный амикацин
Составы липосомального амикацина, пригодные в способах, раскрытых в настоящем описании, могут быть получены, как описано, например, в публикации США No. 20060073198 или 20080089927, обе из которых включены в настоящее описание в качестве ссылки. Обычно амикацин используется в форме фармацевтически приемлемой соли, например, сульфатной соли амикацина.
Липиды, используемые в композициях настоящего изобретения, могут быть синтетическими, полусинтетическими или природными липидами, включая фосфолипиды, токоферолы, стероиды, жирные кислоты, гликопротеиды, такие как альбумин, анионные липиды и катионные липиды. Липиды могут быть анионными, катионными или нейтральными. В одном варианте осуществления липидный состав по существу свободен от анионных липидов, по существу свободен от катионных липидов или от обоих. В одном варианте осуществления липидный состав включает только нейтральные липиды. В другом варианте осуществления липидный состав свободен от анионных липидов или катионных липидов или от обоих. В другом варианте осуществления липид представляет собой фосфолипид. Фосфолипиды включают фосфатидилхолин яйца (EPC), фосфатидилглицерин яйца (EPG), фосфатидилинозитол яйца (EPI), фосфатидилсерин яйца (EPS), фосфатидилэтаноламин (EPE) и фосфатидную кислоту яйца (EPA); дубликаты сои, фосфатидилхолин сои (SPC); SPG, SPS, SPI, SPE и SPA; гидрогенизированные дубликаты яйца и сои (например, HEPC, HSPC), другие фосфолипиды, искусственно созданные с помощью эфирных связей жирных кислот в положениях 2 и 3 глицерина, содержащие цепи из от 12 до 26 углеродных атомов и различные головные группы в положении 1 глицерина, которые включают холин, глицерин, инозитол, серин, этаноламин, а также соответствующие фосфатидные кислоты. Цепи у этих жирных кислот могут быть насыщенными или ненасыщенными, и фосфолипид может создаваться из жирных кислот с различными длинами цепей и различной степенью насыщенности. В частности, композиции составов могут включать дипальмитоилфосфатидилхолин (DPPC), главное составляющее природного сурфактанта легких, а также диолеоилфосфатидилхолин (DOPC). Другие примеры включают димиристоилфосфатидилхолин (DMPC) и димиристоилфосфатидилглицерин (DMPG), дипальмитоилфосфатидилхолин (DPPC) и дипальмитоилфосфатидилглицерин (DPPG), дистеароилфосфатидилхолин (DSPC) и дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилэтаноламин (DOPE) и смешанные фосфолипиды, такие как пальмитоилстеароилфосфатидилхолин (PSPC) и пальмитоилстеароилфосфатидилглицерин (PSPG), триацилглицерин, диацилглицерин, церанид, сфингозин, сфингомиелин и моноацилированные фосфолипиды, такие как моноолеоилфосфатидилэтаноламин (MOPE).
Используемые липиды могут включать аммонийные соли жирных кислот фосфолипидов и глицеридов, фосфатидилглицеринов (PGs), фосфатидных кислот (PAs), фосфатидилхолинов (PCs), фосфатидилинозитолов (PIs) и фосфатидилсеринов (PSs). Жирные кислоты включают жирные кислоты с длинами углеродных цепей от 12 до 26 углеродных атомов, которые являются либо насыщенными, либо ненасыщенными. Некоторые конкретные примеры включают: миристиламин, пальмитиламин, лауриламин и стеариламин, дилауроилэтилфосфохолин (DLEP), димиристо