Фармацевтическая композиция, включающая агонист glp-1, инсулин и метионин
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики и медицины и касается жидкой композиции, включающей агонист GLP-1 или/и его фармакологически приемлемую соль, инсулин гларгин или/и его фармакологически приемлемую соль и, необязательно, по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, отличающейся тем, что данная композиция содержит метионин и имеет рН от 3,5 до 5. Заявлены также комбинация композиций, набор, содержащий комбинацию, и применение для получения лекарственного средства для лечения сахарного диабета. Группа изобретений обеспечивает стабильность при хранении и химическую целостность активных компонентов. 9 н. и 18 з.п. ф-лы, 2 пр., 4 ил.
Реферат
Объектом данной заявки является жидкая композиция, включающая агонист GLP-1 или/и его фармакологически приемлемую соль, инсулин или/и его фармакологически приемлемую соль и, необязательно, по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, причем данная композиция отличается тем, что содержит метионин.
Следующим объектом является композиция по изобретению для лечения сахарного диабета. Еще одним объектом является применение композиции по изобретению для получения лекарственного средства для лечения сахарного диабета. Следующим объектом данной заявки является способ получения композиции по изобретению, включающей композицию агониста GLP-1 или/и его фармакологически приемлемой соли с инсулином или/и его фармацевтически приемлемой солью, метионином и, необязательно, по меньшей мере одним фармацевтически приемлемым вспомогательным веществом. Следующим объектом является способ лечения пациентов композицией по изобретению, включающий введение композиции пациентам.
Обычно композиции инсулина и GLP-1-соединений содержат средство, обеспечивающее изотоничность, буферный раствор для доведения значения pH и консервант. Следующим часто применяемым компонентом композиций инсулина является цинк, который образует с инсулином комплекс. Таким образом, достигают замедленного действия инсулина.
WO 2003/02021 (Eli Lilly) относится к жидкой предварительно приготовленной композиции, включающей соединение GLP-1 и базальный инсулин. Одна конкретная композиция содержит Val8-GLP-1 или эксендин-4, инсулин NPH, глицерин в качестве средства, обеспечивающего изотоничность, м-крезол, фенол в качестве консерванта и фосфатный буфер с pH 7,6 или 8. Другая композиция содержит эксендин-4 или Val8-Glu22-GLP-1(7-37)OH, инсулин-гларгин (лантус), цинк, глицерин и маннитол в качестве средства, обеспечивающего изотоничность, м-крезол в качестве консерванта, ацетат натрия и цинка, pH 4.
В WO 2004/035623 (Zealand Pharmaceuticals) описана жидкая композиция, включающая стабилизированный эксендин, 50 мМ гистидина, от 100 до 200 мМ сахарозы, маннитол или другой приемлемый сахар, 20 мМ метионина, 20 мМ аспаргин-глютамина или Asp с pH 5,3. Стабилизации достигают определенной модификацией аминокислотных остатков эксендина-4(1-39), например, в положениях Gln13, Met14, Trp25 или Asn28. Данная композиция не содержит инсулина.
В WO 2005/046716 (Novo Nordisk) описывают жидкую композицию, которая содержит лираглютид и инсулин аспарт, буферный раствор с pH 7,7, полоксамер 188 в качестве поверхностно-активного вещества, фенол, пропиленгликоль и необязательно цинк. Без полоксамера 188 данная композиция является нестабильной. Стабилизации можно достичь с помощью полисорбата 20.
WO 2006/029634 (Novo Nordisk) относится к жидкой фармацевтической композиции, которая содержит инсулинотропный пептид (Агонист GLP-1), инсулиновый пептид и лиганд HisB10 (лиганд His в положении 10 В-цепи инсулина). Композиция может в качестве ПАВ содержать полисорбат 20 или полоксамер 188. Конкретная описанная в данном документе композиция содержала инсулин человека или B28-Asp-инсулин человека (инсулин аспарт), лираглютид (агонист GLP-1), глицерин в качестве средства, обеспечивающего изотоничность, ацетат цинка с pH 7,4 или 7,9. В зависимости от количества применяемого инсулина или лираглютида данная композиция была частично нестабильна уже после 15 дней хранения при комнатной температуре. Стабильности данной композиции достигали добавлением лиганда HisB10. Следующие композиции состояли из лираглютида, инсулина аспарта или детемира, пропиленгликоля, фенола и фосфатного буфера, pH 7,7. Данные композиции практически сразу были нестабильными. Добавление полоксамера 188 или полисорбата 20 и лиганда HisB10 приводило к стабилизации.
В WO 2006/051103 (Novo Nordisk) описана жидкая композиция, которая содержит детемир (базальный инсулин), лираглютид (соединение GLP-1) и полоксамер 188 или полисорбат 20 в качестве ПАВ. Дополнительно содержатся фенол, NaCl, пропиленгликоль, ацетат цинка и натрий-фосфатный или глицилглициновый буфер (pH 7,7). В некоторых композициях содержится м-крезол. Данные композиции можно стабилизировать добавлением полоксамера 188 или полисорбата 20.
WO 2008/124522 (Biodel) относится к композициям, которые содержат инсулин, цинк-халатирующий агент (например, EDTA или EGTA) и аналог GLP-1.
Во всем мире около 120 млн человек страдают сахарным диабетом. Среди них примерно 12 млн диабетиков I типа, для которых замещение недостающей эндокринной секреции инсулина является в настоящее время единственной возможной терапией. Заболевшие нуждаются пожизненно, как правило, несколько раз в день в инъекциях инсулина. В противоположность I типу диабета, при диабете II типа не обязательно существует недостаток инсулина, однако во множестве случаев, прежде всего в прогрессирующей стадии, лечение инсулином необязательно в комбинации с оральными антидиабетическими средствами рассматривают как самую благоприятную форму терапии.
У здорового человека высвобождение инсулина поджелудочной железой строго связано с концентрацией глюкозы в крови. Повышенный уровень глюкозы в крови, который образуется после еды, вскоре компенсируется соответствующим повышением секреции инсулина. В состоянии натощак уровень инсулина падает до самого низкого значения, которого хватает, чтобы обеспечивать непрерывное снабжение чувствительных к инсулину органов и тканей глюкозой и поддерживать выработку глюкозы в печени ночью на низком уровне. Возмещением физиологической секреции инсулина экзогенным, в большинстве случаев подкожным введением инсулина, как правило, не достигают вышеописанного качества физиологического регулирования уровня глюкозы в крови. Часто доходит до бесконтрольного повышения или понижения уровня глюкозы в крови, которые могут вызывать угрозу для жизни в самых тяжелых формах. Однако наряду с этим повышенный в течение многих лет уровень глюкозы в крови без первоначальных симптомов также представляет значительный риск для здоровья. Крупномасштабное DCCT-исследование в США (The Diabetes Control and Complications Trial Research Group (1993) N. Engl. J. Med. 329, 977-986) однозначно подтвердило, что хронически повышенный уровень глюкозы в крови в значительной мере отвечает за развитие поздних осложнении диабета. Поздние осложнения диабета представляют собой микро- и макрососудистые повреждения, которые проявляют себя при известных обстоятельствах как ретинопатия, нефропатия или невропатия и могут приводить к потере зрения, почечной недостаточности, а также к потере конечностей и, кроме того, сопровождаются повышенным риском для сердца и связанными с нарушением кровообращения болезнями. Из этого следует, что улучшение лечения диабета должно быть нацелено в первую очередь на то, чтобы удерживать уровень глюкозы в крови по возможности ближе к физиологическому диапазону. После программы усиленного инсулинового лечения вышеуказанной цели необходимо достигать неоднократными ежедневными инъекциями быстро- и замедленно действующих препаратов инсулина. Быстродействующие формы принимают перед приемом пищи для того, чтобы выравнивать возникающий после приема пищи подъем уровня глюкозы в крови. Замедленно действующий базальный инсулин должен обеспечивать основное снабжение инсулином, в частности, ночью для исключения гипогликемии.
Инсулин представляет собой полипептид из 51 аминокислоты, которые распределены на 2 аминокислотных цепи: цепь A из 21 аминокислоты и цепь B из 30 аминокислот. Цепи связаны друг с другом 2-мя дисульфидными мостиками. Препараты инсулина много лет применяют для лечения диабета. При этом применяют инсулин не только природного происхождения, а в последнее время также производные инсулина и его аналоги.
Аналоги инсулина представляют собой аналоги инсулина природного происхождения, а именно инсулина человека или инсулина животных, которые отличаются от, соответственно, в остальном такого же инсулина природного происхождения заменой по меньшей мере одного аминокислотного остатка природного происхождения остатком другой аминокислоты и/или добавлением/удалением по меньшей мере одного аминокислотного остатка. При этом речь может идти также об аминокислотах, которые не являются природными.
Производные инсулина представляют собой производные инсулина природного происхождения или аналоги инсулина, которые получены химическим модифицированием. Химическое модифицирование может состоять, например, в добавлении одной или нескольких определенных химических групп к одной или нескольким аминокислотам. Как привило производные инсулина и аналоги инсулина оказывают по сравнению с человеческим инсулином немного измененное действие.
Аналоги инсулина с ускоренным наступлением действия описаны в EP 0214826, EP 0375437 и EP 0678522. EP 0124826 относится к замещению B27 и B28. EP 0678522 описывает аналоги инсулина, которые в положении B29 имеют различные аминокислоты, предпочтительно пролин, но не глютаминовую кислоту. EP 0375437 охватывает аналоги инсулина с лизином или аргинином в B28, которые опционально могут быть модифицированы в B3 и/или A21.
В EP 0419504 описаны аналоги инсулина, которые защищены от химической модификации, в которых заменены аспарагин в B3 и по меньшей мере одна дополнительная аминокислота в положениях A5, A15, A18 или A21.
В WO 92/00321 описаны аналоги инсулина, у которых по меньшей мере одна аминокислота в положениях B1-B6 заменена лизином или аргинином. Данные инсулины имеют согласно WO 92/00321 продленное действие. Замедленное действие также имеют описанные в EP-A 0368187 аналоги инсулина.
Имеющиеся в продаже препараты инсулина из инсулина природного происхождения для инсулин-заместительной терапии различаются в происхождении инсулина (например, инсулин крупного рогатого скота, инсулин свиньи, инсулин человека), а также составом, что может оказывать влияние на профиль действия (начало действия и время воздействия). Благодаря комбинации различных препаратов инсулина можно достигать различных профилей действия и устанавливать как можно более физиологические значения сахара в крови. В настоящее время технология рекомбинантных ДНК делает возможным получение данных модифицированных инсулинов. К ним причисляют инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека, лантус) с длительным временем воздействия. Инсулин гларгин вводят в виде кислого чистого раствора, и затем он вследствие его свойств растворения в физиологической области pH выпадает в подкожной ткани в виде стабильных ассоциатов гексамеров. Инсулин гларгин вводится один раз в день и отличается от других инсулинов длительного действия равномерным профилем в жидкой фазе и связанным с этим уменьшением опасности ночных гипогликемий (Schubert-Zsilavecz et al., 2:125-130(2001)).
Специальный препарат инсулина гларгина, который приводит к удлиненному времени воздействия, отличается тем, что представляет собой прозрачный раствор с кислым значением рН.
Эксендины представляют собой группу пептидов, которые могут снижать концентрацию сахара в крови. Эксендины имеют схожую последовательность с GLP-1(7-36) (53%, Goke et al. J. Biol Chem 268, 19650-55). Эксендин-3 и эксендин-4 стимулируют подъем выработки cAMP в клетках ацинуса поджелудочной железы морских свинок посредством взаимодействия с рецепторами эксендина (Raufman, 1996, Reg. Peptides 61:1-18). Эксендин-3 в противоположность к эксендину-4 вызывает подъем высвобождения амилазы в клетках ацинуса поджелудочной железы. Эксендины действуют как агонисты GLP-1.
Глюкагоноподобный пептид 1 (GLP-1) представляет собой гормон внутренней секреции, который повышает инсулиновый ответ после орального приема глюкозы или жиров. В общем GLP-1 снижает концентрацию глюкагона, замедляет опорожнение желудка, стимулирует биосинтез про-инсулина, повышает чувствительность к инсулину и стимулирует независимый от инсулина биосинтез гликогена (Holst (1999), Curr. Med. Chem 6:1005, Nauck et al. (1997) Exp Clin Endocrinol Diabetes 105:187, Lopez-Delgado et al. (1998) Endocrinology 139:2811). GLP-1 человека имеет 37 остатков аминокислот (Heinrich et al., Endocrinol. 115:2176 (1984), Uttenthal et al., J Clin Endocrinol Metabol (1985) 61:472). Активные фрагменты GLP-1 включают GLP-1(7-36) и GLP-1(7-37).
Эксендин-3, эксендин-4 и агонисты эксендина предлагают для лечения сахарного диабета и предупреждения гипергликемии, при этом уменьшаются подвижность и опорожнение желудка (US 5424286 и WO 98/05351). Аналоги эксендина могут отличаться замещенными аминокислотами и/или оканчивающимися C-обрывами природной последовательности эксендина-4. Подобные аналоги эксендина описаны в WO 99/07404, WO 99/25727 и WO 99/25728.
Твердофазный синтез AVE0010 описан в WO 01/04156 A1. AVE0010 имеет последовательность: desPro36эксендин-4(1-39)-Lys6-NH2. Данное вещество обнародовано в WO 01/04156 как SEQ ID NO:93:
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-S-K-K-K-K-K-K-NH2 (SEQ ID NO:1).
Эксендин-4 (39 AS) имеет последовательность:
H-G-E-G-T-F-T-S-D-L-S-K-Q-M-E-E-E-A-V-R-L-F-I-E-W-L-K-N-G-G-P-S-S-G-A-P-P-P-S-NH2 (SEQ ID NO:2).
Эксендин-3 имеет последовательность (J. Bio. Chem., 267, 1992, 7402-7405):
H-His-Ser-Asp-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-Glu-Ala-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2 (SEQ ID NO: 3).
GLP-1 имеет последовательность:
H-A-E-G-T-F-T-S-D-V-S-S-Y-L-E-G-Q-A-A-K-E-F-I-A-W-L-V-K-G-R-NH2 (SEQ ID NO: 4).
Задача данного изобретения состоит в том, чтобы повысить стабильность жидких композиций, включающих агонист GLP-1 и инсулин. В частности, необходимо улучшить физическую и химическую целостность. Данную задачу решают с помощью того, что агонист GLP-1 и инсулин комбинируют с метионином.
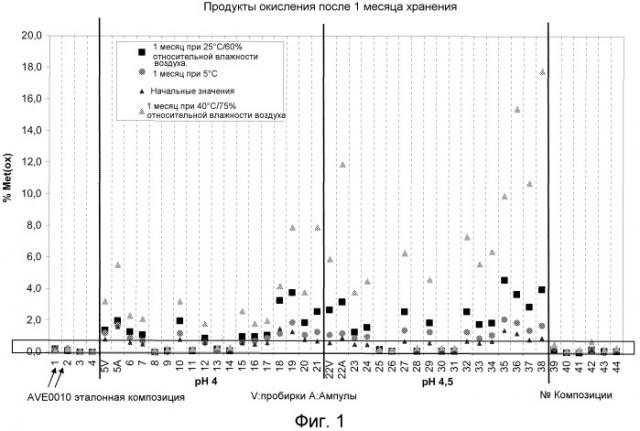
Было обнаружено, что метионин может улучшать стабильность при хранении композиций, включающих агонист GLP-1, такой как AVE0010, и инсулин, такой как инсулин гларгин. Метионин не оказывает влияния на физическую целостность данных композиций.
Стабильность фармацевтически эффективных полипептидов может ухудшаться по различным причинам. К данным причинам принадлежат влияние pH, температуры, света и определенных компонентов.
В контексте данного изобретения было обнаружено, что ряд общепринятых компонентов композиций инсулина или композиций агониста GLP-1 отрицательно сказываются на химической или/и физической целостности и стабильности при хранении композиций, которые содержат инсулин и агонист GLP-1. Данными компонентами являются, например, ацетат, полисорбат 20, полисорбат 80, полоксамер 188, хлорид бензалкония и лизин. Поэтому композиции по изобретению предпочтительно не содержат указанных компонентов.
Объектом данного изобретения является жидкая композиция, включающая агонист GLP-1 или/и его фармакологически приемлемую соль, инсулин или/и его фармакологически приемлемую соль и, необязательно, по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, причем данная композиция отличается тем, что содержит метионин.
Композиция по изобретению содержит метионин предпочтительно в количестве от 0,5 мг/мл до 20 мг/мл, более предпочтительно в количестве от 1 мг/мл до 5 мг/мл, особенно предпочтительно в количестве 3,0 мг/мл. Метионин может применяться в D-форме. Также может применяться метионин в L-форме. Также может применяться смесь D- и L-формы в любых пропорциях.
В частности, композиция по изобретению не содержит ПАВ, такие как полиолы, частичные сложные и простые эфиры и сложные и простые эфиры жирных кислот и многоатомных спиртов, таких как глицерин и сорбитол. Композиции по изобретению, в частности, не содержат частичных сложных и простых эфиров и сложных и простых эфиров жирных кислот и глицерина и сорбитола, выбранных из группы, включающей Span®, Tween®, Myrj®, Brij®, Cremophor®. Далее, композиции не содержат, в частности, полиолов, выбранных из группы, включающей полипропиленгликоли, полиэтиленгликоли, полоксамеры, плюроники, тетроники. В частности, композиции по изобретению свободны от по меньшей мере полисорбата и полоксамера.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит полисорбат, такой как, например, полисорбат 20.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит полисорбат 80.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит полоксамер, такой как, например полоксамер 188.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит хлорид бензалкония.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит гистидин.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит EDTA, в частности натрий-EDTA.
В частности, композиция по изобретению по существу не содержит, предпочтительно совсем не содержит гистидин и натрий-EDTA.
Композиция по изобретению может содержать одно или несколько веществ, которые обычно применяют для буферизации значения pH (буферные вещества). Примерами подобных буферных веществ являются ацетаты, цитраты и фосфаты. В частности, композиция по изобретению может содержать одно или несколько веществ, которые обычно применяют для буферизации значения pH, в количестве, достаточном в качестве противоиона для агониста GLP-1 или/и инсулина. Композиция по изобретению может содержать одно или несколько буферных веществ, например, каждое в количестве до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл или до 0,01 мг/мл. Композиция по изобретению также может по существу не содержать буферных веществ. Предпочтительно композиция по изобретению не содержит буферных веществ.
Композиция по изобретению может содержать ацетат, например, в количестве до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл или до 0,01 мг/мл. Данное количество, например, является достаточным для того, чтобы быть противоионом для агониста GLP-1. Также композиция по изобретению может по существу не содержать ацетат. Предпочтительно композиция по изобретению не содержит ацетат.
Композиция по изобретению может содержать цитрат, например, в количестве до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл или до 0,01 мг/мл. Данное количество, например, является достаточным для того, чтобы быть противоионом для агониста GLP-1. Также композиция по изобретению по существу не содержит цитрат. Предпочтительно композиция по изобретению не содержит цитрат.
Композиция по изобретению может содержать фосфат, например, в количестве до 1 мг/мл, до 0,5 мг/мл, до 0,1 мг/мл, до 0,05 мг/мл, до 0,02 мг/мл или до 0,01 мг/мл. Данное количество, например, является достаточным для того, чтобы быть противоионом для агониста GLP-1. Также композиция по изобретению по существу не содержит фосфат. Предпочтительно композиция по изобретению не содержит фосфат.
Согласно данному изобретению фармацевтическая композиция может иметь значение pH в кислой или физиологической области. Кислая область pH лежит предпочтительно в интервале pH 1-6,8, pH 3,5-6,8 или pH 3,5-5. Физиологическая область pH лежит предпочтительно в интервале pH 2,5-8,5, более предпочтительно pH от 4,0 до 8,5, еще более предпочтительно pH от 6,0 до 8,5. Особенно предпочтительным является значение pH примерно 4,5. Для доведения значения pH пригодны физиологически безопасные разбавленные кислоты (обычно HCl) или соответственно щелочи (обычно NaOH).
Композиция по изобретению может содержать пригодный консервант. Пригодными консервантами являются, например, фенол, м-крезол, бензиловый спирт и/или сложный эфир п-гидроксибензойной кислоты. Предпочтительным является м-крезол. Однако также можно отказаться от применения консерванта.
Композиция по изобретению может содержать ионы цинка. Концентрация ионов цинка находится предпочтительно в области от 1 мкг/мл до 2 мг/мл, более предпочтительно от 5 мкг до 200 мкг цинка/мл, в частности максимум 0,06 мг/мл, особенно предпочтительно 0,06 мг/мл.
Далее, композиция по изобретению может содержать пригодное средство, обеспечивающее изотоничность. Пригодными являются, например, глицерин, декстроза, лактоза, сорбитол, маннитол, глюкоза, NaCl, соединения кальция или магния, такие как CaCl2 и т.д. Концентрация глицерина, декстрозы, лактозы, сорбитола, маннитола и глюкозы находится обычно в области от 100-250 мМ, NaCl находится в концентрации до 150 мМ. Предпочтительным является глицерин. В частности, предпочтителен 85% глицерин в концентрации 20,0 мг/мл.
Далее, композиция по изобретению может содержать дополнительные добавки, например соли, которые замедляют высвобождение по меньшей мере одного инсулина. Предпочтительно композиция не содержит данных добавок.
В частности, данная композиция предусмотрена для парентерального введения. Композиция по изобретению предпочтительно представляет собой пригодную для введения инъекцией композицию, более предпочтительно пригодную для подкожных инъекций. В частности, композиция по изобретению пригодна для однократного ежедневного введения.
В частности, композиция по изобретению после хранения в течение 1 месяца, 2 месяцев, 4 месяцев или 8 месяцев при температуре +5°C или 25°C имеет активность по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% от активности в исходный момент времени.
"Активность" в данной заявке может означать активность инсулина, который применяют в композиции по изобретению. Способы определения активности инсулина известны специалистам.
"Активность" в данной заявке может также означать активность агониста GLP-1, который применяют в композиции по изобретению. Способы определения активности агониста GLP-1 известны специалистам.
Композиция по изобретению, в частности, после хранения в течение 1 месяца, 2 месяцев, 4 месяцев или 6 месяцев имеет химическую целостность. Химическая целостность означает, в частности, то, что после хранения при температуре +5°C, 25°C или 40°C по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% действующих веществ по отношению к исходному моменту времени находятся по существу в химически неизмененной форме.
Химическая целостность может означать химическую целостность агониста GLP-1. Агонист GLP-1 может содержать остаток метионина (например, в положении 14 в AVE0010). Химическая целостность агониста GLP-1 означает, в частности, то, что предотвращено окисление данного остатка метионина.
Химическая целостность может также означать химическую целостность инсулина.
Предпочтительно химическая целостность означает целостность инсулина и агониста GLP-1.
Композиция по изобретению, в частности, после хранения в течение 1 месяца, 2 месяцев, 4 месяцев или 6 месяцев имеет физическую целостность. Физическая целостность означает, в частности, то, что после хранения при температуре +5°C, 25°C или 40°С по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 98% действующих веществ по отношению к исходному моменту времени по существу находятся в физически неизмененной форме.
Физическая целостность может означать физическую целостность агониста GLP-1. Также физическая целостность может означать физическую целостность инсулина. Физическая целостность означает, в частности, то, что агонист GLP-1 или/и инсулин не образуют агрегатов, таких как, например, фибриллы.
Предпочтительно физическая целостность означает физическую целостность инсулина и агониста GLP-1.
Агонист GLP-1 предпочтительно выбирают из группы, состоящей из эксендина-3 и его аналогов и производных, эксендина-4 и его аналогов и производных, при этом агонист GLP-1 более предпочтительно выбирают из группы, состоящей из AVE0010 и эксендина-4.
Эксендин-3, аналоги и производные эксендина-3, эксендин-4 и аналоги и производные эксендина-4 можно найти в WO 01/04156, WO 98/30231, US 5424286, в заявке EP 99610043.4 и в WO 2004/005342. Указанные документы включены в данную работу в виде ссылки. Описанные в указанных документах эксендин-3, эксендин-4 и их аналоги и производные могут быть синтезированы описанными в данной работе способами, причем при необходимости после окончания получения можно производить модификацию.
Последовательности AVE0010 (SEQ ID NO:1), эксендина-4 (SEQ ID NO:2) и эксендина-3 (SEQ ID NO:3) имеют высокую степень соответствия. Последовательности AVE0010 и эксендина-4 идентичны в положениях 1-37. Последовательность 1-39 эксендина-4 в 37 из 39 положений (94%) идентична последовательности эксендина-3 в положениях 48-88. Основываясь на данных последовательностях, специалисты могут приведенные здесь данные положений, которые относятся к определенной последовательности (например, к последовательности AVE0010 или эксендина-4), без затруднений применить к другим последовательностям.
Аналоги и производные эксендина-3 или/и эксендина-4 содержат, в частности, модифицированные последовательности аминокислот. Например, отдельные аминокислоты могут быть удалены (например, desPro36, desPro37, desAsp28, desMet(О)14 в эксендине-4 и соответствующие положения в эксендине-3). Также отдельные положения могут быть заменены (например, Met(O)14, Trp(О2)25, IsoAsp28, Asp28Pro38 в эксендине-4 и соответствующие положения в эксендине-3), причем также можно применять неприродные аминокислоты, такие как Met(O) (метионинсульфоксид или метионинсульфон), Trp(О2) (N-формилкинуренин) или/и IsoAsp (β-аспартат или изоаспартат). Ненатуральные аминокислоты можно без затруднений вводить в последовательность в форме соответствующих аминокислотных структурных элементов.
Далее, могут быть модифицированы C-конец или/и N-конец, например, с помощью дополнительных последовательностей, таких как -(Lys)-, -(Lys)2-, -(Lys)3-, -(Lys)4-, -(Lys)5-, -(Lys)6-, -Asn-(Glu)5-, при этом -(Lys)4-, -(Lys)5-, -(Lys)6-, -Asn-(Glu)5- являются предпочтительными. Карбоксильную группу C-конца предпочтительно модифицируют в группу амида кислоты (-NH2). Необязательно модифицирование C-концов или/и N-концов проводят как дополнительную стадию технологического процесса после окончания синтеза.
Фармацевтически приемлемую соль можно получать на следующей стадии технологического процесса после окончания цикла синтеза согласно способу по изобретению. Способы получения фармацевтически приемлемых солей пептидов известны специалистам. Предпочтительной фармацевтически приемлемой солью является ацетат.
Агонист GLP-1 предпочтительно выбирают из группы, состоящей из эксендина-4, аналогов и производных эксендина-4 и их фармакологически приемлемых солей.
Следующим предпочтительным агонистом GLP-1 является аналог эксендина-4, который выбирают из группы, состоящей из:
H-desPro36-эксендин-4-Lys6-NH2,
H-des(Pro36,37)-эксендин-4-Lys4-NH2,
H-des(Pro36,37)-эксендин-4-Lys5-NH2 и их фармакологически приемлемых солей.
Следующим предпочтительным агонистом GLP-1 является аналог эксендина-4, который выбирают из группы, состоящей из:
desPro36[Asp28]эксендин-4(1-39),
desPro36[IsoAsp28]эксендин-4(1-39),
desPro36[Met(O)14,Asp28]эксендин-4(1-39),
desPro36[Met(O)14,IsoAsp28]эксендин-4(1-39),
desPro36[Trp(O2)25,Asp28]эксендин-2(1-39),
desPro36[Trp(O2)25,IsoAsp28]эксендин-2(1-39),
desPro36[Met(O)14Trp(O2)25,Asp28]эксендин-4(1-39),
desPro36[Met(O)14Trp(O2)25,IsoAsp28]эксендин-4(1-39) и их фармакологически приемлемых солей.
Следующим предпочтительным агонистом GLP-1 является аналог эксендина-4, который выбирают из группы, содержащей аналоги эксендина-4, к С-концам которых, как описано в предыдущей части, присоединен пептид -Lys6-NH2.
Следующим предпочтительным агонистом GLP-1 является аналог эксендина-4, который выбирают из группы, состоящей из:
H-(Lys)6-desPro36[Asp28]эксендин-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Pro38exendin-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Trp(O2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-desAsp28,Pro36,Pro37,Pro38[Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
desMet(O)14Asp28Pro36,Pro37,Pro38эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Rro38[Met(O)14,Trp(O2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
4(1-H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Trp(O2)25,Asp28]эксендин-4(1-39)-Lys)6-NH2 и их фармакологически приемлемых солей.
Также можно выбирать агонист GLP-1 из GLP-1 и аналогов и производных GLP-1. Следующий предпочтительный агонист GLP-1 выбирают из группы, состоящей из Arg34,Lys26(Nε(γ-glutamyl(Nα-гексадеканоил)))GLP-1(7-37) [Лираглютид] и его фармакологически приемлемой соли.
Следующим предпочтительным агонистом GLP-1 является AVE0010. AVE0010 имеет последовательность desPro36эксендин-4(1-39)-Lys6-NH2 (SEQ ID NO:1). Также предпочтительны фармакологически приемлемые соли AVE0010.
Агонист GLP-1, например AVE0010, применяют, в частности, в количестве от 0,01 мг/мл до 0,5 мг/мл или от 0,05 мг/мл до 1,5 мг/мл.
В данной заявке понятие "инсулин" включает не только немодифицированный инсулин, а также аналоги инсулина, производные инсулина и метаболиты инсулина. Композиции по изобретению включают один или несколько компонентов, независимо друг от друга выбранных из группы, которая состоит из инсулина (например, немодифицированного инсулина), аналогов инсулина, производных инсулина, метаболитов инсулина и любых комбинаций указанных веществ.
По меньшей мере один инсулин может быть независимо выбран из группы, которая состоит из инсулина крупного рогатого скота, его аналогов, производных и метаболитов, инсулина свиньи, его аналогов, производных и метаболитов и инсулина человека, его аналогов, производных и метаболитов. Предпочтительно, по меньшей мере один инсулин независимо выбирают из инсулина человека, его аналогов, производных и метаболитов.
Далее, согласно данному изобретению инсулин можно независимо выбирать из немодифицированных инсулинов, в частности из инсулина крупного рогатого скота, инсулина свиньи и инсулина человека.
По меньшей мере один инсулин может быть независимо выбран из группы, состоящей из инсулина крупного рогатого скота, инсулина свиньи и инсулина человека. Более предпочтительно по меньшей мере один инсулин независимо выбирать из инсулина человека. Согласно данному изобретению инсулин может быть выбран из немодифицированного инсулина, в частности из инсулина крупного рогатого скота, инсулина свиньи и инсулина человека.
Согласно данному изобретению производные инсулина представляют собой производные полученного из натуральных источников инсулина или/и аналоги инсулина, которые получены с помощью химического модифицирования. Химическое модифицирование может, например, состоять в присоединении одной или нескольких определенных химических групп к одной или нескольким аминокислотам.
Аналоги инсулина, которые описаны в EP 0214826, EP 0375437, EP 0678522, EP 0419504, WO 92/00321, EP-A0368187 и W02009/063072, могут быть компонентами композиции по изобретению. Документы EP 0214826, EP 0375437, EP 0678522, EP 0419504, WO 92/00321, EP-A0368187 и WO 2009/063072 включены в данную работу в качестве ссылки.
Согласно данному изобретению предпочтительный аналог инсулина может быть выбран из группы, которая включает Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека (инсулин гларгин), Lys(B3)-Glu(B29)-инсулин человека; LysВ28ProВ29инсулин человека (инсулин лизпро), B28Asp-инсулин человека (инсулин аспарт), инсулин человека, у которого пролин в положении B28 заменен Asp, Lys, Leu, Val или Ala и у которого в положении B29 Lys может быть заменен на Pro; AlaB26-инсулин человека; Des(B28-B30)инсулин человека; Des(B27)инсулин человека или B29Lys(ε-тетрадеканоил), des(B30)инсулин человека (инсулин детемир), NεB29-тетрадеканоил des(B30)инсулин человека, NεB29-(Nα-(HOOC(CH2)14CO)-γ-Glu)desB30 инсулин человека, LysB29(Nεлитохолил-γ-Glu)-des(B30)инсулин человека, NεВ29-ω-карбоксипентадеканоил-γ-L-глютаиламид desB3O инсулин человека и NεВ29-ω-карбоксипентадеканоил-γ-амино-бутаноил des(B30) инсулин человека.
Согласно способу по изобретению предпочтительное производное инсулина может быть выбрано из группы, которая включает B29-N-миристоил-des(B30)инсулин человека, B29-N-пальмитоил-des(B30)инсулин человека, B29-N-миристоил инсулин человека, B29-N-пальмитоил инсулин человека, B28-N-миристоил LysB28ProB29 инсулин человека, B28-N-пальмитоил-LysB28ProB29 инсулин человека, B30-N-миристоил-ThrB29LysB30 инсулин человека, B30-N-пальмитоил-ThrB29LysB30 инсулин человека, B29-N-(N-пальмитоил-Y-глютамил)des(B30)инсулин человека, B29-N-(N-литохолил-Y-глютамил)des(B30)инсулин человека, B29-N-(ω-карбоксигептадеканоил)des(B30)инсулин человека и B29-N-(ω-карбоксигептадеканоил)инсулин человека, NεB29-тетрадеканоил des(B30)инсулин человека, NεB29-(Nα-(HOOC(CH2)14CO)-γ-GIu)desB30 инсулин человека, LysB29(Nεлитохолил-γ-Glu)des(B30)инсулин человека, NεB29-ω-карбоксипентадеканоил-γ-L-глютаиламид desB30 инсулин человека и NεB29-ω-карбоксипентадеканоил-γ-амино-бутаноил des(B30)инсулин человека.
Согласно данному изобретению более предпочтительно производное инсулина выбирают из группы, состоящей из Gly(A21)-Arg(B31)-Arg(B32)-инсулина человека, LysВ28ProВ29инсулина человека (инсулин лизпро), B28Asp инсулина человека (инсулин аспарт), B29Lys(ε-тетрадеканоил), desB30 инсулина человека (инсулин детемир).
Композиции по изобретению содержат 60-6000 нмоль/мл, предпочтительно 240-3000 нмоль/мл инсулина, такого как его определяют в данной работе. Концентрация 240-3000 нмоль/мл соответствует в зависимости от применяемого инсулина примерно концентрации 1,4-35 мг/мл или 40-500 единиц/мл.
Одним особенно предпочтительным объектом по изобретению является композиция, такая как описано здесь, включающая по меньшей мере один инсулин, выбранный независимо из LysB28ProB29 инсулина человека (инсулин лизпро), B28Asp инсулина человека (инсулин аспарт), B29Lys(ε-тетрадеканоил), desB30 инсулина человека (инсулин детемир) и инсулина гларгина (Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека), и включающая AVE0010 или/и его фармакологически приемлемую соль. Следующим особенно предпочтительным объектом является композиция, такая как описано здесь, включающая инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека) и AVE0010 (desPro36эксендин-4(1-39)-Lys6-NH2) или/и его фармакологически приемлемую соль. Данные особенно предпочтительные композиции имеют предпочтительно кислый pH 1-6,8, более предпочтительно pH 3,5-6,8, еще более предпочтительно pH 3,5-4,5.
В особом варианте осуществления композиция по изобретению включает следующие компоненты:
(a) desPro36эксендин-4(1-39)-Lys6-NH2,
(b) Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека
(c) хлорид цинка,
(d) м-крезол,
(e) L-метионин,
(f) глицерин,
(g) соляная кислота в количестве? необходимом для установления значения pH примерно 4,5,
(h) раствор NaOH в количестве? необходимом для установления